釩酸鈉鈣化-碳化銨沉法清潔制備釩氧化物新工藝
王少娜,杜浩,2,鄭詩禮,劉彪,閆紅,張懿
(1中國科學院過程工程研究所,中國科學院綠色過程與工程重點實驗室,北京 100190;2中國科學院大學,北京 100049)
釩酸鈉鈣化-碳化銨沉法清潔制備釩氧化物新工藝
王少娜1,杜浩1,2,鄭詩禮1,劉彪1,閆紅1,張懿1
(1中國科學院過程工程研究所,中國科學院綠色過程與工程重點實驗室,北京 100190;2中國科學院大學,北京 100049)
釩酸鈉的后續產品轉化是釩渣亞熔鹽法釩鉻共提清潔生產工藝的關鍵環節,針對釩酸鈉產品轉化提出了釩酸鈉鈣化-碳化銨沉法清潔制備釩氧化物新工藝,系統研究了釩酸鈉鈣化、釩酸鈣碳化銨化、偏釩酸銨冷卻結晶等幾個重要工序。結果表明:通過鈣化-碳化銨化-偏釩酸銨結晶可實現釩酸鈉產品清潔制備釩氧化物,釩回收率達96.99%,所得釩氧化物產品V2O5質量分數達98.53%以上,且從源頭避免了高鹽氨氮廢水的產生,工藝清潔環保。
亞熔鹽;釩酸鈉;溶解性;溶液;結晶;分離
引 言
釩是全球性的稀缺資源和重要戰略金屬,在鋼鐵、化工、航空航天、電子技術等領域應用廣泛,被稱為“現代工業的味精”[1-2]。由釩鈦磁鐵礦生產的釩渣是提釩的主要原料,現行釩渣提釩主流工藝是以純堿、食鹽或芒硝等鈉鹽作為添加劑,在氧化性氣氛中通過高溫焙燒(750~850℃)將含釩原料中低價態的釩轉化為水溶性五價釩的鈉鹽,然后用水浸取鈉化焙燒產物,含釩浸取液經除雜、調節pH后加入銨鹽,使釩以釩酸銨形態沉淀析出,釩酸銨熱分解得到五氧化二釩產品[3-6]。釩渣鈉化焙燒提釩工藝簡單,產品質量好,但釩提取率較低、鉻不能提取,且銨鹽沉釩過程會產生高鹽度、高氨氮的沉釩廢水,嚴重污染環境,治理代價大[7-9]。
針對傳統釩渣鈉化焙燒工藝存在的資源環境制約,中科院過程工程研究所開發了釩渣亞熔鹽法釩鉻高效共提工藝[10-16],該工藝利用NaOH亞熔鹽介質優良的反應特性強化釩渣中釩、鉻尖晶石礦相的分解,可在反應溫度130~200℃實現釩渣中釩鉻的高效共提(釩單次轉化率>95%以上,鉻轉化率>85%)。同時,該工藝通過分步結晶實現了釩、鉻的高效分離,得到了兩種中間產品釩酸鈉和鉻酸鈉[17-21]。釩渣釩鉻共提清潔生產工藝目前已在河鋼承鋼建成了5萬噸示范工程,正在調試運行。釩酸鈉的清潔轉化是工藝后續產品轉化的關鍵環節,傳統工藝中釩酸鈉可在中性或酸性環境下與銨鹽反應轉化為釩酸銨沉淀,后經分離和煅燒后獲得 V2O5產品。如上所述,銨沉過程引入的銨鹽會與鈉鹽混合形成高鹽氨氮廢水,廢水中含有 4000~16000 mg·L-1的和 20 g·L-1以上的 Na+,治理難度大,銨鹽無法循環利用[22-24]。目前一些較發達廠家基本是采用比較原始的蒸氨、濃縮回收鈉鹽等辦法來維持氧化釩的生產,不但大幅增加了生產成本,同時還存在設備易損壞和維護困難等一系列工程化技術難題。高鹽氨氮廢水的排放已成為全世界所有采用浸取-銨鹽沉釩工藝生產氧化釩廠家共同的難題。
基于釩酸鈉清潔轉化生產釩產品的理念,提出了釩酸鈉鈣化-碳化銨沉法清潔制備釩氧化物的新工藝,該工藝可通過Na+-Ca2+-陽離子置換實現釩氧化物的清潔生產。對釩酸鈉鈣化、釩酸鈣碳化銨化、偏釩酸銨結晶等幾個關鍵環節進行了系統研究,通過測定Na2O-V2O5-CaO-H2O四元體系相圖[25],得到了釩酸鈉鈣化的優化溶液濃度區間;通過對釩酸鈣碳化銨化反應的理論分析及系統實驗,得到了釩酸鈣碳化銨化的優化工藝條件;在對NH4HCO3-NH4VO3-H2O體系溶解度分析的基礎上[26],考察了 NH4HCO3濃度、結晶溫度、降溫速度、攪拌速度等工藝參數對結晶分離效率的影響,確定了偏釩酸銨結晶分離的優化工藝參數,得到了合格的釩氧化物產品。以上研究將為鈉系釩渣亞熔鹽法釩鉻共提工藝的進一步應用提供堅實的理論基礎和工藝指導。
1 實驗材料和方法
1.1 實驗材料
正釩酸鈉,分子式 Na3VO4·12H2O,國藥集團化學試劑有限公司生產,分析純,純度大于99%。碳酸氫銨,分子式NH4HCO3,西隴化工股份有限公司生產,分析純,純度大于99%。偏釩酸銨,分子式 NH4VO3,國藥集團化學試劑有限公司生產,分析純,純度大于99%。氫氧化鈉,分子式NaOH,西隴化工股份有限公司生產,分析純,純度大于96%。氧化鈣,分子式CaO,國藥集團化學試劑有限公司生產,分析純,純度大于99%。二氧化碳氣體,純度為99.5%。實驗用高純水由美國Millipore公司 Milli-Q高純水裝置生產,環境溫度下電阻率高于18.2 MΩ·cm。
1.2 實驗儀器
Metter AE 163分析天平(北京光學儀器廠),DF-101S積熱式磁力攪拌加熱器(金壇市醫療儀器廠),D-841-WZ數顯控速攪拌機(天津實驗儀器廠),SHZ-DIII循環水式真空泵(鞏義市予華儀器有限責任公司),聚乙烯瓶(100~250 ml,北京大祥塑料制品廠),恒溫振蕩器(HZ-9212S,太倉市科教器材廠),DHG-9140A電熱鼓風干燥箱(上海一恒科學儀器有限公司),250 ml三口玻璃燒瓶。
鈣化及碳化銨化反應實驗裝置如圖1所示,偏釩酸銨冷卻結晶裝置如圖2所示。
1.3 分析測試儀器
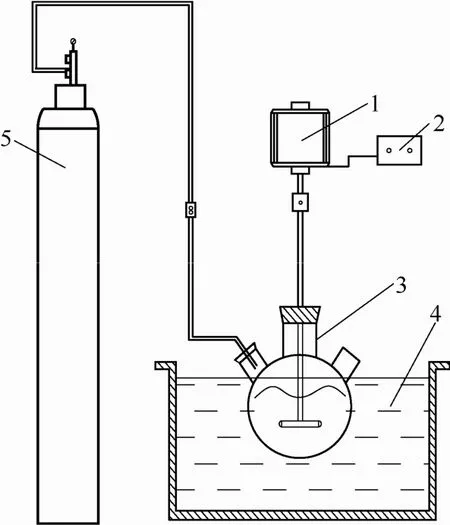
圖1 鈣化及碳化銨化反應實驗裝置Fig.1 Apparatus of calcification and carbonizationammonium reaction
溶液及固相中的釩、鈉、鈣含量采用美國Perkin-Elmer公司的Optima 7300 DV型電感耦合等離子體原子發射光譜儀(美國Perkin-Elmer儀器公司)分析(RSD≤0.5%);溶液中的銨含量采用UV9100系列紫外可見分光光度計(北京萊伯泰科儀器有限公司)分析(RSD≤1%);固相粉末的物相鑒定采用X' Pert PRO MPD型X射線衍射儀(荷蘭帕納克公司)分析;形貌分析采用JSM 6700F 冷場掃描電子顯微鏡(日本電子公司)分析。
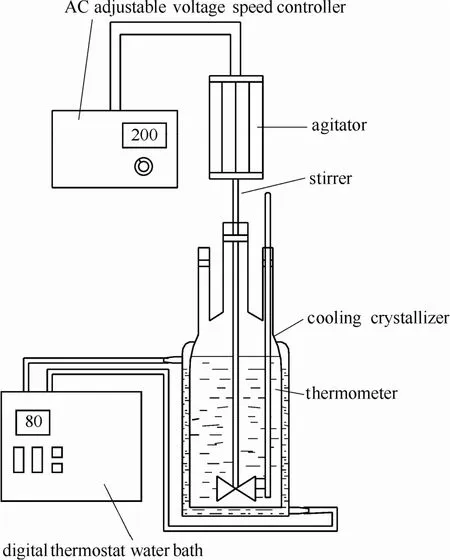
圖2 冷卻結晶實驗裝置Fig.2 Cooling crystallization apparatus
1.4 釩酸鈉鈣化反應
稱取一定量的釩酸鈉加入三口燒瓶中,將三口瓶固定在攪拌裝置上,加入一定體積的純水,設置攪拌速度為200 r·min-1,校正水浴溫度為反應溫度。待釩酸鈉溶解后,稱取定量氧化鈣加入所配溶液中,反應一定時間后停止攪拌,過濾。抽濾結束后,用量筒稱取液相并取樣分析。固相用去離子水洗滌后,在反應溫度下在鼓風干燥箱中烘干,取樣分析。
1.5 釩酸鈣碳化銨化反應
準確稱取一定量的釩酸鈣加入三口燒瓶中,將三口燒瓶固定在攪拌裝置上,加入一定體積的純水,設置攪拌速度為200 r·min-1,校正水浴溫度為反應溫度。將通氣管插入三口燒瓶中,并保證CO2氣體均勻分散進入溶液。打開氣瓶主閥門,調節流量計閥門至流量計示數穩定在1.5 L·min-1。然后加入一定量的碳酸氫銨,反應2 h。碳化反應結束后,關閉氣瓶主副閥門,在反應溫度下保溫抽濾。抽濾結束后,用量筒稱取液相并取樣分析。固相用去離子水洗滌后,反應溫度下在鼓風干燥箱中烘干,取樣分析。
1.6 偏釩酸銨冷卻結晶
配制 75℃一定濃度的NH4HCO3-NH4VO3-H2O溶液(其中NH4HCO3濃度一定,NH4VO3飽和)。將 75℃ NH4VO3飽和的結晶溶液以一定方式冷卻至40℃使其在攪拌條件下冷卻結晶,每隔1 h取溶液分析濃度計算其結晶率變化,結晶一定時間結束后過濾分析溶液,計算結晶率。結晶產物干燥后取樣分析。
2 實驗結果與討論
2.1 釩酸鈉的鈣化反應規律
釩酸鈉鈣化反應的方程式為
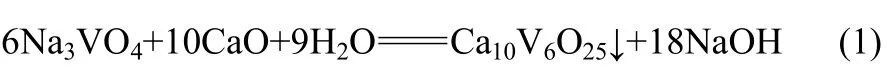
圖3為所測的NaOH-Na3VO4-H2O和NaOH-Na3VO4-Ca(OH)2-H2O體系中Na3VO4的溶解度等溫線。由圖可以看出,當在NaOH-Na3VO4-H2O體系中加入Ca(OH)2后,低堿濃度條件下,液相中Na3VO4的濃度急劇降低;80℃高于 500 g·L-1的NaOH濃度和40℃高于350 g·L-1的NaOH濃度下,由于四元體系中 Ca2+鹽析效應的影響,Na3VO4的溶解度較三元體系略低一些。由溶解度數據初步判斷,當 NaOH濃度低于 150 g·L-1時,在 Ca(OH)2存在的NaOH-Na3VO4-H2O體系中,Na3VO4的溶解度低于5 g·L-1,溶解度較低,表明在此區間可以實現Na3VO4的鈣化,所以Na3VO4的鈣化區間可選取NaOH低于150 g·L-1的范圍。
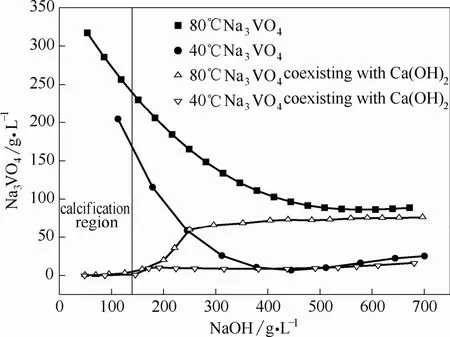
圖3 40℃和80℃時NaOH-Na3VO4-H2O和NaOH-Na3VO4-Ca(OH)2-H2O體系Na3VO4的溶解度Fig.3 Solubilities of Na3VO4in NaOH-Na3VO4-H2O and NaOH-Na3VO4-Ca(OH)2-H2O systems at 40℃ and 80℃
系統研究了NaOH濃度、氧化鈣添加量、溫度、反應時間等因素對釩酸鈉鈣化反應的影響,結果如圖4~圖7所示。圖4考察的是NaOH濃度對鈣化反應的影響,實驗條件為:反應溫度90℃,CaO添加量為理論量的1.5倍,反應時間2 h。圖5考察的是CaO添加量對鈣化反應的影響,將反應式(1) 中生成Ca10V6O25的CaO理論添加量記為1,以此為理論量1考察了CaO添加量為理論量0.5~2倍時釩酸鈉中釩的轉化率,實驗條件為:NaOH濃度150 g·L-1,反應溫度90℃,反應時間2 h。圖6考察的是溫度對鈣化反應的影響,實驗條件為:NaOH濃度150 g·L-1,CaO添加量為理論量的1.5倍,反應時間2 h。圖7中反應時間對鈣化反應的影響實驗條件為:NaOH濃度150 g·L-1,CaO添加量為理論量的1.5倍,反應時間2 h。

圖4 不同NaOH濃度對釩轉化率的影響Fig.4 Effect of NaOH concentration on vanadium conversion rate

圖5 不同氧化鈣量對沉釩率的影響Fig.5 Effect of CaO addition amount on vanadium conversion rate
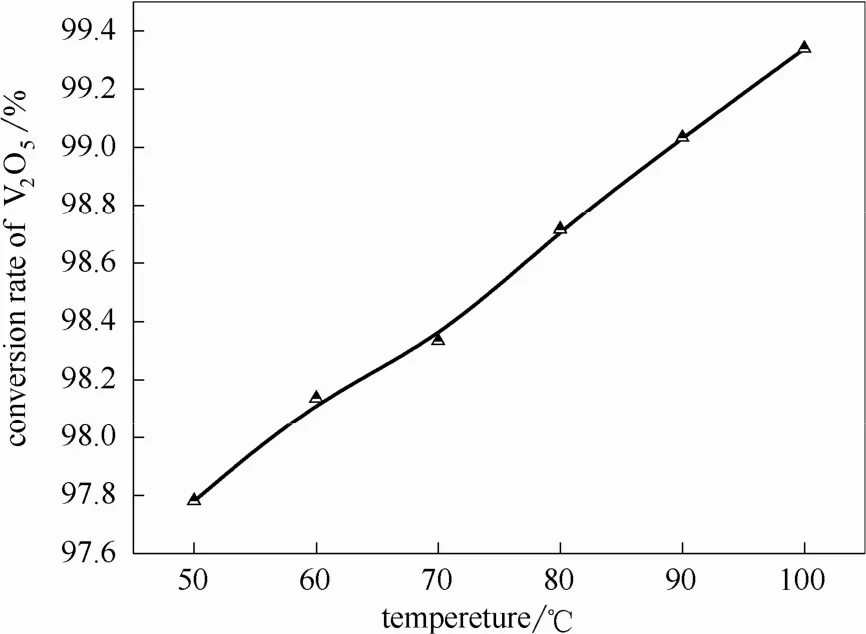
圖6 釩轉化率與溫度的關系Fig.6 Effect of reaction temperature on vanadium conversion rate

圖7 釩轉化率與時間的關系Fig.7 Effect of reaction time on vanadium conversion rate
研究結果表明:通過鈣化工藝可實現釩酸鈉中V與Na的高效分離,釩轉化成釩酸鈣固相,轉化率可達99.63%,Na+以NaOH形式返回反應階段循環使用。釩酸鈉溶液鈣化反應的最佳實驗條件為:反應液NaOH濃度150 g·L-1以下,氧化鈣添加量為化學平衡理論量的1.5倍,反應溫度90℃,反應時間2 h。
所得釩酸鈣固相的成分分析、XRD圖譜和SEM圖見表1、圖8和圖9。從圖8和圖9鈣化產物釩酸鈣的 XRD圖譜可知,最佳實驗條件下生成的固相產物為 Ca10V6O25和 Ca(OH)2的混合物,特征峰峰型明顯,基本沒有雜質峰存在。Ca10V6O25呈現均一的棒狀結構,顆粒尺寸一致。
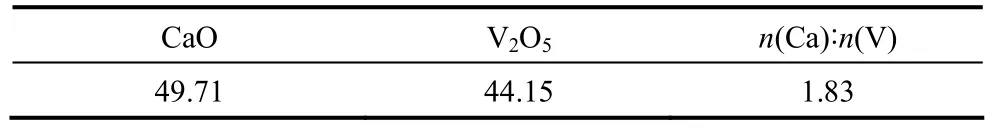
表1 鈣化產物成分分析Table 1 Chemical composition of calcification product/%
2.2 釩酸鈣的碳化銨化反應規律
本課題組提出采用NH4HCO3溶液浸出釩酸鈣,并通入CO2氣體的方法,促進釩酸鈣向Ksp更小的碳酸鈣轉化,具體化學反應方程式如下
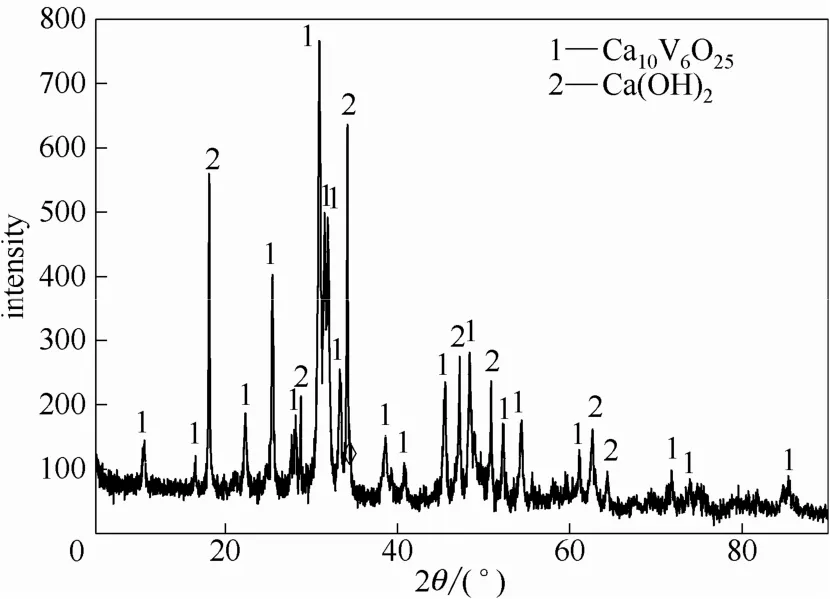
圖8 鈣化產物的XRD譜圖Fig.8 XRD pattern of calcification product

圖9 鈣化產物的SEM圖Fig.9 SEM image of calcification product
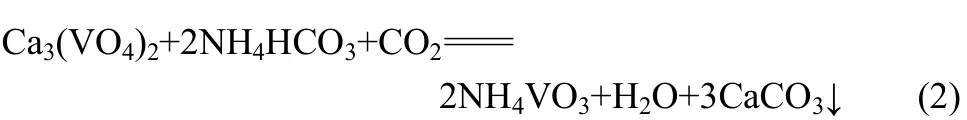
系統考察了 NH4HCO3加入量、反應溫度、液固比對釩酸鈣轉化的影響,結果如圖10~圖12所示,結果表明,在反應溫度40~75℃均可實現釩酸鈣的碳化銨化反應,75℃時反應更為徹底。在反應溫度 75℃,液固比 20:1,通入 CO2流速 1.5 L·min-1,銨釩摩爾比1:1[反應式(2)中與的理論反應量,即與的摩爾比定義為文章中銨釩比],反應時間 30 min條件下,釩酸鈣中釩轉化率可達97.35%,尾渣為碳酸鈣,其中殘釩質量含量為2.04%(以 V2O5計)。
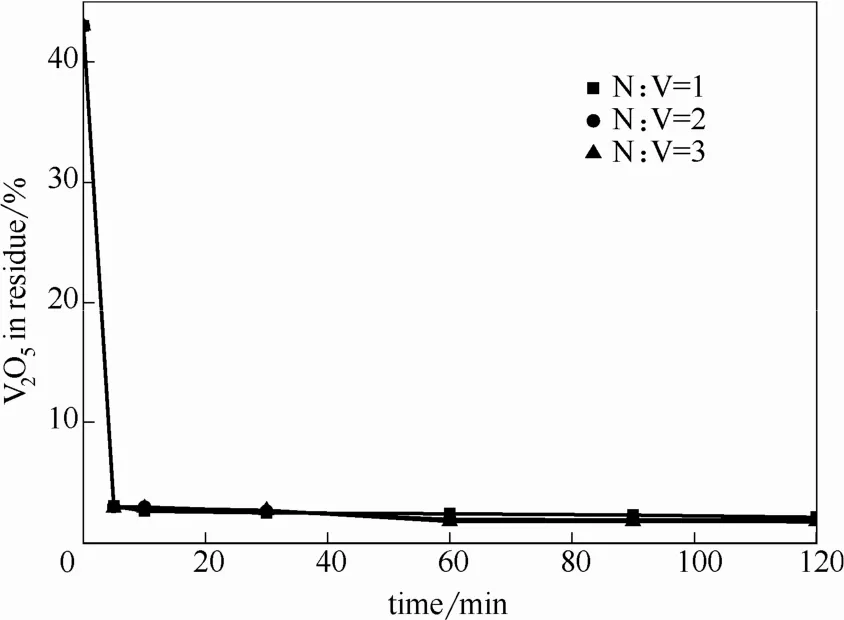
圖10 不同NH4HCO3加入量對釩酸鈣轉化的影響Fig.10 Vanadium content in solid phase of carbonization-ammonium reaction under different additions of NH4HCO3

圖11 不同反應溫度對釩酸鈣轉化的影響Fig.11 Vanadium content in solid phase of carbonization-ammonium reaction at different reaction temperatures
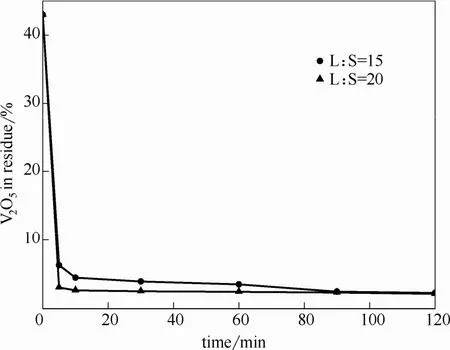
圖12 不同液固比對釩酸鈣轉化的影響Fig.12 Vanadium content in solid phase under different liquid-solid ratios
2.3 NH4HCO3-NH4VO3-H2O體系中NH4VO3的結晶分離
針對碳化銨化后得到的 NH4VO3-NH4HCO3-H2O溶液體系,課題組前期對其溶解度相圖進行了研究[27],結果如圖13所示,圖13表明NH4VO3在體系中的溶解度隨溫度變化差異顯著,可通過冷卻結晶方法實現偏釩酸銨從體系中的分離。
系統研究了碳酸氫銨濃度(10、20、30、40、50 g·L-1)、降溫速率(0.15、0.36、0.58、0.75和1.5℃·min-1)、攪拌轉速(70、150、200、250、300 r·min-1)等因素對偏釩酸銨冷卻結晶的影響,研究結果如圖14~圖17所示。
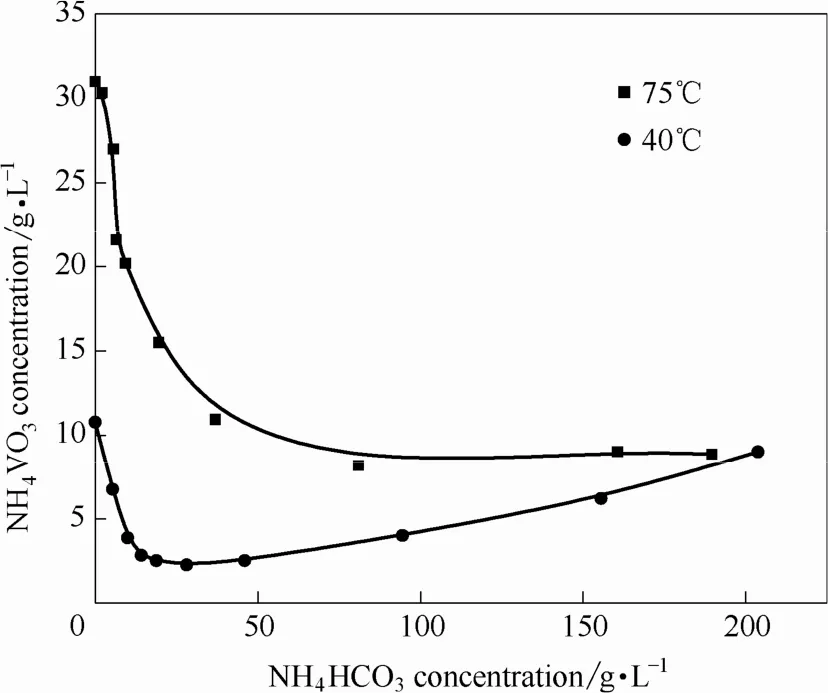
圖13 40℃和75℃時NH4HCO3-NH4VO3-H2O體系中NH4VO3溶解度Fig.13 Solubilities of NH4VO3in NH4HCO3-NH4VO3-H2O system at 40℃ and 75℃
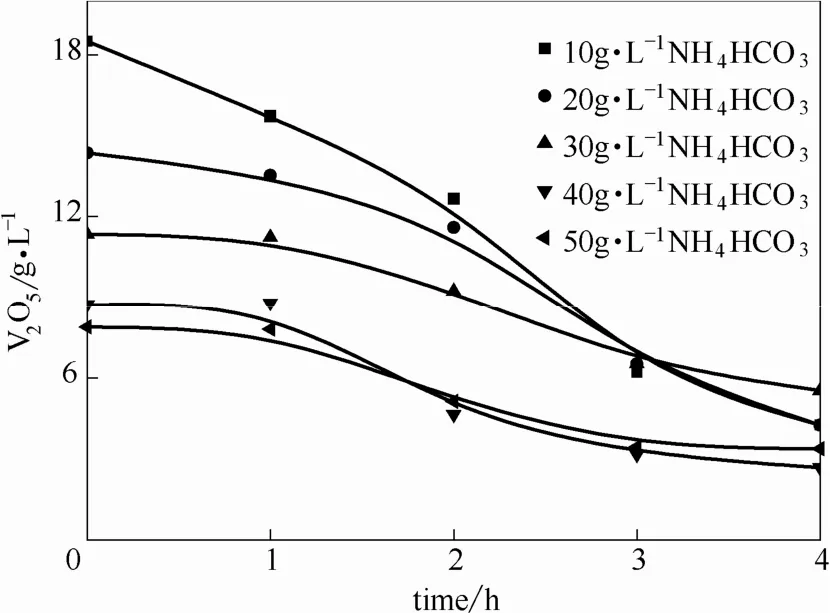
圖14 不同碳酸氫銨濃度下溶液中釩含量隨時間變化Fig.14 V2O5concentration in solution under different NH4HCO3concentration

圖15 不同碳酸氫銨濃度下偏釩酸銨結晶率Fig.15 Crystallization yield of NH4VO3under different NH4HCO3concentration

圖16 降溫速率對偏釩酸銨結晶率的影響Fig.16 Crystallization yield of NH4VO3under different cooling rate

圖17 攪拌轉速對偏釩酸銨結晶率影響Fig.17 Crystallization yield of NH4VO3under different stirrer speed
在攪拌轉速 200 r·min-1,降溫速率 0.36℃·min-1,從75℃冷卻結晶到40℃條件下,考察了碳酸氫銨濃度(10、20、30、40、50 g·L-1)對偏釩酸銨冷卻結晶的影響。對碳酸氫銨濃度影響的研究結果(圖14、圖15)表明,隨著碳酸氫銨濃度的增加,偏釩酸銨結晶率呈現下降的趨勢,并且當碳酸氫銨濃度為10 g·L-1時,溶液中偏釩酸銨的結晶率最高,為81.76%。
圖16為從75~40℃冷卻結晶,降溫速率對偏釩酸銨結晶率的影響,結晶溶液濃度為:NH4HCO310 g·L-1,V2O518.45 g·L-1。從圖中可以看出不同降溫速率條件下,偏釩酸銨的結晶率在結晶前期差異較大,在3 h之前,降溫速率為0.36℃·min-1時,偏釩酸銨的結晶率最高。但當結晶時間達到4 h時,除了降溫速率為1.5℃·min-1,其余降溫速率條件下結晶率差別不大。分析原因,降溫過快,在降溫過程中晶體的生長時間越少,導致結晶前期結晶不易完全,結晶率越低。0.36℃·min-1的降溫速率可以保證晶體有足夠的生長時間,又可保證晶核出現的速度,因此控制降溫速率在0.36℃·min-1。
圖 17為攪拌轉速與偏釩酸銨結晶率的關系。從圖中可以看出,在70~300 r·min-1范圍內,隨著攪拌轉速的增加,偏釩酸銨結晶率呈現先增加后平穩的趨勢,且在攪拌轉速為200 r·min-1時結晶率達到平穩。這是因為當攪拌轉速過低時,由于流場作用不強使得晶體易附著于結晶器內壁,溶液中晶核減少,不易結晶完全;但是當攪拌轉速過高時,攪拌槳與晶體的碰撞概率增加,會造成晶體的二次成核,這會使晶體結晶速度加快,但無法長成大顆粒晶體。結合偏釩酸銨的結晶率情況,選擇200 r·min-1作為攪拌轉速。
綜上,偏釩酸銨優化結晶條件為:碳銨濃度10 g·L-1,攪拌轉速 200 r·min-1,降溫速率 0.36℃·min-1,從 75℃冷卻結晶到 40℃時偏釩酸銨的結晶率可達84.25%,純度99.54%,晶體呈規則棱柱狀,長50~200 μm。結晶產物XRD及SEM如圖18和圖19所示。
對得到的偏釩酸銨晶體在 500℃下煅燒 1~2 h,煅燒后得到的V2O5產物X射線衍射圖如圖20所示。由圖20可以看出,煅燒產物為V2O5。通過對產物成分進行分析計算,得到產品純度為98.53%,說明此工藝可以實現釩酸鈣的產品轉化,并且能夠得到工業品級五氧化二釩產品。
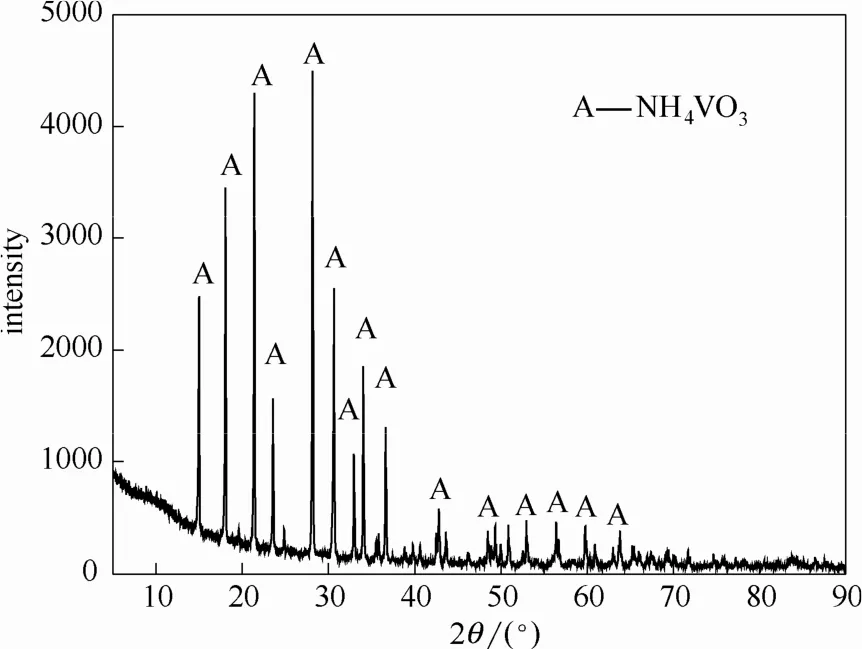
圖18 NH4VO3結晶產物的XRD譜圖Fig.18 XRD pattern of NH4VO3crystallization product

圖19 NH4VO3結晶產物的SEM圖Fig.19 SEM image of NH4VO3crystallization product
2.4 釩酸鈉陽離子置換清潔生產釩氧化物工藝設計
通過對釩酸鈉鈣化、釩酸鈣碳化銨化以及偏釩酸銨結晶體系的研究,形成了以釩酸鈉鈣化-釩酸鈣碳化銨化-偏釩酸銨冷卻結晶為特點的釩產品轉化工藝,工藝流程如圖21所示。該工藝反應結晶效率高,可得到純度為98.53%的五氧化二釩產品,且全過程鈉、鈣、銨可實現閉路循環,無高鹽氨氮廢水排放,清潔環保。
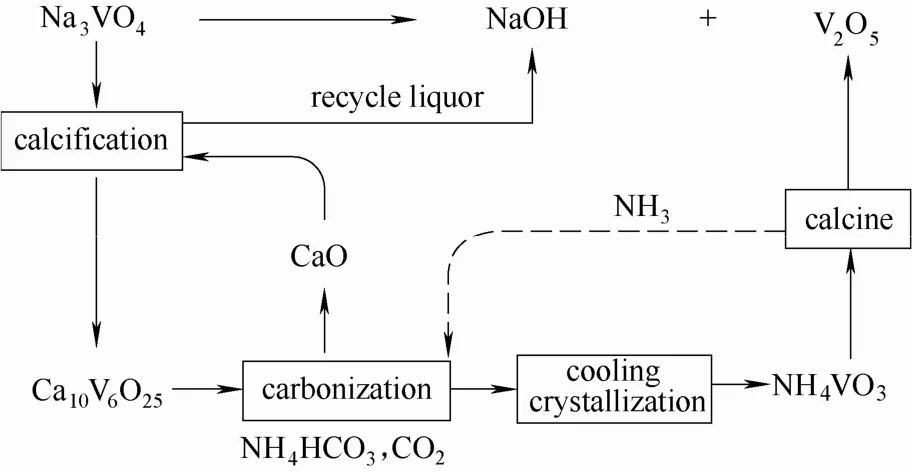
圖21 釩酸鈉清潔生產釩氧化物工藝設計Fig.21 Technology design of cleaner production from sodium vanadate to vanadium oxide
3 結 論
形成了釩酸鈉清潔轉化生產釩氧化物的新方法,得到以下結論。
(1)建立了釩酸鈉中間體鈉、釩鈣化反應分離方法,反應得到的氫氧化鈉溶液可返回用于分解釩渣。通過研究氫氧化鈉濃度、氧化鈣添加量、反應溫度及反應時間等因素對鈣化沉釩的影響,得到優化鈣化工藝條件為:NaOH濃度150 g·L-1以下,氧化鈣添加量為理論量的 1.5倍,反應溫度90℃,反應時間 2 h,此條件下釩鈣化反應率達99.63%以上。
(2)獲得了釩酸鈣碳化銨化反應規律。通過研究反應溫度、液固比、銨釩摩爾比等因素對釩酸鈣碳化銨化反應的影響,得到反應最佳條件,此條件下釩轉化率達97.35%,實現了釩酸鈣的高效銨化轉型。
(3)確定了偏釩酸銨從碳銨溶液中結晶的最佳方式為冷卻結晶,通過研究碳酸氫銨濃度、攪拌轉速、降溫速率等條件對偏釩酸銨結晶的影響,得到偏釩酸銨冷卻結晶優化工藝條件,最高結晶率可達84.25%,產品純度99.54%,晶體呈規則棱柱狀,長50~200 μm。
(4)釩酸鈉鈣化-碳化銨化生產釩氧化物實現了反應介質的循環利用,全過程無廢水排放。
[1] MOSKALYK R R, ALFANTAZI A M. Processing of vanadium: a review[J]. Miner Eng., 2003, 16: 793-805.
[2] NAVARRO R, GUZMAN J, SAUCEDO I, et al. Vanadium recovery from oil fly ash by leaching, precipitation and solvent extraction processes[J]. Waste Manage, 2007, 27: 425-438.
[3] 劉世友. 釩的應用與展望[J]. 稀有金屬與硬質合金, 2000, (2):58-61.LIU S Y. Applications and outlook of vanadium[J]. Rare Metals and Cemented Carbides, 2000, (2): 58-61.
[4] KOZLOV V, DEMIDOV A. Chemical principles of a technology for making pure vanadium pentoxide[J]. Metallurgist, 2000, 44(8):428-433.
[5] SONG W C, LI H, ZHU F X, et al. Extraction of vanadium from molten vanadium bearing slag by oxidation with pure oxygen in the presence of CaO[J]. Trans. Nonferrous Met. Soc. China, 2014, 24:2687-2694.
[6] 陳厚生. 釩渣石灰焙燒法提取V2O5工藝研究[J]. 鋼鐵釩鈦, 1992,13(6): 1-9.CHEN H S. Technical study on extracting V2O5using vanadium slag lime roasting method[J]. Iron Steel Vanadium Titanium, 1992, 13(6):1-9.
[7] 劉作華, 阿依努爾·努爾艾合買提, 連欣, 等. 空氣強化轉爐釩渣濕法浸出行為[J]. 化工學報, 2014, 65(9): 3464-3469.LIU Z H, AYINUER N, LIAN X, et al. Air strengthening of hydrometallurgy process for leaching vanadium from converter slag[J]. CIESC Journal, 2014, 65(9): 3464-3469.
[8] 付自碧. 釩鈦磁鐵礦提釩工藝發展歷程及趨勢[J]. 中國有色冶金,2011, (6): 29-33.FU Z B. Development process and trends of vanadium extraction from vanadium-titanium magnetite ore[J]. China Nonferrous Metallurgy, 2011, (6): 29-33.
[9] 別舒, 王兆軍, 李清海, 等. 石煤提釩鈉化焙燒與鈣化焙燒工藝研究[J]. 稀有金屬, 2010, 34(2): 291-297.BEI S, WANG Z J, LI Q H, et al. Review of vanadium extraction from stone coal by roasting technique with sodium chloride and calcium oxide[J]. Chinese Journal of Rare Metals, 2010, 34(2):291-297.
[10] 鄭詩禮, 杜浩, 王少娜, 等. 亞熔鹽法釩渣高效清潔提釩技術[J].鋼鐵釩鈦, 2012, 33(1): 15-19.ZHENG S L, DU H, WANG S N, et al. Efficient and cleaner technology of vanadium extraction from vanadium slag by sub-molten salt method[J]. Iron Steel Vanadium Titanium, 2012, 33(1):15-19.
[11] 潘自維, 鄭詩禮, 王中行, 等. 亞熔鹽法高鉻釩渣釩鉻高效同步提取工藝研究[J]. 鋼鐵釩鈦, 2014, 35(2): 1-8.PAN Z W, ZHENG S L, WANG Z H, et al. Research on simultaneous extraction of vanadium and chromium from high chromium vanadium slag by sub-molten salt method[J]. Iron Steel Vanadium Titanium,2014, 35(2): 1-8.
[12] WANG Z H, ZHENG S L, WANG S N, et al. Research and prospect on extraction of vanadium from vanadium slag by liquid oxidation technologies[J]. Transactions of Nonferrous Metals Society of China,2014, 24(5): 1273-1288.
[13] WANG Z H, DU H, WANG S N, et al. Electrochemical enhanced oxidative decomposition of chromite ore in highly concentrated KOH solution[J]. Minerals Engineering, 2014, 57: 16-24.
[14] 潘自維, 王大衛, 杜浩, 等. 活性炭強化釩渣中釩、鉻提取技術[J].中國有色金屬學報, 2014, 24(8): 2171-2180.PAN Z W, WANG D W, DU H, et al. Extraction technology of vanadium and chromium from vanadium slags in presence of activated carbon[J]. The Chinese Journal of Nonferrous Metals, 2014,24(8): 2171-2180.
[15] 劉揮彬, 杜浩, 劉彪, 等. KOH亞熔鹽中釩渣的溶出行為[J]. 中國有色金屬學報, 2013, 23(4): 1129-1139.LIU H B, DU H, LIU B, et al. Dissolution behavior of vanadium slag in KOH sub-molten salt[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(4): 1129-1139.
[16] WANG Z H, ZHENG S L, WANG S N, et al. Electrochemical decomposition of vanadium slag in concentrated NaOH solution[J].Hydrometallurgy, 2015, 151: 51-55.
[17] FENG M, ZHENG S L, WANG S N, et al. Solubility investigations in the quaternary NaOH-Na3VO4- Na2CrO4-H2O system at 40 and 80℃[J]. Fluid Phase Equilibria, 2013, 360: 338-342.
[18] 張燕, 王少娜, 鄒興, 等. 堿性介質多元體系中釩酸鈉結晶分離[J].過程工程學報, 2010, (4): 660-666.ZHANG Y, WANG S N, ZOU X, et al. Separation of sodium vanadate in alkali multi-component system[J]. The Chinese Journal of Process Engineering, 2010, (4): 660-666.
[19] FENG M, WANG S N, DU H, et al. Solubility investigations in the NaOH-Na3VO4-Na2CrO4-Na2CO3-H2O at (40 and 80)℃[J]. Fluid Phase Equlibria, 2016, 409: 119-123.
[20] WANG S N, SONG Z W, ZHANG Y, et al. Solubility data for the NaOH-NaNO3-Na3VO4-Na2CrO4-H2O system at (40 and 80)℃[J].Journal of Chemical & Engineering Data, 2010, 55(11):4607-4610.
[21] 杜浩, 王少娜, 劉彪, 等. 一種從釩渣分解液中分離釩鉻的方法:201110061488. 5[P]. 2012-09-19.DU H, WANG S N, LIU B, et al. A new method that separate chromate and vanadate from vanadium slag leaching solution:201110061488.5[P]. 2012-09-19.
[22] 陳迪, 張強. 我國釩產業概況及其環境問題[J]. 冶金叢刊, 2009,10(5): 39-42.CHEN D, ZHANG Q. The profiles of vanadium industry in China and its environmental problems[J]. Metallurgical Collections, 2009,10(5): 39-42.
[23] 王秋霞, 馬化龍. 我國釩資源和V2O5研究、生產的現狀及前景[J].礦產保護與利用, 2009, (5): 47-50 WANG Q X, MA H L. Status and prospects of V2O5product research& production and china’s vanadium resources[J]. Conservation and Utilization of Mineral Resources, 2009, (5): 47-50.
[24] 康興東, 張一敏, 劉濤, 等. 酸性銨鹽沉釩制備高純 V2O5的試驗研究[J]. 礦產綜合利用, 2008, (4): 14-18.KANG X D, ZHANG Y M, LIU T, et al. Experimental study on preparation of high-purity V2O5with acidic ammonium salt precipitation of vanadium-rich liquor[J]. Multipurpose Utilization of Mineral Resources, 2008, (4): 14-18.
[25] LI L J, DU H, YANG N, et al. Solubility in the quaternary Na2O-V2O5-CaO-H2O system at (40 and 80)℃[J]. Journal of Chemical & Engineering Data, 2011, 56(10): 3920-3924.
[26] 趙楚, 馮曼, 王少娜, 等. 40℃和75℃下三元體系NH4HCO3-NH4VO3-H2O中 NH4VO3溶解度的測定[J]. 化工進展,2014, 33(6): 1408-1412.ZHAO C, FENG M, WANG S N, et al. Solubility investigation of NH4VO3in the ternary NH4HCO3-NH4VO3-H2O system at 40℃ and 75℃[J]. Chemical Industry and Engineering Progress, 2014, 33(6):1408-1412.
[27] YAN H, DU H, WANG S N, et al. Solubility data in the ternary NH4HCO3-NH4VO3-H2O and (NH4)2CO3- NH4VO3-H2O systems at(40 and 70)℃[J]. Journal of Chem. Eng. Data, 2016, 61(7): 2346-2352.
New technology from sodium vanadate to vanadium oxide by calcification and carbonization-ammonium process
WANG Shaona1, DU Hao1,2, ZHENG Shili1, LIU Biao1, YAN Hong1, ZHANG Yi1
(1Key Laboratory for Green Process and Engineering, Institute of Process Engineering, Chinese Academy of Sciences,Beijing 100190, China;2University of Chinese Academy of Sciences, Beijing 100049, China)
A new process which transforms sodium vanadate, the intermediate product during the previous vanadium-chromium co-extraction by vanadium slag sub-molten salt process, to vanadium oxide using calcification and carbonization-ammonium method was proposed. The calcification of sodium vanadate,carbonization-ammonium of calcium vanadate, and cooling crystallization of ammonium vanadate were systematically studied. The results showed that vanadium oxide prepared by sodium vanadate can be realized by calcification and carbonization-ammonium method. Vanadium recovery rate can arrive at 96.99% and the purity of product V2O5over 98.53% (mass fraction). The production of high salt ammonia nitrogen wastewater was avoided from source, and environmental-friendly was realized.
sub-molten salt; sodium vanadate; solubility; solution; crystallization; separation
date:2016-10-26.
Prof. ZHENG Shili, slzheng@ipe.ac.cn
supported by the National Natural Science Foundation of China (51404227) and the National Basic Research Program of China(2013CB632605).
TF 111
A
0438—1157(2017)07—2781—09
10.11949/j.issn.0438-1157.20161511
2016-10-26收到初稿,2017-04-10收到修改稿。
聯系人:鄭詩禮。
王少娜(1979—),女,博士研究生,副研究員。
國家自然科學基金項目(51404227);國家重點基礎研究發展計劃項目(2013CB632605)。

