海島棉GbHCT基因的表達分析
加得拉·吐留汗,倪志勇,邱迎風,曲延英,陳全家
(新疆農業大學 農學院,農業生物技術重點實驗室,烏魯木齊 830052)
海島棉GbHCT基因的表達分析
加得拉·吐留汗,倪志勇,邱迎風,曲延英,陳全家
(新疆農業大學 農學院,農業生物技術重點實驗室,烏魯木齊 830052)
通過海島棉基因組數據庫和GSDS 2.0在線生物信息學軟件,分析GbHCT基因的結構,利用實時熒光定量PCR技術,檢測GbHCT基因在海島棉不同組織和棉纖維不同發育時間的表達量。結果表明,該基因DNA序列長度為1 953 bp,開放閱讀框長度為1 311 bp,編碼436個氨基酸,在海島棉基因組中對應scaffold3453序列,含有1個內含子和2個外顯子。GbHCT基因在不同組織和纖維發育不同時期中均有表達,在各個組織中,苞葉和花中表達量最高,在棉纖維不同發育時期開花后5 d和25 d表達量最強。該基因可能參與棉纖維發育伸長期和次生壁增厚期。為深入研究該基因的功能,構建植物表達載體pEGAD-GbHCT并轉入根癌農桿菌,為下一步研究奠定試驗基礎。
海島棉;GbHCT;棉花纖維基因表達;植物表達載體
木質素(lignin)是自然界中僅次于纖維素的大分子物質,是植物細胞壁的重要組成成分[1]。主要由對-羥基苯基木質素(p-hydroxyphenyl lignin,H木質素)、愈創木基木質素(guaiacyl lignin,G木質素)和紫丁香基木質素(syringyl lignin,S木質素) 3種單體分別聚合形成[2]。莽草酸/奎寧酸羥基肉桂酰轉移酶(shikimate/quinatehydroxycinnamoyltransferase,HCT)是木質素生物合成途徑中控制木質素G/S-單體生物合成的關鍵限速酶,該酶通過調節木質素H-單體與G/S-單體的生物轉化從而達到調控植物體木質素單體組成[3-4]。Hoffmann等[5]從煙草莖的抽提物中克隆HCT基因,葛文雅等[6]和王雪霞等[7]在擬南芥、煙草、大麥、毛果楊、黃瓜、高粱、玉米等植物中得到HCT基因。前人用RNA干擾(RNAi)技術和煙草脆裂病毒(tobaccorattlevirus,TRV)侵染的方法抑制擬南芥和煙草中HCT基因表達,發現轉基因植株表現出植株矮小的特征[8]。
陸地棉(GossypiumhirsutumL.)和海島棉(GossypiumbarbadenceL.)是商業價值最高的栽培品種。棉纖維由棉花種子的表皮毛發育而成,是一種優良的天然纖維。一般經歷45~50 d,根據其形成和發育過程可分為纖維起始分化、纖維伸長及初生壁合成、次生壁合成和脫水成熟4個時期[9-10]。有研究證明,纖維品質優越的海島棉中木質素總體含量低于其他棉種,這可能是海島棉棉纖維比其他品種更細的原因[11]。通過基因工程手段降低木質素含量,從而實現纖維品質的改良是一個可行的方法。改變植物木質素生物合成調控的途徑有兩種方法,一種是降低木質素含量,另一種方法是改變木質素的組成結構[12]。棉花不同基因型和不同發育時期有上千個可調控基因,僅有少數基因被分離鑒定。目前,研究者們對于HCT基因的研究更多的是在模式植物中,棉花中研究主要集中在基因的克隆和生物信息學分析等方面。因此,在棉花中分離并鑒定與纖維發育相關基因,分析這些基因在纖維發育中具有的功能,闡明棉纖維發育的分子機理,對于棉花纖維品質的改良和產量的提高具有非常重要的理論和經濟意義。
本研究利用實時熒光定量PCR技術從海島棉‘新海21’中克隆棉花GbHCT基因,并對其進行生物信息學分析。通過實時熒光定量PCR技術對海島棉不同組織和纖維發育不同時期的表達量進行分析并成功構建pEGAD-GbHCT植物表達載體,為研究GbHCT基因的功能提供基礎。
1 材料與方法
1.1 材 料
1.1.1 植物材料 在棉花生長盛花期 (7月至8月中旬)于新疆阿克蘇地區收集‘新海21’海島棉的苞葉、花及棉纖維不同發育時期即開花后8個不同時間0、5、10、15、20、25、30、35 d的纖維。室內種植‘新海21’,待長出2~3片葉后取根、莖和葉。
1.1.2 菌種、載體與試劑 10×buffer含(Mg2+)、dNTP、TaqDNA聚合酶、DNA marker DL 2000、DNA marker DL 15000、瓊脂糖凝膠回收試劑盒、質粒小提試劑盒、RNA plant plus reagent試劑盒、多糖多酚植物總RNA提取試劑盒均購自北京天根生化科技有限公司;TransStart○RTip Green qPCRSuperMix、大腸桿菌(E.coli)DH5α感受態購自北京全式金生物科技有限公司;pMD19-T載體和限制性內切酶T4連接酶購自TaKaRa公司;EcoRⅠ、HindⅢ、ThermoRevertAid First strand cDNA Synthesis Kit購自Thermo Fisher Scientific公司;農桿菌EH105菌株、pEGAD載體均由新疆農業大學農業生物技術重點實驗室保存;其他試劑均為國產分析純;引物合成由北京華大生物科技公司完成;測序工作由上海美季生物科技公司完成。
1.2 方 法
1.2.1 RNA的提取及cDNA 第一鏈的合成 利用TianGen公司RNA plant plus reagent試劑盒,提取‘新海21’海島棉根、莖、葉、苞葉、花的總RNA,參照TianGen多糖多酚植物總RNA提取試劑盒說明書,提取不同發育時期棉纖維總RNA。參照ThermoRevertAid First strand cDNA Synthesis Kit試劑盒操作步驟合成cDNA第一條鏈,-20 ℃保存,備用。
1.2.2 目標基因的克隆 根據棉纖維發育轉錄組庫中篩選得到的目標Unigene序列Unigene30610,利用primer premer 5.0軟件設計特異引物:GbHCT-F:5′-ATGGAGATTACTATAAAGGAGTCTGC-3′ 和GbHCT-R:5′-TTAAAACTCATAAATAAGTTTTTCAAAAA-3′送華大科技合成,合成后引物進行RT-PCR擴增。反應條件為:10×Buffer含(Mg2+) 5 μL,2.5 mmol/L dNTP 4 μL,10 μmol/L 上游引物和下游引物各2 μL,cDNA 1.5μL,Taq酶(5 U/μL )0.5μL,ddH2O 35 μL,總體積為50 μL。反應程序為:預變性94 ℃ 4 min;變性 94 ℃ 30 s,退火50 ℃ 30 s,延伸72 ℃ 1 min ,35個循環;再延伸72 ℃ 10 min,結束反應。取 4 μL PCR 產物進行電泳檢測。采用普通DNA產物純化試劑盒純化PCR產物與pMD19-T連接,轉化大腸桿菌DH5ɑ感受態細胞,涂布于含有氨芐青霉素(50 mg/mL)的LB固體培養基上,37 ℃培養12~14 h 后挑取單菌落,PCR和雙酶切鑒定陽性克隆送上海美季公司測序。
1.2.3 序列分析 用已獲得的GbHCT基因的cDNA序列作為探針在GossypiumbarbadenceAnnotation Project(Http://cotton.cropdb.org)檢索獲得對應海島棉基因組DNA序列,采用GSDS 2.0(http: //gsds.cbi.pku.edu.cn /index.php)分析基因的結構[13]。
1.2.4 實時熒光定量PCR分析 根據GbHCT序列設計實時熒光定量PCR引物。序列為GbHCT-F:5′-AAGTCGACTATTCTGGAGGAA- TATCTTC-3′和GbHCT-R:5′-ATGGTACAA- TGGCAGGCGTCA-3′。以棉花 GhUBQ7為內參基因。序列GhUBQ7-F為:5′-GACCTACACCAAGCCCAAGAAG-3′ ,GhUBQ7-R:5′-TGA- GCCCACACTTACCACAATAGT-3′。采用Trans Start Tip Green qPCR SuperMix試劑盒。反應體系為20 μL,模板cDNA 1.5 μL,10 μmol/L 上下游引物各0.4 μL,2×TransStartTip Green qPCR Super Mix 10 μL,Passive Reference Dye(50×) 0.4 μL,加 ddH2O至20 μL。利用7500 Fast Real-Time PCR儀擴增反應程序采用兩步法:預變性95 ℃ 20 s,95 ℃ 3 s,退火60 ℃ 30 s收集熒光。目的基因與內參基因分別設3個技術重復。試驗結果按照2-△△Ct法進行數據分析。
1.2.5 構建植物表達載體pEGAD-GbHCTpEGAD載體和GbHCT序列設計2條添加酶切位點EcoRⅠ和HindⅢ的引物序列為nTHCT-F:5′-TAAGAATTCATGGAGATTACTATAAAGGAGTCTGC-3′和nTHCT-R:5′-TATAAGCTTTTAAAACTCATAAATAAGTTTTT- CAAAAA-3′以pMD19-T-GbHCT重組質粒為模板,進行PCR擴增。將擴增得到的目標片段經凝膠純化回收試劑盒純化回收后,用EcoR I和Hind III雙酶切回收產物與pEGAD載體,在T4DNA連接酶的作用下連接轉化。酶切體系為:EcoR I和Hind III各1 μL,Buffer 5 μL,回收的目的片段pEGAD質粒 13 μL。連接體系:10×T4ligase Buffer 1 μL,pEGAD Vector 2 μL,目的DNA回收片段6 μL,T4DNA ligase 1 μL,總體積 10 μL。放入 22 ℃連接儀連接20 min,轉化大腸桿菌 DH5α,培養過夜后挑取單菌落,進行菌液PCR和質粒雙酶切鑒定后送至上海美季測序。
1.2.6GbHCT基因植物表達載體轉化農桿菌 挑取根癌農桿菌EHA105單菌落于5 mL YEB 液體培養基(含Rifampicin 50 mg/L)中,28 ℃ 250 r/min振蕩培養,吸取2 mL菌液加入50 mL YEB培養基至OD600為0.6左右,制備農桿菌感受態細胞,采用凍融法把pEGAD-GbHCT質粒DNA轉化到農桿菌感受態細胞,接種于含有50 mg/L Kan 和50 mg/L Rif 的YEB 固體平板上,28 ℃培養約2 d,挑單菌落,接種于YEB 液體培養基中,28 ℃振蕩培養過夜。經PCR鑒定得到1 311 bp 條帶的特異條帶。
2 結果與分析
2.1 RNA的提取與檢測
分別提取海島棉‘新海21’的根、莖、葉、苞葉、花及8個纖維發育時期(開花后時間)0、5、10、15、20、25、30、35 d的總RNA,利用Colibri Spectrometer紫外分光光度計檢測RNA樣品的質量濃度和完整性。結果顯示:提取的RNA樣品OD260/OD280的比值在1.8~2.0,OD260/OD230比值均大于1.8(圖1、圖2)。經10 g/L的瓊脂糖凝膠電泳后28S rRNA、18S rRNA和5S rRNA條帶明亮,清晰可用于后續試驗。

圖1 海島棉不同組織RNA電泳圖Fig.1 Electrophoresis of PCR product of RNA extracted from different tissues of Gossypium barbadence L.

圖2 海島棉纖維不同發育時期RNA電泳圖Fig.2 Electrophoresis of PCR product of RNA extracted from different development stages of Gossypium barbadence L.
2.2GbHCT基因的克隆和氨基酸序列分析
根據海島棉轉錄組數據中的HCT序列設計引物,將擴增產物克隆到pMD19-T載體上(圖3)測序,結果表明:GbHCT基因開放閱讀框長度為1 311 bp,編碼436個氨基酸,GenBank登錄號為KT378286。預測的GbHCT蛋白質分子質量為48.58 ku,等電點為6.03。GbHCT基因對應海島棉基因組中的Gbscaffold3453.1序列,含有1個長度為91 bp的內含子和2個長度分別為410 bp和899 bp的外顯子。
2.3GbHCT基因的q-PCR分析
為揭示GbHCT基因在海島棉中的表達特性,以海島棉‘新海21’的根、莖、葉、苞葉、花、及花后0、5、10、20、25、30、35 d纖維的總RNA作為模板,以UBQ7為內參基因,進行不同組織和不同發育時期的表達分析,試驗結束后按照2-△△Ct法進行數據分析。將葉和花后20 d設為對照組,表達量為1。結果表明:GbHCT基因在不同組織和不同發育時期均有表達,在不同組織中,苞葉和花中優勢表達,根、莖和葉中表達量較低(圖4)。

M.DNA Marker;1.PCR產物 PCR products
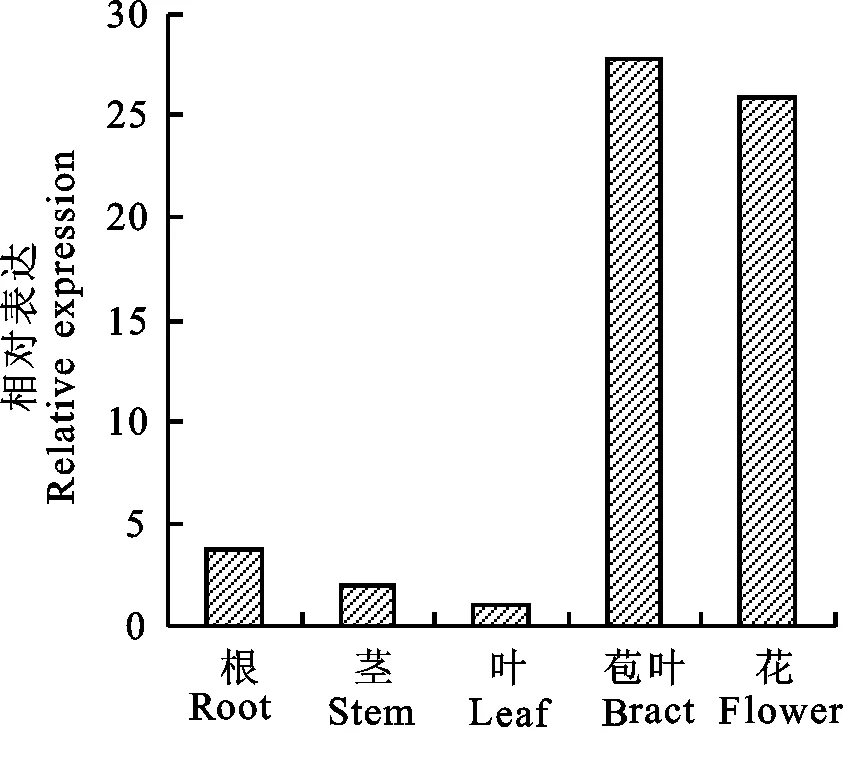
圖4 GbHCT基因在海島棉不同組織中的表達Fig.4 Expression of GbHCT in different tissues of Gossypium barbadence L.
在不同發育時期5 d和25 d出現GbHCT基因表達量最高峰,分別達到對照組的69倍和36倍,其次是10 d和15 d。其他時期表達量微弱(圖5)。

圖5 GbHCT 基因在海島棉纖維不同發育時間的表達Fig.5 Expression of GbHCT different fiber development periods of Gossypium barbadence L.
2.4GbHCT基因植物表達載體的構建及農桿菌轉化
利用帶酶切位點引物進行PCR擴增,獲得目的片段(圖6-A),利用EcoR I和Hind III酶切重組質粒,與相同酶切的植物表達載體連接轉化。菌液PCR、雙酶切鑒定獲得1 311 bp左右的片段,經上海美季測序證實目的基因已成功整合(圖6-B)。用測序正確的重組質粒pEGAD-GbHCT轉化農桿菌EHA105菌株,進行菌液PCR鑒定,得到1 311 bp的目的條帶,證明pEGAD-GbHCT重組質粒已經被成功轉入農桿菌(圖7)。

M.DNA Marker;1.植物表達載體PCR產物 PCR products of plant expression vector;2.重組質粒的酶切鑒定 Restriction enzyme digestion of recombinant plasm
圖6 植物表達載體pEGAD-GbHCT的構建
Fig.6 Construction of plant expression vector pEGAD-GbHCT

M.DNA marker;1~10.GbHCT基因GbHCTgene
圖7 轉化農桿菌菌液 PCR 檢測
Fig.7 Identification of transformed agrobacterial liquid with PCR
3 討 論
棉纖維發育的各個時期參與多個基因和轉錄因子,這些基因和轉錄因子在不同組織和不同發育時期的表達中有顯著差異。明確這些基因在各個時期的表達特征,對改良纖維品質提供候選基因具有重要意義。有研究已證實,在成熟棉纖維細胞細胞壁形成過程中存在木質素的生物合成途徑,而且在不同棉花亞種(海島棉和陸地棉)及不同棉花類型(白色棉和彩色棉)木質素含量存在顯著差異[14]。曹雙瑜等[15]研究發育中棉纖維木質素的含量,得出單位棉鈴木質素的含量隨棉纖維發育的遞增木質素含量越低,棉纖維斷裂比強度越高。Fan等[16]研究表明,木質素沉積可能與減少細胞壁的增厚和影響細胞成熟過程中細胞壁停止生長有關。
本研究以海島棉‘新海21’的根、莖、葉、苞葉、花等組織和8個不同棉纖維發育時間即花后0、5、10、15、20、25、30、35 d為材料,通過實時熒光定量PCR檢測GbHCT基因在海島棉中的表達量。在材料選擇上,本研究收集棉纖維發育的4個時期的纖維,為充分研究該基因在棉纖維發育各個時期的表達提供基礎。利用實時熒光PCR檢測這些組織和不同發育時期發現GbHCT基因在不同組織中苞葉和花中表達量最高,棉纖維發育時期5 d和25 d中具有很強的表達。棉花纖維次生壁的發育和苯丙烷代謝途徑基因的表達量在時間上具有一致性,因此,GbHCT基因在25 d 具有較強的表達與預期的結果一致。肖向文等[11]研究的GhHCT在棉纖維發育16 d出現最高峰與本文高表達出現的25 d都是細胞壁加厚期與本研究結果相似。而在5 d出現的高表達量,初步推測GbHCT基因可能參與棉纖維起始。比較GbHCT基因在不同組織和不同棉纖維發育時期的表達可以發現,GbHCT基因雖然在各個組織中均有表達,但GbHCT基因表達高峰期出現在棉纖維不同發育時期。表明GbHCT基因是一個與棉纖維發育相關的基因并參與棉纖維發育的伸長期和次生壁增后期。棉纖維的長度是由纖維伸長期決定,強度和細度由次生壁增后期決定,因此,可以初步斷定GbHCT基因可能在棉纖維的長度、細度和強度等指標形成中有作用。
Reference:
[1] 劉 偉,李 高,楊 杞,等.檸條錦雞兒HCT基因克隆及序列分析[J].內蒙古農業大學學報,2014,35(1):77-82.
LIU W,LI G,YANG Q,etal.Cloning and sequence analysis of a hydroxycinnamoyl-coenzyme a shikimate/quinate hydroxycinnamoyl transferase encodinggene fromCaraganakorshinkiikom[J].JournalofInnerMongoliaAgriculturalUniversity,2014,35(1):77-82 (in Chinese with English abstract).
[2] 聶明才,霍淑平,孔 武.木質素模型化合物的研究進展[J].林產化學與工業,2010,30(5):115-121.
NIE M C,HUO SH P,KONG W.Research progress of lignin model compounds[J].ChemistryandIndustryofForestProducts,2010,30(5):115-121 (in Chinese with English abstract).
[3] 李宗梅.小立碗蘚羥基肉桂酰基轉移酶基因功能及調控研究初探[D].武漢:華中農業大學,2013.
LI Z M.Identification and characterization of a novel hydoxycinnamoyl transferase from thePhyscomitrellapatensand the regulation ofP.patensHCT[D].Wuhan:Huazhong Agricultural University,2013 (in Chinese with English abstract).
[4] 王雪霞,薛永常,趙文超.木質素生物合成中C3H/HCT的研究進展[J].生命的化學,2008,28(5):650-653.
WANG X X,XUE Y CH,ZHAO W CH.Progrees C3H/HCT in lgnin biosynthesis[J].ChemistryofLife,2008,28(5):650-653 (in Chinese with English abstract).
[5] HOFFMANN L,MAVRY S,MARTZ F,etal.Purification,cloning and properties of an acyltransferase controliting shikimate and quinate ester intermediatas in phenyl propanod metabolism[J].JournalofBiologicalChemistry,2003,278(1):95-103.
[6] 葛文雅,惠 偉,閆洪波,等.鴨梨 PbHCT3基因的克隆及表達分析[J].西北植物學報,2012,32(5):0871-0875.
GE W Y,HUI W,YAN H B,etal.Cloning and expression analysis of PbHCT3 gene inPyrusbretschneideriRehd .cv.‘Yali’ [J].ActaBotanicaBoreale-OccidentaliaSinica,2012,32(5):871-875(in Chinese with English abstract).
[7] 王雪霞,曹 方,薛永常.楊樹木質素合成酶hct基因的克隆及核苷酸序列分析[J].遼寧林業科技,2009,6(1):4-7.
WANG X X,CAO F,XUE Y CH.Cloning sequence analysis of lignin biosynthesishctgene in poplar[J].JournalofLiaoningForestryScience&Technology,2009,6(1):4-7 (in Chinese with English abstract).
[8] HOFFMANN L,BESSEAU S,GEOFFROY P,etal.Silencing of hydroxycinnamoyl-coenzyme A shikimate/quinate hydroxycinnamoyltransferase affects phenylpropanoid biosynthesis[J].PlantCell,2004,16(6):1446-1465.
[9] 閆洪穎.棉花纖維發育過程超微結構觀察和次生壁木質素含量的分析[D].烏魯木齊:新疆農業大學,2009.
YAN H Y.ltra-structural observation on fiber cell and lignin content analysis of secondary wall during cotton fiber development [D].Urumqi:Xinjiang Agriculture University,2009(in Chinese with English abstract).
[10] 陳 薔,崔百明,黎娟華,等.棉花纖維品質分子改良研究進展[J].中國生物工程雜志,2009,29(5):111-115.
CHEN Q,CUI B M,LI J H.Progress on molecular improvement of cotton fiber qualities [J].ChinaBiotechnology,2009,29(5):111-115(in Chinese with English abstract).
[11] 肖向文,朱奇朗,劉海峰,等.棉花莽草酸/奎寧酸羥基肉桂酰轉移酶基因(GhHCT)的克隆、生物信息學分析及表達特性[J].農業生物技術學報,2014,22(05):572-579.
XIAO X W,ZHU Q L,LIU H F.etal.Cloning,bioinformatics analysis and expression characteristic of shikimate/quinate hydroxycinnamoyl transferase gene(GhHCT) in cotton (GossypiumhirsutumL.)[J].JournalofAgriculturalBiotechnology,2014,22(5):572-579(in Chinese with English abstract).
[12] 劉 媛,黃真池,曾富華,等.木質素單體生物合成途徑研究進展[J].湛江師范學院學報,2007,28(6):87-99.
LIU Y,HUANG ZH CH,ZENG F H,etal.Advances in study of the biosynthesis pathway of lignin monomer[J].JournalofZhanjiangNormalCollege,2007,28(6):87-99((in Chinese with English abstract).
[13] 汪曉東,陳 洋,于月華,等.大豆 GmNF-YA3基因結構及原核表達分析[J].作物雜志,2015(4):47-50.
WANG X D,CHEN Y,YU Y H,etal.Structural and prokaryotic expression analysis of GmNF-YA3 gene [J].Crops,2015(4):47-50(in Chinese with English abstract).
[14] 胡文冉,范 玲,師維軍,等.一種確立棉花纖維中木質素含量和纖維品質相關關系的方法:中國,201010143263[P].2010-08-11.
HU W R,FAN L,SHI W J,etal.A method to establish the relationship between lignin content and fiber quality: China,201010143263[P].2010-08-11 (in Chinese).
[15] 曹雙瑜,胡文冉,范 玲.發育中棉纖維硫酸木質素含量動態變化[J].新疆農業科學,2012,49(7):1184-1189.
CAO SH Y,HU W R,FAN L.The dynamic changes of klason lignin contents during cotton fiber development[J].XinjiangAgriculturalSciences,2012,49(7):1184-1189(in Chinese with English abstract).
[16] FAN L,SHI W J,HU W R,etal.Molecular and biochemi-cal evidence for phenylpropanoid synthesis and pres-ence of wall-linked phenolics in cotton fibers[J].JournalofIntegrativePlantBiology,2009,51(7):626-637.
(責任編輯:史亞歌 Responsible editor:SHI Yage)
Expression Analysis ofGbHCTGene inGossypiumbarbadenceL.
Jiadela·Tuliuhan,NI Zhiyong,QIU Yingfeng,QU Yanying and CHEN Quanjia
(College of Agronomy,Xinjiang Agricultural University,Key Laboratory of Agricultural Biological Technology,Urumqi 830052,China)
In this study,the structure of geneGbHCTwas analyzed by using an online bioinformatics software genomic database ofGossypiumbarbadenceand GSDS 2.0.The expression ofGbHCTgene in different tissues and different fiber development stages of cotton was analyzed by real-time quantitative PCR.A length of 1 953 bp from genomic DNA ofGbHCTwas cloned by PCR.GbHCTcontain open reading frames of 1 311 bp encoding proteins of 436 amino acid residues.The genomic DNA ofGbHCTcontained two exons and one intron which were located in the scaffold 3 453 ofGossypiumbarbandenseL.Real-time quantitative PCR analysis revealed thatGbHCTwas expressed at higher level in bracts and flowers,and it was predominantly expressed in 5 d and 25 d during cotton fiber development,so we suggested that this gene may be involved in regulating fibre elongation and secondary wall thickening.Plant expression vector pEGAD-GbHCTwas constructed and transferred into theAgrobacteriumtumefaciensEHA105 for further experiment.
GosypiumbarbadenseL.;GbHCT; Cotton fiber gene expression ;Plant expression vector
2016-03-31 Returned 2016-05-23
High-tech Research and Development Program of Xinjiang Uygur Autonomous Region (No.20141103).
Jiadela·Tuliuhan,female,master student.Research area:quality of cotton fiber.E-mail:jaderatoleuhan@163.com
CHEN Quanjia,male,professor.Research area:cotton genetic breeding.E-mail:chqjia@126.com
日期:2017-06-05
2016-03-31
2016-05-23
自治區高技術研究發展計劃(20141103)。 第一作者:加得拉·吐留汗,女,碩士研究生,研究方向為棉花纖維品質改良。E-mail:jaderatoleuhan@163.com 通信作者:陳全家,男,教授,主要從事棉花分子育種研究。E-mail:chqjia@126.com
Q786
A
1004-1389(2017)06-0849-06
網絡出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170605.1715.014.html

