紫花苜蓿高頻體胚發生及萌發成苗技術與轉基因應用
溫之雨,董福雙,張華寧,楊瑞娟,2,張艷敏
(1.河北省農林科學院 遺傳生理研究所,河北省植物轉基因中心,石家莊 050051;2.河北師范大學 生命科學學院,石家莊 050024)
紫花苜蓿高頻體胚發生及萌發成苗技術與轉基因應用
溫之雨1,董福雙1,張華寧1,楊瑞娟1,2,張艷敏1
(1.河北省農林科學院 遺傳生理研究所,河北省植物轉基因中心,石家莊 050051;2.河北師范大學 生命科學學院,石家莊 050024)
以紫花苜蓿的子葉或葉片為外植體,建立高頻體胚發生及成苗技術體系,為苜蓿耐逆性狀的遺傳改良提供技術支撐。在愈傷誘導、體胚誘導、體胚成熟與萌發等幾個關鍵環節,分析比較培養基組分對培養效果的影響。建立在SHDK培養基上誘導愈傷、MB(-/+)+ABA 0.4 mg/L+PEG-6000 50 g/L+蔗糖50 g/L培養基上誘導體胚、Bio2Y培養基上促體胚發育成熟、1/2 MS(或SH)培養基上體胚萌發成苗的高頻再生技術體系。最適條件下,每克胚性愈傷組織可產生77.9個正常萌發成苗的健康體胚。再生植株在生長箱內經過2周20 ℃、16 h/d的光照培養后移栽溫室,成活率達90%以上。利用該離體再生技術成功地將凝集素基因PPA導入苜蓿中,獲得抗蚜轉基因苜蓿。
紫花苜蓿;體胚發生;離體再生;轉基因
苜蓿(MedicagosativaL.)是重要的豆科牧草,營養豐富,蛋白質質量分數占其干物質的17%~20%,被譽為“牧草之王”。種植苜蓿對改良土壤、保持水土及保護環境亦大有益處。中國人口眾多,保障糧食生產的任務艱巨;為保證糧食生產的耕地面積,發展苜蓿必須向鹽堿灘涂要空間。雖然苜蓿表現出一定的耐鹽性,可在輕度鹽堿土壤上生存,但尚缺乏可耐中重度鹽堿的種質資源。培育強耐鹽苜蓿新品種對開發利用鹽堿灘涂地及增加苜蓿生物產量具有重要作用。
耐鹽苜蓿資源短缺,再加上苜蓿雜交育種困難,利用轉基因技術改良苜蓿的耐鹽性是加快苜蓿新品種選育的有效途徑。苜蓿轉基因植株的獲得主要由農桿菌介導法[1-5]。大多數的轉化技術依賴于苜蓿的組織培養和離體再生,極少利用莖尖建立的in planta轉化方法[6]。盛慧等[7]的報道雖然沒有經過愈傷誘導過程,但用子葉節為受體通過叢生芽發生途徑也沒有擺脫組織培養的束縛。因此,建立高效的苜蓿離體再生技術體系是苜蓿遺傳轉化的重要組成部分。苜蓿的離體再生途徑包括器官發生和體胚發生2種途徑[8]。其中,體胚發生再生途徑因胚狀體起源于單細胞,具有嵌合體少、遺傳背景一致的優點;胚狀體具有的雙極性使其可發育成同時具有芽和根的完整植株,避開不定芽發育中的生根困難問題。遺傳轉化體通過體胚發生途徑直接成苗可降低轉化細胞的無性變異風險及非轉化細胞的逃逸選擇風險[9]。但體細胞胚胎再生途徑存在培養周期長、分化頻率偏低、組織培養條件要求嚴格等弊端,這些因素限制紫花苜蓿遺傳轉化效率的提高。王成龍等[10]探索紫花苜蓿的叢生芽再生系統,使其再生頻率比體胚再生系統提高1倍,進一步分析發現,叢生芽再生系統與體胚再生系統的芽分化率相差不大(分別為70.4%和67.1%),差別主要是單個外植體分化的芽數,前者為8.11,后者為2.83。雖然該系統可在相對較短的時間內獲得大量的叢生芽,但其存在的高畸形芽率也不容小覷。
植物細胞全能性賦予每個細胞發育成完整植株的可能性,但實際上并非每一個細胞都能被有效誘導發育成小植株,它與細胞的組織來源及生理狀態等有關。在小麥、玉米、大豆、棉花等多種作物上都報道組織培養的基因型依賴性[11-15]。在苜蓿上也有基因型影響紫花苜蓿愈傷組織和體胚形成的報道[16-17]。克服這一困難的方法之一是選擇再生頻率高的基因型,但由此產生的問題是影響轉基因作物的實用性或延遲轉基因作物的生產應用。本研究以生產用苜蓿品種為材料,從愈傷誘導、體胚誘導、體胚成熟與萌發等幾個關鍵環節入手,進行較為系統的研究,旨在解決苜蓿體胚誘導效率及萌發效率的雙低問題,從而建立紫花苜蓿高頻體胚發生的離體再生技術,為苜蓿的遺傳轉化提供良好的受體轉化系統。
1 材料與方法
1.1 材 料
供試材料為紫花苜蓿品種‘三得利’的無菌苗。
1.2 外植體準備
先將苜蓿種子用φ=70%的乙醇消毒1~2 min,再用1 g/L的氯化汞消毒10~12 min,無菌水充分沖洗3~4遍。將種子放到鋪有滅菌濾紙的平皿內,用鑷子轉接到1/2 MS培養基上。在25 ℃、16 h/8 h光暗周期、2 000 lx光照強度下培養7~10 d。然后將外植體按子葉、葉柄、莖段和下胚軸等分開,每一外植體約3 mm大小。
1.3 所用培養基及培養條件
以SH[18]、MS[19]及Bio2Y[20]等為基礎培養基,附加不同種類及濃度的激素分別用于愈傷誘導、體胚誘導與成熟及體胚萌發成苗。各階段所用培養基的組分詳見表1;培養基的pH用KOH調節到5.8。 所有培養物都在(25±2) ℃的培養室內進行培養,除愈傷誘導階段無光照外,其他各階段維持16 h/d的光照條件。

表1 苜蓿體胚誘導各階段所用的培養基Table 1 Media used in different periods during embryo induction and maturation
1.4 正交試驗優化體胚誘導培養基
以MB(-/+)為基礎培養基,以ABA、AgNO3和PEG-6000為效應因子,進行L9(34)正交設計。上述3因子的試驗水平分別為0、0.2和0.4 mg/L;0、10和20 mg/L;0、25和50 g/L。將SHDK培養基上誘導的胚性愈傷轉移到上述相應培養基上,每處理1瓶,5次重復。用接種后的(瓶+愈傷)質量減去接種前的瓶質量得到每瓶的愈傷質量。20 d后將體胚轉移到1/2 SH或1/2 MS培養基上,2周后調查芽和根發育健全、可正常萌發成苗的體胚數,計算各處理每克愈傷組織形成可正常萌發的體胚數。
1.5 凝集素基因PPA轉化苜蓿
1.5.1 轉基因植株的獲得 外植體為生產用苜蓿品種‘三得利’的無菌苗子葉,農桿菌株為攜帶抗蚜PPA基因的EHA105。抗蚜基因PPA來源于掌葉半夏,構建在帶有卡那霉素抗性標記的PBI121質粒載體上,并由35S啟動子控制。遺傳轉化采用外植體預培養和共培養各為3 d的方式[21]。共培養結束后,將外植體轉移到恢復培養基(SHDK+頭孢噻肟鈉500 mg/L)上暗培養7 d。然后轉入篩選培養基(成分同恢復培養基,添加卡那霉素30 mg/L),經過2~3次繼代培養獲得抗性愈傷組織。將淺黃綠色、粘稠并帶有顆粒狀結構物的愈傷組織轉移到附加有ABA 0.4 mg/L和PEG-6000 50 g/L的體胚誘導培養基MB(-/+)上誘導體胚形成;在Bio2Y+50 g/L蔗糖培養基上促體胚發育成熟;在MS或1/2 MS培養基上促體胚萌發成苗。再生植株在光照培養箱內經過2周25 ℃、16 h/d的光照培養后移栽溫室。
1.5.2 PCR、RT-PCR和PCR-Southern檢測 植物基因組DNA的提取采用CTAB法。植物總RNA提取用上海華堯/華舜公司的RNArose。PCR擴增PPA基因的上游引物序列為:5′-ATGGCCTCCAAGCTCCTCCTC-3′,下游序列為:5′-CTACGCGGCAATTGGGCGCTT-3′,由生工生物工程(上海)股份有限公司合成。PCR反應所用TAQ酶、dNTP等試劑購自北京天根生化公司,RT-PCR反應所用試劑為TaKaRa RNA PCR Kit(AMV) Ver.3.0。Southern blot采用ROCHI公司生產的Dig High Prime Labeling and Detection Starter Kit I,根據產品說明書進行操作。
2 結果與分析
2.1 外植體來源對愈傷狀態的影響
子葉、葉柄、莖段、下胚軸等4種外植體在SHDK培養基上的愈傷誘導率差異不大,均可達到95%以上;但不同外植體對愈傷誘導表現出不同的時間響應和質量效果。下胚軸切段最先愈傷化,其次是葉柄、子葉,莖段反應最慢。在愈傷繼代過程中,莖段來源愈傷最易褐化死亡,淘汰率最高,其次是下胚軸來源愈傷,子葉和葉柄來源的愈傷狀態最好。下胚軸來源愈傷增殖速度較快,顏色較淺,分散性較強,不易分化體胚;子葉來源愈傷較易形成淺黃綠色、粘稠糊狀并嵌有顆粒狀物的胚性愈傷組織,體胚分化率較高,是比較理想的外植體來源。
2.2 培養基對體胚誘導效果的影響
挑選在SHDK培養基上獲得的淺黃綠色、粘稠并有顆粒狀結構物的愈傷組織轉移到體胚誘導培養基上,培養1周后,在MSBN培養基上的愈傷組織表面就陸續出現綠色的球狀突起,并很快形成較硬的“蓋”覆蓋愈傷,沒有體胚發生(圖1-a)。在MS0和MB(-)培養基上的愈傷組織,在培養2~3周后,肉眼可觀察到有體胚發生。MB(-)培養基的體胚誘導效果好于MS0(圖1-b,1-c)。MS0培養基上體胚數量較少,不僅發生體胚的愈傷塊數少,每塊愈傷上面形成的體胚數也少。MB(-/+)培養基[在MB(-)基礎上KNO3加倍]的體胚誘導效果較好,每一塊愈傷組織都有體胚形成,且愈傷組織內部到后期亦有體胚形成;體胚數量也較其他3個處理明顯增加(圖1-d),每克愈傷組織形成的體胚數平均為39.5±6.2。

A.MSBN培養基 MSDN medium; b.MS0培養基 MS0 medium; c.MB(-)培養基 MB(-) medium; d.MB(-/+)培養基 MB(-/+) medium
圖1 不同培養基上的體胚誘導效果
Fig.1 Somatic embryo induction on different media
2.3 體胚成熟與萌發
將子葉型胚直接轉移到MS0或1/2 MS培養基上后,大部分體胚不能正常萌發成苗。部分胚狀體子葉異常膨大后停止生長,或出現連體的子葉,或出現試管苗的玻璃化,或出現大量次級體胚,不能發育成完整的植株;有的胚狀體膨大后出現脫分化重新愈傷化現象。據2個批次試驗的調查統計,體胚正常萌發成苗的比率僅為5.8%(表2)。

為此,借鑒黎茵等[22]的方法,添加一個體胚成熟的液體培養過程,即將獲得的體胚放入促進體胚成熟的液體培養基(SH基本鹽+L-Proline 3.45 g/L+(NH4)2SO41.65 g/L+蔗糖20 g/L)中,100 r/min震蕩培養5~7 d,然后挑選發育正常的體胚轉移到1/2 MS或1/2 SH固體培養基上進行萌發培養,2周后調查體胚萌發率。由表3可見,增加這一促體胚成熟的液體培養過程,對提高體胚的正常萌發率效果并不明顯。

表2 未經體胚成熟培養過程的體胚發育情況Table 2 Development of somatic embryos without maturity promotion treatment
注: * 數據為2批次試驗“平均數±標準差”。
Note: Data marked with * represents average value and stand division of shoot percentage for Exp.1 and Exp.2.

表3 經過液體體胚成熟培養過程的體胚萌發情況Table 3 Development of somatic embryos after maturity promotion in liquid medium
因此,本研究又以ABA、AgNO3和PEG-6000為效應因子進行L9(34)正交試驗優化體胚誘導條件。結果表明,在體胚誘導培養基中添加AgNO3、PEG、ABA等對以后體胚萌發的影響效果不同(表4)。PEG-6000的效應值最大,硝酸銀為負效應。最后確定合適的體胚誘導培養基為MB(-/+)+ABA 0.4 mg/L+PEG-6000 50 g/L+蔗糖50 g/L+瓊脂4.5 g/L,pH 5.8。最適條件下,每克胚性愈傷組織可產生77.9個正常(或健康)體胚。
將誘導的體胚適時轉移到Bio2Y培養基上進行10~14 d的促發育培養,可減少MB(-)培養基上時間太長引發的球形胚重愈傷化現象,從而進一步提高體胚的正常萌發率。最終建立體胚高頻發生、正常萌發的苜蓿離體再生技術體系,即:SHDK培養基上誘導愈傷,MB(-/+)+ABA 0.4 mg/L+PEG-6000 50 g/L+蔗糖50 g/L培養基上誘導體胚,Bio2Y培養基上促體胚發育成熟,1/2 MS(或SH)培養基上體胚萌發成苗。再生植株在光照培養箱內經過2周20 ℃、16 h/d的光照培養后移栽溫室,成活率90%以上。體胚萌發、再生植株移栽前煉苗及溫室移栽情況見圖2。
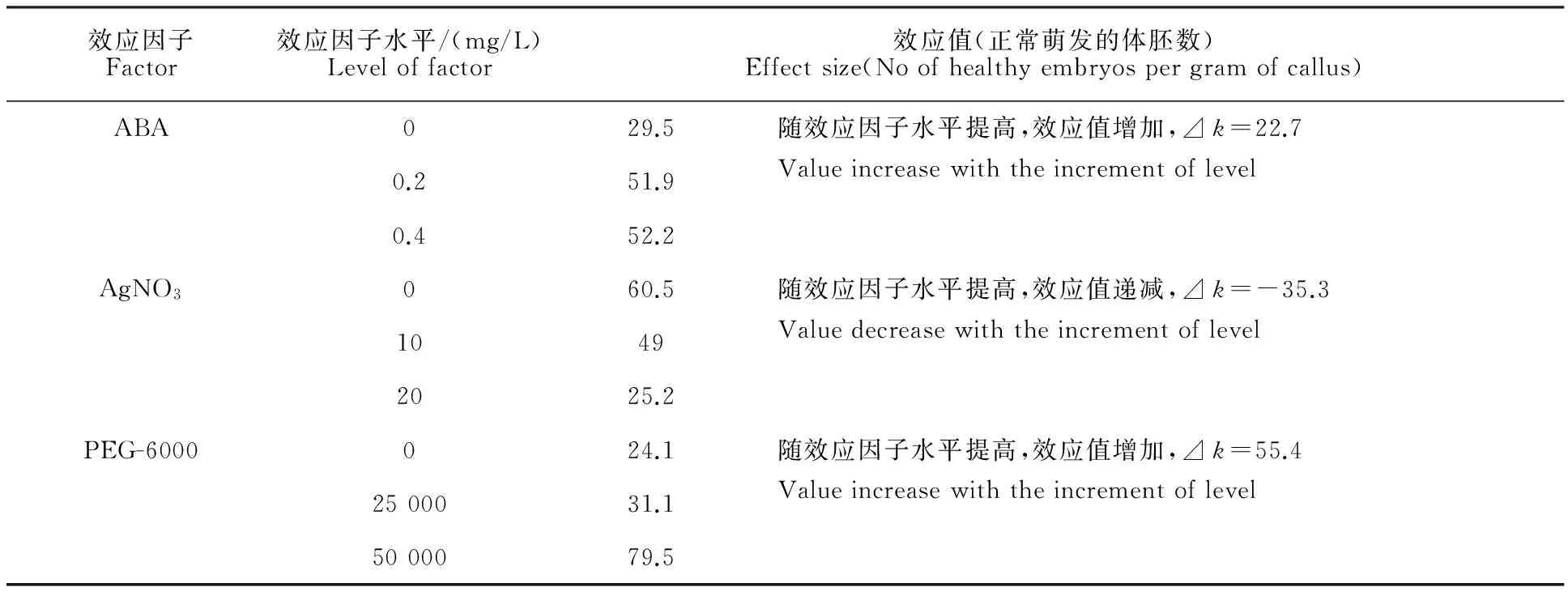
表4 AgNO3、PEG和ABA對苜蓿健康體胚誘導的效應比較[L9(34)]Table 4 Effect of AgNO3,PEG and ABA on the induction of somatic embryos in alfalfa

A.培養基上體胚萌發情況 Embryo germination on medium;b.光照培養箱內煉苗 Plantlets acclimatization in growth cabinet;c.溫室內移栽成活 Plantlets grown in soil
圖2 再生植株的成苗與移栽
Fig.2 Formation and transplanting of plantlets
2.4PPA抗蚜基因轉化苜蓿
共侵染經預培養3 d的子葉50枚,在含有30 mg/L卡那霉素的SHDK培養基上獲得抗性愈傷組織23塊,抗性愈傷獲得率為46%。抗性愈傷在含有15 mg/L卡那霉素的體胚誘導及體胚萌發培養基上培養后獲得16個再生植株。再生植株經練苗后移栽溫室成活9株。經PCR(圖3-a)、PCR-Southern(圖3-b)鑒定8株為陽性,表明外源PPA基因已整合進苜蓿基因組。RT-PCR結果表明,外源PPA基因可在轉錄水平正常表達(圖3-c)。
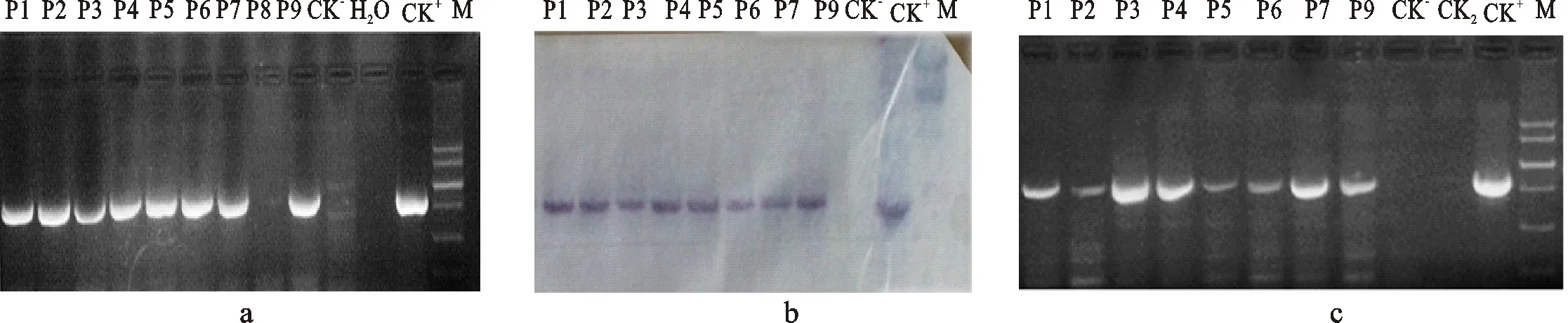
A.轉PPA基因苜蓿的PCR方法檢測 Detection ofPPAgene in transgenic alfalfa by PCR method; b.轉PPA基因苜蓿的PCR-Southern鑒定 Identification ofPPAgene in transgenic alfalfa by PCR-Southern method; c.轉PPA基因苜蓿在轉錄水平的表達檢測 Detection ofPPAgene expression at the transcription level in transgenic alfalfa.
P1~P9.轉化再生植株 Plantlets regenerated from transformation; CK-.陰性對照 Negative control without transformation; CK+.陽性對照 Positive control plant; CK2.P9植株經DNase I 消化后的RNA樣品,以排除樣品未消化干凈的DNA樣品干擾 RNA sample from plant P9 digested with DNase I to verify if the DNA contamination was eliminated.
圖3 轉PPA基因苜蓿的分子鑒定
Fig.3 The identification ofPPAtransgenic alfalfa by PCR,PCR-Southern and RT-PCR methods
3 討 論
紫花苜蓿的愈傷誘導多以MS、UM、SH等為基礎培養基附加不同種類和濃度的植物激素[10,23-24]。激素中2,4-D作用最為顯著,其單獨使用或與其他細胞分裂素組合,都能成功地誘導出愈傷組織。不同的2,4-D濃度,誘導的愈傷組織結構形態差異很大,不同外植體來源的愈傷組織生長所需的激素種類和濃度也不同[25]。本研究采用SH為基礎培養基,比較容易地誘導出呈粘稠、微黃綠色、具結構性內容物的胚性愈傷組織。困難的是體胚,特別是“健康”體胚的誘導和成熟。只有“健康”的體胚才可最終發育成完整的植株。


4 結 論

Reference:
[1] 梁慧敏,夏 陽,孫仲序,等.根癌農桿菌介導苜蓿遺傳轉化體系的建立[J].農業生物技術學報,2005,13(2):152-156.
LIANG H M,XIA Y,SUN ZH X,etal.Establishment of genetic transformation system ofMedicagosativamediated byAgrobacteriumtumefaciens[J].JournalofAgriculturalBiotechnology,2005,13(2):152-156(in Chinese with English abstract).
[2] ZHANG H,HUANG Q M,SU J.Development of alfalfa(MedicagosativaL.) regeneration system and Agrobacterium-mediated genetic transformation [J].AgriculturalSciencesinChina,2010,9(2):170-178.
[3] 王庭輝,馬暉玲,史 毅,等.基于漩渦振蕩莖尖生長點轉化法的Lyz-GFP雙元基因在‘隴東苜蓿’中的轉化和表達[J].甘肅農業大學學報,2012,47(5):109-114.
WANG T H,MA H L,SHI Y,etal.Transformation and expression of the dual genes of Lyz-GFP gens in alfalfa(‘Long Dong’) based on the method of vortex concussion growing point of stem tip [J].JournalofGansuAgriculturalUniversity,2012,47(5):109-114(in Chinese with English abstract).
[4] 魏正巍,朱延明,化 燁,等.轉 GsPPCK1基因苜蓿植株的獲得及其耐堿性分析[J].作物學報,2013,39(1):68-75.
WEI ZH W,ZHU Y M,HUA Y,etal.Transgenic alfalfa with GsPPCK1 and its alkaline tolerance analysis [J].ActaAgronomicaSinica,2013,39(1):68-75(in Chinese with English abstract).
[5] 吳 婧,才 華,柏 錫,等.轉 GsGST13/SCMRP基因雙價苜蓿的耐鹽性分析[J].草業學報,2014,23(1):257-265.
WU J,CAI H,BAI X,etal.An analysis of salt tolerance of transgenic alfalfa with the GsGST13/SCMRP gene [J].ActaPrataculturaeSinica,2014,23(1):257-265(in Chinese with English abstract).
[6] WEEKS J T,YE J,ROMMENS C M.Development of an in planta method for transformation of alfalfa(Medicagosativa) [J].TransgenicResearch,2008,17(4):587-597.
[7] 盛 慧,朱延明,李 杰,等. DREB2A 基因對苜蓿遺傳轉化的研究[J].草業科學,2007,24(3):40-45.
SHEN H,ZHU Y M,LI J,etal.Genetic transformation of DREB2A gene into alfalfa [J].PrataculturalSclence,2007,24(3):40-45(in Chinese with English abstract).
[8] 葛 軍,劉振虎,盧欣石.紫花苜蓿再生體系研究進展[J].中國草地,2004,26(2):63-68.
GE J,LIU ZH H,LU X SH.Review on the research progress of regeneration system of alfalfa [J].GrasslandofChina,2004,26(2):63-68(in Chinese with English abstract).
[9] UZELAC B,NINKOVI S,SMIGOCKI A,etal.Origin and development of secondary somatic embryos in transformed embryogenic cultures ofMedicagosativa[J].BiologiaPlantarum,2007,51(1):1-6.
[10] 王成龍,周美亮,董雪妮,等.紫花苜蓿兩種再生體系的優化及比較[J].中國農業科技導報,2015,17(4):53-61.
WANG CH L,ZHOU M L,DONG X Netal.Optimization and comparison of two regeneration system of alfalfa(MedicagosativaL.) [J].JournalofAgriculturalScienceandTechnology,2015,17(4):53-61(in Chinese with English abstract).
[11] GONZALEZ J M,FRIERO E,JOUVE N.Influence of genotype and culture medium on callus formation and plant regeneration from immature embryos ofTriticumturgidumDesf.cultivars [J].PlantBreeding,2001,120(6):513-517.
[12] ZALE J M,BORCHARDT-WIER H,KIDWELL K K,etal.Callus induction and plant regeneration from mature embryos of a diverse set of wheat genotypes [J].PlantCell,TissueandOrganCulture,2004,76(3):277-281.
[13] JIN S,ZHANG X,NIE Y,etal.Identification of a novel elite genotype for in vitro culture and genetic transformation of cotton [J].BiologiaPlantarum,2006,50(4):519-524.
[14] PARROTT W A,WILLIAMS E G,HILDEBRAND D F,etal.Effect of genotype on somatic embryogenesis from immature cotyledons of soybean [J].PlantCell,TissueandOrganCulture,1989,16(1):15-21.
[15] 郭新梅,張曉東,韓立新,等.不同基因型玉米幼胚愈傷組織的培養特性[J].西北農林科技大學學報(自然科學版),2007,35(4):68-72.
GUO X M,ZHANG X D,HAN L X,etal.Characteristic of callus induced from immature embryo among different maize inbreds [J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2007,35(4):68-72(in Chinese with English abstract).
[16] CHEN T H H,MAROWITCH J,THOMPSON B G.Genotypic effects on somatic embryogenesis and plant regeneration from callus cultures of alfalfa [J].PlantCell,TissueandOrganCulture,1987,8(1):73-81.
[17] DU S,ERICKSON L,BOWLEY S.Effect of plant genotype on the transformation of cultivated alfalfa(Medicagosativa) byAgrobacteriumtumefaciens[J].PlantCellReports,1994,13(6):330-334.
[18] SCHENK R U,HILDEBRANDT A C.Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures [J].CanadianJournalofBotany,1972,50(1):199-204.
[19] MURASHIGE T,SKOOG F.A revised medium for rapid growth and bioassay with tobacco tissue cultures [J].PhysiologiaPlantarum,1962,15(3):473-497.
[20] ATANASSOV A,BROWN D C W.Plant regeneration from suspension culture and mesophyll protoplasts ofMedicagosativaL.[J].PlantCell,TissueandOrganCulture,1984,3(2):149-162.
[21] LIU Z H,ZHANG H M,LI G L,etal.Enhancement of salt tolerance in alfalfa transformed with the gene encoding for betaine aldehyde dehydrogenase [J].Euphytica,2011,178(3):363-372.
[22] 黎 茵,黃學林,肖潔凝,等.根癌農桿菌介導苜蓿體胚轉化及轉基因植株再生[J].中山大學學報(自然科學版),2004,43(4):79-81.
LI Y,HUANG X L,XIAO J N,etal.Regeneration of transgenic alfalfa(MedicagosativaL.) byAgrobacteriummediatedtransformation[J].ActaScientiarumNaturaliumUniversitatisSunyatseni,2004,43(4):79-81(in Chinese with English abstract).
[23] 張 麗,甘曉燕,王敬東,等.6個紫花苜蓿栽培品種高效再生體系的建立[J].西北農業學報,2013,22(8):72-77.
ZHANG L,GAN X Y,WANG J D,etal.Efficient regeneration system of six cultivars inMedicagosativa[J].ActaAgriculturaeBoreali-occidentalisSinica,2013,22(8):72-77(in Chinese with English abstract).
[24] 楊國鋒,毛雅妮,孫 娟,等.聚乙二醇6000對雜花苜蓿體胚發生的影響及體胚的細胞學觀察[J].中國農學通報,2010,26(18):63-66.
YANG G F,MAO Y N,SUN J,etal.Effects of PEG 6000 on somatic embryogenesis of variegated alfalfa and cytological observation of somatic embryo [J].ChineseAgriculturalScienceBulletin,2010,26(18):63-66(in Chinese with English abstract).
[25] 肖荷霞,王 瑛,高 峰,等.外植體及激素對SANDITI紫花苜蓿愈傷組織誘導和分化的影響[J].河北農業大學學報,2003,26(4):47-52.
XIAO H X,WANG Y,GAO F,etal.Induction and regeneration of callus ofMedicagosativaL.‘SANDITI’ [J].JournalofHebeiAgriculturalUniversity,2003,26(4):47-52(in Chinese with English abstract).
[26] 張萬軍,王 濤.紫花苜蓿愈傷成苗高頻再生體系的建立及其影響因子的研究[J].中國農業科學,2002,35(12):1579-1583.
ZHANG W J,WANG T.Construction the system of high frequency regeneration from callus of alfalfa and study on the effect factors [J].ScientiaAgriculturaSinica,2002,35(12):1579-1583(in Chinese with English abstract).
[27] WALKER K A,SATOS J.Morphogenesis in callus tissue ofMedicagosativa:the role of ammonium ion in somatic embryogenesis [J].PlantCell,TissueandOrganCulture,1981,1(1):109-121.
[28] 王海波.植物組織與細胞培養通用分析模式的探討[D].北京:中國農業科學院,1994.
WANG H B.Studies on common analytical formular for plant in vitro culture [D].Beijing: Chinese Academy of Agricultural Sciences,1994(in Chinese with English abstract).
[29] ATTREE S M,MOORE D,SAWHNEY V K,etal.Enhanced maturation and desiccation tolerance of white spruce [Piceaglauca(Moench) Voss] somatic embryos:effects of a non plasmolysing water stress and abscisic acid [J].AnnalsofBotany,1991,68(6):519-525.
[30] PARROTT W A,BAILEY M A.Characterization of recurrent somatic embryogenesis of alfalfa on auxin-free medium [J].PlantCell,TissueandOrganCulture,993,32(1):69-76.
[31] DAS NEVES L O,DUQUE S R L,DE ALMEIDA J S,etal.Repetitive somatic embryogenesis inMedicagotruncatulassp.narbonensis andM.truncatulaGaertn cv.‘Jemalong ’[J].PlantCellReports,1999,18(5):398-405.
[32] 沈海龍,高翔翔,楊 玲.甘露醇、蔗糖和低溫預處理對花楸體細胞胚誘導的影響[J].植物生理學通訊,2008,44(4):677-681.
CHEN H L,GAO X X,YANG L.Effects of mannitol,sucrose and cold pretreatment on somatic embryogenesis ofSorbuspohuashanensis(Hance) Hedl [J].PlantPhysiologyCommunications,2008,44(4):677-681(in Chinese with English abstract).
(責任編輯:顧玉蘭 Responsible editor:GU Yulan)
High Frequency of Embryogenesis and Germination to Seedling in Alfalfa and Its Application in Transgenic Research
WEN Zhiyu1,DONG Fushuang1,ZHANG Huaning1,YANG Ruijuan1,2and ZHANG Yanmin1
(1.Institute of Genetics and Physiology,Hebei Academy of Agriculture and Forestry Sciences/Plant Genetic Engineering Center of Hebei Province,Shijiazhuang 050051,China;2.College of Life Science,Hebei Normal University,Shijiazhuang 050024,China)
The objective of this study was to establish the technique for high efficient embryogenesis and seedling development using cotyledons or leaves from aseptic seedlings as explants,which will provide a technical support for genetic improvement of tolerance to abiotic stresses in alfalfa(Medicagosativa).The effects of different medium ingredients on callus induction,embryogenetic induction,maturation,and germination were compared.The technique for high-frequency of embryogenesis included induction of callus on SHDK medium,induction of embyros on MB(-/+) + 0.4 mg/L ABA+50 g/L PEG-6000+50 g/L sucrose,growth of embryos on Bio2Y medium,and development of seedling on 1/2 MS(or SH) medium.Under the optimal conditions,about 77.9 healthy embryos that formed seedlings were produced per gram of callus.The seedlings regenerated were grown in a growth chamber at 20 °C with a photoperiod of 16 h light and 8 h dark for two weeks prior to transplanting to a greenhouse,and the survival rate was over 90%.This technique was successfully used in the transformation ofPPAgene into alfalfa and the transgenic alfalfa with resistance to aphid was obtained.
MedicagosativaL; Somatic embryogenesis; In vitro regeneration; Transgene
2016-03-18 Returned 2016-04-19
The Natural Science Foundation of Hebei Province,China(No.C2013301033).
WEN Zhiyu,male,associate research fellow.Research area: crop resources innovation.E-mail: wzy1800@126.com
ZHANG Yanmin,female,research fellow.Research area: tissue culture and transgenic technology.E-mail: zhym63@163.com
日期:2017-06-05
2016-03-18
2016-04-19
河北省自然科學基金(C2013301033)。 第一作者:溫之雨,男,副研究員,主要從事農作物資源創新研究。E-mail: wzy1800@126.com 通信作者:張艷敏,女,研究員,主要從事組織培養與轉基因技術研究。E-mail: zhym63@163.com
S512.1+2
A
1004-1389(2017)06-0882-08
網絡出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170605.1728.022.html

