辛伐他汀對膿毒癥小鼠肺損傷的保護作用
楊文萍,孔冰冰,趙 欣,張 榮,王 煜
·論著·
辛伐他汀對膿毒癥小鼠肺損傷的保護作用
楊文萍,孔冰冰,趙 欣,張 榮,王 煜*
目的 觀察辛伐他丁對膿毒癥小鼠急性肺損傷的保護作用,并探討其可能機制。方法 采用盲腸結扎穿孔術制備膿毒癥小鼠模型,將72只雄性C57BL/6小鼠隨機分成3組:假手術組、膿毒癥急性肺損傷組(膿毒癥組)、膿毒癥+辛伐他汀治療組(治療組)。治療組給予辛伐他汀0.2 μg/g,q12h腹腔注射1周;假手術組、膿毒癥組給予等量安慰劑腹腔注射1周。分別于造模后6、12、24 h留取肺臟標本。HE 染色觀察肺組織病理學變化,免疫組化檢測肺組織toll樣受體4(Toll-like receptor 4,TLR4)蛋白的表達,ELISA測定肺組織勻漿中IL-1β及TNF-α的表達水平。結果 與假手術組比較,造模后6、12、24 h,膿毒癥組肺組織病理學評分、肺組織TLR4蛋白的表達,以及TNF-α、IL-1β水平明顯升高(P<0.05);與膿毒癥組相比,治療組上述指標明顯降低(P<0.05)。結論 辛伐他汀通過抑制TLR4信號轉導通路,減少其下游炎癥介質TNF-α、IL-1β的釋放,對膿毒癥導致的急性肺損傷具有一定保護作用。
辛伐他汀;膿毒癥;toll樣受體4;TNF-α;IL-1β;急性肺損傷
0 引言
膿毒癥是宿主對感染的反應失調而導致危及生命的器官功能不全,是重癥監護病房的主要死因。肺臟是膿毒癥時最易受損傷的靶器官,急性肺損傷(Acute lung injury,ALI)出現最早,且發生率最高[1]。Toll-like receptor 4(TLR4)在膿毒癥所致肺損傷的病情發展中發揮重要作用,敲除TLR4基因或者靶向抑制TLR4的表達可以顯著減輕ALI的程度[2-4]。近年研究表明,他汀類藥物即3-羥基-3-甲基戊二酰輔酶A(HMG-CoA)還原酶抑制劑,具有獨立于降血脂作用之外的抗炎、免疫調節、改善血管內皮細胞等多效性。本研究采用盲腸結扎穿刺術(Cecal ligation and puncture,CLP)法復制膿毒癥大鼠模型,給予藥物辛伐他汀干預,探討辛伐他汀對膿毒癥急性肺損傷的保護作用及可能的機制。
1 材料和方法
1.1 實驗動物、試劑 健康SPF級C57BL/6成年雄性小鼠,體重:25~35 g。小鼠由我院本溪基地動物實驗中心提供,動物檢疫合格證號:SCXK(京)2014-0004。所有實驗通過我院動物實驗倫理委員會批準(倫理號:2015PS251K)。TLR4 Antibody購自美國Novus Biologicals公司,羊抗鼠免疫組化二抗試劑盒SP9002購自北京中杉金橋公生物技術公司,TNF-α 和IL-1β ELISA試劑盒購自欣博盛生物科技有限公司。
1.2 小鼠膿毒癥模型的制備 采用盲腸結扎穿孔法制備模型[5]。小鼠經5%水合氯醛(0.6 mL/100 g)腹腔注射麻醉后,采取前腹正中切口,沿前腹正中線作3 cm長的切口,從腹腔中取出盲腸,用5~0縫線結扎盲腸的50%(從盲腸游離端到結扎位置占盲腸全長的50%)。在盲端與結扎處的中點處,用18號針頭由腸系膜側無血管處向非腸系膜側貫穿盲腸,避開盲腸血管。從穿孔的兩端分別擠出少量糞便,然后將盲腸回納入腹腔,逐層關腹。假手術組實驗小鼠跳過盲腸結扎穿孔步驟,其他步驟與膿毒癥組相同。
1.3 實驗動物分組與處理 將C57BL/6成年雄性小鼠72只隨機分為3組:假手術組、膿毒癥急性肺損傷組(膿毒癥組)、膿毒癥+辛伐他汀治療組(治療組),每組24只。分別于造模前1周開始進行預處理:治療組給予辛伐他汀0.2 μg/g,間隔12 h,腹腔注射,共1周;假手術組、膿毒癥組給予等量安慰劑0.02 mL/g,間隔12 h,腹腔注射,共1周。分別于造模后的6、12、24 h進行取材。
1.4 肺組織病理學觀察 4%多聚甲醛固定小鼠肺組織,切割至厚度約0.5 cm組織塊,常規組織梯度酒精脫水、透明、浸蠟、包埋、連續切片,行 HE 染色。光鏡下觀察肺組織病理學變化。綜合肺泡水腫、間質水腫、肺泡內白細胞聚集數量、出血和肺泡壁厚度等采用肺損傷評分法評價肺損傷程度[6]。
1.5 肺組織TLR4蛋白的表達 肺組織TLR4蛋白檢測采用SP法。石蠟包埋肺組織切成3.5 u切片,常規脫蠟,PBS漂洗,3%過氧化氫去離子水阻斷內源性過氧化物酶活性。胰蛋白酶修復后,正常兔血清封閉非特異性抗原,滴加1∶500羊抗小鼠TLR4 抗體,4 ℃過夜。PBS漂洗后滴加辣根過氧化物酶標記山羊抗小鼠IgG二抗,37 ℃溫孵育30 min,PBS漂洗后DAB顯色蘇木素復染,脫水、透明、封片。陽性結果為呈環狀分布的棕黃色或棕褐色顆粒,通過NIS-ElementSF 2.30圖像采集軟件進行圖像采集,應用image-pro-plus軟件測出陽性部分平均光密度值(OD值)。
1.6 ELISA法測定肺組織TNF-α 和IL-1β 肺組織放入預冷的勻漿介質(pH 7.4,0.01 mol/L,Tris-HCL 0.000 1 mol/L EDTA-2Na,0.01 mol/L蔗糖,0.8%氯化鈉溶液)中研磨,4 ℃環境下制備肺組織勻漿。ELISA試劑盒測定小鼠肺組織TNF-α 和IL-1β含量,嚴格按使用說明書步驟進行操作。
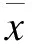
2 結果
2.1 光鏡下肺組織病理變化 假手術組小鼠肺臟無炎癥損害改變;膿毒癥組鏡下肺間質可見大量炎癥細胞浸潤,其中以淋巴細胞和漿細胞為主,支氣管周圍可見淋巴細胞團分布,彌漫的支氣管及肺泡擴張,肺泡相互融合。肺臟病理損害呈時間依賴性,其中以24 h肺臟損害最為明顯;辛伐他汀治療組可見淋巴細胞及漿細胞浸潤明顯減少,淋巴細胞團減少,甚至局部消失,支氣管及肺泡擴張較前明顯減輕,肺泡融合減少。見圖1。與假手術組比,膿毒癥組6 h、12 h和 24 h肺組織病理評分明顯增高(P<0.05);治療組各時間點肺組織評分均較同期膿毒癥組明顯降低(P<0.05),見表1。

表1 三組小鼠不同時點肺組織病理學評分比較
注:與假手術組比較,*P<0.05;與膿毒癥組比較,#P<0.05
2.2 肺組織TLR4蛋白的表達情況 TLR4為炎癥信號轉導通路重要介質,主要表達于肺泡細胞膜上,鏡下觀察陽性表達為棕色環形沉著顆粒,藍色為蘇木素染色的細胞核。鏡下可見假手術組無棕色顆粒沉著,TLR4表達不明顯;膿毒癥組肺泡細胞膜棕色顆粒廣泛均勻增多,且呈時間依賴性;治療組鏡下可見棕色顆粒明顯減少。與假手術組比,膿毒癥組6 h、12 h、24 h OD值均明顯增加,差異有統計學意義(P<0.05);與膿毒癥比,治療組12 h、24 h OD值明顯下降,差異有統計學意義(P<0.05)。見圖2和表2。

圖1 三組小鼠不同時點肺組織病理學變化(400×)
注:A.假手術組6 h;B.假手術組12 h;C.假手術組24 h;D.膿毒癥組6 h;E.膿毒癥組12 h;F.膿毒癥組24 h;G.治療組6 h;H.治療組12 h;I.治療組24 h。肺HE染色顯示,肺間質有大量的炎癥細胞浸潤,廣泛的支氣管和肺泡擴張;任何時間點治療組的肺損傷均較膿毒癥組減輕

圖2 三組小鼠不同時點肺組織TLR4蛋白的表達(400×)
注:A.假手術組6 h;B.假手術組12 h;C.假手術組24 h;D.膿毒癥組6 h;E.膿毒癥組12 h;F.膿毒癥組24 h;G.治療組6 h;H.治療組12 h;I.治療組24 h。免疫組化染色顯示,任何時間點膿毒癥組肺組織TLR4 蛋白表達均高于假手術組,假手術組的TLR4 蛋白表達均低于其他兩組

表2 小鼠肺組織TLR4蛋白表達水平的OD值(n=7)
注:與假手術組比較,*P<0.05;與膿毒癥組比較,#P<0.05
2.3 肺組織TNF-α水平 與假手術組比較,膿毒癥組6、12、24 h肺組織TNF-α水平均明顯升高,差異有統計學意義(P<0.05),其中以膿毒癥組12 h TNF-α 水平升高最顯著;辛伐他丁治療組各時點肺組織TNF-α水平較同期膿毒癥組明顯下降,差異有統計學意義(P<0.05),見表3。

表3 小鼠肺組織TNF-α表達水平(pg/mL,n=7)
注:與假手術組比較,*P<0.05;與膿毒癥組比較,#P<0.05
2.4 肺組織IL-1β水平 與假手術組比較,膿毒癥組6 h、12 h、24 h肺組織IL-1β水平均明顯升高,差異有統計學意義(P<0.05),其中以膿毒癥組12 h IL-1β 水平升高最顯著;辛伐他丁治療組各時點肺組織IL-1β水平較同期膿毒癥組明顯下降,差異有統計學意義(P<0.05),見表4。

表4 小鼠肺組織IL-1β表達水平(ng/mL,n=7)
注:與假手術組比較,*P<0.05;與膿毒癥組比較,#P<0.05
3 討論
膿毒癥導致的急性肺損傷在臨床中有很高的發生率和病死率,在抗感染治療基礎上,有效防治感染繼發的肺損傷是降低膿毒癥病死率的重要手段。動物實驗研究發現,膿毒癥導致的肺臟病理損害主要為炎癥細胞的浸潤、淋巴細胞團的形成、肺泡及支氣管的擴張、肺泡相互融合等一系列炎癥反應[7]。
Toll樣受體家族是一類固有免疫受體,分布十分廣泛,在淋巴細胞、單核細胞、巨噬細胞、樹突狀細胞中具有很高的表達。其中,TLR4是toll樣受體家族中的重要成員之一,屬于Ⅰ類跨膜受體,分子結構由細胞外區、跨膜區和細胞內區組成。TLR4的細胞外區是識別脂多糖的重要結構,經過跨膜區及細胞內區將信息整合導入細胞內,使細胞內區域發生聚合活化反應,引起細胞內廣泛的信號傳導,使NF-κB以二聚體的活化形式轉移進入細胞內,并與編碼TNF-α及IL-1β基因的順式元件結合,參與這些促炎因子基因的表達和調控[8]。膿毒癥引起急性肺損傷的一系列過度炎癥反應也正是通過TLR4通路的作用使肺泡巨噬細胞呈瀑布樣釋放TNF-α、IL-1β等促炎因子,最終導致急性呼吸窘迫綜合征[9-10]。TNF-α 是膿毒癥最早產生的多功能細胞因子,可以激活肺組織中的中性粒細胞、肺泡巨噬細胞、內皮細胞和血小板,進一步誘導氧自由基、其他炎性因子及溶酶體酶的產生和釋放,發揮“級聯放大”的作用,直接損害肺血管內皮細胞和肺泡Ⅱ型細胞,從而加重肺組織的損傷。炎癥反應過程中TNF-α是始動因素,IL-1β起協同作用[11]。IL-1β不能直接活化炎性白細胞,但可以引起IL-8的分泌,通過改變前炎癥介質或抗炎癥細胞因子的表達和影響組織多形核中性粒細胞聚集而促進炎癥的發展[12]。本實驗發現,膿毒癥大鼠6 h即出現肺組織TNF-α、IL-1β升高,12 h 達高峰,24 h稍下降。而辛伐他汀治療組各時點肺組織TNF-α、IL-1β表達明顯下降。膿毒癥組鏡下肺間質可見大量炎癥細胞浸潤,其中以淋巴細胞和漿細胞為主,彌漫的支氣管及肺泡擴張,肺泡相互融合;辛伐他汀治療組肺組織病理損傷明顯減輕。辛伐他汀的作用機制可能是其抑制了膿毒癥小鼠肺組織TLR4信號的激活,并由此減少了該信號通路下游炎癥因子TNF-α和IL-1β的產生,能部分改善膿毒癥所致的肺損傷。辛伐他汀是一種多靶點的肺損傷保護藥物,有望為膿毒癥的治療提供新的靶點。
[1] Ornellas DS,Maron-Gutierrez T,Ornellas FM,et al.Early and late effects of bone marrow-derived mononuclear cell therapy on lung and distal organs in experimental sepsis[J].Respir Physiol Neurobiol,2011,178 (2):304-314.
[2] Tauseef M,Knezevic N,Chava KR,et al.TLR4 activation of TRPC-6-dependent calcium signaling mediates endotoxin-induced lung vascular permeability and inflammation[J].J Exp Med,2012,209(11):1953-1968.
[3] He Z,Chen X,Wang S,et al.Toll-like receptor 4 monoclonal antibody attenuates lipopolysaccharide-induced acute lung injury in mice[J].Exp Ther Med,2014,8(3):871-876.
[4] Deng Y,Yng Z,Gao Y,et al.Toll-like receptor 4 mediates acute lung injury induced by high mobility group box-1[J].PloS One,2013,8(5):e64375.
[5] Rittirsch D,Huber-Lang MS,Flierl MA,et al.Immunodesign of experimental sepsis by cecal ligation and puncture[J].Nat Protoc,2009,4(1):31-36.
[6] Mikawa K,Nishilla K,Takao Y,et al.0NO-1714,a nitric oxide synthase inhibitor,attenuates endotoxin-induced acute lung injury in rabbits[J].Anesth Analg,2003,97(6):1751-1755.
[7] Tasaka S,Koh H,Yamada W,et al.Attenuation of endotoxin-induced acute lung injury by the Rho-associated kinase inhibitorY-27632[J] .Am J Respir Cell Mol Biol,2005,32(6):504-510.
[8] 付朝暉,姚尚龍,袁世熒.鹽酸戊乙奎醚對膿毒癥致大鼠急性肺損傷時Toll樣受體4及NT-κB表達的影響[J].中華麻醉學雜志,2013,33(9):1134-1137.
[9] 石計朋,黃麗密,錢燕,等.橄欖油脂肪乳對LPS誘導急性肺損傷SD幼年大鼠前炎癥因子TNF-α IL-1β、IL-6的影響[J].實用預防醫學,2014,21(3):275-277.
[10]岳穩娜.Toll樣受體與呼吸道感染性疾病的研究進展[J].國際兒科學雜志,2016,43(8):618-621.
[11]Levi M.The coagulant response in sepsis and inflammation[J].Ham ostaseologie,2010,30(1):10-12.
[12]Kim GP,Roh SI,Park SK.Alleviation of experimental spectic shock in mice by acidic polysaccharide isolated from the medicinal mushroom Phellinus Linteus[J].Biol Pharm Bull,2003,26(1q):1418-1423.
Protective effects of simvastatin on lung injury of sepsis mice
YANG Wen-ping,KONG Bing-bing,ZHAO Xin,ZHANG Rong,WANG Yu*
(Emergency Department,Shengjing Hospital of China Medical University,Shenyang 110004,China)
Objective To explore the protective effect of simvastatin on sepsis-induced lung injury of mice and its possible mechanisms.Methods Totally 72 male C57BL/6 rats were randomly divided into sham group,sepsis group of acute lung injury(sepsis group) and cecal ligation and puncture operation (CLP)+ simvastatin (treatment group).Rat sepsis model was established by CLP.The mice in treatment group were intraperitoneally injected with simvastatin (0.2 μg/g,once per 12 hours) for a week;mice in sham group and sepsis group were given equal volume of placebo.The lung tissue specimens were gathered at 6,12 and 24 h after operation.Pathological changes of lung tissue were observed by HE staining;the contents of lung TNF-α and IL-1β were detected by enzyme-linked immunosorbent assay (ELISA);the expression of TLR4 protein in lung tissues were detected by immunohistochemical method.Results The pathological scores of lung tissue,the expression of TLR4 protein and the levels of TNF-α and IL-1β in sepsis group were higher than those of sham group (P<0.05),and the above indexes in treatment group were lower than those of sepsis(P<0.05).Conclusion Simvastatin has certain protective effect on lung injury caused by sepsis.The effect may be mediated by the inhibition of TLR4 signal pathway by simvastatin and the consequent decrease of the generation of downstream inflammatory factors,such as TNF-αand IL-1β.
Simvastatin;Sepsis;Toll-like receptor 4;TNF-α;IL-1β;Acute lung injury
2017-03-14
中國醫科大學附屬盛京醫院急診科, 沈陽 110004
遼寧省自然科學基金項目(2015020527)
10.14053/j.cnki.ppcr.201707001
*通信作者

