雌激素與尾懸吊法導致雄性C57小鼠骨質疏松關系的研究
程強 康文博 孟嘉 李碩 劉剛 趙建寧*
1. 南京大學醫學院附屬金陵醫院骨科,江蘇 南京 210046; 2. 第四軍醫大學基礎部藥理學教研室,陜西 西安 710032
骨質疏松以骨含量下降,骨結構退化為基本特征,往往引發疼痛和骨折[1]。目前大多數研究集中于卵巢切除和絕經后導致的骨質疏松,男性骨質疏松方面的研究較少。男性在青年時期可比女性獲得更高的骨量峰值,并且男性出現骨量丟失的開始時間遲于女性,但骨質疏松性骨折給男性患者造成損傷絲毫不遜于女性[2]。過去的觀點認為雄激素水平下降在男性原發性骨質疏松過程中發揮了主導作用[3]。最新研究發現,雄激素完全不敏感綜合征患者仍具有正常生長體形和骨骼成熟,且單一的雄激素不能彌補由于雄激素受體功能喪失的骨質丟失[4],表明雄激素在維持骨量過程中的作用可能沒有我們想象中的那么強大。在雌激素缺乏性骨質疏松模型中,雌激素比雄激素更能有效地反映骨轉化水平和骨密度[5,6]。臨床研究證實雌激素對絕經后骨質疏松有良好的治療作用,這一過程主要是通過雌激素受體 (ER)α和β實現對骨骼代謝的調節[7,8],但是其具體作用機制尚未完全明確。
尾懸吊是一種研究失重與廢用的方法,最早在1979年由Morey等[9]提出,廣泛運用于研究微重力環境下動物肌肉萎縮和骨質疏松方面的研究。不同年齡,性別以及基因背景骨質疏松程度差異性較大,目前以SD或者Wistar大鼠最為常用,但在藥物效應評價方面,大鼠骨皮質重建活性較低不利于于評價[10],同為嚙齒類動物的小鼠也很常見,其中以個體差異性較小、適應性佳的C57小鼠最為常用[11],處于生長期的小鼠對尾懸吊最敏感[12]。
為了進一步了解雌激素以及雌激素受體在尾懸吊導致的小鼠骨質疏松中的作用,本文在前期建立C57小鼠骨質疏松模型基礎上,通過給予雌激素以及雌激素受體拮抗劑ICI182,780干預,探討雌激素對雄性C57小鼠骨質疏松的作用及其內在機制。
1 材料和方法
1.1 實驗分組和造模
32只10周齡雄性C57BL/6J小鼠22~23 g,由第四軍醫大學實驗動物中心提供。小鼠適應性飼養1w后按照隨機數表法分為4組,即對照組(control,C),模型組(model,M),雌激素組(estrogen,E2),雌激素+雌激素受體抑制劑組(estrogen+ICI182,780,E+I)。根據之前的方法除對照組外建立小鼠尾懸吊模型[13],所用試劑溶于10%乙醇溶液中,C和M組分別皮下注射10%乙醇溶液50 μL/d天,E2組給予雌激素1 μg/d,E+I組分別給予雌激素1 μ和ICI182,780 100 μg/d,持續兩周。本實驗相關動物使用遵守“第四軍醫大學動物實驗管理條例”。
1.2 主要試劑
獸用雌二醇注射液(杭州動物藥品廠),小鼠麻醉劑(5%水合氯醛溶液),雌激素ELISA試劑盒(武漢博士德生物工程有限公司),小鼠TRAP,OPG,NMDA免疫組化染色試劑盒(中杉金橋),ICI182,780(北京樂博生物科技有限公司),小鼠NR2A、Runx2-抗(美國abcam公司),小鼠來源二抗(西安壯志生物科技有限公司)。
1.3 標本采集
所用實驗動物于第15d脫頸致死,取小鼠眼球血后離心得血清置于-20℃保存,用于ELISA試劑盒檢測血清中雌激素水平,取雙側股骨用0.9%氯化鈉注射液浸潤的紗布包裹,保存于-70℃。
1.4 Micro CT掃描及重建分析
顯微CT是一種非侵入性評估手段,為骨質疏松程度提供準確的定性及定量分析[14]。每組取4根右側股骨,用小動物顯微CT(Inveon,德國西門子公司)掃描重建。選取股骨髁生長板近端0.5~1.5 mm處和股骨正中1.0 mm區域作為興趣區(region of interest,ROI)分析小梁骨相對體積(bone volume/total volime,BV/TV)、小梁骨數量(trabecular bone number,Tb.N)、小梁骨分離度(trabecular bone separation,Tb.Sp)、小梁骨厚度(trabecular bone thickness,Tb.Th),皮質骨BMD(bone mineral density),表長度(cortical area,Ct.Ar)、厚度(cortical thickness,Ct.Th)等指標。采用Mimics軟件(版本10.0,美國Materialise公司)建立ROI三維圖像。
1.5 生物力學檢測
每組取4根左側股骨,利用電子三點彎曲疲勞試驗機(型號ELF3520,美國BOSE公司)進行三點彎曲測試,測試股骨中段生物力學性能。參數設置:速度1.2 mm/min,跨距8 mm至股骨斷裂。隨后使用游標卡尺量取斷端內外徑以及皮質骨厚度,重復3次取平均值。直接記錄最大載荷(nax loading),根據檢測結果繪制載荷-變形曲線計算彎曲彈性模量(Elastic modulus)[13]。
1.6 形態學檢查
取各組剩余的右側股骨,固定于4%多聚甲醛溶液中,EDTA脫鈣,石蠟包埋[13],沿冠狀面切片進行OPG、TRAP以及NMDA免疫組化染色,分別觀察成骨、破骨細胞形態以及NR2A受體表達情況。每根股骨各選取三張400倍鏡染色圖片,使用Image Pro Plus圖像分析軟件(版本6.0,美國Cybernetics公司)統計骨表面成骨細胞數(N.Ob/BS)以及破骨細胞數(N.Oc/BS)并取平均值,測量三張片子NR2A平均光密度值。
1.7 蛋白免疫印跡(Western blotting)
取各組剩余的左側股骨,選定股骨遠端1.5 mm區域的骨,剔除骨膜,PBS沖洗骨髓腔,用錫箔紙包裹后置于-70℃保存12 h后置于液氮中。用研磨方法提取骨蛋白[15],并轉移到PVDF膜上,5%脫脂牛奶洗封閉,NR2A、Runx2一抗孵育過夜,抗鼠二抗孵育1 h以上。β-actin作為內參,將對照組β-actin的光密度值設為1,使用Tanon 5200全自動化學發光成像分析系統進行拍攝和分析。
1.8 統計學處理
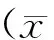
2 結果
2.1 一般狀況
小鼠一般狀態良好,無意外死亡,體重及血清雌激素變化見表1,尾懸吊小鼠3 d后體質量達到最低點,隨后緩慢上升,至14 d時M組小鼠體重仍顯著低于C組(P<0.05),但是與E+I組相比,差異無統計學意義。M組小鼠血清雌激素水平較C組顯著下降,差異有統計學意義(P<0.05),而E+I和E組小鼠血清雌激素含量顯著高于C和M組。
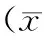
表1 不同組小鼠體質量與雌激素水平±s)Table 1 Changes of mice body weight and estrogen level in different groups(±s)
與C組比較,*P<0.05,**P<0.01;與M組比較,#P<0.05,##P<0.01,下同。
2.2 顯微CT掃描
顯微CT掃描結果見表2,M組小梁骨多數參數下降,與C組相比差異具有統計學意義。E組各項參數顯著改善并好于M組,與C組相比差異無統計學意義,E+I組各參數水平與M組類似。M組皮質骨BMD較C組下降明顯,E組皮質骨有部分指標好于C組。E+I組的皮質骨指標較C組和E組明顯下降,但是與M組相比差異無統計學意義。圖1可見M組和E+I組股骨遠端骨小梁區域較C組破壞,空洞明顯,各組皮質骨結構完整但M組和E+I組明顯變薄。
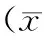
表2 不同組小鼠小梁骨和皮質骨參數±s)Table 2 Changes of trabecular bone parameters in different groups(±s)
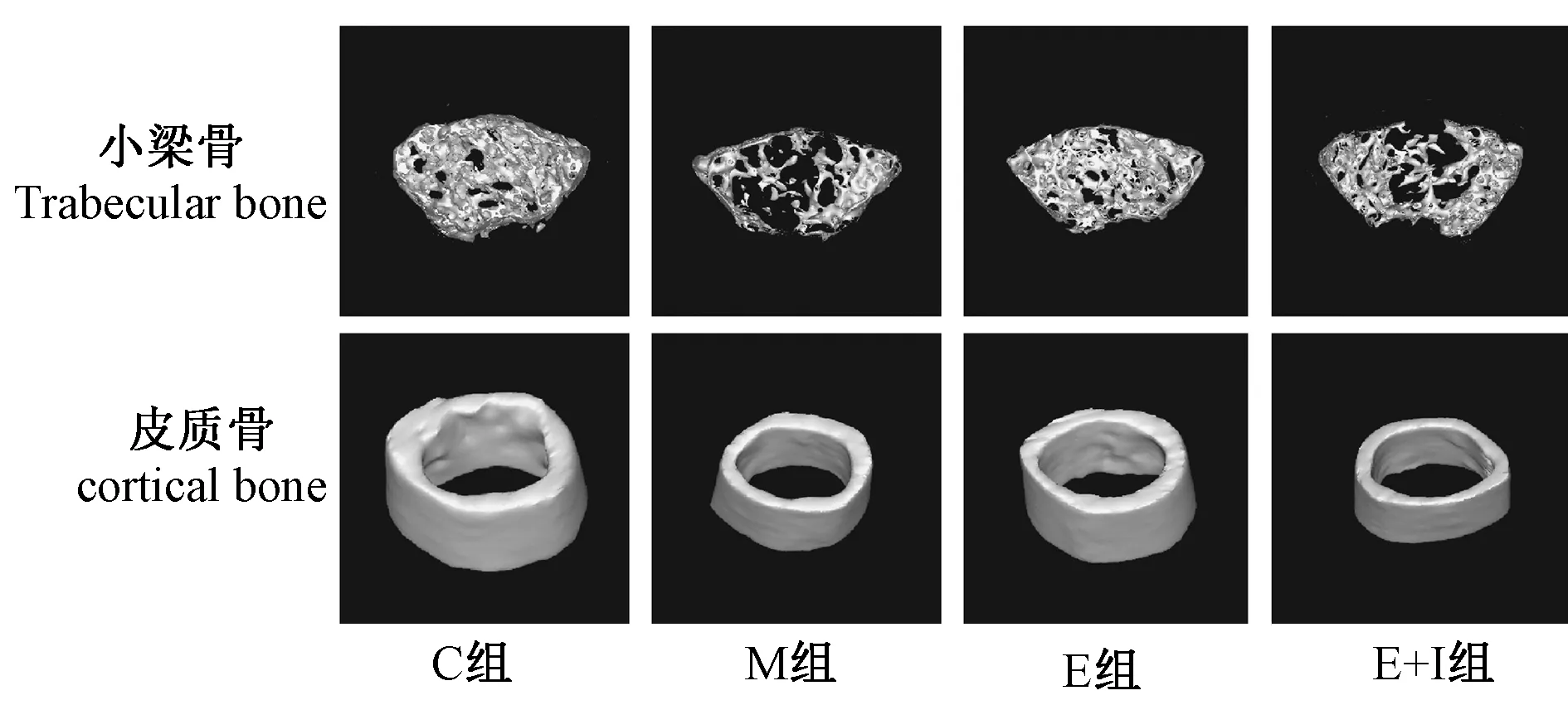
圖1 不同組小鼠股骨ROI三維重建圖像示意圖Fig.1 3D pictures of ROI of the femur in different groups
2.3 生物力學檢測
生物力學檢測結果見表3,尾懸吊導致M組和E+I組的生物學指標顯著下降,其中最大載荷、彈性模量等指標較C組顯著下降,M組與E+I組相比差異無統計學意義。
2.4 形態學變化
圖3為不同組股骨遠端形態學示意圖,統計各組單位長度內成骨細胞數(表5),發現M組顯著低于C組,差異有統計學意義,而E組成骨細胞數較M組顯著上升,使用雌激素抑制劑干預之后,成骨細胞數目明顯下降;統計各組單位長度內破骨細胞數(表5),M組中破骨細胞數較對照組增多,而E組和E+ICI組中破骨細胞數無明顯變化。統計不同組NR2A平均光密度值(表5),M組較C組顯著下降,雌激素干預后E組顯著上升,應用雌激素受體抑制劑后上升勢頭得到抑制。
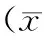
表3 不同組小鼠股骨生物力學指標±s)Table 3 Mechanical properties of the femur in different groups(±s)
2.5 WB
圖3A是不同組小鼠骨蛋白的表達示意圖,可見尾懸吊2 w后,M組NR2A(圖3B)以及Runx2蛋白(圖3C)表達顯著降低,E組表達升高,使用雌激素受體抑制劑后,上述蛋白表達水平受到抑制。
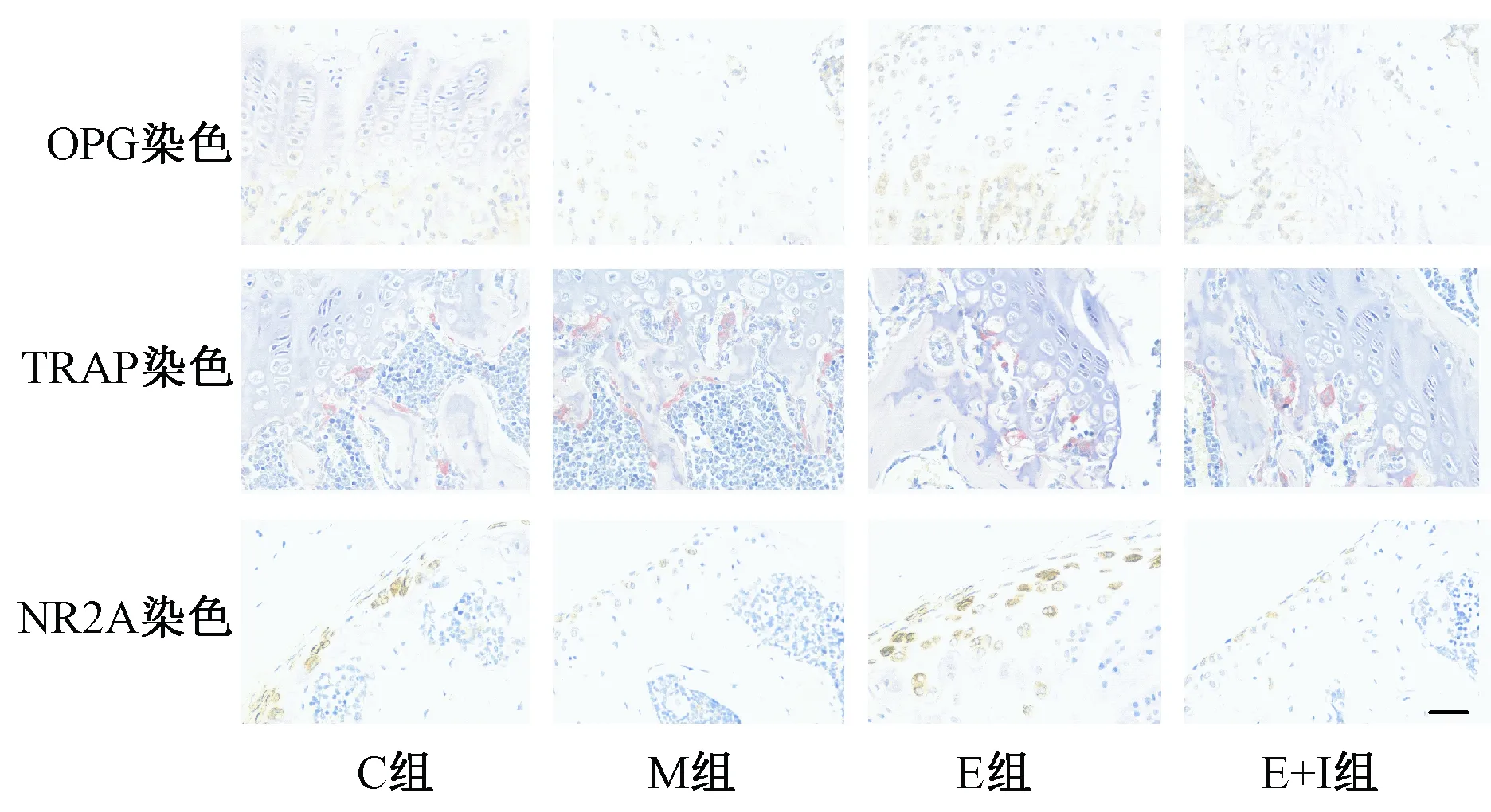
圖2 不同組小鼠股骨遠端形態學示意圖(n=4,比例尺:200 μm)Fig.2 Morphological changes of the distal femur in different groups (n=4, scale bar: 200 μm)
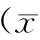
表5 不同組小鼠骨小梁成骨細胞和破骨細胞計數±s)Table 5 Number of osteoblasts and osteoclasts in the trabecular bone in different groups(±s)
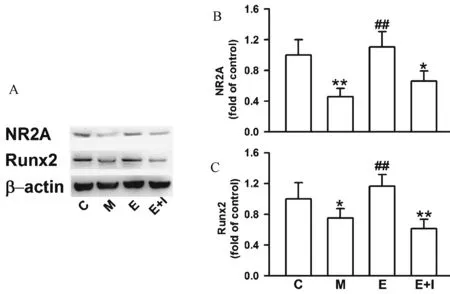
圖3 不同組小鼠骨相關蛋白表達Fig.3 Expression of osteogenesis-associated proteins in different groups
3 討論
尾懸吊兩周就能引起小鼠骨質的顯著丟失,其具體機制尚未完全清楚。雌激素作為一種內源性激素,具有較好的耐受性,對絕經后骨質疏松等高代謝型骨質疏松有較好的治療效果[16]。研究發現雌激素在雄性體內具有重要作用,且這一過程與雌激素受體的表達水平密切相關[17]。性激素主要來源于睪丸,卵巢,少部分來源于腎上腺。嚙齒類動物因其特殊的生理構造,懸尾狀態下雄鼠的睪丸會回縮進入腹腔,造成睪酮合成水平下降[18],而雄鼠體內的雌激素大部分由睪酮轉化而來,因而懸尾的直接后果導致了體內雌激素水平的明顯下降,這與本文的研究結果相符,懸尾兩周后M組小鼠雌激素水平較C組下降了50%左右。
雌激素是脂溶性且易被胃酸分解,本文中將雌激素溶于花生油中,并通過皮下注射的方式進行給藥,既提高了藥物吸收率又避免肌肉注射引起局部組織壞死。在劑量選擇方面參照文獻[19],該生理劑量的雌激素已經被證實具有較好的骨量、骨顯微結構保護作用。ICI182,780是一種非特性雌激素受體抑制劑,能夠無差別阻斷ERα和β[20]。研究發現雌激素受體缺陷患者,其體內雌激素水平正常,但是骨質流失現象卻十分嚴重[21],而在芳香化酶缺陷的患者中,雄激素正常而雌激素水平偏低,同樣也存在此現象,此外ERα、β基因敲除小鼠也出現了骨質疏松[22]。本文發現補充外源性雌激素之后,能較好地抑制骨質流失,較對照組并未出現顯著骨容量下降。使用雌激素受體抑制劑干預后骨質流失并未得到顯著改善,表明在此過程中雌激素通過雌激素受體發揮骨保護作用。
谷氨酸是一種突觸興奮性遞質,通過調節cbfa1/Runx2信號通路促進骨組織中成骨細胞的增殖和分化[23],介導谷氨酸釋放的離子型谷氨酸受體NMDA受體的亞型2A(NR2A)表達十分活躍[24]。本文中發現尾懸吊2w后,M組小鼠股骨遠端NR2A表達量顯著下降,E組表達水平明顯回升并超過C組,E+I組的NR2A仍處于較低水平。反映成骨細胞增殖分化活性的重要分子Runx2,其表達趨勢與NR2A基本一致,表明雌激素與雌激素受體結合后,可能參與了促進NMDA受體激活和谷氨酸釋放的過程,最終引發成骨細胞增殖。
男性隨著年齡增長體內雄激素水平逐漸下降,但是雌激素水平在青年與老年時期差別大不,這部分解釋了老年男性發生發生骨質疏松的概率低于老年女性[25],因此將雌激素水平作為判定骨質疏松的指標比雄激素更加具有說服力。本文發現使用雌激素受體抑制劑之后,雌激素抗骨質疏松的效應基本喪失,說明雌激素受體在抗骨質疏松中過程中起關鍵作用,雌激素和雌激素受體兩者作用相輔相成,缺一不可。但是長期運用雌激素來的不良反應,大大限制了其在臨床的運用。本文發現雌激素發揮骨質疏松作用,可能是通過促進NR2A受體表達刺激谷氨酸釋放來實現的,這就為將來尋找新型抗骨質疏松藥物提供了思路:直接調節NMDA受體的藥物可能具有類雌激素效應,同時也避免了運用雌激素帶來的不良反應。
綜上,本實驗發現在尾懸吊導致的雄性小鼠骨質疏松模型中,雌激素通過雌激素受體,可能參與激活骨組織中的NR2A表達升高,促進成骨細胞增殖和分化,發揮骨保護的作用。本文進一步確認了雌激素在雄性小鼠抗骨質疏松過程中的重要作用,同時為未來尋找適合的骨質疏松藥物提供了一個新的思路。

