骨鈣素與認知功能障礙關系的研究進展
楊倩 顧朋穎
1. 安徽醫科大學附屬省立醫院老年醫學科,安徽 合肥 230032 2. 安徽醫科大學附屬省立醫院南區干部病房,安徽 合肥 230036
認知功能障礙是一種普遍的公共健康問題,主要分為輕度認知功能障礙和癡呆兩大類。全球每年大約有460萬人被診斷為癡呆,每20年增加2倍,到2050年癡呆患者將達到1.315億。在老年人群中,認知功能障礙已帶來嚴重后果,癡呆對健康看護和社會花費負擔巨大[1]。骨鈣素(osteocalcin,OC)不僅參與骨代謝,影響骨密度,而且參與糖脂代謝,改善動脈硬化,影響神經遞質的合成。最近許多研究表明糖尿病、動脈硬化、骨質疏松與認知功能障礙關系密切[2-4],而OC作為代謝調節因子,可能通過不同方式影響認知功能,本文就二者關系的研究進展進行綜述。
1 OC的結構和功能
OC是由1號染色體(1q25-q31)上的BGLAP(bone gamma-carboxyglutamate protein)基因編碼,由成骨細胞特異分泌的,一種維生素K依賴性的非膠原蛋白,OC含有γ-氨基蛋白,又稱γ-羧基谷氨酸蛋白,完整的OC分子是由49個氨基酸組成的多肽,可以用胰蛋白酶水解成3個片段,即N末端、中端和C末端[5]。OC含有3個(17、21和24位)依賴于維生素K的γ-羧基谷氨酸,這3個殘基是依賴維生素K和CO2羧化酶復合物作用下由谷氨酸轉變而來的,根據這3個殘基是否被完全羧化,分為羧化不全骨鈣素(uncarboxylated osteocalcin,ucOC)和完全羧化骨鈣素(carboxylated osteocalcin,cOC)[6]。成骨細胞和破骨細胞分泌OC并將之存儲于骨基質中,在生理情況下通過骨吸收脫羧后以uc OC形式釋放入血,研究表明uc OC為OC的活性形式,而c OC無活性[7]。既往研究表明OC參與骨代謝,具有維持骨的正常曠化并抑制異常羥基磷灰石形成的生理功能,通過促進造骨細胞鈣化為成骨細胞而參與骨骼發育。但近年來不斷發現骨骼也是一種內分泌器官,OC作為一種激素,具有旁分泌、自分泌和循環分泌的作用,OC和靶器官形成的骨-靶器官內分泌循環如圖1(圖片引自文獻[8])所示。OC和靶器官之間存在反饋調節,如胰島細胞產生胰島素刺激成骨細胞分泌OC,反過來OC不僅可以增加胰島素敏感性,刺激β-細胞增殖,還可作用于骨骼肌、脂肪組織、睪丸等來調節全身代謝功能,而OC作用于大腦調節神經遞質的合成并影響認知功能,開啟了人們對OC的重新認識。

圖1 骨-靶器官內分泌循環Fig.1 Endocrine cycle in bone-target organs
2 OC對認知功能的直接作用
在動物模型中,Oury等[9]發現體內不含OC的小鼠其行為異常主要表現為與焦慮和抑郁有關的認知功能損害。有研究表明OC在大腦中生成并作為一種神經肽參與緊張感覺刺激的信息傳輸[10]。OC可以穿過血腦屏障作用于腦干、中腦和海馬來影響幾種與學習和記憶形成有關的神經傳導物質的合成,已證實OC通過以下途徑直接作用于大腦[9]:OC誘導神經元中鈣離子聚集,激活腦干和藍斑中神經元的動作電位,同時抑制腦干γ-氨基丁酸(gamma-aminobutyric acid,GABA)中間神經元動作電位頻率,進而刺激5 -羥色胺、兒茶酚胺合成的基因表達,抑制GABA生物合成相關基因的表達,因此影響相應神經遞質的合成。另外,OC還可直接阻止海馬中神經元凋亡,從而保護與空間學習和記憶相關的認知功能。研究進一步發現,孕鼠體內OC對正常胎兒的大腦發育有潛在影響,在胎兒骨發育之前,OC即存在于胎兒血中;去除OC的母鼠可以增加其幼兒海馬體中神經細胞的凋亡[9]。這些研究表明OC對大腦發育和認知功能有直接影響,但具體機制還需更深一步研究。
衰老導致人體骨密度及ucOC水平降低[11]。低骨密度和認知功能損害共存,骨質疏松增加了輕度認知功能損害到阿爾茨海默病的進展速度,甚至阿爾茲海默病的發生[4]。調節OC表達的主要基因是Runx2,該基因突變導致鎖骨顱骨發育不全,日本學者[12]觀察到,鎖骨顱骨發育不全患者常出現認知功能缺陷。我國學者研究發現抑郁癥的患者其體內有較低水平的ucOC,并且ucOC與抑郁呈負相關,另外該團隊在2型糖尿病患者中經多元逐步回歸校正分析發現血清ucOC水平降低,其認知功能也下降[13]。Josep等[14]利用核磁共振成像液體衰減反轉恢復(fluid-attenuated inversion recovery,FLAIR)技術研究OC對大腦及認知功能的影響發現,低OC水平的患者在其尾狀核及殼核區有較低的FLAIR強度,而FLAIR技術對認知功能的預測敏感性較高,經統計分析發現低OC是認知損害的獨立危險因素(F=3.551,P=0.01343;R2=0.103),其研究數據表明OC可能通過作用于基底節的微觀結構來影響認知功能。目前國內外對OC與認知關系的研究仍較少,還有大量未知領域有待進一步探索。
3 OC與認知功能障礙的危險因素
3.1 OC與糖代謝
骨骼作為一個內分泌器官,其分泌的OC對機體能量代謝平衡起著重要的調控作用。Ferron等[15]給予小鼠皮下持續泵入ucOC 4周后,發現小鼠體內血糖降低、胰島素分泌增加及胰島素敏感性提高。Lee等[7]研究OC基因敲除(Ocn-/-)小鼠顯示β-細胞增殖降低,葡萄糖耐受不良和胰島素抵抗。臨床研究[16]也發現OC通過刺激胰島素的分泌和胰島素的敏感性來加強機體對葡萄糖的作用,它的水平與血糖和糖化血紅蛋白(hemoglobin A1c,HbA1c)呈負相關,高血糖可影響OC的合成,在高血糖狀態下由于胰島素分泌及作用缺陷,成骨細胞上表達的胰島素受體數量減少,成骨細胞功能被抑制,從而導致OC合成減少。
長期高血糖可引起慢性糖尿病性腦病,即通過氧化應激、微血管病變等機制使大腦神經元數量減少、形態異常或功能失調,導致相關學習和記憶功能障礙[2];而長期應用胰島素的糖尿病患者血糖波動較大,易引起低血糖,造成海馬萎縮,引起認知損害。OC對血糖具有調節作用,推測OC可以通過血糖的變化來影響認知功能。
3.2 OC與脂代謝
Lee等[7]研究發現,在食欲不受影響的情況下,胚胎干細胞磷酸酶敲除(Esp-/-)小鼠體內OC活性增加,其能量消耗也增加,脂肪含量及甘油三酯水平低于對照組野生型小鼠,而向野生型小鼠中持續輸注OC,其甘油三酯水平明顯降低,同樣OC基因敲除(Ocn-/-)小鼠則表現為肥胖及高脂血癥。另外,Fernand ez-Real等[17]對健康人群的研究以及我國學者[18]對骨質疏松患者的觀察均發現,OC水平與血漿甘油三酯水平呈負相關(r=-0.54,P=0.01[17];r=-0.499,P=0.03[18])。
脂代謝紊亂可加重動脈粥樣硬化的進展,而動脈硬化是血管性認知障礙的重要危險因素之一。我國學者[19]研究發現高脂飲食可引起血管內皮細胞損傷,導致炎癥因子增加,加速動脈粥樣硬化過程,而向高脂飲食組小鼠體內注射OC后,其體內各種炎癥因子如腫瘤壞死因子-α(TNF-α)、白介素-1(IL-1)和白介素-12(IL-12)水平明顯降低,表明OC對高脂血癥引起的動脈硬化具有保護作用。高血脂還可通過載脂蛋白來調節β淀粉樣蛋白(amyloid-β,Aβ)的形成并妨礙神經突觸的完整性,因此導致阿爾茲海默病的病理改變[20]。OC對脂代謝的影響與動脈硬化及阿爾茲海默病相關,推測OC可能通過血脂水平的調節間接參與認知功能的改變。
4 OC與認知功能障礙的保護因素
4.1 OC與瘦素
瘦素是由脂肪組織特異分泌的一種小分子多肽類激素,其受體LRb除分布于下丘腦多個核團區表達神經肽Y的細胞膜上外,還分布于調節學習與記憶的海馬等其他腦區[21]。研究表明瘦素參與神經突觸的形成和軸突生長,增加海馬區腦源性神經營養因子的表達,具有神經保護作用;基礎實驗及臨床研究均發現瘦素不僅能夠減少磷酸化的tau蛋白,減輕神經纖維纏結,而且可以減少Aβ含量,進而能夠改善阿爾茲海默癥患者的記憶功能[22]。
瘦素可通過外周及中樞雙重作用實現其對OC的功能調節。在外周通路中,瘦素作用于成骨細胞,激活轉錄激活因子4(ATF4),而ATF4可誘導成骨細胞中胚胎干細胞磷酸酶(embryonicstem cell phosphatase,Esp)基因表達增加,進而骨細胞中Esp基因編碼的蛋白酪氨酸磷酸酶(osteotesticular protein tyrosine phosphatase,OST-PTP)含量升高,最終大量OC轉化為ucOC,促進骨骼發育[23]。在中樞性通路中,瘦素通過向腦干神經元發出信號來阻止5-羥色胺的合成,該神經物質減少了交感神經活動,反過來抑制骨形成及增加骨吸收,進而影響OC的合成[21]。相反ucOC可以作用于脂肪組織,促進脂肪細胞分泌瘦素。以上表明OC與瘦素之間通過中樞神經系統形成反饋調節(見圖2,圖片引自文獻[24]),瘦素影響5-羥色胺的合成并改善阿爾茲海默病病理結構,猜測OC可能通過瘦素對認知功能起保護作用。
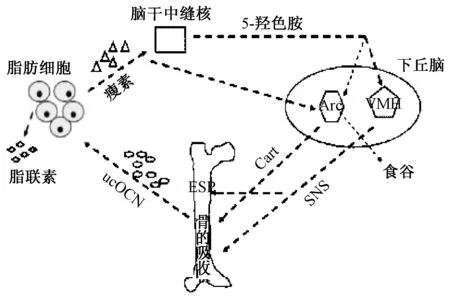
圖2 瘦素和骨鈣素間的反饋調節Fig.2 Feedback regulation between leptin and osteocalcin注:OCN:骨鈣素;VMH:腹內側下丘腦;Arc:下丘腦弓狀核;SNS:交感神經系統
4.2 OC與脂聯素
脂聯素是由脂肪細胞分泌的一種內源性生物活性多肽,在血漿中含量極其豐富。脂聯素通過與脂聯素受體1和脂聯素受體2結合, 既調節脂肪代謝,又參與骨代謝[25],影響OC的合成。相反,Lee等[7]研究顯示去除OC的小鼠較對照組野生小鼠血脂聯素水平降低,臨床研究進一步發現血液中ucOC可作用于脂肪細胞,促進脂聯素的分泌[26]。
脂聯素受體除分布于成骨細胞外,還分布于大腦組織中,高脂聯素水平對大腦具有保護作用[27]。Sakr[28]在患有糖尿病的大鼠中應用西格列汀治療后,其體內脂聯素水平及下丘腦脂聯素受體1信使RNA的表達均增加,進而使小鼠的記憶及認知功能提高。脂聯素可有效降低阿爾茲海默病患者體內促炎細胞因子水平,并預防Aβ的神經毒性作用[29]。另外,脂聯素增加胰島素敏感性,并通過調控胰島素信號轉導來維持大腦葡萄糖水平,進而影響海馬中神經元膽堿能受體功能和GABA的合成,最終改善空間學習和記憶行為有關的認知障礙和記憶障礙[30-31]。以上研究表明脂聯素參與認知功能的調節,而OC與脂聯素合成與分泌相互影響,推測脂聯素作為OC與認知障礙之間的保護因子起作用。
5 展望
骨代謝的標志物OC以低羧化活化形式進入血液循環,作用于骨以外的靶器官,如胰腺、脂肪組織和大腦,并通過不同途徑直接或間接影響認知功能。目前國內外對骨鈣素與糖脂代謝,糖尿病、動脈硬化、骨質疏松與認知障礙之間的研究較多,而骨鈣素與認知功能之間的直接作用研究較少,如果能夠從分子和基因方面深入了解OC在大腦中的功能,將有助于探索認知干預的新方法。

