IL-4, IL-6和TNF-α對臍帶血來源的間充質(zhì)干細胞成骨分化的作用
劉佳 羅映紅 龍昱 劉小云
1. 長沙醫(yī)學院基礎(chǔ)醫(yī)學院,湖南 長沙 410219 2. 長沙醫(yī)學院附屬第一醫(yī)院,湖南 長沙 410219
外傷、腫瘤切除術(shù)后的較大骨缺損如果依賴自然修復(fù),進程緩慢,效果不良。Vacanti等[1]率先提出以組織工程技術(shù)構(gòu)建骨來進行補缺,開辟了生物材料修補的新途徑。組織工程可使用的種子細胞有多種,臍血來源的間充質(zhì)干細胞是其中上佳選擇。從取材的角度,相對于骨髓來源,人臍血獲取容易得多,避免了穿刺取骨髓的痛苦,不會給產(chǎn)婦和胎兒造成傷害,且避免了倫理問題;另外,人臍血細胞更接近胚胎干細胞,其免疫原性不強,降低了排異風險,提高了效果[2]。但是促使臍帶血來源的間充質(zhì)干細胞成骨分化的因素尚未完全明確。有研究表明,干細胞所處的微環(huán)境對細胞分化起著正向或者負向調(diào)節(jié)作用,骨損傷過程的局部為炎性微環(huán)境,炎性細胞因子是否對干細胞成骨分化存在促進或抑制作用,因此本實驗選擇細胞因子IL-4、IL-6和TNF-α,研究其對間充質(zhì)干細胞成骨分化的影響。
1 材料和方法
1.1 材料
選自37~40周自然分娩的產(chǎn)婦捐獻者,新生兒分娩離開母體后正常斷離臍帶,消毒臍帶斷端,臍靜脈穿刺,抽吸出臍帶及胎盤內(nèi)的血液,采集臍血量約為15~50 mL,在無菌玻璃瓶中與肝素(40 U/mL)混勻抗凝;采集后12 h內(nèi)分離臍血干細胞。捐獻者為長沙醫(yī)學院第一附屬醫(yī)院產(chǎn)婦,采集臍血均征得產(chǎn)婦及其家屬同意和醫(yī)學倫理委員會批準(批準文號:20160023),并經(jīng)檢測排除傳染性疾病及遺傳疾病。
1.2 實驗用主要試劑
DMEM培養(yǎng)基(美國Gibco公司);胎牛血清(杭州四季青公司);人重組IL-4, IL-6和TNF-α(美國R&D Systems公司);地塞米松、β-甘油磷酸鈉、維生素C、FITC標記鼠抗人抗體、胰蛋白酶、Percoll分離液(美國Sigma公司);ALP檢測試劑盒(南京建成公司);其他試劑為分析純。
1.3 臍帶血采集,分離、干細胞鑒定
獲取干細胞主要參考邵帥研究組的實驗方法進行[3]:取15~25 mL抗凝臍血,加入等體積PBS振搖混勻,每次取液體10 mL,置于20 mL預(yù)配好Percoll分離液上層,以2 000 r/min離心20 min;吸取中間白色細胞層,PBS沖洗后離心去上清,吸取離心管底細胞,加入含10%胎牛血清的DMEM培養(yǎng)液緩慢吹打均勻,計數(shù)后調(diào)整細胞濃度接種于細胞培養(yǎng)瓶中,置于37 ℃、5%CO2培養(yǎng)箱中培養(yǎng)。分別在培養(yǎng)3 d、6d后換培養(yǎng)液,去掉未貼壁細胞。當細胞生長融合約90%時,加入0.25%胰蛋白酶溶液室溫下消化2 min,按照1∶2比例傳代培養(yǎng),顯微鏡下觀察細胞生長狀態(tài)。
細胞表面標志物的檢測:取對數(shù)生長期的第3代臍血培養(yǎng)細胞,胰蛋白酶消化細胞,離心后棄上清,加PBS調(diào)整細胞濃度1×109/L,并將其分裝為每管0.2 mL,分別加入FITC標記鼠抗人CD29、CD34、CD44 0.01 mL混勻,對照組加入FITC 0.01 mL,在4 ℃避光孵育30 min,離心去上清后PBS清洗2遍,以0.5 mL的PBS重懸細胞,用流式細胞儀檢測細胞表面標記。
1.4 成骨分化培養(yǎng)
1.4.1基礎(chǔ)成骨誘導組:取生長旺盛的第3代臍血間充質(zhì)干細胞,以胰蛋白酶消化后計數(shù),以105/孔的細胞數(shù)接種于細胞培養(yǎng)6孔板中進行成骨分化誘導。加入基礎(chǔ)成骨誘導劑(含10%胎牛血清的DMEM+0.01 μmol/L地塞米松+10 mmol/Lβ-甘油磷酸鈉+0.1 mmol/L抗壞血酸)進行培養(yǎng)。空白對照組為不加成骨誘導劑的細胞,以完全培養(yǎng)液(含10%胎牛血清的DMEM)常規(guī)培養(yǎng)。基礎(chǔ)成骨誘導組和空白對照組均設(shè)3平行孔,每3 d換培養(yǎng)液1次,倒置顯微鏡下觀察間充質(zhì)干細胞的生長情況。
1.4.2細胞因子誘導組:間充質(zhì)干細胞加入基礎(chǔ)成骨誘導劑進行培養(yǎng),培養(yǎng)后融合達80%時,用胰蛋白酶消化后以5×105/mL細胞密度接種于24孔板中,貼壁后換液時,分別加入細胞因子IL-4, IL-6和TNF-α至終濃度為10 ng/mL,之后每次更換培養(yǎng)液時維持相應(yīng)細胞因子的濃度。另設(shè)不加細胞因子的細胞為陰性對照組。每組設(shè)6平行孔。
1.5 檢測成骨分化的程度
細胞堿性磷酸酶(alkaline phosphatase,ALP)活性檢測:將細胞在誘導3 d和9d時棄去培養(yǎng)液,PBS洗滌3次后每孔加入0.2%TritonX-100 400 μL破裂細胞,1 h后收集液體,離心取上清10 μL,置于96孔板,按照ALP測定試劑盒說明進行操作,用酶標儀測定520 nm吸光度值(OD值),以公式:ALP活力(金氏單位/100 mL)=(OD測定-OD空白)÷(OD標準-OD空白)×0.1 mg/mL×100 mL(1個金氏單位為100 mL樣品在37 ℃與基質(zhì)作用15 min產(chǎn)生1 mg酚),計算ALP活力并比較。
鈣結(jié)節(jié)染色:在6孔板中以細胞因子誘導18 d后吸棄培養(yǎng)基,PBS清洗2次,95%乙醇固定細胞后PBS洗滌2次,加0.5%茜素紅染色劑孵育30 min,棄去茜素紅,PBS清洗2遍,室溫下干燥,高倍鏡下隨機選取10個視野觀察鈣結(jié)節(jié)形態(tài),并統(tǒng)計鈣結(jié)節(jié)數(shù)。
1.6 統(tǒng)計學處理

2 結(jié)果
2.1 臍帶血干細胞形態(tài)觀察和表面標志物測定
Percoll分離液分離臍血,得到的中間白色層細胞在接種后48~72 h內(nèi)貼壁,開始細胞生長緩慢,形態(tài)不均一,呈現(xiàn)梭形和小圓形等多種形態(tài);經(jīng)過2~3次換培養(yǎng)液,基本去除了不貼壁的細胞;2周后生長較快,形成較均一的長多邊形細胞,當融合達到80%左右時可見細胞呈漩渦狀,細胞面積隨著時間延長逐漸延展(圖1)。采用流式細胞儀測定細胞表面抗原分子,CD29(99.5%)和CD44(98.7%)均高表達; CD34(1.1%)基本不表達(圖2);提示細胞為較純的間充質(zhì)干細胞。
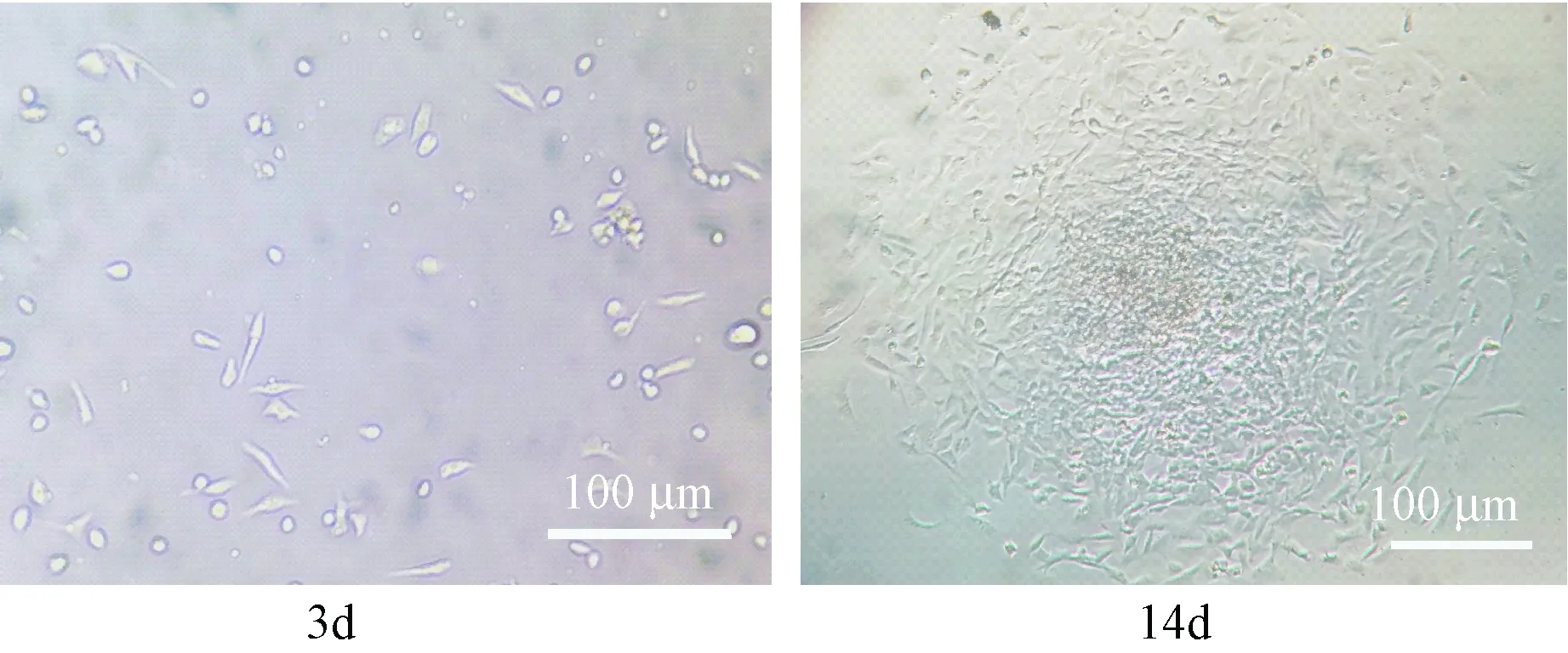
圖1 臍帶血干細胞原代培養(yǎng)(×400)Fig.1 Primary culture of human umbilical cord blood mesenchymal stem cells (×400)

圖2 干細胞表面標志表達量測定Fig.2 Expression levels of stem cell surface markers
2.2 基礎(chǔ)成骨誘導分化
基礎(chǔ)成骨誘導組和空白對照組在倒置顯微鏡下觀察,細胞形態(tài)相似,生長速度也未見明顯區(qū)別。
2.3 細胞因子作用后ALP活性測定結(jié)果
誘導3 d時,IL-6、TNF-α組的ALP活力高于陰性對照組(P<0.05);誘導9 d時,IL-4、IL-6實驗組ALP活性均顯著高于陰性對照組(P<0.01)。結(jié)果顯示,隨著誘導培養(yǎng)時間的延長,實驗組和對照組均呈現(xiàn)逐漸升高的趨勢;對照組ALP活性增長不快(1.71倍),細胞因子IL-4、IL-6刺激后各實驗組細胞內(nèi)ALP活力顯著增強,誘導9 d時,其中IL-6組的ALP活力為誘導3 d時的活力的9.51倍;TNF-α組ALP活力在短時間(3 d)內(nèi)有增加,但是TNF-α作用時間達到9 d時,ALP活力反倒未提升了,提示TNF-α對成骨分化的促進作用有效期短。見表1。
2.4 茜素紅染色結(jié)果
實驗組細胞經(jīng)細胞因子誘導成骨18 d后,以茜素紅染色,可見被染成紅色的鈣結(jié)節(jié),結(jié)節(jié)形態(tài)無規(guī)則、大小不一;其中IL-6組鈣結(jié)節(jié)數(shù)目最多,高倍鏡視野下可見(11.2±1.75)個結(jié)節(jié);TNF-α組鈣結(jié)節(jié)為(4.5±1.90)個,且鈣質(zhì)含量不高、結(jié)節(jié)染色較淺;IL-4組高倍鏡視野結(jié)節(jié)數(shù)目(6.4±1.78)個,但普遍面積較小;陰性對照組偶見鈣結(jié)節(jié),結(jié)節(jié)數(shù)為(0.6±0.84),且面積小(圖3)。各細胞因子實驗組鈣結(jié)節(jié)數(shù)都比陰性對照顯著(n=10,P<0.01)。



分組作用時間ALP活力(king’sU)作用時間ALP活力(king’sU)陰性對照組3d265 5±33 59d453 2±20 4 IL-4組301 8±18 9911 6±24 1?? IL?6組496 0±68 8?4714 7±31 6?? TNF?α組387 2±21 2?527 2±40 5
注:與陰性對照組比較,*P<0.05,**P<0.01

圖3 細胞因子成骨誘導后茜素紅染色(×400)Fig.3 Alizarin red staining of MSCs induced by IL-4, IL-6, or TNF-α (×400)
3 討論
臍帶等結(jié)構(gòu)在女性生產(chǎn)后,常作為醫(yī)療廢棄物處置,這極為可惜,因為臍血有很多具有多向分化能力的干細胞,除了造血干細胞,間充質(zhì)干細胞也可在體內(nèi)外分化為成骨細胞、軟骨細胞和脂肪細胞。臍血間充質(zhì)干細胞的分離和培養(yǎng)方法,本課題組采用的是國內(nèi)同行研究人員類似的方式,實驗不需要高精儀器來完成,方法較為簡易,培養(yǎng)中可逐步去掉非貼壁細胞的血細胞和造血干細胞。鑒定間充質(zhì)干細胞則需要檢測其特異性的表面標志物,例如CD29、CD44、CD90或CD105等間充質(zhì)干細胞標志物是否表達,同時滿足造血干細胞特異性標志物CD34不表達。本組實驗中培養(yǎng)的第3代細胞,以流式細胞儀進行表面標志物測定,確定細胞以間充質(zhì)干細胞為主,血細胞極少;細胞分離量雖有限,但足以用于實驗研究。
許多胞外成分可引導間充質(zhì)干細胞向成骨細胞分化,如骨形成蛋白2[4]、成纖維細胞生長因子、轉(zhuǎn)化生長因子β、胰島素樣生長因子[5]、力生長因子[6]等,但較常用的方法為地塞米松、β-甘油磷酸鈉、抗壞血酸共同促間充質(zhì)干細胞成骨分化。其中地塞米松可以促進間充質(zhì)干細胞堿性磷酸酶活性增強,早期促基質(zhì)合成,后期促鈣化;β-甘油磷酸鈉迅速水解生成磷酸根離子,可作為堿性磷酸酶的底物,促進鈣鹽沉積;抗壞血酸可以促進細胞合成膠原,形成鈣化。本實驗除了采用經(jīng)典的基礎(chǔ)成骨誘導劑(抗壞血酸+β-甘油磷酸鈉+地塞米松),還加入了新的成分——炎性細胞因子如TNF-α、IL-4、IL-6等,為了探索更有效的的成骨分化誘導因素。
在骨損傷修復(fù)的初始階段,炎性相關(guān)細胞因子被釋放在損傷部位,短時間內(nèi)對周圍的各類細胞都有著促進增殖、加速修復(fù)的作用,有研究表明,IL-10等細胞因子可抑制破骨細胞活性、加速成骨[7],但是也有研究者提出IL-6促進破骨細胞增殖和活性[8]。成骨細胞和破骨細胞都是已經(jīng)分化的細胞,而各類細胞因子是否影響原始的多能間充質(zhì)干細胞分化成為成骨細胞、對骨修復(fù)進行支持,這是有爭議的。本實驗顯示,細胞因子TNF-α,IL-6和IL-4在人類臍血來源間充質(zhì)干細胞的成骨分化中的促進作用。濃度10ng/mL的TNF-α作用3 d,IL-6,IL-4在作用9 d后顯著增加了ALP活力,三種細胞因子誘導18 d后則顯著增加鈣結(jié)節(jié)的形成,在基礎(chǔ)成骨誘導劑的作用上更進一步促進成骨。其中尤其是IL-6,顯著的增強了ALP活力,在骨結(jié)節(jié)的形成上也能看出其作用顯著。總之,所選細胞因子短時間(18 d)內(nèi)都有提高成骨分化的作用,但是TNF-α只在極短時間內(nèi)(3 d)起作用,估計主要是一過性促進成骨的作用;本實驗結(jié)果與陳林等[9]的TNF-α對成骨分化的影響受作用時間、作用濃度的影響,較為相同。比較三種細胞因子,IL-6起效快、有效時間較長、效果顯著,可能是合適的間充質(zhì)干細胞成骨分化誘導因子,這也與Angela等[10]結(jié)果較為一致。

