骨質疏松癥與動脈粥樣硬化疾病的研究進展
張 欣,劉 敏,戴火祥,黃麗紅
(吉林大學中日聯(lián)誼醫(yī)院 老年病干部科,吉林 長春130033)
*通訊作者
骨質疏松癥與動脈粥樣硬化疾病的研究進展
張 欣,劉 敏,戴火祥,黃麗紅*
(吉林大學中日聯(lián)誼醫(yī)院 老年病干部科,吉林 長春130033)
骨質疏松癥與動脈粥樣硬化性疾病是老年人群的常見慢性病。既往認為這兩種疾病是不相關的,但是現(xiàn)在越來越多的證據(jù)表明這兩種疾病之間存在密切的聯(lián)系。大量流行病學研究表明骨質疏松癥與動脈粥樣硬化性疾病常常共存于同一個體,并且存在共同的影響因素,以及二者兼顧的治療藥物。本文將從一些骨代謝指標調節(jié)劑以及相關炎性因子的方面簡述骨質疏松癥與動脈粥樣硬化性疾病的共同發(fā)病機制,將對未來開辟新的靶向治療藥物提供研究思路。
1 流行病學
骨質疏松患者常伴有動脈粥樣硬化。在一項來自Rotterdam的研究分析中表明,低骨礦物質密度(LBMD)與外周動脈疾病的風險增加有關[1]。Hak AE等對720例絕經后婦
女做了主動脈鈣化與骨量之間的相關性的前瞻性研究,進行了8.9±0.8年的隨訪,通過監(jiān)測腹主動脈鈣化程度與掌骨骨密度的變化,發(fā)現(xiàn)了絕經后婦女動脈粥樣硬化中鈣化的進展與骨量減少有關[2]。動脈粥樣硬化的早期階段的特征是血管順應性的變化,在Kenichi Hirose等的7865例大樣本量研究中,測量動脈僵硬度(肱-踝脈搏波速度)與骨密度降低(BMD)顯著相關。這一發(fā)現(xiàn)進一步表明動脈粥樣硬化的早期階段和骨密度降低之間的關聯(lián)[3]。而骨量減少是骨質疏松的早期病理表現(xiàn)。由此可得,骨質疏松與動脈粥樣硬化存在著密切的聯(lián)系。
現(xiàn)有的在人類和動物的體內外研究實驗表明,許多致動脈粥樣硬化因子/因素如雌激素缺乏、血脂異常、氧化應激、一氧化氮(NO)的降低、炎性細胞因子、同型半胱氨酸,和久坐不動的生活方式等也影響骨形成[2,4]。表明二者之間存在著共同的影響因素。
國內外文獻報道,目前臨床上廣泛應用的他汀類和雙膦酸鹽類藥物具備二者兼顧的治療作用。他汀類藥物是羥甲基戊二酰輔酶A(HMG-CoA)還原酶抑制劑,廣泛用于抗動脈脈粥樣硬化的治療。有研究通過監(jiān)測服用他汀類藥物患者的骨密度測定結果,發(fā)現(xiàn)他汀類藥物可以增加骨密度。表明他汀類藥物不僅能抗動脈粥樣硬化,同時也可能具有抑制骨質疏松的作用,而其相關藥理機制尚未完全明了。雙膦酸鹽類藥物常用于治療骨質疏松癥。在陳基敏[5]等的藥物臨床研究中,經阿侖膦酸鈉治療6個月后,絕經后女性骨質疏松患者的頸動脈內膜中層厚度與治療前比較顯著降低,證明阿侖膦酸鈉可以改善絕經后女性骨質疏松癥患者動脈粥樣硬化的程度,并且其抗動脈粥樣硬化的藥理作用已有相關文獻報道。
2 共同發(fā)病機制
很多國內外學者研究發(fā)現(xiàn)骨質疏松癥與動脈粥樣硬化性疾病可能存在共同的發(fā)病機制。例如旁分泌的骨代謝指標調節(jié)劑如基質Gla蛋白(MGP)和骨鈣素(OC),骨形態(tài)發(fā)生蛋白(BMP)和骨橋蛋白(OPN),骨保護素(OPG)等也存在于脈管系統(tǒng)中[16]。而一些與動脈粥樣硬化有關的炎性細胞因子如核因子κB(NF-κB)、一氧化氮(NO)等也具有調節(jié)骨代謝的作用。
2.1 基質Gla蛋白(MGP)和骨鈣素(OC)
2.1.1 γ-羧基酸(GLA)含有蛋白質,包括基質Gla蛋白(MGP)和骨鈣素(OC),是類骨質形成的關鍵調節(jié)劑和抑制劑。MGP是一種分泌蛋白,在軟骨細胞和血管平滑肌細胞內表達。MGP調節(jié)軟骨內骨形成及抑制血管壁鈣化(圖1)。經華法林治療的大鼠,維生素K依賴的MGP發(fā)生明顯的消耗,出現(xiàn)了加速礦化和生長板閉合的結果[6]。有研究證實,在妊娠早期抗凝治療的人類胚胎中也有類似的特點[7]。這些數(shù)據(jù)都明確了MGP抗骨礦化的作用。同時,有研究發(fā)現(xiàn),缺乏MGP表達的基因敲除小鼠,快速出現(xiàn)廣泛的、甚至是致命的動脈鈣化[8]。MGP在正常人中組成型表達,而在主動脈粥樣硬化斑塊的患者中是表達上調[9],說明可能存在一些代償機制來限制血管的鈣化作用。
2.1.2 Osteocalcin(OC),是豐富存在于骨組織中的蛋白質,也能抑制鈣化。OC基因缺失的小鼠表現(xiàn)出了骨形成的增強[10],同時表明OC可能在抑制骨礦化過程中并不發(fā)揮主導作用。而有人體研究表明,在正常血管和動脈粥樣硬化血管中OC與MGP表達相平行[11],并且血清OC在動脈粥樣硬化婦女表達升高[12,13]。有研究推測指出OC可能通過影響MGP間接抑制動脈粥樣硬化的發(fā)生。總而言之,目前OC在骨及血管壁中發(fā)揮的作用尚未闡明。
2.2 Nuclear factor κB (NF-κB) 核因子κB
核因子κB (Nuclear factor κB,NF- κB) 是調節(jié)細胞基因轉錄的關鍵因子之一。 NF- κB能特異的結合DNA,參與許多基因特別是與機體防御功能及炎癥反應有關的即早基因的表達調控。 組織學研究發(fā)現(xiàn),人類動脈粥樣硬化斑塊中激活的核因子NF-κB主要見于血管的中膜層和內膜層細胞中。在經典途徑中,IκB作為一種抑制蛋白,與NF-κB緊密結合從而抑制了NF-κB的活性,當細胞受到外界刺激時,IκB蛋白被快速磷酸化后被蛋白酶降解,而解離出來的NF-κB轉位至細胞核,結合并刺激靶基因的表達,同時IκB的降解產物p50/p65 二聚物,轉移至胞核后啟動與細胞免疫、 炎性反應等有關因子的基因表達[14,15],在動脈血管壁內引起炎癥反應進一步發(fā)生動脈粥樣硬化。因此NF-κB的激活是動脈粥樣硬化發(fā)生發(fā)展的始動機制之一[16]。同時有研究表明,NF- κB傳導的通路對破骨細胞的基因表達和激活骨吸收、以及對多個成骨因子表達的抑制有著重要作用(圖1)[17]。這種轉錄因子激活動脈壁的炎癥反應和激活破骨細胞、抑制成骨細胞的機制可能是連接動脈粥樣硬化和骨質疏松癥的最重要的事件之一。
2.3 骨形態(tài)發(fā)生蛋白(BMP)和骨橋蛋白(OPN)
2.3.1 BMPs屬于轉化生長因子-β(TGF-β)蛋白質家族,BMP-2和BMP-4是誘導骨形成的主要分子[18]。有研究表明,局部應用BMP刺激成骨和人體骨間隙愈合[19]。有文獻提出,BMP-2/4能吸引多能間充質細胞向成骨細胞譜系的轉化(圖1),并且BMPs能刺激成骨細胞分化過程中的關鍵分子核心結合因子α1(Cbfa-1)的表達[20]。鑒于其骨誘導特性,我們可以推測,骨形態(tài)發(fā)生蛋白的表達有利于血管鈣化。并且事實上,有研究發(fā)現(xiàn)在人類動脈粥樣硬化病變部位BMP-2和Cfba-1表達是增強的,而在正常動脈缺如[21]。而且發(fā)現(xiàn)BMP-Cbfa-1通路對MGP有抑制效應,抑制MGP限制血管鈣化的作用,因此BMP-2可以間接促進血管鈣化。
2.3.2 Osteopontin(OPN),一種多功能的非膠原基質蛋白,在各種類型細胞,包括骨和血管組織細胞中表達。最近的研究表明,OPN基因敲除的小鼠有抵抗骨吸收的作用[22,23]。因此OPN是破骨細胞活性的重要調節(jié)器,增強破骨細胞活性,加速骨吸收(圖1)。此外,OPN可能是血管炎癥的關鍵作用,可能直接參與動脈粥樣硬化的形成。有研究表明,OPN激活血管平滑肌細胞中的血管緊張素II誘導的炎癥因子NF-κB和AP-1,引發(fā)血管壁的炎癥反應[24](圖1)。事實上,在過度表達OPN的轉基因小鼠中發(fā)現(xiàn)血管中膜層增厚以及血管損傷后內膜層增生[25]。因此,OPN可能獨立地調節(jié)骨質礦化和血管壁炎癥反應。
2.4 骨保護素(OPG)以及RANK/RANKL/OPG
骨保護素(osteoprotegerin,OPG),是一種腫瘤壞死因子(TNF)受體家族誘導的可溶性的細胞因子,也被稱為破骨細胞抑制因子,可以有效的抑制破骨細胞的形成[26]。由骨髓基質細胞、成骨細胞、血管平滑肌細胞(VSMC)和內皮細胞產生,因此廣泛存在于人體多種組織內。由成骨細胞分泌的OPG配體OPGL與成熟破骨細胞表面的RANK(receptor activator of NF-κB)/RANKL(receptor activator of NF-κB ligand)(RANK為膜受體,RANKL為膜配體)結合,促進破骨細胞分化,增強其活性,RANK/RANKL在破骨細胞的生長分化中發(fā)揮著至關重要的作用。而OPG與OPGL結合抑制其與RANK結合,間接抑制破骨細胞活性,抑制骨吸收(圖1)。所以,OPG可以反映骨代謝水平,當OPG降低時,骨吸收增多。而絕經后期OPG升高,表明機體狀態(tài)骨吸收大于骨形成,代償性OPG升高。OPG在正常的主動脈平滑肌細胞及血管內皮細胞中亦有表達,并且發(fā)現(xiàn)在晚期動脈粥樣硬化病變中,OPG的水平與血管鈣化相關,研究結果表明,OPG有抑制血管鈣化的作用。并且OPG可以通過改善內皮細胞功能而阻止炎癥因子聚集,抑制血管壁的炎癥反應,從而產生抑制動脈粥樣硬化的作用。
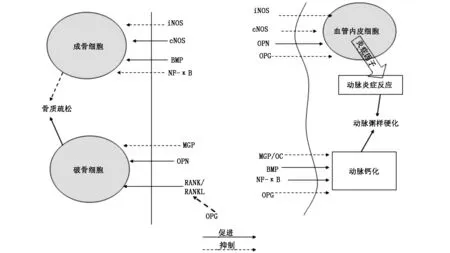
圖1 骨質疏松與動脈粥樣硬化的共同發(fā)病機制
2.5 一氧化氮(NO)
NO,是一個調節(jié)骨和血管各項功能的關鍵的多分子物質。NO在內皮細胞由一組內皮型一氧化氮合酶(NOS)催化產生,這種一氧化氮合成酶催化L精氨酸轉換成NO和瓜氨酸。正常機體生理狀態(tài)下會產生一種依賴于鈣和鈣調蛋白的結構型NOS(cNOS),通過這個路徑會生成少量的NO對血管內膜起保護作用,維持成骨細胞和破骨細胞的正常生理功能。相反,病理狀態(tài)下會產生一種不依賴鈣和鈣調蛋白的誘導型NOS(iNOS),可以獨立和持續(xù)地產生大量NO[27]。
有文獻報道小鼠內皮cNOS的缺失導致高血壓、內皮功能障礙、增強血管新生內膜的形成;同時,這些小鼠還表現(xiàn)出成骨細胞數(shù)量和功能的降低、骨皮質變薄、骨密度降低等骨質疏松的病理表現(xiàn)[28]。并且發(fā)現(xiàn)高劑量外源性雌激素作用于cNOS基因敲除小鼠沒有表現(xiàn)出典型的合成代謝刺激。這些研究表明,cNOS活性在成骨細胞功能和骨轉換中起著至關重要的作用,并且證實有些藥物如雌激素等是通過調節(jié)cNOS來達到治療骨質疏松的效果的[29]。與之相反,在病理狀態(tài)下,iNOS誘導產生的高濃度NO,抑制成骨細胞的生長和分化[30]。在一項隨機對照試驗中,在患炎癥性骨質疏松癥的小鼠模型中,相比于野生型小鼠,缺乏iNOS的小鼠的骨質流失較輕[31],此時,NO水平與BMD值呈負相關。而在動脈粥樣硬化發(fā)生過程中,當血管發(fā)生炎癥反應時,內皮細胞、血管平滑肌細胞、炎癥細胞中iNOS可誘導NOS催化產生NO[32]。NO通過降低血小板內Ca 2 +的濃度,抑制血小板的激活和集聚,延緩動脈粥樣硬化的發(fā)展[33]。并且,NO有強大的舒張血管的作用,主要通過一氧化氮 / 環(huán)磷酸鳥苷途徑舒張血管,同時有研究表明NO能抑制內皮素-1的分泌從而產生舒張血管的作用。大劑量的NO有抑制動脈粥樣硬化發(fā)生、發(fā)展的作用。因此,在骨和血管組織中,NO的生物反應是劑量依賴性的。iNOS加重骨丟失但能抑制血管收縮,而缺乏cNOS加速動脈粥樣硬化和骨質疏松癥(圖1)。
3 展望
綜上所述,骨質疏松與動脈粥樣硬化之間確實存在著某些共同的發(fā)病機制,他們共同影響著骨質疏松癥和動脈粥樣硬化性疾病的發(fā)生、發(fā)展甚至轉歸,然而,骨質疏松和動脈粥樣硬化之間是否存在明確的因果關系以及是否互為危險因素還有待進一步研究。隨著我國人口老齡化進程的加速,與年齡明顯相關的骨質疏松癥及動脈粥樣硬化疾病的發(fā)生越來越多,充分認識這兩種疾病,繼續(xù)深入研究它們的共同發(fā)病機制有助于開辟新的二者兼顧的臨床治療途徑。
[1]van der Klift M,Pols HA,Hak AE,et al.Bone Mineral Density and the Risk of Peripheral Arterial Disease:The Rotterdam Study[J].Calcif.Tissue Int,2002,70(6):443.
[2]Hak AE,Pols HA,van Hemert AM,et al.Progression of aortic calcification is associated with metacarpal bone loss during menopause:a population-based longitudinal study[J].Arterioscler.Thromb.Vasc.Biol,2000,20(8):1926.
[3]Hirose K,Tomiyama H,Okazaki R,et al.Increased Pulse Wave Velocity Associated with Reduced Calcaneal Quantitative Osteo-sono Index:Possible Relationship Between Atherosclerosis and Osteopenia[J].J Clin Endocrinol Metab,2003,88(6):2573.
[4]Uyama O,Yoshimoto Y,YamamotoY,et al.Bone changes and carotid atherosclerosis in postmenopausal women[J].Stroke,1997,28(9):1730.
[5]陳基敏,陳咸川,謝吟靈.阿侖膦酸鈉對絕經后女性骨質疏松癥患者動脈粥樣硬化影響的研究[J].中國實驗診斷學,2016,20(4):544.
[6]Price PA,Williamson MK,Haba T,et al.Excessive mineralization with growth plate closure in rats on chronic warfarin treatment[J].Proc Natl Acad Sci USA,1982,79(24):7734.
[7]Pauli RM,Lian JB,Mosher DF,et al.Association of congenital deficiency of multiple vitamin K-dependent coagulation factors and the phenotype of the warfarin embryopathy:clues to the mechanism of teratogenicity of coumarin derivatives[J].Am J Hum Genet,1987,41(4):566.
[8]Luo G,Ducy P,McKee MD,et al.Spontaneous calcification of arteries and cartilage in mice lacking matrix GLA protein[J].Nature,1997,386(6620):78.
[9]Shanahan CM,Proudfoot D,Tyson KL,et al.Expression of mineralisation-regulating proteins in association with human vascular calcification[J].Z.Kardiol,2000,89(Suppl.2):63.
[10]Ducy P,Desbois C,Boyce B,et al.Increased bone formation in osteocalcin-deficient mice[J].Nature,1996,382(6590):448.
[11]Dhore CR,Cleutjens JP,Lutgens E,et al.Differential expression of bone matrix regulatory proteins in human atherosclerotic plaques[J].Arterioscler Thromb Vasc Biol,2001,21(12):1998.
[12]Lane NE,Sanchez S,Genant HK,et al.Short-Term Increases in Bone Turnover Markers Predict Parathyroid Hormone-Induced Spinal Bone Mineral Density Gains in Postmenopausal Women with Glucocorticoid-Induced Osteoporosis[J].Osteoporos Int,2000,11(5):434.
[13]Bini A,Mann KG,Kudryk BJ,et al.Noncollagenous bone matrix proteins,calcification,and thrombosis in carotid artery atherosclerosis[J].Arterioscler Thromb Vasc Biol,1999,19(8):1852.
[14]Abedin M,Tintut Y,Demer LL.Vascular calcification.Mechanisms and clinical ramifications[J].Arterioscler Thromb Vasc Biol,2004,24:1161.
[15]Doherty TM,Fitzpatrick LA,Inoue F,et al.Molecular,endocrine,and genetic mechanisms of arterial calcification[J].Endocr Rev,2004,25:629.
[16]石 翠,胡 剛,汪 海.NF-κB在動脈粥樣硬化中的始動作用[J].中國藥理學通報,2004,20(4):382.
[17]吳昆鵬,戴永武,楊巧珠,等.NF-κB 信號通路與骨質疏松[J].中國老年學雜志,2011,31(19):3852.
[18]Wozney JM,Rosen V,Celeste AJ,et al.Novel regulators of bone formation:molecular clones and activities[J].Science,1988,242(4885):1528.
[19]Ferretti C.and Ripamonti,U.(2002).Human segmental mandibular defects treated with naturally derived bone morphogenetic proteins[J].J.Craniofac.Surg,2002,13(3):434.
[20]Lee KS,Kim HJ,Li QL,et al.Runx2 Is a Common Target of Transforming Growth Factor β1 and Bone Morphogenetic Protein 2,and Cooperation between Runx2 and Smad5 Induces Osteoblast-Specific Gene Expression in the Pluripotent Mesenchymal Precursor Cell Line C2C12[J].Mol.Cell Biol,2000,20(23):8783.
[21]Engelse MA,Neele JM,Bronckers AL,et al.Vascular calcification:expression patterns of the osteoblast-specific gene core binding factor α-1 and the protective factor matrix gla protein in human atherogenesis[J].Cardiovasc Res,2001,52(2):281.
[22]Yoshitake H,Rittling SR,Denhardt DT,et al.Osteopontin-deficient mice are resistant to ovariectomy-induced bone resorption[J].Proc Natl Acad Sci USA 1999,96(14):8156.
[23]Ihara H,Denhardt DT,Furuya K,et al.Parathyroid Hormone-induced Bone Resorption Does Not Occur in the Absence of Osteopontin[J].J Biol Chem,2001,276(16):13065.
[24]蔡若男,葉寬萍,金 暉.骨質疏松與動脈粥樣硬化相關發(fā)病機制的研究進展[J].中國骨質疏松雜志,2009,15(10):789.
[25]Isoda K,Nishikawa K,Kamezawa Y,et al.Osteopontin Plays an Important Role in the Development of Medial Thickening and Neointimal Formation[J].Circ Res,2002,91(1):77.
[26]Khosla S.Minireview:The OPG/RANKL/RANK System[J] .Endocrinology,2001,142(12):5050.
[27]Moncada S,Palmer RM,and Higgs EA.Nitric oxide:physiology,pathophysiology,and pharmacology[J].Phar-macol.Rev,1991,43(2):109.
[28]Armour KE,Armour KJ,Gallagher ME,et al.Defective Bone Formation and Anabolic Response to Exogenous Estrogen in Mice with Targeted Disruption of Endothelial Nitric Oxide Synthase[J].Endocrinology,2001,142(2),760.
[29]房 雷,張奕華,查曉明.一氧化氮與骨質疏松[J].中國藥學雜志,2005,40(22):1681.
[30]Mancini L,Moradi-Bidhendi N,Becherini L,et al.The Biphasic Effects of Nitric Oxide in Primary Rat Osteoblasts Are cGMP Dependent[J].Biochem Biophys Res Commun,2000,274(2):477.
[31]Armour K J,Armour KE,van’t Hof RJ,et al.Activation of the inducible nitric oxide synthase pathway contributes to inflammation-induced osteoporosis by suppressing bone formation and causing osteoblast apoptosis[J].Arthritis Rheum,2001,44(12):2790.
[32]Hukkanen M,Hughes FJ,Buttery LD,et al.Cytokine-stimulated expression of inducible nitric oxide synthase by mouse,rat,and human osteoblast-like cells and its functional role in osteoblast metabolic activity[J].Endocrinology,1995,136(12):5445.
[33]薛永亮,唐 寧,華曉東,等.一氧化氮與動脈粥樣硬化[J].中國動脈硬化雜志,2009,17(8):698.
1007-4287(2017)07-1290-04
2016-07-22)

