游離亞硝酸(FNA)對A2O污泥菌群結構的影響
馬琳娜,劉文龍,張 瓊,彭永臻,*(.北京工業大學,國家工程實驗室,北京市污水脫氮除磷處理與過程控制工程技術研究中心,北京 004;.哈爾濱工業大學城市水資源與水環境國家重點實驗室,黑龍江 哈爾濱 50090)
游離亞硝酸(FNA)對A2O污泥菌群結構的影響
馬琳娜1,劉文龍2,張 瓊1,彭永臻1,2*(1.北京工業大學,國家工程實驗室,北京市污水脫氮除磷處理與過程控制工程技術研究中心,北京 100124;2.哈爾濱工業大學城市水資源與水環境國家重點實驗室,黑龍江 哈爾濱 150090)
為了探究采用游離亞硝酸(FNA)實現連續流A2O工藝短程硝化的可行性,考察了不同濃度的FNA對氨氧化菌(AOB)和亞硝酸鹽氧化菌(NOB)的活性影響,研究了通過投加FNA對活性污泥進行預處理后A2O反應器的運行效果和微生物菌群結構的變化.結果表明,當FNA濃度為1.12mgHNO2-N/L時,經過3h的缺氧處理,AOB和NOB的活性分別下降了60%和86%,對NOB有一定的選擇性抑菌效應,而投加FNA并對活性污泥進行缺氧處理后的A2O反應器平均出水NH4+-N、NO2--N和NO3--N分別為12.76、1.56和7.82mg/L,亞硝酸鹽積累率(NAR)僅為20%左右,并沒有實現預期的短程硝化.高通量和定量PCR的結果也表明,投加FNA并進行缺氧處理后活性污泥中AOB的種群豐度由2.05×108copies/gVSS下降到了3.96×105copies/gVSS,導致系統的氨氧化過程受到了較大影響.最終Nitrobacter和Nitrospira豐度降低,Nitrotoga占總序列數的1.66%,是造成系統無法通過FNA預處理實現連續流A2O工藝短程硝化的原因.
短程硝化;FNA;氨氧化菌;亞硝酸鹽氧化菌;菌群結構;A2O
短程硝化是將硝化反應只進行到氨氧化階段,而不進行將亞硝酸鹽氧化為硝酸鹽的過程[1].實現短程硝化反硝化的工藝有多種,主要通過抑制NOB,使AOB成為優勢菌種.短程硝化反硝化具有節省25%的曝氣能耗,減少40%的碳源投加量,減少污泥產量等優點[2].短程硝化的控制因素有很多,如溫度、污泥停留時間、DO、pH值、交替運行和抑制劑等[3-10].眾多研究者認為,的質子化產物游離亞硝酸(FNA)對許多微生物如氨氧化細菌、亞硝酸鹽氧化細菌存在一定的抑制作用[11-15].有研究發現FNA對AOB和NOB增殖的抑制濃度分別為 0.4mgHNO2-N/L和 0.02mg HNO2-N/L[16].張 宇 坤 等[17]發 現 當 FNA≥0.2mgHNO2-N/L時,NOB的活性會被完全抑制.利用這樣的抑制濃度差異,委燕等[18]采用人工配水在SBR反應器中利用FNA實現了短程硝化.目前眾多研究者主要是在序批式反應器中通過 FNA對AOB和NOB的選擇性抑制實現了短程硝化[19-20],而在城市生活污水連續流A2O反應器中FNA對AOB和NOB及污泥菌群結構的影響卻鮮有報導.
基于上述背景和分析,本研究將在傳統 A2O反應器的基礎上增加 FNA預處理單元,即投加FNA并對活性污泥進行缺氧攪拌,考察FNA對A2O反應器污泥中AOB和NOB的活性影響,及污泥種群結構的變化.
1 材料與方法
1.1 試驗用水和接種污泥
試驗用水采用北京工業大學教工住宅區化糞池的生活污水,具體水質如表1所示.試驗所采用的接種污泥取自北京某城市污水處理廠的剩余污泥,經過馴化,系統的脫氮除磷性能基本穩定.FNA預處理對AOB和NOB活性的影響試驗所用污泥取自A2O裝置的排泥.

表1 試驗用水水質Table 1 Characteristics of influent wastewater
1.2 試驗裝置
以 A2O反應器為短程消化系統啟動的主反應器,A2O反應器由有機玻璃制成,總有效容積為54L(圖1),配有攪拌器、氣泵、蠕動泵等,厭氧池、缺氧池和好氧池的體積比為 2:3:4.內回流比為300%,污泥回流比為100%,MLSS=2000~ 3000mg/ L,泥齡為15d,好氧池DO=3~4mg/L.FNA預處理單元采用有效容積為3L的SBR反應器,由有機玻璃制成,配有攪拌器和 pH檢測儀.運行過程中取A2O反應器的出水水樣,檢測NO4+-N、NO2--N和NO3--N的濃度,以評價活性污泥的硝化性能.試驗共分3個階段,每階段的運行條件如下:
第Ⅰ階段(0~30d):將北京某城市污水處理廠二沉池的剩余污泥接種于A2O反應器中,反應器中的活性污泥不經過 FNA預處理,即不投加FNA和缺氧攪拌.A2O反應器的水力停留時間為8h,泥齡15d,共運行30d.
第Ⅱ階段(31~40d):在原有的A2O反應器基礎上,每天從 A2O反應器取泥水混合液 5.4L(占A2O反應器容積的10%),洗泥濃縮至3L后倒入容積為3L的SBR反應器中,一次性投加亞硝酸鈉儲備液至 SBR反應器內使 NO2--N濃度為5g/L,通過投加0.1mg/L的HCl和NaOH溶液控制SBR內的pH=7.0±0.05,溫度為室溫25℃,使得FNA=1.12mgHNO2-N/L,然后缺氧攪拌 3h,完成對活性污泥的FNA預處理.反應結束后洗泥將活性污泥倒回A2O反應器的厭氧池,A2O反應器的運行方式同第Ⅰ階段.每天進行一次,共處理10d.
第Ⅲ階段(41~65d):停止投加FNA和缺氧攪拌,即停止FNA預處理,即A2O反應器的運行方式同第Ⅰ階段.
1.3 考察FNA對污泥中AOB與NOB活性的影響
向 A2O反應器的排泥中投加不同濃度的FNA并對活性污泥進行缺氧攪拌,研究FNA對污泥中的AOB和NOB的活性影響.試驗污泥取自穩定運行 30d的 A2O 二沉池的剩余污泥,MLSS約為2500mg/L.首先取活性污泥洗泥3次,確保泥水混合液中沒有溶解態的有機物、NH4+、NO2-和NO3-.后將洗過的泥水混合液平均加入7個有效容積為800mL的反應器中.在7個反應器中分別投加一定的NaNO2儲備液,用去離子水定容至800mL.使NO2--N濃度分別為 0、300、500、800、1500、3000、5000mgN/L.試驗在室溫25℃的條件下進行缺氧攪拌3h,運行過程中通過投加0.1mol/L的HCl和NaOH溶液調節反應器內的pH,使pH=7.0±0.05.最終使每個反應器中的FNA濃度分別為0、0.067、0.11、0.18、0.34、0.67、1.12mgHNO2-N/L.FNA的濃度根據公式(1)、(2)計算[12].預處理結束后,洗泥然后進行AOB和NOB的活性測定.
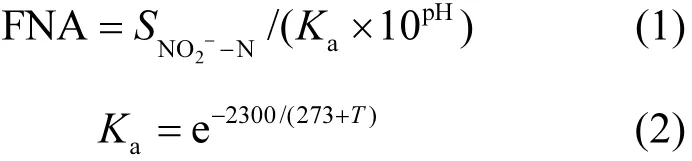
式中: SNO2??N為亞硝酸鈉濃度,mgN/L;T為反應器內的溫度,℃.
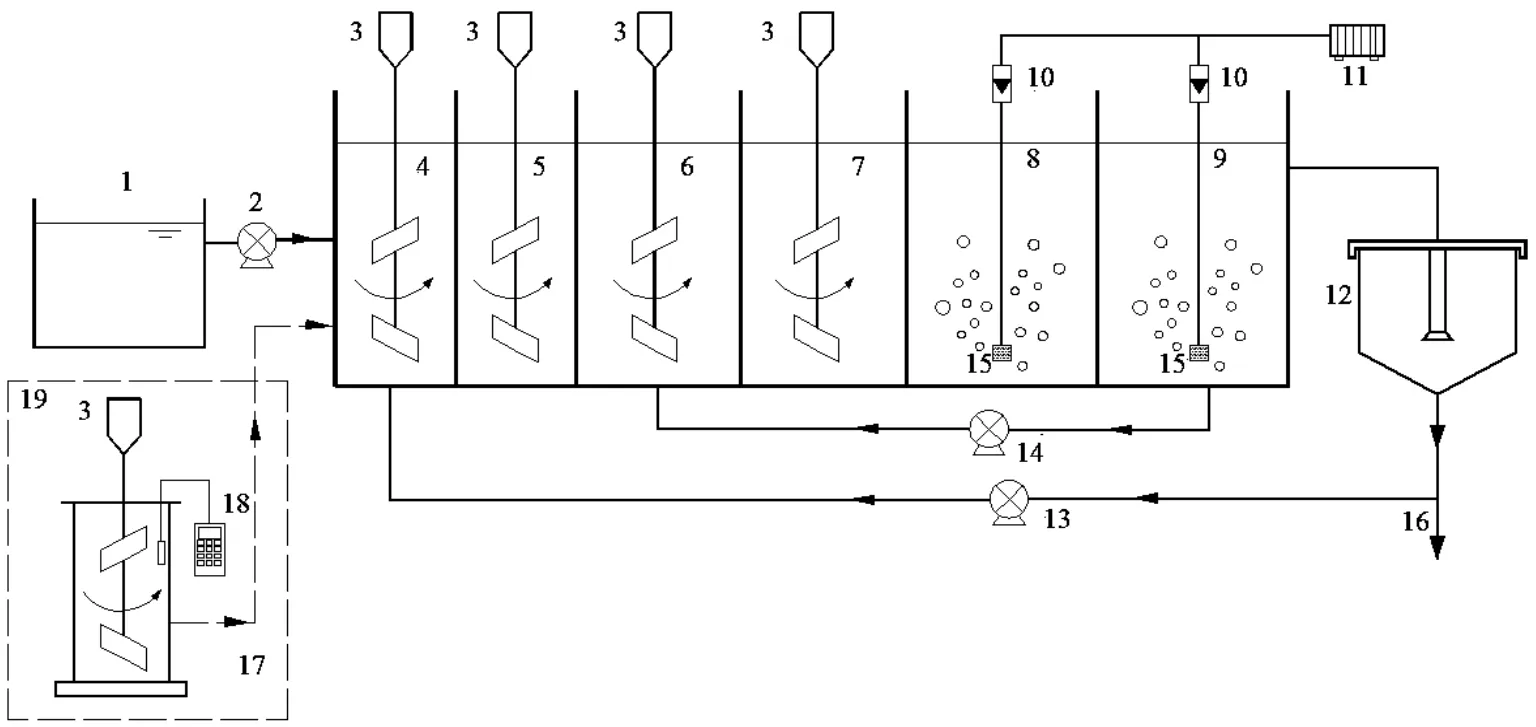
圖1 A2O及 FNA預處理工藝裝置示意Fig.1 Schematic diagram of the A2O and FNA pre-treatment process
1.4 活性污泥中AOB和NOB的活性測定
向7個SBR反應器中分別投加NaNO2儲備液,使得SBR反應器中NO2--N的初始濃度均為30mg/L,曝氣60min(DO >4.0mg/L),間隔10min取樣.反應結束后再分別投加 NH4Cl儲備液,使得SBR反應器中的NH4+-N濃度均為30mg/L,曝氣60min(DO>4.0mg/L),間隔10min取樣.然后測定水樣中NO2--N和NH4+-N的濃度.AOB 和NOB的活性采用NH4+-N和 NO2--N比氧化速率表征,計算混合液中NH4+-N和NO2--N在反應過程中的濃度降低速率,用FNA濃度為0mg HNO2-N/L的反應器中AOB和NOB的活性作為參比,計算其他FNA濃度下AOB和NOB的底物降解速率占參比數值的百分比表示AOB和NOB的活性變化.
1.5 分析項目與方法
pH值和DO采用德國WTW pH/oxi340i儀和WTW DO/oxi340i儀在線監測.混合液污泥濃度MLSS采用濾紙稱重法;揮發性污泥質量濃度MLVSS采用馬弗爐灼燒重量法測定[21];水樣經過 0.45μm濾紙過濾后測定 NH4+-N、NO2--N和NO3--N,采用美國LACHAT公司Quik Chem 8500Series2流動注射分析儀.采用 Fast DNA Spin Kit for Soil(QBIOgen Inc.,Carlsba,CA,美國)DNA提取試劑盒提取反應器活性污泥樣品的總DNA.
采用特異性引物對AOB amoA功能基因,隸屬于NOB菌群的Nitrospira和Nitrobacter以及全菌的16S rRNA進行qPCR擴增.采用Mx3005P實時定量 PCR 擴增儀(Agilent Technologies, American).所用引物及其核苷酸序列見表2.
1.6 MiSeq高通量測序
MiSeq高通量測序實驗流程如下:
首先完成基因組 DNA的抽提,然后進行PCR擴增,將PCR產物用QuantiFluor? -ST藍色熒光定量系統(Promega公司)進行檢測定量,構建MiSeq文庫,最終進行Miseq測序并進行菌群結構分析.
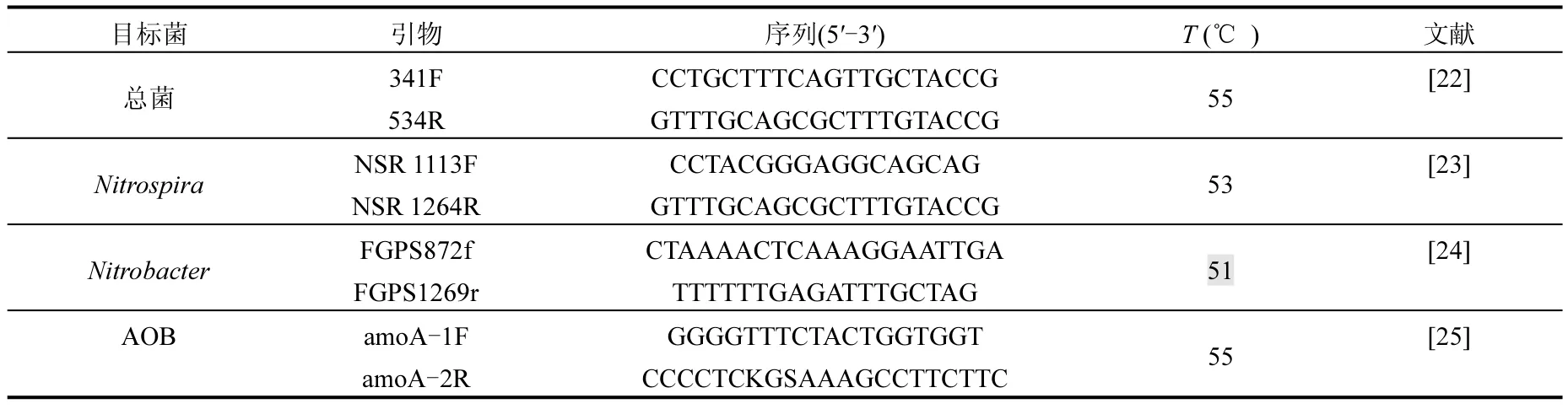
表2 實時定量PCR所用引物及退火溫度Table 2 Primers and annealing temperature in real-time qPCR analysis
2 結果與討論
2.1 不同濃度FNA對污泥中AOB與NOB活性的影響
通過投加濃度為0.067、0.11、0.18、0.34、0.67、1.12mgHNO2-N/L的FNA并對活性污泥進行缺氧攪拌,污泥中 AOB剩余活性分別為78%、67%、65%、61%、42%和40%;NOB的剩余活性分別為63%、57%、54%、41%、23%和14%(圖 2).可以觀察到在缺氧條件下,相同濃度的FNA對NOB的抑制始終大于AOB.當FNA濃度達到 1.12mgHNO2-N/L時,其對 AOB和NOB活性的抑制作用的差異最大.委燕等[18]采用北京高碑店污水處理廠回流污泥經缺氧FNA(0.27mg HNO2-N/L)處理6h,發現NOB活性下降83.57%,而AOB的活性僅下降22.34%.馬斌等[19]采用0.75mgHNO2-N/L的FNA處理北京高碑店污水處理廠二沉池的剩余污泥后,活性污泥中AOB剩余活性為83%,NOB的剩余活性僅為14%.本試驗中,AOB和NOB受抑制的程度差異較小,這可能是由于污泥來源不同,污泥中微生物種群結構存在差異,并且不同種屬的 AOB和NOB對FNA也可能存在著耐受程度的差異.
那么向連續流A2O反應器中的部分活性污泥中投加FNA,使濃度達到1.12mgHNO2-N/L并對活性污泥進行缺氧攪拌,即采用 FNA預處理,理論上可以利用污泥中NOB的NO2?-N氧化速率低于AOB的NH4+-N氧化速率來實現城市污水短程硝化.
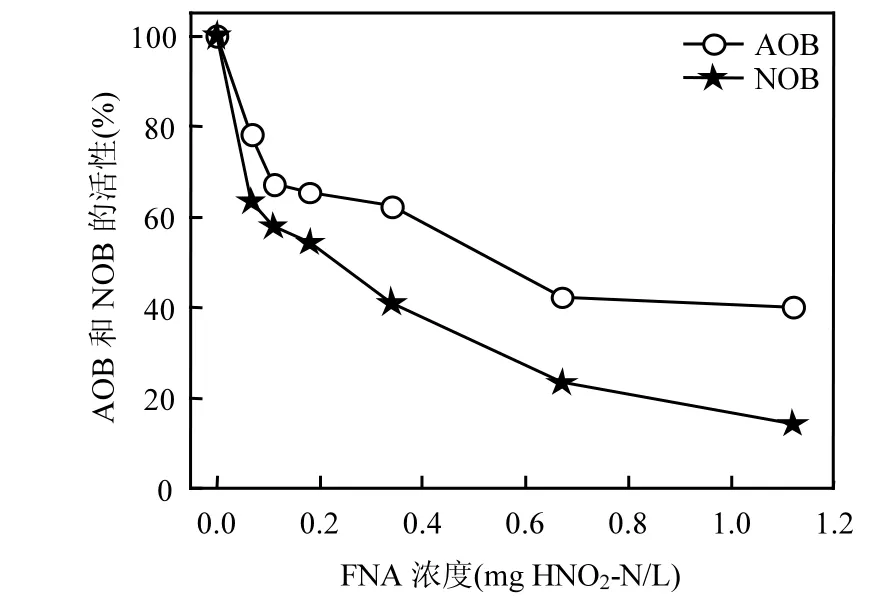
圖2 FNA對AOB和NOB的活性影響Fig.2 Effect of FNA on the activities of AOB and NOB
2.2 基于FNA預處理的A2O工藝短程硝化反硝化的啟動
根據FNA對活性污泥中的AOB和NOB活性影響的研究結果,考察反應器在第Ⅱ階段的脫氮性能.從圖 3可以看出在 1~30d,平均出水NH4+-N、NO2--N和NO3--N濃度分別為0.91、0.81和12.65mg/L,總氮去除率在75.93%左右.在31~40d,平均出水 NH4+-N、NO2--N和 NO3--N濃度分別為約為 7.09、1.63和 16.55mg/L,NAR在8.79%左右,總氮去除率約為56.83%.第40d結束 FNA預處理后,平均出水 NH4+-N約為12.76mg/L,NO2--N 和 NO3--N 濃度分別為1.51mg/L和 7.82mg/L,NAR后維持在 20%左右,TN的平均去除率為64.72%.在第40~65d沒有實現預計的較高的NAR,從出水較高的NH4+-N濃度可以推測,氨氧化過程受到了一定的影響,系統中的AOB活性可能也受到了抑制,NOB的活性沒有徹底地喪失,出水中的 NO3--N濃度還是較高,沒有達到預期的短程硝化效果.
2.3 活性污泥菌群結構分析
為了探究在處理結束后的 25d中沒有出現預期的較高的NO2--N積累的原因,分別取第15d和第 65d的活性污泥樣品分別記為 Before和After,后采用MiSeq高通量測序技術分析了FNA預處理前后的活性污泥中的微生物結構的變化.從處理前和處理后的污泥樣品Before和After的微生物菌群結構中分別獲得了37920、33765條優化序列,有效序列平均長度為 443,符合 MiSeq高通量測序的要求.以 3%差異性對非重復序列進行操作分類單元(OUT)劃分,以評估樣品中微生物種群豐度及多樣性,處理前后的泥樣分別劃分為615、697個OTUs.處理前后的泥樣中微生物菌群豐度指數見表 3.微生物菌群 Shannon多樣性指數,可用來估算污泥樣品中的微生物多樣性及均一性[26],由表3可知,處理后的泥樣中微生物菌群的Shannon指數更高,這可能是由于FNA的抑制使得大部分不適應高濃度FNA環境的細菌不斷減少,同時減弱了其與適應于高濃度FNA環境細菌的競爭,因此后者可以利用充足的底物不斷增值,所以污泥中的微生物均一性有所提高.
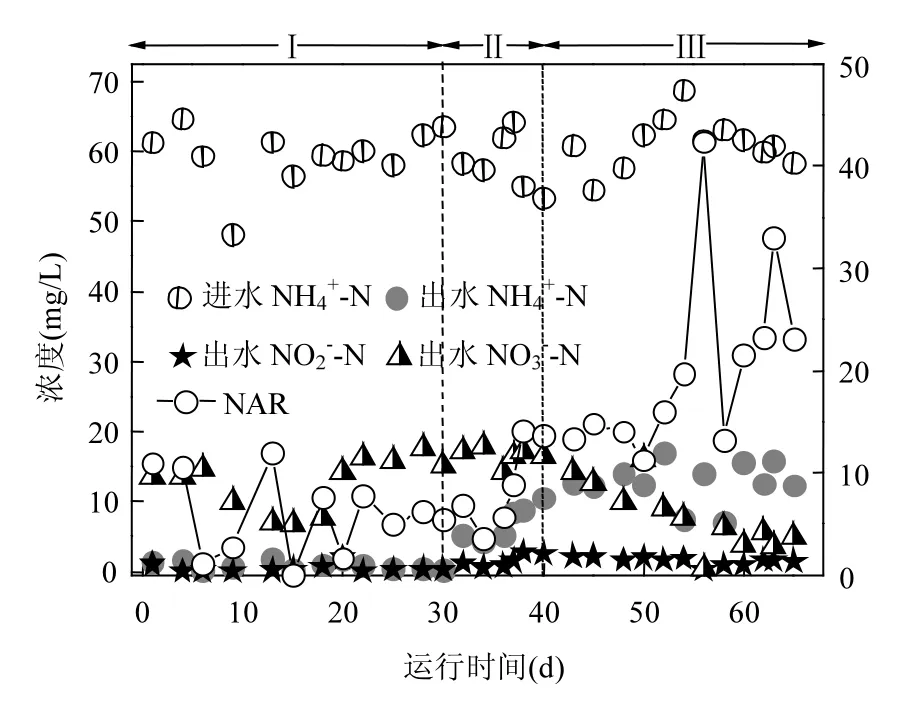
圖3 系統運行65d對氮的去除效果Fig.3 Nutrient removal performance of 65days operational period

表3 反應前后污泥樣品多樣性指數統計Table 3 Diversity statistics for different sludge samples
此外,對每個OTU進行分類學分析,在97%相似性水平下統計 2個污泥樣品中共用或獨有的OUT數目,并繪制OTUs分布的Venn圖(圖4).Venn圖可以直觀地反映出不同泥樣的 OTUs數目組成的相似性以及重疊情況[27].由圖 4可知,2個泥樣的微生物菌群中共有 941個 OTUs,兩者共有的 OUTs有 371個,占全部 OTUs的39.4%.這說明經過FNA預處理,污泥的菌群結構發生了一定的變化.共有的 OTUs中有 5.81%屬于 Comamonadaceae_unclassified(叢毛單胞菌科);Dokdonella 占 5.75%,屬于黃單胞菌科;Zoogloea(動膠菌屬)占3.46%,Thauera(陶厄菌屬)占4.13%,2.1%為Nitrospira(硝化螺旋菌屬).
由圖 5可知,預處理前后的系統微生物菌群均具有較高的生物多樣性.預處理前的系統中Zoogloea(動膠菌屬)占6.04%,可用于形成污泥絮體菌膠團[28];Nitrospira(硝化螺菌屬)占 3.39%,是系統中參與硝化反應的優勢菌種,可完成對亞硝酸鹽的氧化反應.處理后的活性污泥中Thauera(陶厄菌屬)變為系統中的優勢菌屬,占6.64%,其具有反硝化的能力[29-30].在預處理后的活性污泥中出現的Candidatus Nitrotoga,占總序列數的1.66%.
通過FNA預處理,活性污泥中Nitrospira(硝化螺菌屬)、Nitrosomonas(亞硝化單胞菌屬)均出現了減少的現象.Nitrospira從占總序列數的3.39%減少到0.41%.由于FNA預處理后,氨氧化菌Nitrosomonas的減少,使得氨氧化過程受到了較大程度的影響,這導致了反應器進水中的NH4+-N 沒有得到充分的氧化,只有少部分NH4+-N被氧化為NO2--N,底物的減少也同時影響了亞硝酸鹽氧化菌的增殖.此外,在預處理前的污泥中并未檢測到有Nitrotoga的存在,但它在預處理后的污泥中卻占總序列數的 1.66%.推測是由于在 FNA預處理的階段,污泥中的 Nitrotoga逐漸適應了高濃度FNA、低pH值的條件,在其他細菌受到較大抑制同時反而成為了硝化細菌中的優勢菌屬.Lücker等[31]發現了Nitrotoga是一種重要的亞硝酸鹽氧化菌,并發現了在 Nitrotoga作為唯一亞硝酸鹽氧化菌的污水處理廠中,出水NO2--N濃度很低.所以筆者認為,雖然Nitrospira從占總序列數的 3.4%減少到了 0.41%,但是Nitrotoga的增殖使得反應器中的NO2--N依然得到了氧化,所以出水并沒有出現大量的亞硝酸鹽積累.
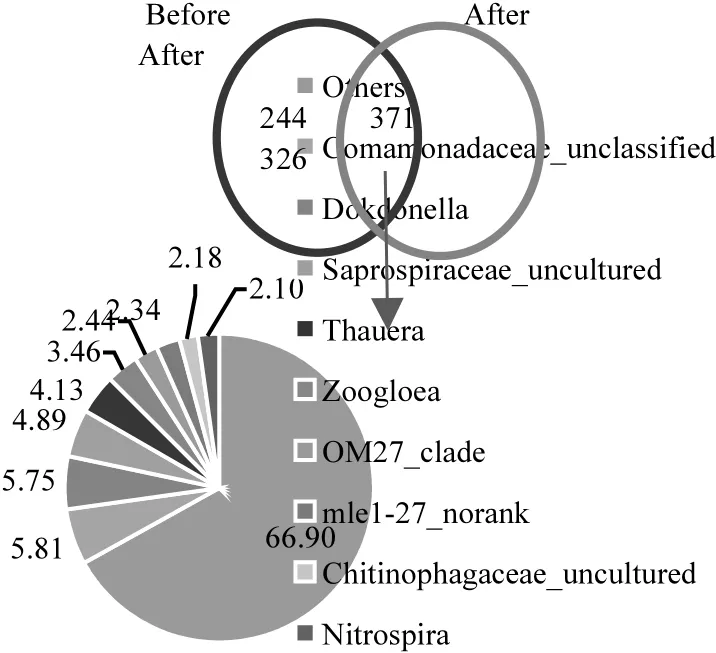
圖4 基于OTUs的微生物菌群Venn圖Fig.4 Venn diagram of microorganism communities of different sludge samples based on OTUs

圖5 MiSeq高通量測序序列在屬水平上的分布Fig.5 Taxonomic classification of MiSeq high-through sequencing at the genus leve
為了驗證高通量測序對污泥中功能性微生物測序結果,本研究采用實時定量PCR對污泥中的硝化細菌進行了進一步的定量分析,并對處理前后活性污泥的菌群結構進行比較.經過FNA預處理PCR分析結果顯示(表4),在FNA預處理前系統中AOB、Nitrobacter、Nitrospira的種群豐度分別為 2.05×108、8.32×108、5.97×108copies/ gVSS,分別占全菌的0.91%、3.64%、2.64%.可以看出在FNA預處理前Nitrobacter、Nitrospira均比AOB的種群豐度高,在FNA預處理前的污泥中 NOB的種群數量更占優勢,污泥屬于全程硝化污泥.由于Nitrobacter、Nitrospira在菌群中的數量優勢,使得出水的平均 NO3--N 為12.65mgN/L而出水平均 NO2--N 濃度只有0.98mgN/L,幾乎沒有亞硝酸鹽的積累.當增加了FNA預處理后,系統中的菌群結構發生了較大的變化,總菌數量由之前的 2.26×1010降低為3.61×109.AOB和NOB的數量也均出現了明顯的下降,可以看出FNA的生物毒性對系統中的細菌均產生了抑制效應.AOB的種群豐度下降了3個數量級,由2.05×108下降到了3.96×105.作為初始系統中優勢菌種的Nitrobacter由8.23×108降低為2.72×107,僅占全菌總數的0.75%.FNA預處理后的污泥中AOB占全菌總數也減少到了0.01%.由于 AOB數量的減少,系統的氨氧化效果受到較大的影響,使得反應器的出水平均氨氮濃度達到了12.77mgN/L,氨氧化過程受到了較大程度的破壞.
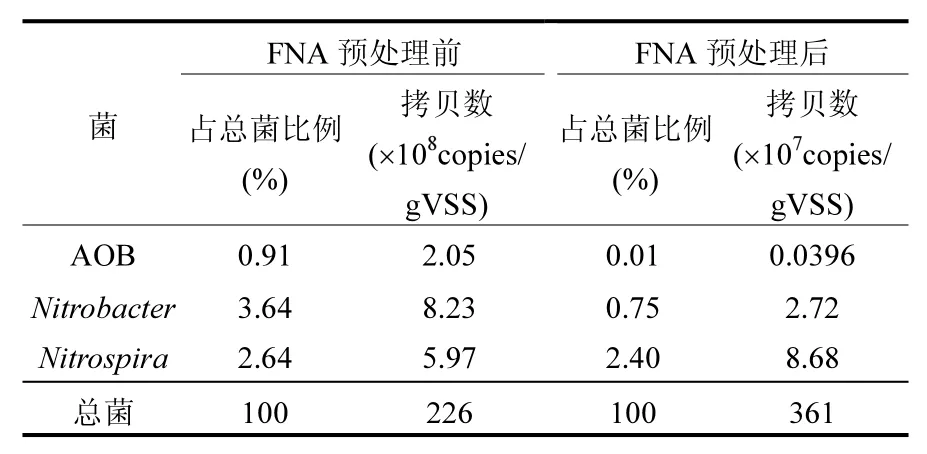
表4 總菌、AOB、Nitrospira和Nitrobacter的實時定量結果Table 4 qPCR results of bacteria, AOB, Nitrospira and Nitrobacter
3 結論
3.1 缺氧條件下,3h的FNA預處理對NOB的抑制作用大于AOB.
3.2 通過 FNA預處理活性污泥可以導致活性污泥中總菌、AOB、Nitrospira和Nitrobacter種群豐度的下降,改變污泥的微生物種群結構,影響A2O系統的氨氧化過程.
3.3 通過FNA預處理可以馴化出適應高FNA濃度的細菌.其中,Nitrotoga細菌可能適應于高濃度FNA環境,并不斷增值從而破壞A2O系統短程硝化.
[1] Fdzpolanco F, Villaverde S, Garcia P A. Temperature effect on nitifying bacteria activity in biofilters-activation and free ammonia inhibition [J]. Water Science and Technology, 1994,30(11):121-130.
[2] 張立秋,韋朝海,張可方,等.常溫下 SBBR反應器中短程同步硝化反硝化的實現 [J]. 工業用水與廢水, 2008,39(4):1-5.
[3] 高大文,彭永臻,王淑瑩.控制pH實現短程硝化反硝化生物脫氮技術 [J]. 哈爾濱工業大學學報, 2005,(12):1664-1666.
[4] 卞 偉,李 軍,趙白航,等.硝化污泥中 AOB/NOB對硝化特性的影響 [J]. 中國環境科學, 2016,36(8):2395-2401.
[5] 高大文,彭永臻,王淑瑩.交替好氧/缺氧短程硝化反硝化生物脫氮Ⅰ.方法實現與控制 [J]. 環境科學學報, 2004,24(5):761-768.
[6] 高大文,彭永臻,王淑瑩.交替好氧/缺氧短程硝化反硝化生物脫氮Ⅱ.過程控制模式的確定 [J]. 環境科學學報, 2004,24(5): 769-775
[7] 于德爽,彭永臻,張相忠,等.中溫短程硝化反硝化的影響因素研究 [J]. 中國給水排水, 2003,(1):40-42.
[8] Ruiz G, Jeison D, Chamy R. Nitrification with high nitrite accumulation for the treatment of wastewater with high ammonia concentration [J]. Water Research, 2003,37:1371-1377.
[9] 高春娣,王惟肖,李 浩,等.SBR法交替缺氧好氧模式下短程硝化效率的優化 [J]. 中國環境科學, 2015,35(2):403-409.
[10] Hanaki K, Wantawin C, Ohgaki S. NitificationI at low-levels of dissolved-oxygen with and without organic loading in a suspended-growth reactor [J]. Water Research, 1990,24(3): 297-302.
[11] Zhou Y, Oehmen A, Lim M, et al. The role of nitrite and free nitrous acid (FNA) in wastewater treatment plants [J]. Water Research, 2011,45(15):4672-4682.
[12] Anthonisen A C, Loehr R C, Prakasam T, et al. Inhibition of nitrification by ammonia and nirous-acid [J]. Journal Water Pollution Control Federation, 1976,48(5):835-852.
[13] Wang Q, Ye L, Jiang G, et al. A free nitrous acid (FNA)-based technology for reducing sludge production [J]. Water Research, 2013,47(11):3663-3672.
[14] Anthonisem A C, Loehr R C, Prakasam T, et al. Inhibition of Nitrification by Ammonia and Nitrous-acid [J]. Journal Water Pollution Control Federation, 1976,48(5):835-852.
[15] Zhang Y, He S, Niu Q, et al. Characterization of three types of inhibition and their recovery processes in an anammox UASBreactor [J]. Biochemical Engineering Journal, 2016,109:212-221.
[16] Vadivelu V M, Yuan Z, Fux C, et al. The inhibitory effects of free nitrous acid on the energy generation and growth processes of an enriched Nitrobacter culture [J]. Environmental Science & Technology, 2006,40(14):4442-4448.
[17] 張宇坤,王淑瑩,董怡君,等.游離氨和游離亞硝酸對亞硝態氮氧化菌活性的影響 [J]. 中國環境科學, 2014,34(5):1242-1247.
[18] 委 燕,王淑瑩,馬 斌,等.缺氧FNA對氨氧化菌和亞硝酸鹽氧化菌的選擇性抑菌效應 [J]. 化工學報, 2014,(10):4145-4149.
[19] 馬 斌,委 燕,王淑瑩,等.基于FNA處理污泥實現城市污水部分短程硝化 [J]. 化工學報, 2015,66(12):5054-5059.
[20] Wang Q, Ye L, Jiang G, et al. Side-stream sludge treatment using free nitrous acid selectively eliminates nitrite oxidizing bacteria and achieves the nitrite pathway [J]. Water Research, 2014,55: 245-255.
[21] Apha. Standard methods for the examination of water and wastewater.14th ed [J]. Washington DC: APHA American Public Health Association, 1976.
[22] Nishijima M, Lindsay D J, Hata J, et al. Association of thioautotrophic bacteria with deep-sea sponges [J]. Marine Biotechnology, 2010,12(3):253-260.
[23] Geets J, de Cooman M, Wittebolle L, et al. Real-time PCR assay for the simultaneous quantification of nitrifying and denitrifying bacteria in activated sludge [J]. Applied Microbiology and Biotechnology, 2007,75(1):211-221.
[24] Degrange V, Bardin R. Dectection and counting of nitrobacter populations in soul by PCR [J]. Applied and Environmental Microbiology, 1995,61(6):2093-2098.
[25] Wang S, Wang Y, Feng X, et al. Quantitative analyses of ammonia-oxidizing Archaea and bacteria in the sediments of four nitrogen-rich wetlands in China [J]. Applied and Environmental Microbiology, 2011,90(2):779-787.
[26] Navarro R R, Hori T, Inaba T, et al. High-resolution phylogenetic analysis of residual bacterial species of fouled membranes after NaOCl cleaning [J]. Water Research, 2016,94:166-175.
[27] Wang B, Peng Y, Guo Y, et al. Illumina MiSeq sequencing reveals the key microorganisms involved in partial nitritation followed by simultaneous sludge fermentation, denitrification and anammox process [J]. Bioresource Technology, 2016,207:118-125.
[28] Shao Y, Chung B S, Lee S S, et al. Zoogloea caeni sp nov., a floc-forming bacterium isolated from activated sludge [J]. International Journal of Systematic and Evolutionary Microbiology, 2009,59:526–530.
[29] Scholten E, Lukow T, Auling G, et al. Thauera mechernichensis sp nov., an aerobic denitrifier from a leachate treatment plant [J]. International Journal of Systematic Bacteriology, 1999,49(3): 1045-1051.
[30] Liu B B, Zhang F, Feng X X, et al. Thauera and Azoarcus as functionally important genera in a denitrifying quinoline-removal bioreactor as revealed by microbial community structure comparison [J]. FEMS Microbiology Ecology, 2006,55(2):274-286.
[31] Luecker S, Schwarz J, Gruber-Dorninger C, et al. Nitrotoga-like bacteria are previously unrecognized key nitrite oxidizers in full-scale wastewater treatment plants [J]. ISME Journal, 2015, 9(3):708-720.
Effect of free nitrous acid (FNA) on microorganism community structures of A2O sludge.
MA Lin-na1, LIU Wen-long2, ZHANG Qiong1, PENG Yong-zhen1,2*(1.National Engineering Laboratory for Advanced Municipal Wastewater Treatment and Reuse Technology, Engineering Research Center of Beijing , Beijing University of Technology, Beijing 100124, China;2.State Key Laboratory of Urban Water Resource and Environment, Harbin Institute of Technology, Harbin 150090, China). China Environmental Science, 2017,37(7):2566~2573
In order to assess the feasibility of achieving nitritation in the anaerobic/anoxic/oxic (A2O) system through the strategy of free nitrous acid (FNA) sludge treament, the activities of ammonium oxidizing bacteria (AOB) and nitrite oxidizing bacteria (NOB) activities was studied. Besides, the variations of nutrient removal performance and microorganism community structures in the A2O reactor after long-term FNA sludge treatment were investigated. Results showed that the activities of AOB and NOB decreased by 60% and 86% respectively after the sludge subjectd to FNA treatment at 1.12mg HNO2-N/L for 3h. The average effluent concentrations of NH4+-N, NO2--N and NO3--N in the A2O system were 12.76, 1.56 and 7.82mg/L respectively. The nitrite accumulation rate (NAR) was around 20%, indicating that nitritation in the A2O system was not achieved by the FNA sludge treament. Furthermore, High-throughput sequencing and qPCR results showed that AOB abundance was greatly decreased from 2.05×108copies/gVSS to 3.96×105copies/gVSS and the ammonia oxidation process was negatively affected. In addition, Nitrobacter and Nitrospira were also inhibited, while Nitrotoga accounted for 1.66% of total sequences, for which the nitritation in the A2O system was not achieved by FNA sludge treatment strategy.
nitritation;FNA;ammonium oxidizing bacteria (AOB);nitrite oxidizing bacteria (NOB);community structures;A2O
X703
A
1000-6923(2017)07-2566-08
馬琳娜(1991-),女,河北石家莊人,北京工業大學研究生,主要從事污水生物處理理論與應用研究.
2016-12-12
國家重點研發計劃課題(2016YFC0401102);北京市教委資助項目
* 責任作者, 教授, pyz@bjut.edu.cn

