羥基自由基快速殺滅典型水華藻的研究
丁麗飛,李海燕,白敏冬*,鄭 武,郭 楓,張芝濤(.廈門大學環境與生態學院,海洋生物資源開發利用協同創新中心,福建 廈門 3602;2.大連海事大學環境工程研究所物理系,遼寧 大連 6026)
羥基自由基快速殺滅典型水華藻的研究
丁麗飛1,李海燕1,白敏冬1*,鄭 武1,郭 楓1,張芝濤2*(1.廈門大學環境與生態學院,海洋生物資源開發利用協同創新中心,福建 廈門 361102;2.大連海事大學環境工程研究所物理系,遼寧 大連 116026)
以典型水華藻銅綠微囊藻、針桿藻和四尾柵藻為研究對象,利用大氣壓強電離放電高效生成的羥基自由基(?OH)對3種藻進行殺滅.采用熒光染色、流式細胞儀和光合活性等生物學方法,確定?OH殺滅的閾值濃度和時間,并觀察細胞形態變化.結果表明,當混合藻中銅綠微囊藻、針桿藻和四尾柵藻的初始藻密度分別為19.5×104、21.8×104和4.90×104cells/mL時, ?OH殺滅的閾值濃度為1.07mg/L,致死時間為4.5s;形態觀察結果表明,處理后各種藻的形態是完整的,無內溶質溢出.因此,采用?OH可實現高效快速殺滅水華藻,有效保障飲用水安全.
羥基自由基;水華藻;致死閾值;暴露時間
藻華是世界性的水環境問題,而我國的諸多湖泊與河流庫區的高藻爆發形勢日益嚴峻.這些湖庫水是我國飲用水水源的重要組成部分,高藻爆發時,藻密度、化學需氧量、氨氮等水質指標超過地表水Ⅲ類標準,不僅會增加自來水廠的生產成本,甚至引起減產或停產.常規飲用水處理工藝難以解決藻類毒素、嗅味物質等高藻引發的水質超標問題,嚴重威脅城市供水和飲用水安全[1].
目前,采用化學氧化法控制藻華已成為全世界范圍內的研究熱點.Daly等[2]研究氯法殺滅密度為30×104cells/mL的銅綠微囊藻,當CT值(氧化劑的暴露總量)為7~29(mg·min)/L時,所有藻細胞失去活性,但產生三氯甲烷、鹵乙酸等鹵代有機消毒副產物[3].Zhou等[4]研究了二氧化氯法殺滅密度為100×104cells/mL的銅綠微囊藻,作用時間為10min時,藻細胞去除率達到91.5%,但產生的副產物 ClO2-和 ClO3-具有較大的潛在毒性[5]. Huo等[6]采用濃度為0~60mg/L的H2O2殺滅銅綠微囊藻,作用時間為3h時,致死率達到99%,然而H2O2濃度大,殺滅高藻的成本過高[7], H2O2在使用和運輸過程中存在爆炸隱患.Coral等[8]研究臭氧法致死細胞密度為25×104和150×104cells/ mL的銅綠微囊藻,在CT值小于0.2mg·min/L時,所有細胞失活,若水中Br-和Cl-濃度較高,O3氧化會生成 HOBr等消毒副產物[9],且臭氧法的一次性設備投資、運行成本高,設備及附屬設備龐大.Li等[10]利用水利空化產生羥基自由基技術,處理初始葉綠素含量為 0.17mg/m3的銅綠微囊藻,當羥基濃度為 2.03μmol/L,3d內對藻的去除率可達91.2%.顧雨辰等[11]利用高壓脈沖氣液混合放電殺滅銅綠微囊藻,結果表明在優化條件下,該方法在5d時間內,對葉綠素含量為0.15mg/m3的銅綠微囊藻的致死率可達 99%以上.因此采用氯氣、二氧化氯、H2O2和O3等常規氧化劑去除水中藻細胞時,存在生成具有潛在毒性的消毒副產物、反應時間長、投資和運行成本高、安全性差、設備龐大等多種問題.而采用電離放電法除藻成為當今熱點[12].
本文針對 3種典型的水華藻,即銅綠微囊藻、針桿藻和四尾柵藻,在大氣壓條件下采用強電離放電高效制備?OH溶液,開展了?OH對上述3種典型水華藻的殺滅研究.結合SYTOX Green熒光染色技術、流式細胞儀法和光合活性參數Fv/Fm值,分別確定了?OH對3種典型水華藻的致死閾值和時間,為高藻水高效安全處理提供新方法,為高藻爆發時期飲用水處理工藝的改進提供新思路.
1 材料與方法
1.1 材料
實驗所用的銅綠微囊藻(Microcystis aeruginosa, FACHB-905)、針桿藻(Synedra sp., FACHB-843)和 四 尾 柵 藻 (Scenedesmus quadricuauda, FACHB-44)購自中科院武漢水生所.銅綠微囊藻屬藍藻門色球藻科微囊藻屬,細胞球形、圓球形,直徑3~5μm左右,細胞淡藍色或綠色,常聚集生長,群體具無色柔和溶解性的膠被,以二分裂形式進行繁殖.針桿藻屬硅藻門羽紋綱無殼縫目,細胞長桿形,長10μm左右,殼面披針形,中部寬,從中間到兩端逐漸狹窄;四尾柵藻屬綠藻門柵藻科柵藻屬,細胞為長圓形、圓柱形,長15~20μm,常由4個細胞構成,群體中的各個細胞以其長軸相互平行、其細胞壁彼此緊密排列在一個平面上,互相平齊,群體兩側細胞的上下兩端各具 1刺,刺長 10~13μm.3種藻的培養基依次為BG11、Erdschreiber和SE,培養條件均為(25±1)℃, pH=(7.1±0.1),光照 2000lux,光:暗=12h:12h.實驗過程中取對數期的藻細胞完成殺滅實驗.
實驗配水是由純水機(Millipore Milli-Q,美國)制取,用于實驗系統配制試劑.
1.2 實驗系統
?OH快速殺滅典型水華藻的實驗系統如圖1所示,待處理高藻水流量為 4L/min,由泵泵入管路中,O2(純度為99.9%)的流量為0.5L/min,通入到氧等離子體發生器中,在大氣壓下微輝光與微流注交替促成的強電離放電作用下,O2被電離、離解生成O2+、O(1D)、O、O2-、O2(a1?g)、O3等氧活性粒子,通過高壓射流空化效應高傳質效率地注入到水中,生成以?OH為主的氧自由基溶液,其中還包括H2O2、HO2ˉ、O2?ˉ、O3?ˉ、HO3?等自由基[10-11],統稱為總氧化劑 TRO.在管路中?OH對藻細胞進行快速高效的殺滅,取樣點的殺滅時間分別為0.4s、1.3s、2.1s、2.9s、3.7s、4.5s.

圖1 ?OH處理高藻水系統Fig.1 ?OH treating system of algae-laden water
1.3 實驗方法
1.3.1 總氧化劑TRO濃度檢測 TRO是以?OH為主,包括H2O2、HO2ˉ、O2?ˉ、O3?ˉ、HO3?和O2+H2O等氧自由基的總氧化劑濃度,由在線監測儀(ATi Q45H,美國)檢測,同時依據USEPA 330.5標準中的 DPD(N,N-二乙基對苯二胺)分光光度法進行測定[13].
1.3.2 藻細胞活性分析 熒光顯微鏡計數法,染色劑為SYTOX?Green(Life Technologies,美國)核酸染色劑是帶 3個正電荷的不對稱花青染色,與表面帶正電荷的活體藻細胞互相排斥,并且由于其大分子染色結構,它不能穿透活細胞膜.相反,?OH影響藻細胞膜的通透性,允許 SYTOX Green核酸染色劑進入失去活性的藻細胞內,與核酸結合,在488nm藍激發光激發下,呈現綠色熒光;活細胞呈現葉綠素的自體紅色熒光[14-15].通過觀察紅色熒光和綠色熒光清晰地辨別藻細胞死活.采用徠卡DM6000B全自動熒光顯微鏡,放大400倍,在自然光下找到藻細胞,分別在綠色激發光和藍色激發光下判別死活、計數,以 100格為一個計數單位,按1mL記錄.
流式細胞儀(Accuri C6,BD,美國)檢測,加入適量的染色劑(SYTOX?Green)于 1mL樣品中,避光,置于渦旋振蕩后靜置7min,經60μm篩絹過濾,發出的綠色熒光在 FL1(525nm)通道被收集,發出的紅色熒光在FL3(620nm)通道被收集,數據通過FlowJo 7.6分析處理[16-17].
1.3.3 藻細胞的光合能力分析 光合活性參數Fv/Fm表示藻細胞光合反應中心PSII的最大光量子產量,反應了植物的最大潛在光合能力,該值越大說明光和潛力越大.樣品經15min的暗適應,使用葉綠素熒光儀脈沖儀(PHYTO-PAM Walz,德國)和Photo win v2.13(ED)操作軟件測定,其計算公式為:
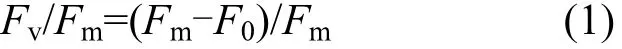
2 結果與討論
2.1 采用熒光染色法確定?OH殺滅閾值
基于?OH致死混合藻的實驗,銅綠微囊藻、針桿藻和四尾柵藻的初始藻濃度分別為19.5×104、21.8×104和 4.90×104cells/mL,總藻為46.2×104cells/mL,總氧化劑TRO濃度設置為0、0.51、0.79、0.96、1.07、1.24和1.31mg/L,反應時間為4.5s.TRO致死混合藻的關系曲線如圖2所示,隨著TRO濃度的增高,活藻密度急劇下降,?OH殺滅3種藻的閾值濃度為1.07mg/L.

圖2 TRO對3種藻致死閾值的影響Fig.2 Effect of TRO on the lethal threshold of 3algae species

圖3 ?OH致死3種藻前后的熒光顯微鏡觀察結果Fig.3 Light and fluorescence microscope of 3kinds of algae before and after ?OH inactivation
采用顯微鏡分析原藻細胞及閾值(1.07mg/L)致死藻細胞形態的變化,如圖3所示.自然光下觀察,原藻細胞(圖A、B、C)通體周圓,細胞壁光滑完好,胞內結構分布清晰,顏色鮮亮稠密;處理后(圖A1、B1、C1),藻細胞外形基本沒有變化,但顏色暗淡,胞內分布模糊.在熒光下觀察,原藻細胞(圖a、b、c)發出紅色的葉綠素自體熒光;處理后(圖a1、b1、c1)細胞核發出強烈的綠色熒光,證明細胞死亡,染色劑通過細胞膜進入細胞,與細胞核中的 DNA結合,使細胞核染色.根據藻細胞形態學分析,閾值濃度下細胞形態完整,無觀察到內溶質溢出.
2.2 采用光合能力確定?OH殺滅閾值

圖4 TRO對藻的光合參數Fv/Fm的影響Fig.4 Effect of TRO on photosynthetic parameter Fv/Fmof algae
2.3 采用流式細胞儀確定?OH殺滅閾值
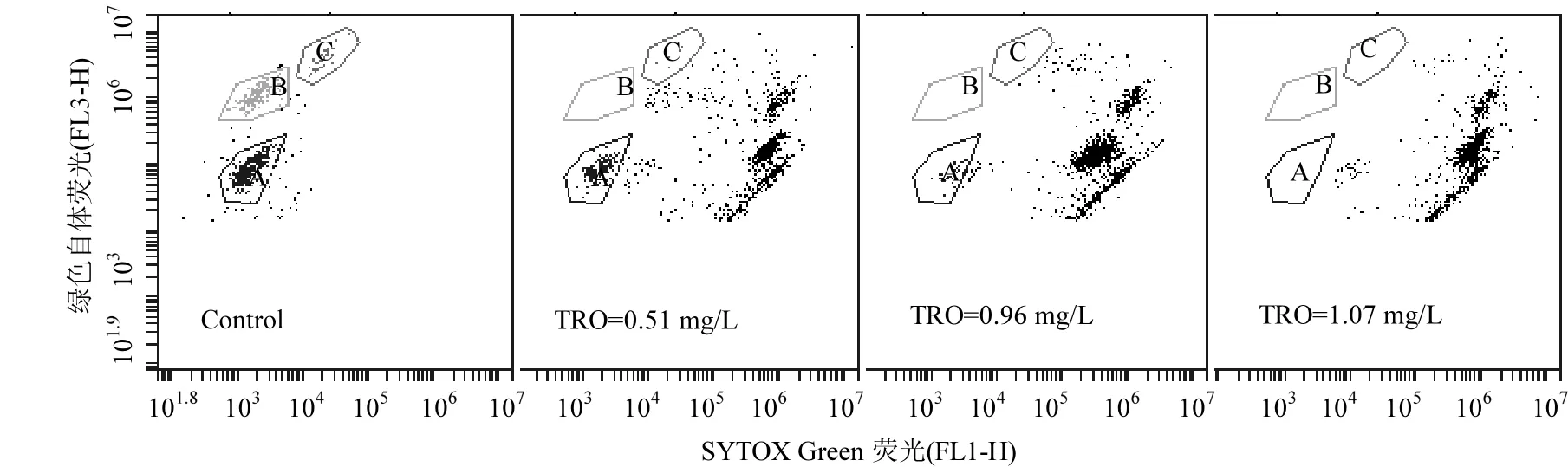
圖5 ?OH致死3種藻的流式細胞儀檢測結果Fig.5 Flow cytometry results of ?OH inactivation of 3algae species Control為對照組;A:銅綠微囊藻;B:針桿藻;C:四尾柵藻
?OH致死 3種藻的流式細胞儀檢測結果如圖5所示,橫坐標反應了SYTOX Green染色劑與細胞核酸結合后發出的綠色熒光強度,通過FL1-H通道收集;縱坐標反應了葉綠素的自發紅色熒光強度,通過FL3-H通道收集;3種藻分布在不同區域,其中A、B、C依次為銅綠微囊藻、針桿藻和四尾柵藻,3部分總和占總藻 99.8%(如圖Control),隨著TRO濃度增高,A、B、C部分的藻細胞數量逐漸減少,并向右邊偏移;當 TRO濃度為0.51mg/L時,A、B、C部分的藻細胞占34.8%;當TRO濃度為0.96mg/L時,A、B、C部分的藻細胞占16.4%;當TRO濃度為閾值濃度1.07mg/L時,3部分的藻細胞數量為 0,且在熒光顯微鏡下觀察,所有藻細胞發綠色熒光,藻細胞結構完整,由此表明,強氧化劑?OH可能對藻細胞中的DNA造成損傷,進而致死藻細胞.
2.4 ?OH殺滅3種藻的時間效應
在致死閾值濃度1.07mg/L時,將初始藻密度為46.2×104cells/mL的混合藻液注入到實驗系統中(圖1),以氧活性粒子注入到管路中的高壓射流器處為0s,分別依次于不同作用時間(分別為0.3、2.1、2.9、3.7、4.5s)的取樣口取樣,同時用過量的飽和硫代硫酸鈉終止反應,測定樣品的光合活性參數Fv/Fm,結果如圖6所示.由圖6可知,隨著作用時間的增加,藻細胞光合活性呈現明顯下降趨勢.Fv/Fm值在4.5s內快速由0.65降至0(儀器顯示為不能檢出),表明?OH能快速進入細胞,在4.5s內使藻細胞的光合系統損傷而失去光合活性.藻細胞形態分析結果顯示,閾值濃度下細胞結構沒有變化,無內溶質溢出,細胞形態完整.
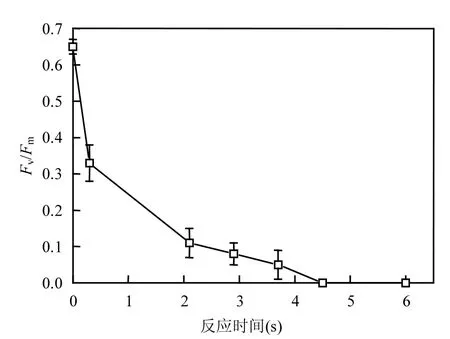
圖6 ?OH致死藻時間對光合參數Fv/Fm的影響Fig.6 Effect of ?OH inactivation time for algae on photosynthetic parameter Fv/Fm
據 Zhou等[4]研究二氧化氯法殺滅密度為100×104cells/mL 的銅綠微囊藻,在 ClO2為 1.0mg/L,作用時間 10min時,藻細胞去除率達91.5%,但藻的細胞膜破裂,產生的副產物ClO2-和具有較大的潛在毒性[5];Coral等[8]研究臭氧法殺滅細胞密度為150×104cells/mL的銅綠微囊藻,在O3為4.0mg/L,作用時間10min時,所有細胞失活,內溶質溢出;據Huase等[22]研究表明高錳酸鉀法殺滅密度為390×104cells/mL的銅綠微囊藻,在KMnO4為5mg/L,當作用2h時,Fv/Fm由0.45降至0.07,藻細胞去除率達84.6%,大量內溶質溢出;Zhou等[23]研究過氧化氫法和硫酸銅法殺滅密度為400×104cells/mL的銅綠微囊藻,當作用4h時,在0.5mmol/L(即17mg/L)H2O2作用下,藻細胞的光合參數由 0.42降至 0.05;在 2.5μmol/L(即0.4mg/L)CuSO4作用下,藻細胞的光合參數由0.42降至0.04,但細胞膜破裂,藻毒素MC-LR外溢.常規氧化劑與藻細胞長時間接觸作用是導致藻細胞失活和破損的主要原因.而?OH法可實現快速殺滅,這是由于?OH具有非常高的反應速率常數(109mol/L·s),是其它氧化劑的107倍以上,反應速度極快,可在數秒內完成整個生化反應過程.
3 結論
3.1 采用?OH開展致死銅綠微囊藻、針桿藻和四尾柵藻混合藻的實驗研究,當初始藻密度分別為19.5×104、21.8×104和4.90×104cells/mL時,混合藻的致死 TRO閾值為 1.07mg/L,致死時間為4.5s.
3.2 在低劑量致死閾值條件下,?OH氧化銅綠微囊藻、針桿藻和四尾柵藻后,藻細胞失去活性,且藻細胞形態完整,細胞未發生破裂.
3.3 本研究規模化制備的?OH為高藻水的高效快速安全處理提供了新方法.
[1] Merel S, Clement M, Thomas O. State of the art on cyanotoxins in water and their behavior towards chlorine [J]. Toxicon, 2010,55: 677-691.
[2] Daly R I, HO L, Brookes J D. Effect of chlorination on Microcystis aeruginosa cell integrity and subsequent microcystin release and degradation [J]. Environmental Science and Technology, 2007,41:4447-4453.
[3] Fang J Y, Ma J, Yang X, et al. Formation of carbonaceous and nitrogenous disinfection by-products from the chlorination of Microcystis aeruginosa [J]. Water Research, 2010,44(6):1934-1940.
[4] Zhou S Q, Shao Y S, Gao N Y, et al. Effect of chlorine dioxide on cyanobacterial cell integrity, toxin degradation and disinfection by-product formation [J]. Science of the Total Environment, 2014,482:208-213.
[5] Carlton B D, Habash D L, Basaran A H, et al. Sodium chlorite administration in Long-Evans rats: reproductive and endocrine effects [J]. Environmental Research, 1987,42(1):238-245.
[6] Huo X, Chang D W, Tseng J H, et al. Exposure of Microcystis aeruginosa to hydrogen peroxide under light: kinetic modeling of cell rupture and simultaneous microcystin degradation [J]. Environmental Science and Technology, 2015,49(9):5502-5510.
[7] Gao L, Pan X, Zhang D, et al. Extracellular polymeric substances buffer against the biocidal effect of H2O2on the bloom-forming cyanobacterium Microcystis aeruginosa [J]. Water Research, 2015,69:51-58.
[8] Coral L A, Zamyadi A, Barbeau B, et al. Oxidation of Microcystis aeruginosa and Anabaena flos-aquae by ozone: impacts on cell integrity and chlorination by-product formation [J]. Water Research, 2013,47(9):2983-2994.
[9] Jung Y, Yoon Y, Hong E, et al. Inactivation characteristics of ozone and electrolysis process for ballast water treatment using B. subtilis spores as a probe [J]. Mar Pollut Bull, 2013,72(1):71-79.
[10] Li P, Song Y, Yu S L. Removal of Microcystis aeruginosa using using hydrodynamic cavitation: Performance and mechanisms [J]. Water Research, 2014, 62: 241–248.
[11] 顧雨辰,張光生,郝小龍,等.高壓脈沖氣液混合放電等離子體對銅綠微囊藻的滅活研究 [J]. 上海環境科學, 2013,32(6):257-263.
[12] 洪偉辰,白敏冬,滿化林,等.氣浮-?OH強氧化組合工藝處理高藻水的研究 [J]. 中國環境科學, 2015,35(12):3634-3639.
[13] Bai M D, Zhang, Z T, Bai M D, et al. Synthesis of ammonia using CH4/N2plasmas based on micro-gap discharge under environmentally friendly condition [J]. Plasma Chem Plasma P, 2008,28(4):405-414.
[14] Bai M D, Zhang Z T, Zhang N H, et al. Treatment of 250 t/h Ballast Water in Oceanic Ships Using ·OH Radicals Based on Strong Electric-Field Discharge [J]. Plasma Chem Plasma P, 2012, 32(4):693-702.
[15] US EPA Method 330.5. Chlorine, Total Residual (Spectrophotometric, DPD) [S].
[16] Machado M D, Soares E V. Development of a short-term assay based on the evaluation of the plasma membrane integrity of the alga Pseudokirchneriella subcapitata [J]. Appl Microbiol Biotechnol, 2012,95(4):1035-1042.
[17] Zhou S Q, Shao Y S, Gao N Y, et al. Effects of different algaecides on the photosynthetic capacity, cell integrity an microcystin-LR release of Microcystis aeruginosa [J]. J Hazard Mater, 2013,219-220:267-275.
[18] 李 芳,白敏冬,洪偉辰,等.羥基自由基快速致死水華針桿藻的研究 [J]. 環境科學學報, 2016,32(2):550-556.
[19] Bai M D, Zheng Q L, Tian Y P, et al. Inactivation of invasive marine species in the process of conveying ballast water using?OH based on a strong ionization discharge [J]. Water Research, 2016,96:217-224.
[20] Renger G, Volker M, Eckert H, et al. On the mechanism of photosystem II deterioration by UV-B irradiation [J]. Photochem Photobiol, 1989,49(1):97-105.
[21] Matsubara S, Chow W S. Populations of photo inactivated photosystem II reaction centers characterized by chlorophylla fluorescence [J]. Plant Biology, 2004,101:18234-18239.
[22] Huase Ou, Gao N Y, Wei C W, et al. Immediate and long-term impacts of potassium permangante on photosynthetic capacity, survival and microcystin-LR release risk of Microcystis aeruginosa [J]. J Hazard Mater, 2012,219-220:267-275.
[23] Zhou S Q, Shao Y S, Gao N Y, et al. Effects of different algaecides on the photosynthetic capacity, cell integrity and microcystin-LR release of Microcystis aeruginosa [J]. Science of the Total Environment, 2013,463–464:111-119.
Research on the rapid inactivation of typical algae blooms by hydroxyl radical.
DING Li-fei1, LI Hai-yan1, BAI min-dong1*, ZHENG Wu1, GUO Feng1, ZHANG Zhi-tao2*(1.College of Environment &Ecology, Xiamen University, Xiamen 361102, China;2.Environmental Engineering Institute, Dalian Maritime University, Dalian 116026, China). China Environmental Science, 2017,37(7):2633~2638
Algae blooming in water sources breaks out increasingly and seriously threatened the water supply safety. Bench scale tests were conducted to study the effects of ?OH generated from strong ionization discharge and high pressure water jet cavitation on cell density, cell integrity and photosynthetic capacity of 3kinds of typical freshwater algae. Algae species including Microcystis aeruginosa, Synedra sp., and Scenedesmus quadricuauda were respectively prepared at concentrations of 19.5×104, 21.8×104and 4.90×104cells/mL, and the cell integrity was assessed by flow cytometry. Results suggested that the?OH lethal threshold of the algae was 1.07mg/L within the exposure time of 4.5s. The cell morphological observation results showed that all the cells were integral and no cytoplasm composition spilled. Hence, large-scale production of ?OH is a novel method to inactive typical algae species efficiently and to protect drinking water safety simultaneously.
hydroxyl radical;algae blooms;lethal threshold;exposure time
X52
A
1000-6923(2017)07-2633-06
丁麗飛(1990-),女,福建寧德人,碩士研究生,主要從事水污染防控研究.
2016-11-01
國家科技支撐計劃資助項目(2013BAC06B01, 2013BAC06B02);國家重大科研儀器研制項目(61427804)
* 責任作者, 白敏冬, 教授, mindong-bai@163.com; 張芝濤, 教授, newzhangzhitao@163.com

