不同干燥條件連翹葉茶有效成分含量比較
麻景梅,王迎春,李琛,王夢,鄭倩,牛麗穎
1.河北中醫(yī)學院,河北 石家莊 050091;2.河北省中藥配方顆粒工程技術研究中心,河北 石家莊 050091;3.石家莊市中醫(yī)院,河北 石家莊 050001
不同干燥條件連翹葉茶有效成分含量比較
麻景梅1,2,王迎春1,2,李琛1,2,王夢1,2,鄭倩3,牛麗穎1,2
1.河北中醫(yī)學院,河北 石家莊 050091;2.河北省中藥配方顆粒工程技術研究中心,河北 石家莊 050091;3.石家莊市中醫(yī)院,河北 石家莊 050001
目的 比較不同干燥條件下連翹葉茶中總黃酮、連翹酯苷 A 和連翹苷含量,確定連翹葉茶最佳干燥方式。方法 采用紫外分光光度法,以亞硝酸鈉-三氯化鋁-氫氧化鈉溶液體系為顯色劑,在波長 500 nm 處測定總黃酮含量;采用 HPLC 同時測定連翹酯苷 A 和連翹苷含量,色譜柱為 Diamosil C18(2)柱(4.6 mm× 250 mm,5 μm),流動相為乙腈-0.4%乙酸水溶液,梯度洗脫,檢測波長 277 nm,柱溫 30 ℃,流速 1.0 m L/m in。結果 不同干燥條件連翹葉茶中總黃酮含量基本相同;不同干燥條件連翹葉茶中連翹酯苷 A 和連翹苷含量順序為:通風陰干干燥>真空干燥>鼓風干燥。結論 不同干燥條件對連翹葉茶中總黃酮含量無明顯影響,對連翹酯苷 A 和連翹苷的含量影響較大,通風陰干比鼓風干燥和真空干燥更有利于連翹酯苷 A 和連翹苷成分的保存。
連翹葉茶;總黃酮;連翹酯苷A;連翹苷;紫外分光光度法;高效液相色譜法
連 翹 葉為 木犀 科植 物連 翹 Forsythia suspensa(Thunb.)Vahl的干燥葉,連翹的入藥部位為其果實,其葉不作為藥用。近年來研究發(fā)現,連翹葉化學成分組成與其果實有極大相似性,且有效成分連翹酯苷A和連翹苷的含量高于連翹果實[1-2]。現代藥理研究表明,連翹葉具有抗炎、抗菌、抗衰老、保護肝臟、調節(jié)免疫功能等作用[3]。民間有將連翹葉制成茶飲用的習慣,將連翹葉開發(fā)成茶品,對連翹資源的綜合利用有重要意義。茶葉制作工藝中尤為重要的環(huán)節(jié)是干燥,常見的干燥方式主要有烘干、陰干等。為研究不同干燥方式對連翹葉中有效成分的影響,本試驗采用紫外分光光度法測定不同干燥條件連翹葉茶中總黃酮的含量,并采用 HPLC 同時測定連翹酯苷 A 和連翹苷的含量,為連翹葉茶的制作工藝提供依據。
1 儀器與試藥
TU-1901 雙光束紫外可見分光光度計(北京普析);LC-15C 高效液相色譜儀(日本島津),SPD-15C型紫外檢測器,SIL-10AF 自動進樣器,CTO-15C 柱溫箱,LC solution 色譜工作站;TB-215D、BSA224SCW 電子天平(賽多利斯)。
蘆丁對照品(批號 100080-201408)、連翹酯苷 A對照品(批號 111810-201405)、連翹苷對照品(批號110821-201213),中國食品藥品檢定研究院;乙腈為色譜純,水為超純水,其余試劑均為分析純。連翹葉茶樣品(自制),常溫通風陰干、鼓風干燥、真空干燥樣品均為同一批連翹葉原料加工,連翹葉均來源于河北中醫(yī)學院藥用植物園,經河北中醫(yī)學院中藥鑒定教研室侯芳潔鑒定為木犀科連翹屬植物連翹的干燥葉。
2 方法與結果
2.1 總黃酮含量測定
2.1.1 對照品溶液的制備 精密稱取蘆丁對照品適量,置 50 m L 量瓶中,加甲醇適量,振搖溶解,放冷,稀釋至刻度,搖勻,即得每 1 m L 含蘆丁 0.201 2 mg的對照品溶液。
2.1.2 供試品溶液的制備及顯色方法 取連翹葉茶粉末(過 80 目篩)約 0.5 g,精密稱定,置于錐形瓶中,精密加 70%乙醇 20 m L,密塞,稱定質量,超聲提取 30 min,放冷,再稱定質量,用 70%乙醇補足減失的質量,搖勻,濾過,即得供試品溶液。精確吸取1.0 m L 供試品溶液,置 25 m L 量瓶中,加水至 8 m L,加 5%亞硝酸鈉溶液 1 m L,混勻,放置 6 m in,加 10%三氯化鋁溶液 1 m L,搖勻,放置 6 m in,加氫氧化鈉試液 10 m L、再加水稀釋至刻度,搖勻,放置 15 min,在 500 nm 波長處測定吸收度[4-6]。
2.1.3 蘆丁標準曲線的繪制 精密吸取對照品溶液2、3、4、6、8 m L,分別置 25 m L 量瓶中,各加水至8 m L,加 5%亞硝酸鈉溶液 1 m L,混勻,放置 6 m in,加 10%三氯化鋁溶液 1 m L,搖勻,放置 6 m in,加氫氧化鈉試液 10 m L,再加水稀釋至刻度,搖勻,放置15 min,在 500 nm 波長處測定吸收度,以吸收度為縱坐標,蘆丁濃度為橫坐標,繪制標準曲線,得回歸方程 Y=10.055 9X+0.064 1(r=0.999 6),線性范圍為 0.016 0~0.064 4 mg/m L。
2.1.4 精密度試驗 取“2.1.1”項下對照品溶液 5 m L,連續(xù)進樣測定6次,記錄吸光度。結果蘆丁吸光度的RSD=1.21%,表明儀器精密度良好。
2.1.5 穩(wěn)定性試驗 精密稱取同一連翹葉茶樣品(常溫陰干 24 h),按“2.1.2”項下制備方法供試品溶液,顯色后分別于放置 0、10、20、30、45、60 min進樣測定,記錄吸光度。結果吸光度 RSD=2.64%,表明供試品溶液在 60 m in 內基本穩(wěn)定。
2.1.6 重復性試驗 取同一連翹葉茶樣品(常溫陰干 24 h)6 份,精密稱定。按“2.1.2”項下方法制備供試品溶液,顯色后測定,記錄吸光度。結果吸光度RSD=1.77%,表明本方法重復性良好。
2.1.7 加樣回收率試驗 取已知含量的連翹葉茶樣品(常溫陰干 24 h)適量,共 6 份,分別加入一定量的蘆丁對照品,按“2.1.2”項下方法制備供試品溶液,顯色后進樣測定,記錄吸光度,計算樣品含量和加樣回收率。結果平均加樣回收率為 100.02%,RSD=2.49%,表明本方法準確度良好,見表 1。
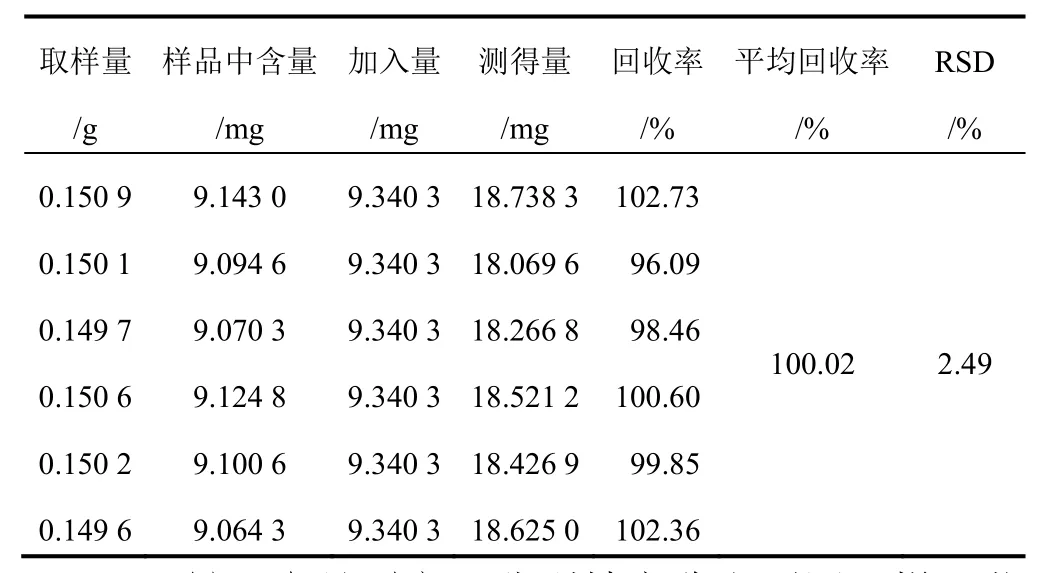
表 1 蘆丁加樣回收率試驗
2.1.8 樣品含量測定 分別精密稱取不同干燥工藝下連翹葉茶 0.5 g,按“2.1.2”項下方法制備供試品溶液,并進行顯色,測定吸光度,由標準曲線回歸方程可得總黃酮的質量濃度并計算含量,結果見表2。
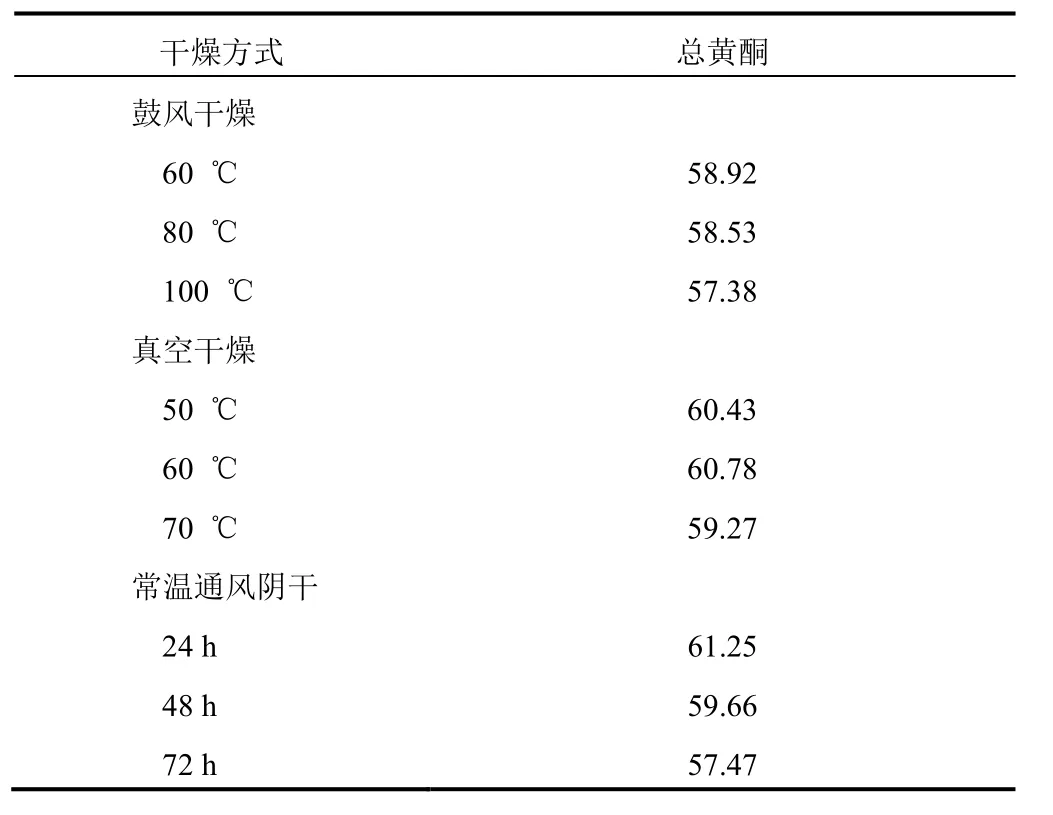
表 2 不同干燥條件下連翹葉茶中總黃酮含量測定結果(n=3,mg/g)
2.2 連翹酯苷 A 和連翹苷含量測定
2.2.1 色譜條件 色譜柱:Diamosil C18(2)柱(4.6 mm×250 mm,5 μm);以乙腈為流動相 A,0.4%乙酸水溶液為流動相B,按表3進行梯度洗脫;流速1.0 m L/m in;檢測波長:277 nm;進樣量:10 μL;柱溫:30 ℃。理論塔板數按連翹酯苷 A 峰計算應不低于 5000,按連翹苷峰計算不低于 3000[7-9]。

表 3 流動相梯度洗脫程序(%)
2.2.2 對照品溶液的制備 精密稱取連翹酯苷 A、連翹苷對照品適量,置量瓶中,加 70%甲醇,制得0.536 1 mg/m L 連翹酯苷 A 和 0.104 8 mg/m L 連翹苷混合對照品溶液。
2.2.3 供試品溶液的制備 取本品適量,研細,稱取約 0.20 g,精密稱定,置具塞錐形瓶中,精密加入70%甲醇 25 m L,密塞,稱定質量,超聲處理(功率250 W,頻率 50 kHz)30 m in,放冷,再稱定質量,用甲醇補足減失的質量,搖勻,過濾,取續(xù)濾液,即得。
2.2.4 專屬性試驗 分別精密吸取對照品溶液和供試品溶液各 10 μL,注入液相色譜儀,按“2.2.1”項下色譜條件進行測定,記錄色譜圖,結果見圖1。
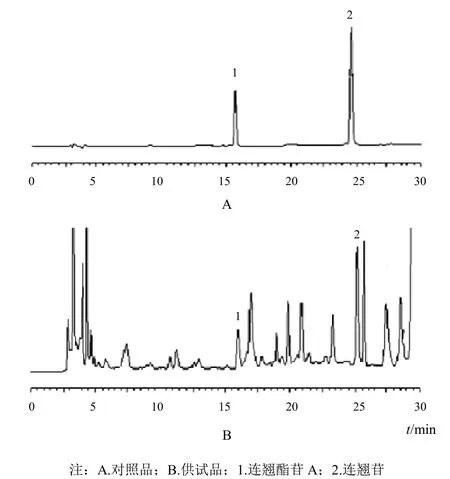
圖 1 連翹葉茶中連翹酯苷 A 和連翹苷 HPLC 圖
2.2.5 線性關系考察 精密吸取混合對照品溶液 2、4、6、10、20 μL,按“2.2.1”項下色譜條件測定。以峰面積為縱坐標,連翹酯苷A和連翹苷進樣量為橫坐標,繪制標準曲線。結果回歸方程分別為:連翹酯苷 A Y=1.546 1×105X+2.604 1×104,r=0.999 8;連翹苷 Y=7.359 6×105X+3.019 0×104,r=0.999 7。連翹酯苷 A 和連翹苷進樣量分別在 1.072 2~10.722 0 μg和 0.209 6~2.096 0 μg 范圍內線性關系良好。
2.2.6 精密度試驗 精密吸取“2.2.2”項下混合對照品溶液 10 μL,連續(xù)進樣 6 次,測定連翹酯苷 A 和連翹苷峰面積,其 RSD 分別為 1.68%和 1.01%,表明儀器的精密度良好。
2.2.7 穩(wěn)定性試驗 取同一供試品溶液,分別于制備后 0、2、4、6、8、12 h 進樣,測定連翹酯苷 A 和連翹苷的峰面積,結果 RSD 分別為 1.58%和 1.32%,表明供試品溶液在 12 h 內穩(wěn)定性良好。
2.2.8 重復性試驗 取同一連翹葉茶樣品(常溫陰干 24 h),精密稱定,平行 6 份,按“2.2.3”項下方法制備供試品溶液,進樣測定,結果連翹葉茶中連翹酯苷 A 和連翹苷的平均含量分別為 27.30 mg/g 和7.28 mg/g,RSD 分別為 1.30%和 1.51%,表明該方法的重復性良好。
2.2.9 加樣回收率試驗 取已知含量的連翹葉茶(常溫陰干 24 h),精密稱定,平行 6 份,分別按樣品中含量∶對照品加入量大致 1∶1比例加入一定量的對照品溶液,按“2.2.3”項下方法制備供試品溶液,測定并計算各成分的加樣回收率及 RSD。結果供試品溶液中連翹酯苷 A及連翹苷的平均加樣回收率分別為 101.82%和 101.97%,RSD 分別為 1.32%和 1.95%,表明該方法的準確度良好,見表 4、表 5。
2.2.10 連翹葉茶樣品含量測定 分別精密稱取不同干燥條件下連翹葉茶(過 80 目篩)0.2 g,按“2.2.3”項下方法制備供試品溶液,按“2.2.1”項下色譜條件測定,結果見表6。
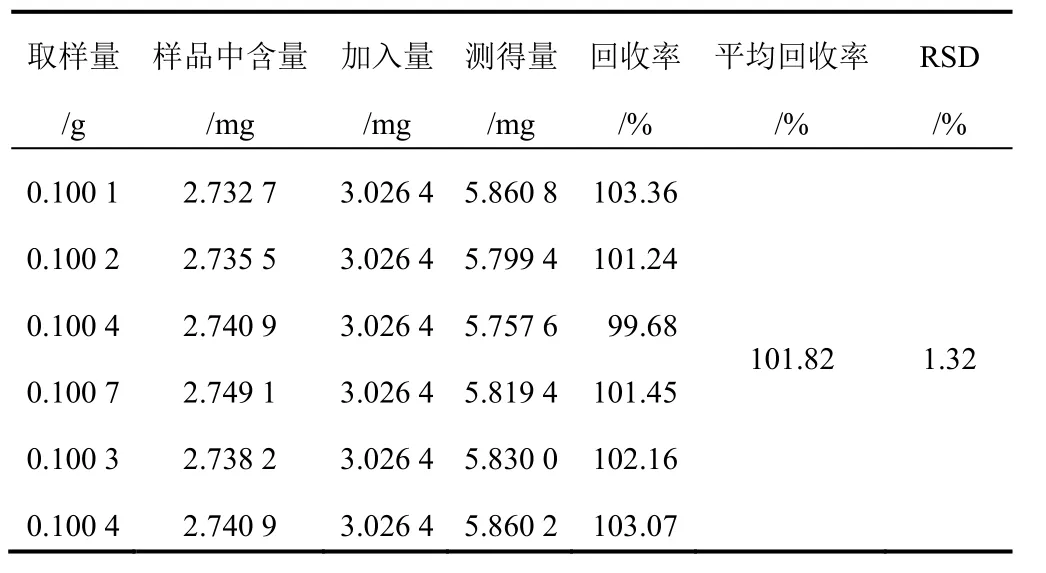
表 4 連翹酯苷 A 加樣回收率試驗
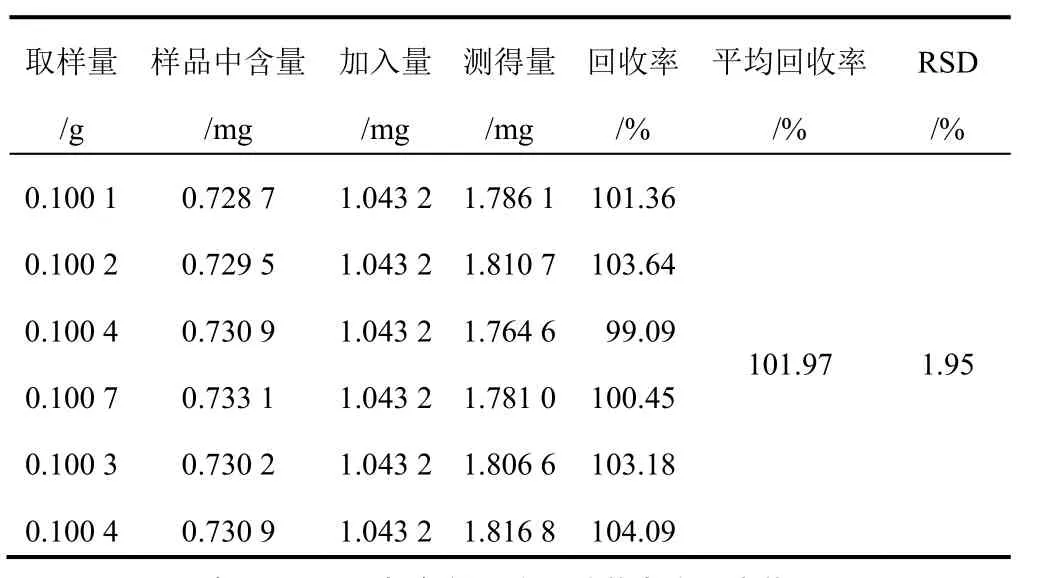
表 5 連翹苷加樣回收率試驗
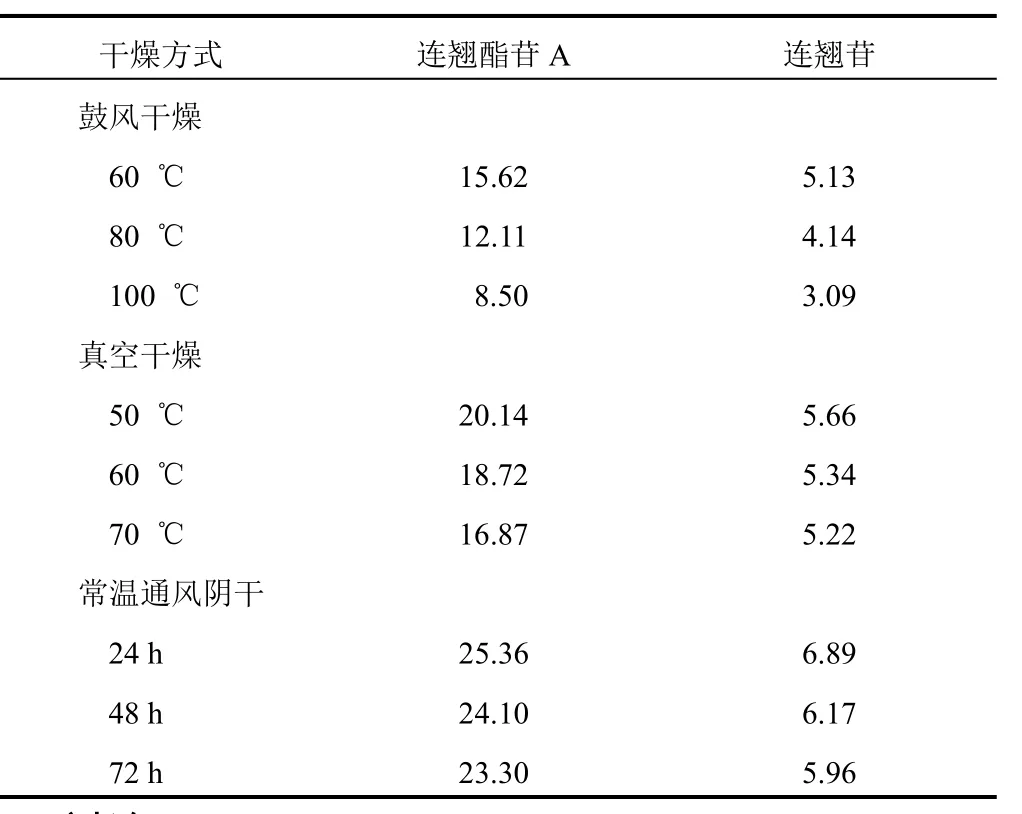
表 6 不同干燥條件下連翹葉茶中連翹酯苷 A及連翹苷含量測定結果(mg/g,n=3)
3 討論
3.1 供試品溶液制備方法選擇
總黃酮供試品溶液的制備方法中,對提取方法(水浴回流法、超聲提取法)、提取溶媒(60%乙醇、70%乙醇、80%乙醇)進行單因素考察,最終確定以70%乙醇 20 m L 超聲 30 m in 提取連翹葉茶中總黃酮。
HPLC 供試品溶液制備方法試驗過程中,分別對連翹酯苷A和連翹苷的提取方法(水浴回流法、超聲提取法)、提取溶媒(50%甲醇、70%甲醇、100%甲醇)、溶媒用量(25、50 m L)、提取時間(20、30 m in、60 min)進行了單因素考察,經過比較,最終選擇提取方法為 70%甲醇 25 m L,超聲 30 min。
3.2 色譜條件的選擇
采用二極管陣列檢測器,在波長 190~390 nm 對連翹酯苷 A和連翹苷混合對照品溶液進行全波長掃描,二者在 277 nm 波長附近均有明顯吸收;同時考察了流動相類型與梯度比例,確定以乙腈-0.4%乙酸為流動相梯度洗脫,結果各成分完全分離且峰形較好。
3.3 干燥方式的選擇
干燥工藝所用連翹葉樣品都經過炒青的方式殺青,蒸發(fā)了鮮葉部分水分,并起到殺酶保苷的作用。
黃酮類化合物是一類廣泛存在于自然界、具有多種藥理活性的天然多酚類化合物。通過對不同干燥方式連翹葉茶總黃酮含量測定的比較,發(fā)現常溫通風陰干、真空干燥、鼓風干燥3種不同干燥方式對連翹葉茶中總黃酮含量無明顯影響。
連翹酯苷A和連翹苷是連翹的主要有效成分,對不同干燥條件下連翹葉茶中2種成分的含量進行測定及對比研究發(fā)現,不同干燥條件對連翹葉茶中連翹酯苷A和連翹苷的含量有較大影響,其含量順序為常溫通風陰干>真空干燥>鼓風干燥。常溫通風陰干時間長短對連翹酯苷A和連翹苷的含量無影響;真空干燥溫度總體較低隨著溫度升高,二者含量無明顯變化,鼓風干燥隨著溫度升高,二者含量都有所下降,尤其對連翹酯苷A含量影響較大。
本試驗除了對有效成分含量進行對比,還發(fā)現常溫通風陰干的連翹葉茶為青綠色,而真空干燥和鼓風干燥的連翹葉茶略顯黑色,陰干的連翹葉茶外觀色澤較真空干燥和鼓風干燥為好,并且陰干的連翹葉茶更加清香。結合連翹葉茶實際制作過程樣品量較大的情況,為達到樣品充分干燥的目的,考慮選擇連翹葉茶經炒青后的干燥方式為常溫通風陰干 48 h。
[1] 葉華,吳臻,李發(fā)榮.連翹葉入藥的問題及思考[J].臨床合理用藥雜志, 2011,4(9):74-75.
[2] 王曉燕,常斷玲.連翹葉和連翹果提取物指紋圖譜比較研究[J].齊魯藥事,2011,30(10):574-575.
[3] 梅雪,周安琴,李靜,等.連翹葉的化學成分、藥理學與毒理學研究概況[J].中國藥房,2015,26(22):3143-3146.
[4] 柴建新,萬茵,付桂明,等.杜仲葉總黃酮含量測定方法優(yōu)化[J].中國食品學報,2013,13(4):225-230.
[5] 田建平,李娟玲,胡遠艷,等.冬青屬苦丁茶葉總黃酮含量測定與資源評價[J].食品科技,2014,39(1):278-281.
[6] 張文莉,高敏,石森林.分光光度法測定山楂葉提取物中總黃酮的含量[J].中華中醫(yī)藥學刊,2011,28(5):1148-1151.
[7] 原江鋒,邱智軍,劉建利,等.連翹葉綠茶制備及活性成分分析[J].河南科技大學學報:自然科學版,2015,36(2):78-82.
[8] 靳茂禮,趙韶華,王玉峰,等.連翹葉 UPLC 指紋圖譜及主要活性成分含量測定[J].中國中醫(yī)藥信息雜志,2013,20(5):52-55.
[9] 姬雪禮,李文烈,鄭曉杰,等.高效液相色譜法同時測定連翹葉中連翹酯苷 A 和連翹苷含量[J].中國藥業(yè),2014,23(7):33-34.
Com parison of Effects of Different Drying Methods on Contents of Effective Components of Forsythiae Fructus Leaves Tea
MA Jing-mei1,2, WANG Ying-chun1,2, LI Chen1,2, WANG Meng1,2, ZHENG Qian3, NIU Li-ying1,2(1. Hebei University of Chinese Medicine, Shijiazhuang 050091, China; 2. Hebei TCM Formula Granule Engineering&Technology Research Center, Shijiazhuang 050091, China; 3. Shijiazhuang Traditional Chinese Medicine Hospital, Shijiazhuang 050001, China)
Objective To compare the contents of total flavonoids, forsythoside A and phillyrin in Forsythiae Fructus leaves tea under different drying conditions; To determine the best drying method for Forsythiae Fructus leaves tea. Methods With the sodium nitrite-aluminum trichloride-sodium hydroxide solution as color reagent, total flavonoids in forsythiae Fructus leaves tea were determined by UV spectrophotometry at the wavelength of 500 nm. HPLC was used to determ ine the contents of forsythiaside A and phillyrin. The analysis was performed on a Diamosil C18 (2) column (4.6 mm × 250 mm, 5 μm); the mobile phase was composed of acetonitrile and 0.4% acetic acid With gradient elution; the detection wavelength was set at 277 nm; the flow rate was 1.0 m L/m in at column temperature of 30 ℃. Results The content of total flavonoids of Forsythiae Fructus leaves tea under different drying conditions was basically the same; the sequence of the contents of forsythoside A and Forsythin of Forsythiae Fructus leaves tea under different drying conditions was∶ ventilated drying > vacuum drying > blast drying. Conclusion Different drying conditions have no effect on the contents of total flavonoids in Forsythiae Fructus leaves tea, but have obvious effects on the contents of forsythiaside A and phillyrin. Ventilation shade is better than blast drying and vacuum drying for preverence of forsythiaside A and forsythin.
Forsythiae Fructus leaves tea; total flavonoids; forsythoside A; phillyrin; UVspectrophotometry; HPLC
R284.1
A
1005-5304(2017)08-0076-04
2016-11-14)
(
2016-12-08;編輯:陳靜)
河北省食品藥品監(jiān)督管理局普通項目(PT2014056);河北省高等學校科學技術研究重點項目(ZD2015001)
牛麗穎,E-mail:niul iyingyy@163.com
10.3969/j.issn.1005-5304.2017.08.017

