溶液環境下微生物誘導碳酸鈣沉積影響因素研究
孔繁浩,趙志峰
(南京林業大學土木學院,南京210037)
溶液環境下微生物誘導碳酸鈣沉積影響因素研究
孔繁浩,趙志峰*
(南京林業大學土木學院,南京210037)
現有的微生物誘導碳酸鈣沉積(MICP)技術的研究對象大多是簡單離子化學環境下的松散砂土,而實際工程中往往需要面對各種不同環境下形成的土體。以江蘇東部沿海地區海相吹填粉土的化學環境為依托,選用巴氏芽孢桿菌進行溶液環境下微生物誘導碳酸鈣沉積試驗。通過定量分析研究了環境溫度、環境pH、氯化鹽、土體中膠結陽離子含量等環境因素對微生物誘導碳酸鈣生成量的影響規律。結果表明,在14~36℃時碳酸鈣的生成量隨著溫度的升高而增加,總體呈上升趨勢;當溶液pH為9時,碳酸鈣生成量最多,并且堿性較強的溶液(pH為10~11)比弱堿性溶液(pH為7~8)誘導生成的碳酸鈣量更多;溶液里高濃度的氯化鹽能夠抑制碳酸鈣的生成,相比而言同濃度下氯化鈣比氯化鈉更易抑制碳酸鈣生成;原始土體中少量的兩種膠結離子之間沒有相互抑制的作用,當土體中膠結陽離子濃度總和一致時,碳酸鈣產量基本一致。研究結果可為實際注漿時采用MICP技術加固土體提供有效的依據。
微生物誘導碳酸鈣沉積;溶液環境;溫度;氯化鹽;陽離子
在2011—2020年期間,我國建設填海造地預期規模將占到新增建設用地面積的19.75%,而江蘇作為全國規劃填海的重要省份,至2020年圍墾面積將占全國的72.9%,因此,大規模處理海相吹填粉土成為江蘇建設中的關鍵任務。
現有的吹填土處理方法不僅工期長、施工成本高,而且有可能對周圍環境產生有害影響,所以迫切需要尋求更好的替代方法。自2004年Whiffin[1]研究微生物CaCO3沉積產生微生物水泥開始,一種新型的注漿加固土體技術便引起了學術界的重視,即微生物誘導碳酸鈣沉積(MICP)——指利用微生物新陳代謝過程中發生的礦化作用誘導生成碳酸鈣,具有優異的黏結性和固結性能[2-3]。該方法中的巴氏芽孢桿菌不僅使得方解石成核,而且其脲酶活性及其與尿素良好的親和力能促使方解石的進一步生成[4-6]。微生物固化土體因其能耗少、環境友好以及良好的生物相容性等優勢[7],已成為固化海相吹填粉土的一種新選擇。
近年來MICP技術已經受到眾多學者的關注,在細菌的培養環境、脲酶活性及碳酸鈣的生成規律等方面的研究取得了一定進展。Al Qabany等[8]和Okwadha等[9]發現不同的細菌濃度、膠結液濃度、環境pH和溫度都會對脲酶活性產生一定的影響,進而影響到沉積碳酸鈣的質量。Cheng等[10]對比了酸堿度對膠結物含量與強度的影響,結果表明,在堿性條件下,微生物誘導生成的碳酸鈣質量最多,中性條件下次之,酸性條件下最少。沈吉云[11]和趙茜[12]通過試驗研究發現細菌脲酶活性、尿素濃度、鈣離子濃度和pH等因素對MICP過程有明顯影響。
海相沉積土具有典型的堿性多鹽特點,而海水含有豐富的離子成分,但目前對海相環境下MICP的研究較少。因此,筆者主要研究微生物在溶液環境中的工作性能,分析微生物生長及脲酶活性變化規律,并對微生物不同工作環境因素等進行定量研究,以期為實際注漿時MICP技術加固土體提供有效依據。
1 材料與方法
1.1 試驗材料
1.1.1 試驗用菌
試驗所用的菌種為巴氏芽孢桿菌(Sporosarcinapasteurii),購買于德國菌種保藏中心(DSMZ)。培養液采用DSMZ推薦的培養液,其成分:15 g/L酪蛋白胨、5 g/L大豆蛋白、5 g/L NaCl(分析純)以及20 g/L的尿素,用1 mol/L的NaOH將其pH調至7.5,并用高溫蒸汽進行滅菌。將活化后巴氏芽孢桿菌接種至培養液中,在30℃條件下放入轉速為130 r/min的培養箱中培養24~48 h。采用電導率儀測量細菌脲酶的活性,紫外可見光光度儀在600 nm波長時的吸光度來測定細菌數量。
1.1.2 試驗土體中的化合物濃度
試驗以江蘇東部沿海最大的填海工程“東臺條子泥吹填工程”的海相吹填粉土為研究對象,測量出試驗土體的各化合物濃度如表1所示,土體的pH為9.06。
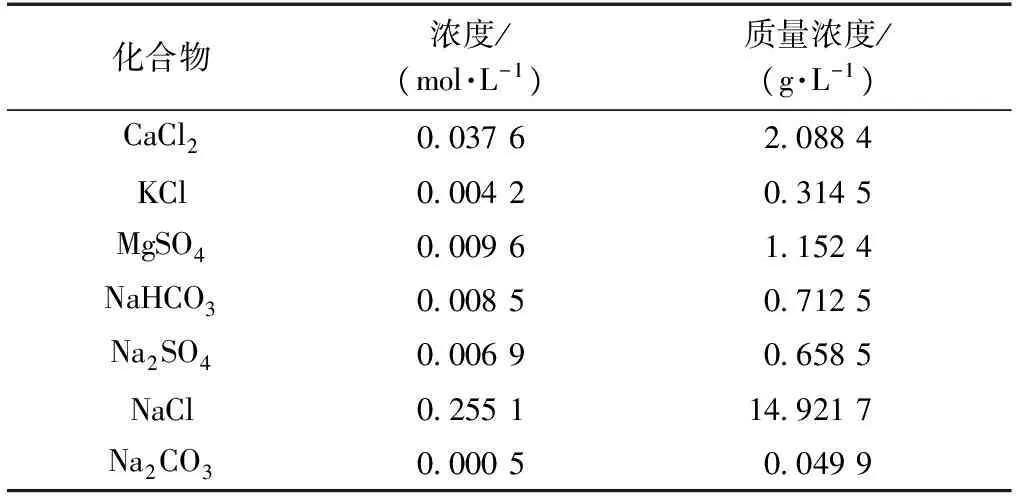
表1 土體孔隙水各化合物濃度
1.1.3 膠結液配置
試驗膠結液由兩部分組成,即土壤孔隙液和CaCl2、尿素(1∶1)混合溶液。先按試驗土體中含有的離子成分配置1 L的土壤孔隙液,將pH調制9.06;再用土壤孔隙液配置0.25和0.50 mol/L CaCl2與尿素(1∶1)混合溶液,其中CaCl2為微生物誘導生成碳酸鈣提供鈣源,尿素為微生物生長提供氮源。
1.2 試驗方法
本試驗研究溶液環境下,在環境溫度、環境pH、氯化鹽和土體中膠結陽離子濃度等不同工作環境對微生物誘導碳酸鈣沉積的影響。首先試驗選取活性及濃度較好的菌液,其次由于高濃度的氯化鈣本身對菌液脲酶活性有一定的抑制作用[13-14],選取濃度為0.25和0.50 mol/L的膠結液,由于注漿時膠結液不進行滅菌處理,所以混合前未經滅菌處理。菌液與膠結液按照一定比例在不同工作環境下靜置反應約100 min,使其充分反應,同時為了避免誤差,需將反應100 min后的溶液進行紫外線滅菌處理,最后對溶液進行過濾并烘干,稱取碳酸鈣的質量。
實際環境中土體的環境溫度主要受兩個因素影響,即土體深度和地表溫度,且受地表溫度影響較大,2月土溫最低,8月土溫最高,地表溫度大約在0~40℃。徐明星[15]測量江蘇沿海灘涂地區土壤pH均值為8.87,總體樣本的pH為7.64~9.51。盧霞[16]測量濱海鹽土鹽分含量,在21個土樣鹽分含量中顯示,土體的鹽分含量為0.205~17.289 g/kg,平均值3.527 g/kg。因此,根據實際環境中各影響因素水平范圍,試驗各個影響因素如表2所示。

表2 試驗因素
注:改變土中膠結離子時,以土中原始Ca2+濃度為基底,分別擴大0,1,2,3倍,在此基礎上又結合原始Mg2+濃度(Mg2+濃度變化與Ca2+類似)。
1.2.1 生成碳酸鈣的測量
將反應后溶液中的上清液及沉淀倒入離心管中,放入離心機中以4 200 r/min的轉速離心20 min,用液槍吸去上清液加入純水攪拌后以相同的條件離心3次。將離心管底部的碳酸鈣用純水沖洗至燒杯中,放入烘箱中烘干(105.5℃,24 h)后燒杯質量記m2,初始燒杯質量記m1,即溶液反應下碳酸鈣的生成量m=m1-m2。由于菌液含量相對較少,基本完全反應,所以離心時不會有細菌脫離上清液和碳酸鈣一起沉淀。
1.2.2 微生物生長及脲酶活性控制
Whiffin[1]通過試驗證明了尿素水解量與溶液電導率變化量成正比,可以測出每分鐘電導率變化量來衡量脲酶活性。其關系可用公式[14]表示:尿素水解量(mmol/L)=電導率變化量(mS/cm)×11.11。
將菌種以V菌種∶V營養液=1∶400接種到營養液中,將其放入溫度為30℃、振蕩頻率為130 r/min的搖床中,連續培養48 h,每隔4 h取三角瓶中的中部菌液;取10 mL菌液與90 mL的1.1 mol/L尿素溶液中混合(菌液與尿素的比例為1∶9),保證混合后的溶液均勻,用電導率儀測試10 min內溶液電導率變化,將溶液電導率的變化量取平均值后,根據公式(1)算出脲酶活性。
2 結果與分析
2.1 微生物生長及脲酶活性變化分析
在0~8 h以內,巴氏芽孢桿菌的數量增長比較迅速,大部分細胞開始分裂,細胞生長比較快。當8~40 h之間時,細胞分裂趨于穩定,細菌數量幾乎呈直線型增長,此時細胞新陳代謝穩定。40~48 h之間,隨著營養液中營養物質的消化和不利于細菌生長的物質產生,細胞代謝能力下降,細菌數量不再有明顯的增長。菌液的脲酶活性曲線與生長曲線的變化趨勢大致一致,隨著時間的增長,脲酶活性不斷變大,使得催化尿素水解的能力也逐漸增強,并且在20~32 h時趨于相對穩定狀態。由于24~30 h時細菌的濃度及脲酶的活性相對較好,本試驗采用培養24~32 h的菌液,用純水將菌液OD600調整到1.19~1.21,酶活性為6.20~6.60 mS/(cm·min)(24℃),如圖1所示。
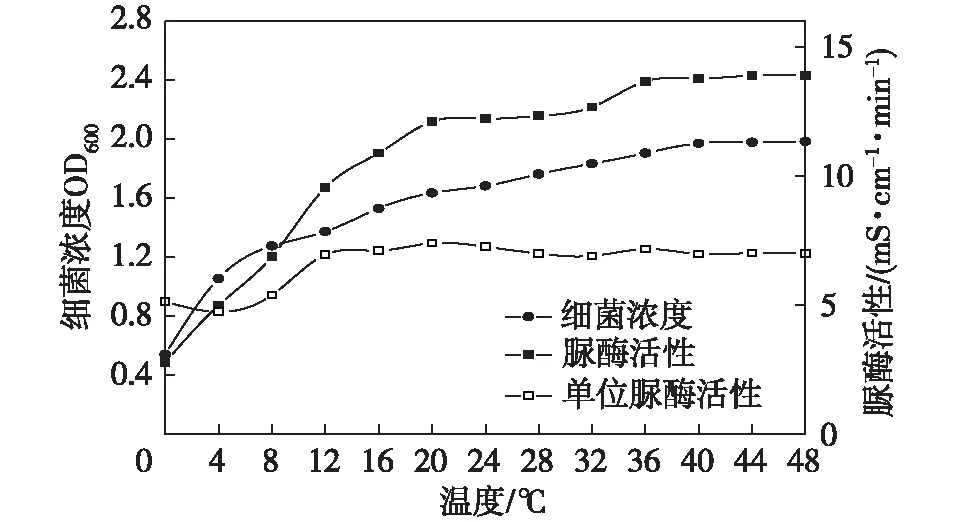
圖1 巴氏芽孢桿菌生長曲線和脲酶活性曲線Fig. 1 The growth curve of Sporosarcina pasteurii and curve of urease activity
2.2 環境溫度影響分析
由于碳酸鈣在20~60℃情況下溶解度比較小(0.145 0~0.177 3 g/L[1]),可以忽略不計。在溶液環境下,當14~36℃時,無論是0.25 mol/L(0.25 mol(1)和0.25 mol(2)為平行樣)還是0.50 mol/L的混合液,碳酸鈣的生成量都隨溫度的升高而增多,呈現出上升的趨勢;在30~36℃時,碳酸鈣的生成量增長緩慢,接近于平穩狀態(圖2)。
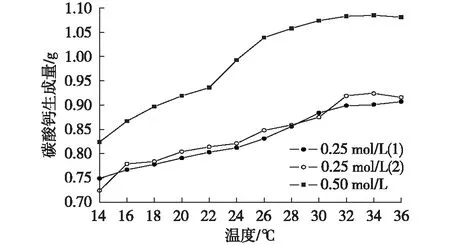
圖2 碳酸鈣生成量隨環境溫度的變化Fig. 2 The production of CaCO3with the change in environmental temperature
2.3 環境pH影響分析
pH是影響微生物生長繁殖的重要影響要素之一,當pH超出微生物承受范圍時,微生物生長則會受到影響,而適宜的環境pH有利于脲酶活性的升高及細菌數量的增長。本次試驗中,當混合液的濃度為0.25或0.50 mol/L、pH為9時碳酸鈣生成量最多;當pH為10或11時的碳酸鈣生成量高于pH為7或8時(圖3)。
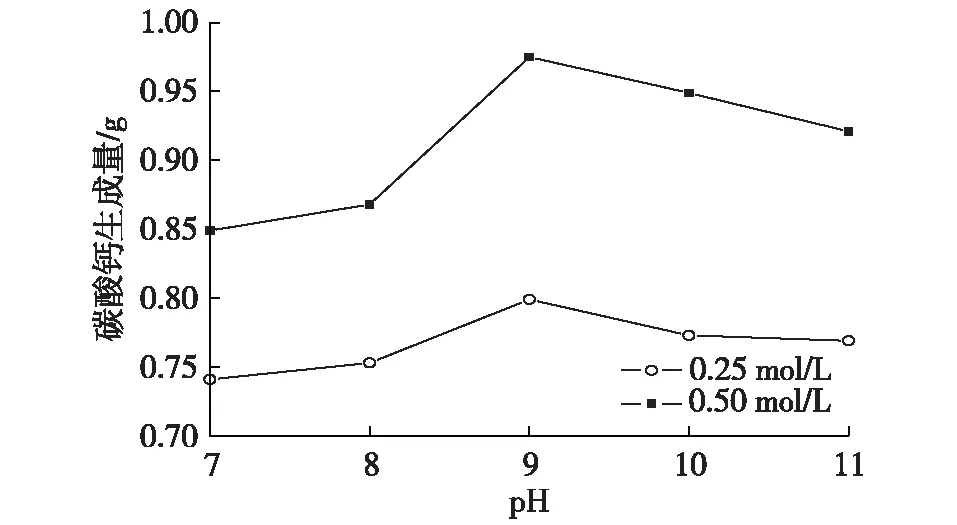
圖3 碳酸鈣生成量隨pH的變化Fig. 3 The production of CaCO3with the change in pH
本試驗中pH為9時碳酸鈣生成量最多,與pH為9時脲酶活性最高有關,這與張越[13]試驗中pH為8.8左右時酶的活性達到峰值的結果一致。同時,張越試驗中得到的脲酶活性隨pH變化規律和本研究中得到的溶液環境下碳酸鈣的生成量隨pH的變化規律較接近。細菌在弱堿性環境下分解尿素的效果更好。
2.4 氯化鹽影響分析
海相吹填粉土在海水的不斷沖刷和陽光照射下,土中的海水不斷蒸發,從而導致留在土體中的鹽分會不斷增多,呈現出堿性多鹽的特點。土體中氯化鹽含量在一定程度上影響MICP生成碳酸鈣。
當溶液中加入不同濃度的氯化鹽(NaCl和CaCl2)時,對碳酸鈣的生成量有不同的影響(圖4)。當加入0.5 mol/L NaCl(CaCl2)時碳酸鈣減少了20.37%(34.40%),當加入3.0 mol/L NaCl(CaCl2)時碳酸鈣減少量為74.47%(87.67%)。由曲線的整體趨勢可以看出,在0~3 mol/L濃度下,隨著氯化鹽濃度的提升,碳酸鈣的生成量不斷減少。
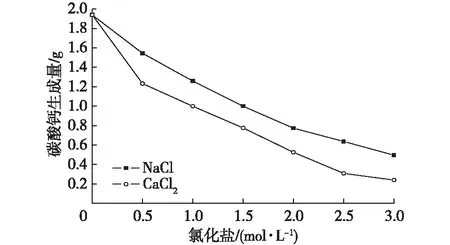
圖4 碳酸鈣生成量隨氯化鹽濃度的變化Fig. 4 The production of CaCO3with the change in chlorate concentrations
造成這一現象的原因是:細菌的細胞壁和細胞膜類似于滲透膜,高濃度的氯化鹽溶液與細菌的細胞質的濃度會形成濃度差,這樣就形成了發生滲透作用的條件,從而使細菌細胞質內的水分向外滲出,導致細胞脫水及變小,甚至死亡,使得細菌不易生長。同時,Whiffin[1]還研究發現,不同離子不同價位和大小對脲酶活性都有一定的影響。因此,高濃度的氯化鹽對細菌脲酶活性有一定的抑制作用,使得碳酸鈣的生成量減少。
當溶液中的金屬離子濃度相同時,即加入同濃度的CaCl2時碳酸鈣生成量比NaCl要少,說明在相同濃度下,CaCl2比NaCl更易抑制細菌脲酶活性。同時當加入的氯化鹽在0.5~2.0 mol/L之間時,NaCl和CaCl2在各濃度區間對碳酸鈣生成質量的影響基本無變化(表3),說明Na+和Ca2+對碳酸鈣的生成影響近似。
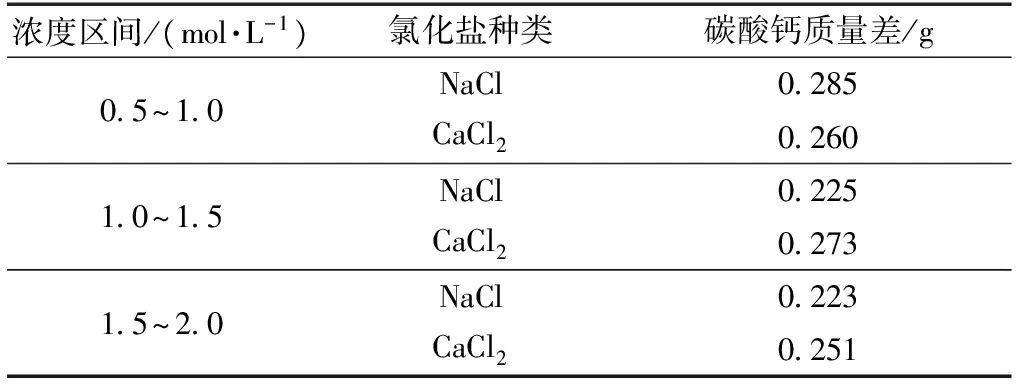
表3 氯化鹽各濃度間碳酸鈣差值
由圖4可知,CaCl2曲線一直位于NaCl曲線的下方,這是由于相同濃度的CaCl2比NaCl多了一倍的Cl-,說明Cl-對碳酸鈣的生成量也有著一定的抑制作用。由于圖4中兩條曲線在0.5~3.0 mol/L時斜率接近,表明碳酸鈣生成量受氯離子濃度變化率影響較小。
為了對實際注漿過程有所參考,本次試驗還模擬了菌液和膠結液的用量相同時(即用50 mL菌液和50 mL膠結液等比例反應),膠結液濃度對碳酸鈣生成量的影響,試驗結果如圖5和圖6所示。碳酸鈣生成量隨膠結液濃度的升高而增加,整體呈上升趨勢,但曲線的斜率逐漸降低。與碳酸鈣理論生成量相比,隨著膠結液濃度的升高,實際生成的碳酸鈣與理論值相差越來越大。因此,當菌液和膠結液等比例反應時,雖然碳酸鈣生成量隨膠結液濃度呈上升趨勢,但利用率不斷降低,說明較高濃度的氯化鈣會抑制脲酶活性,使得碳酸鈣相對生成量減少。
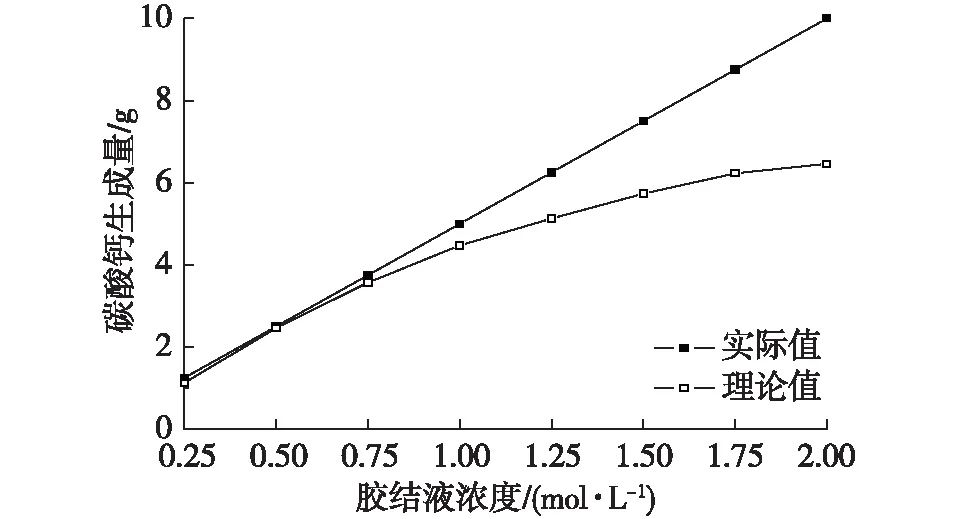
圖5 等比例反應下碳酸鈣生成量隨膠結液濃度的變化Fig. 5 The production of CaCO3under the equal proportion reaction with the change in the cementing fluid concentrations
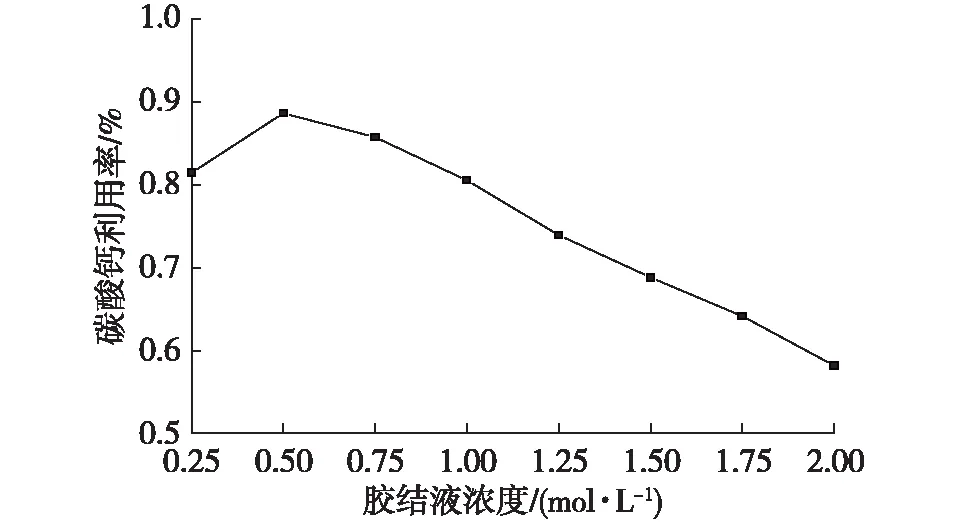
圖6 等比例反應下碳酸鈣的利用率Fig. 6 Utilization rate of CaCO3under the equal proportion reaction
2.5 膠結陽離子(Ca2+和Mg2+)影響分析
由于參加反應的菌液過量,所以溶液中的膠結離子在MICP過程中會全部轉化成沉淀物,所以反應完成后沉淀物試驗生成量和理論生成量是一致的。當Mg2+濃度不變,只改變Ca2+濃度,生成的沉淀量隨著膠結陽離子濃度的增加而增多。雖然試驗中難免存在誤差,但是實際值基本圍繞理論值波動,誤差在允許范圍之內;當Ca2+濃度不變,只改變Mg2+濃度,與上述規律亦然(圖7、圖8)。
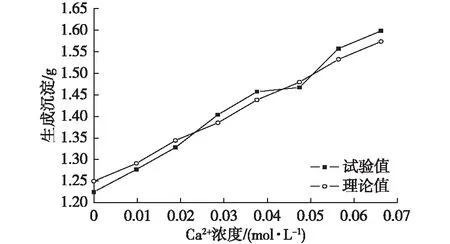
圖7 沉淀量隨土體中Ca2+含量變化Fig. 7 The precipitation capacity with the change in Ca2+contents in the soil
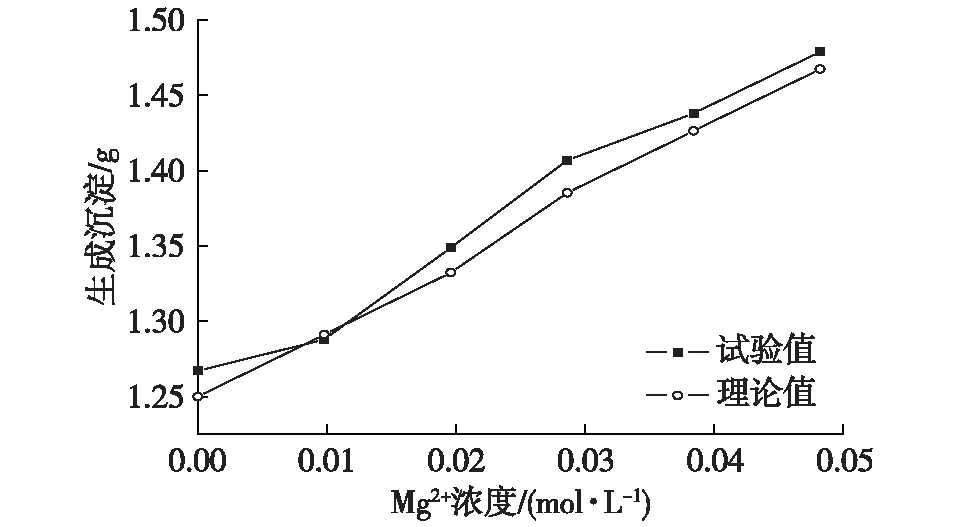
圖8 沉淀量隨土體中Mg2+含量變化Fig. 8 The precipitation capacity with the change in Mg2+contents in the soil
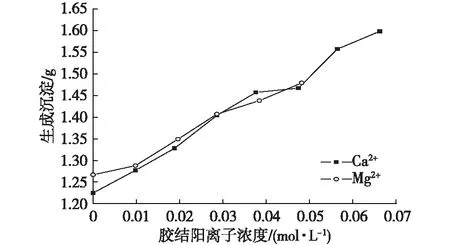
圖9 沉淀量隨土體中膠結陽離子含量變化Fig. 9 The precipitation capacity with the change in Mg2+contents in the soil
隨著Mg2+或Ca2+濃度的增加,生成的沉淀量均呈線性上升趨勢,而且斜率相近。這說明無論是變化Mg2+濃度還是Ca2+濃度,只要兩者的總濃度相同,生成的沉淀量大致相同。原始土體中膠結離子之間沒有相互抑制的作用,只要膠結陽離子濃度總和一致,則沉淀量基本一致(圖9)。
3 結 論
本研究利用尿素水解巴氏芽孢桿菌,進行溶液環境下微生物誘導碳酸鈣沉積試驗,研究環境溫度、環境pH、氯化鹽、土體中膠結陽離子等不同工作環境下碳酸鈣生成量的變化規律,得到的結論如下:
1)當14~30℃時,碳酸鈣的生成量隨之增長較快,大致呈直線段增長;當30~36℃時,碳酸鈣的生成量也隨之增長緩慢,接近于平穩狀態,總體呈上升的趨勢。
2)碳酸鈣生成量最多的pH為9,當pH為10或11時的碳酸鈣生成量高于pH為7或8時,表明本試驗的細菌在堿性環境下能夠生成相對多的碳酸鈣。
3)當溶液中加入不同濃度的氯化鹽,即NaCl和CaCl2時,會抑制碳酸鈣的生成;氯化鹽濃度越高,對碳酸鈣生成量的影響越顯著。Na+和Ca2+對碳酸鈣的生成影響近似,Cl-對碳酸鈣的生成也有著一定的抑制作用。同時,當菌液和膠結液等比例反應時,碳酸鈣生成量隨膠結液的濃度上升而增多,但利用率不斷降低。
4)無論是改變Ca+還是Mg2+濃度,只要兩者的總濃度相同,生成的沉淀量液大致相同。原始土體中少量的兩種膠結離子之間沒有相互抑制的作用,只要膠結陽離子濃度總和一致,則沉淀量基本一致。
[ 1 ] WHIFFIN V S. Microbial CaCO3precipitation for the production of biocement[D]. Perth:Murdoch University, 2004.
[ 3 ]GHOSH P, MANDAL S, CHATTOPADHYAY B D, et al. Use of microorganism to improve the strength of cement mortar[J]. Cement and Concrete Research, 2005, 35(10):1980-1983.
[ 4 ]黃琰, 羅學剛, 何晶, 等. 微生物在石英砂中誘導方解石沉積的實驗研究[J]. 西南科技大學學報, 2009, 24(2):65-69. HUANG Y, LUO X G, HE J, et al. Studies on the experiment of microbiologically-induced calcite precipitation in silica[J]. Journal of Southwest University of Science and Technology, 2009, 24(2):65-69.
[ 5 ]QIAN C X, PAN Q F, WANG R X. Cementation of sand grains based on carbonate precipitation induced by microorganism[J]. Science China Technological Sciences, 2010, 53(8):2198-2206.
[ 6 ]榮輝, 錢春香, 李龍志. 微生物水泥膠結機理[J]. 硅酸鹽學報, 2013, 41(3):314-319. RONG H, QIAN C X, LI L Z. Cementation mechanism of microbe cement[J]. Journal of the Chinese Ceramic Society, 2013, 41(3):314-319.
[ 7 ]DEJONG J T, SOGA K, KAVAZANJIAN E, et al. Biogeochemical processes and geotechnical applications:progress, opportunities and challenges[J]. Geotechnique, 2013, 63(4):287.
[ 8 ]AL QABANY A, SOGA K, SANTAMARINA C. Factors affecting efficiency of microbially induced calcite precipitation[J]. Journal of Geotechnical and Geoenvironmental Engineering, 2011, 138(8):992-1001.
[ 9 ]OKWADHA G D O, LI J. Optimum conditions for microbial carbonate precipitation[J]. Chemosphere, 2010, 81(9):1143-1148.
[10]CHENG L, SHAHIN M A, CORD-RUWISCH R, et al. Soil stabilisation by Microbial-Induced Calcite Precipitation (MICP):investigation into some physical and environmental aspects[C]//7th International Congress on Environmental Geotechnics:iceg 2014. Engineers Australia, 2014:1105.
[11]沈吉云. 微生物成因土工材料實驗及應用研究[D]. 北京:清華大學, 2009. SHEN J Y. Experiments and applications of bio-geomaterials[D]. Beijing:Tsinghua University, 2009.
[12]趙茜. 微生物誘導碳酸鈣沉淀(MICP)固化土壤實驗研究[D]. 北京:中國地質大學(北京), 2014. ZHAO Q. Experimental study on soil improvement using microbial induced calcite precipitation(MICP)[D]. Beijing:China University of Geosciences, 2014.
[13]張越. 微生物用于砂土膠凝和混凝土裂縫修復的試驗研究[D]. 北京:清華大學, 2014. ZHANG Y. Research on sand cementation and concrete cracks repairment by microbially induced carbonate precipitation technology[D]. Beijing:Tsinghua University, 2014.
[14]VAN PAASSEN L A. Biogrout, ground improvement by microbial induced carbonate precipitation[D]. Delft:Delft University of Technology, 2009.
[15]徐明星. 江蘇沿海灘涂地區典型剖面土壤性質演化及其高光譜響應研究[D]. 南京:南京大學,2011. XU M X. Evolution of soil basic properties and its hyperspectral response in typical profiles of coastal tidal region of Jiangsu Province, China[D]. Nanjing:Nanjing University, 2011.
[16]盧霞. 濱海鹽土鹽分含量與其光譜特征的關系研究[J]. 水土保持通報, 2012, 32(5):186-190. LU X. Relationship between saline concentration and its reflectance spectra for seashore saline soil[J]. Bulletin of Soil and Water Conservation, 2012, 32(5):186-190.
Study on influencing factors of microbial inducedcalcite precipitation insolution environment
KONG Fanhao, ZHAO Zhifeng*
(SchoolofCivilEngineering,NanjingForestryUniversity,Nanjing210037,China)
The objects of existing microbial induced calcite precipitation (MICP) technology are mainly loose sand in simple ionic chemical environments. However, the soil to be improved in practical engineering is often formed under different sedimentary and chemical environment. Few corresponding studies involved the MICP in different types of soil and environment. Therefore, the MICP experiments ofSporosarcinapasteuriiin the solution environment were conducted based on reclamation soil in the eastern coastal areas in Jiangsu Province. The influence of environment temperature, pH, the content of chlorate, and the contents of cementing cations on the MICP were analyzed by quantitative tests in the laboratory. The results showed that the production mass of calcium carbonate increased with the increase of temperature in the range from 14℃ to 36℃, generally presenting a rising trend. In addition, most calcium carbonate was generated when the solution pH was 9. And the production of calcium carbonate in strong alkaline solution (pH 10-11) was more than that in weak alkaline (pH 7-8). A high concentration of chlorate solution could inhibit the formation of calcium carbonate, and under the same concentration of calcium chloride and sodium chloride, the calcium chloride was more likely to inhibit the generation of calcium carbonate than sodium chloride was. There was no mutual inhibition between the two kinds of cementing cations in the original soil. When the total cementing cation concentration was constant, the production of calcium carbonate was basically the same, regardless of the proportion of each cation. The results may provide the effective guidance for actual soil grouting reinforcement process by using the MICP technology.
microbial induced calcite precipitation (MICP); solution environment; temperature; chloride salt; cation
2016-12-13
2017-03-25
日本和歌山縣資助項目。
KOMATSU Kohei, 男,教授,研究方向為木結構建筑。E-mail:kkomatsu@rish.kyoto-u.ac.jp
基金項目:國家自然科學基金(51578293)。
TU433
A
2096-1359(2017)04-0146-06
收稿日期:2016-08-07 修回日期:2017-01-03
作者簡介:孔繁浩,男,研究方向為環境巖土與地下工程。通信作者:趙志峰,男,副教授。E-mail:zzf0911@163.com

