基于核心素養的高考化學試題命制研究
福建 洪茲田 陳女婷
基于核心素養的高考化學試題命制研究
福建 洪茲田 陳女婷
2017年高考命題要突出“一體四層四翼”的特點,“四層”包括必備知識、關鍵能力、學科素養、核心價值。基于核心素養的試題命制成為高考化學試題命題的新視角。核心素養視角下的試題命制要以核心素養為測試宗旨,以實際問題為測試任務,以真實情境為測試載體,以化學知識為解決問題的工具。本文對核心素養中的“宏觀辨識與微觀探析”“變化觀念與平衡思想”“證據推理與模型認知”“科學探究與創新意識”“科學精神與社會責任”五個維度進行分述,以期得到高考命題的新思路。
維度一:宏觀辨識與微觀探析
視角1:能從不同角度認識物質的多樣性,并對物質進行分類
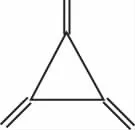
A.均為芳香烴
B.互為同素異形體
C.互為同系物
D.互為同分異構體
解析:軸烯與苯分子式都是C6H6,二者分子式相同,結構不同,互為同分異構體,故選項D正確。
答案:D
視角2:能從元素和原子、分子的水平認識物質的組成、結構、性質和變化,形成“結構決定性質”的觀念
例2 (2013全國Ⅰ)香葉醇是合成玫瑰香油的主要原料,其結構簡式如下,下列有關香葉醇的敘述正確的是()
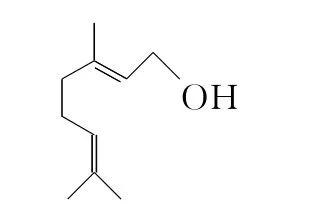
A.香葉醇的分子式為C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高錳酸鉀溶液褪色
D.能發生加成反應不能發生取代反應
解析:由鍵線式可知,香葉醇的分子式為C10H18O,故A正確;因含,能使溴的四氯化碳溶液褪色,故B錯誤;含鍵、—OH,能使酸性高錳酸鉀溶液褪色,故C錯誤;含能發生加成反應,含—OH能發生取代反應,故D錯誤。
答案:A
視角3:能從宏觀和微觀相結合的角度分析和解決實際問題
例3 (2015全國Ⅰ)短周期元素W、X、Y、Z的原子序數依次增加。m、p、r是由這些元素組成的二元化合物,n是元素Z的單質,通常為黃綠色氣體,q的水溶液具有漂白性,0.01mol·L-1r溶液的pH為2,s通常是難溶于水的混合物。上述物質的轉化關系如圖所示。下列說法正確的是( )
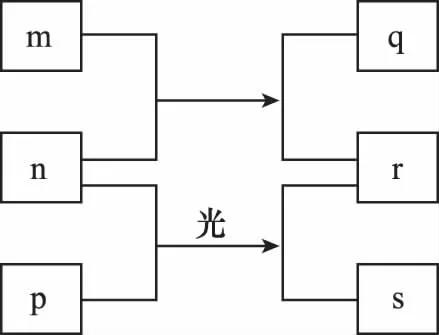
A.原子半徑的大小:W<X<Y
B.元素的非金屬性:Z>X>Y
C.Y的氫化物常溫常壓下為液態
D.X的最高價氧化物的水化物為強酸
解析:n是黃綠色氣體單質,則n為Cl2,Z為Cl,p是二元化合物,且在光照下與Cl2反應,產物r為一元強酸HCl,s是難溶于水的混合物,則p是CH4,氯氣與m反應生成的產物q具有漂白性,且同時生成HCl,則m為H2O。由于W、X、Y、Z的原子序數依次增加,則W、X、Y、Z依次為H、C、O、Cl。同周期元素從左到右原子半徑依次減小,故原子半徑H<O<C,故A錯誤;非金屬性O>Cl>C,故B錯誤;O的氫化物為水,常溫下為液態,故C正確;C的最高價氧化物的水化物碳酸為弱酸,故D錯誤。
答案:C
維度二:變化觀念與平衡思想
視角1:能認識物質是運動和變化的,知道化學變化需要一定條件,并遵循一定的規律
例4 (2016上海)一定條件下,一種反應物過量,另一種反應物仍不能完全反應的是( )
A.過量的氫氣與氮氣
B.過量的濃鹽酸與二氧化錳
C.過量的銅與濃硫酸
D.過量的鋅與18mol·L-1硫酸
解析:合成氨是一個可逆反應,反應物不可能完全消耗,故A正確;二氧化錳只與濃鹽酸反應,若濃鹽酸過量,二氧化錳可完全反應,故B錯誤;銅活潑性弱,只能與濃硫酸反應,濃硫酸當濃變稀后與銅不反應,故C正確;過量的鋅與18mol·L-1硫酸溶液反應,首先生成SO2,當濃變稀的時候生成氫氣,故D錯誤。
答案:AC
視角2:認識化學變化的本質是有新物質生成,并伴有能量的轉化;認識化學變化有一定限度,是可以調控的
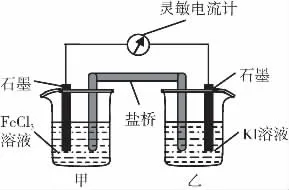
A.反應開始時,乙中石墨電極上發生氧化反應
B.反應開始時,甲中石墨電極上Fe3+被還原
C.電流計讀數為零時,反應達到化學平衡狀態
D.電流計讀數為零后,在甲中溶入FeCl2固體,乙中的石墨電極為負極
解析:由圖示結合原電池原理分析可知,Fe3+得電子變成Fe2+被還原,I-失去電子變成I2被氧化,故A、B正確;電流計讀數為零時Fe3+得電子速率等于Fe2+失電子速率,反應達到平衡狀態,故C正確;D項在甲中溶入FeCl2固體,平衡向左移動,I2被還原為I-,乙中石墨為正極,故D錯誤。
答案:C
視角3:能多角度、動態的分析化學反應,運用化學反應原理解決實際問題
例6 (2016全國Ⅰ)298K時,在20.0mL 0.10mol·L-1氨水中滴入0.10mol·L-1的鹽酸,溶液的pH與所加鹽酸的體積關系如圖所示。已知0.10mol·L-1氨水的電離度為1.32%,下列有關敘述正確的是( )

A.該滴定過程應該選擇酚酞作為指示劑
B.M點對應的鹽酸體積為20.0mL
C.M點處的溶液中c(NH+4)=c(Cl-)=c(H+)=c(OH-)
D.N點處的溶液中pH<12
解析:鹽酸滴定氨水時,生成NH4Cl,溶液顯酸性,應選擇甲基橙作指示劑,故A錯誤;若M點鹽酸體積為20.0mL,則二者恰好完全反應生成NH4Cl,NH4Cl中NH+4水解導致該點溶液呈酸性,要使溶液呈中性,則氨水應略過量,即鹽酸體積小于20.0mL,故B錯誤;M點溶液根據電荷守恒得c(NH+4)+c(H+)=c(Cl-)+c(OH-),因pH=7,則c(H+)=c(OH-),可得c(NH4+)=c(Cl-),M點溶液的溶質為NH4Cl和NH3·H2O,NH+4水解和NH3·H2O電離相互抑制,水的電離程度很小,故M點c(NH+4)=c(Cl-)>c(H+)=c(OH-),故C錯誤;N點為氨水溶液,氨水濃度為0.10mol·L-1,該氨水電離度為1.32%,則該溶液中c(OH-)=0.10mol·L-1×1.32%=1.32×10-3mol·L-1,c(H+)=Kw/c(OH-)=7.6×10-12mol·L-1,所以該點溶液pH<12,故D正確。
答案:D
維度三:證據推理與模型認知
視角1:具有證據意識,能基于證據對物質組成、結構及其變化提出可能的假設,通過分析推理加以證實或證偽
例7 (2016上海)類比推理是化學中常用的思維方法。下列推理正確的是( )
A.CO2是直線形分子,推測CS2也是直線形分子
B.SiH4的沸點高于CH4,推測H2Se的沸點高于H2S
C.Fe與Cl2反應生成FeCl3,推測Fe與I2反應生成FeI3
D.NaCl與濃H2SO4加熱可制HCl,推測NaBr與濃H2SO4加熱可制HBr
解析:O和S是同族元素,形成的CO2和CS2都是直線形分子,故A正確;C和Si,Se和S都分別為同族元素,所形成的氫化物都為分子晶體,相對分子質量越大,分子間作用力越大,熔沸點越高,故B正確;I2的氧化性較弱,與Fe反應生成的是FeI2,故C錯誤;濃H2SO4氧化性很強,可將HBr氧化為Br2,不能用該方法制取HBr,故D錯誤。
答案:AB
視角2:建立觀點、結論和證據的邏輯關系
例8 (2015福建,節選)科學家正在研究溫室氣體CH4和CO2的轉化和利用。
(4)一定條件下,CH4和CO2都能與H2O形成籠狀結構(如下圖所示)的水合物晶體,其相關參數見下表。CH4與H2O形成的水合物俗稱“可燃冰”。
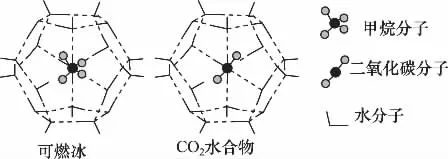
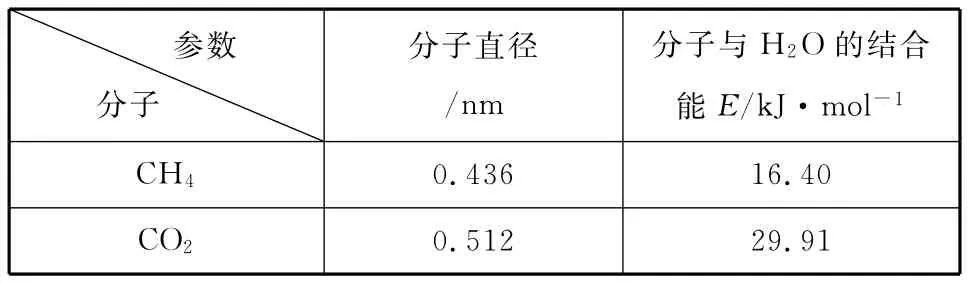
參數分子分子直徑/nm分子與H2O的結合能E/kJ·mol -1________CH40.512 29.91 0.436 16.40_______CO2
②為開采深海海底的“可燃冰”,有科學家提出用CO2置換CH4的設想。已知上圖中籠狀結構的空腔直徑為0.586nm,根據上述圖表,從物質結構及性質的角度分析,該設想的依據是______________________________________。
解析:由表中數據可知,籠狀結構的空腔直徑為0.586nm,大于CO2分子直徑(0.512nm),而且CO2與H2O分子之間的結合力大于CH4,故可實現用CO2置換出“可燃冰”中CH4的設想。
答案:CO2的分子直徑小于籠狀空腔直徑,且與H2O的結合力大于CH4
視角3:通過分析、推理等方法認識研究對象的本質特征、構成要素及其相互關系,從而建立模型
例9 (2016上海)能證明乙酸是弱酸的實驗事實是( )
A.CH3COOH溶液與Zn反應放出H2
B.0.1mol·L-1CH3COONa溶液的pH大于7
C.CH3COOH溶液與NaCO3反應生成CO2
D.0.1mol·L-1CH3COOH溶液可使紫色石蕊變紅
解析:與Zn反應放出H2只能證明乙酸具有酸性,不能證明其酸性強弱,故A錯誤;CH3COONa水溶液顯堿性,說明CH3COO-可以水解,可以證明乙酸是弱酸,故B正確;與NaCO3反應生成CO2證明乙酸的酸性比碳酸強,但是不能證明其酸性強弱,故C錯誤;使紫色石蕊變紅只能證明乙酸具有酸性,但是不能證明其酸性強弱,故D錯誤。
答案:B
維度四:實驗探究與創新意識
視角1:能發現和提出有探究價值的問題,能從問題和假設出發,確定探究目的,設計探究方案,進行實驗探究
例10 (2010廣東,節選)某研究小組用MnO2和濃鹽酸制備Cl2時,利用剛吸收過少量SO2的NaOH溶液對其尾氣進行吸收處理。
(3)吸收尾氣一段時間后,吸收液(強堿性)中肯定存在Cl-、OH-和S。請設計實驗,探究該吸收液中可能存在的其他陰離子(不考慮空氣中CO2的影響)。
②設計實驗方案,進行實驗。請在答題線上寫出實驗步驟以及預期現象和結論。限選實驗試劑:3mol·L-1H2SO4、1mol·L-1NaOH、0.01mol·L-1KMnO4、淀粉-KI溶液、紫色石蕊試液。

實驗步驟預期現象和結論步驟1:取少量吸收液于試管中,滴加3mol·L-1H2SO4至溶液呈酸性,然后將所得溶液分置于A、B 試管中_________________________________________________步驟2:____________________________________步驟3:_____________________________________________________
答案:(3)①只存在ClO-②步驟2:在A試管中滴加紫色石蕊試液 若先變紅后褪色,證明有ClO-,否則無步驟3:在B試管中滴加0.01mol·L-1KMnO4溶液 若紫紅色褪去,證明有S,否則無
視角2:在科學探究探究中學會合作,面對“異常”現象敢于提出自己的見解
例11 (2016全國Ⅱ,節選)某班同學用如下實驗探究Fe2+、Fe3+的性質。回答下列問題:
(5)丁組同學向盛有H2O2溶液的試管中加入幾滴酸化的FeCl2溶液,溶液變成棕黃色,發生反應的離子方程式為___________________;一段時間后,溶液中有氣泡出現,并放熱,隨后有紅褐色沉淀生成,產生氣泡的原因是___________________,生成沉淀的原因是____________________(用平衡移動原理解釋)。
解析:溶液變成棕黃色,說明H2O2氧化Fe2+生成H2O2分解起到催化劑作用,產生氣泡的原因是Fe3+催化H2O2分解生成氧氣,FeCl3溶液中存在水解平衡:Fe3++3H2O·Fe(OH)3+3H+,水解反應為吸熱反應,H2O2分解放出熱量,促進Fe3+的水解平衡正向移動。
維度五:科學精神與社會責任
視角1:具有嚴謹求實的科學態度,具有探索未知、崇尚真理的意識
例12 (2012福建,節選)實驗室常用MnO2與濃鹽酸反應制備Cl2。
(2)制備反應會因鹽酸濃度下降而停止。為測定反應殘余液中鹽酸的濃度,探究小組同學提出的下列實驗方案:④進行丁方案(與足量Zn反應,測量生成的H2體積)實驗,裝置如下圖所示(夾持器具已略去)。
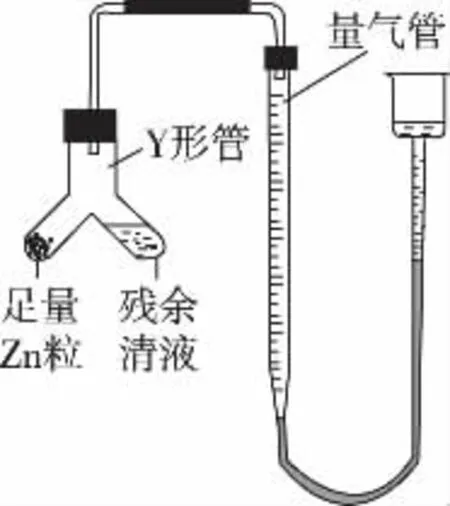
(ⅰ)使Y形管中的殘余清液與鋅粒反應的正確操作是將________轉移到________中。
(ⅱ)反應完畢,每間隔1分鐘讀取氣體體積、氣體體積逐漸減小,直至不變。氣體體積逐次減小的原因是___________________(排除儀器和實驗操作的影響因素)。
答案:(ⅰ)鋅粒 殘留溶液 (ⅱ)氣體未冷卻到室溫
視角2:贊賞化學對社會發展的重大貢獻,具有可持續發展意識和綠色化學觀念,能對與化學有關的社會熱點問題做出正確的價值判斷
例13 (2016全國Ⅰ,內容略)第11題“三室式電滲析法”將工業廢水轉化為硫酸和氫氧化鈉溶液,第38題“以秸稈為原料合成聚酯類高分子化合物”,都體現了化學與可持續發展的理念;第28題“NaClO2是一種重要的殺菌消毒劑,也常用來漂白織物等”;第37題“鍺(Ge)是典型的半導體元素,在電子、材料等領域應用廣泛”,展現了化學貼近時代、貼近社會、貼近生活的理念;第26題依托實驗要求考生理解消除污染的策略,第36題有關高錳酸鉀的使用價值和制備工藝,引導學生關心身邊的科學問題、關注社會發展和進步。
(作者單位:福建省廈門市翔安第一中學)

