電化學復習中需要澄清的幾個問題
河北 錢明安 韓萬中
電化學復習中需要澄清的幾個問題
河北 錢明安 韓萬中
電化學內容較多,它們在高中教材中的編排是以漸進的方式分批呈現的,由于課本呈現出來的知識比較簡潔,學生在復習過程中往往忽略知識的遞進性和邏輯推理的嚴密性,得到一些簡單化的、絕對化和僵化的結論。
一、構成原電池的條件是什么呢?
人教版(下同)必修2,以鋅氫原電池開始學習原電池時,往往把原電池構成的條件總結為:①自發的氧化還原反應;②活潑性不同的兩種電極材料;③電解質溶液;④形成閉合電路。這樣的結論是固定不變的嗎?
隨后學習燃料電池的時候,問題就立刻出現了,H2和O2要反應必須點燃,那么在常溫下屬于自發的氧化還原反應嗎?“自發”屬于熱力學概念,也就是反應的ΔG<0,需要整合選修4《化學反應原理》的內容才會理解。至于燃料電池的電極材料一般為惰性電極,如鉑電極、石墨電極等,具有很強的催化活性,這是動力學問題。
選修4《化學反應原理》再次學習氫氧燃料電池時,教材介紹它的兩個的電極都是鉑,并非活動性不同的材料。但它的兩極所吸附的化學物質不同,使兩極電勢不同,從而產生了電流。
再一點,教材中詳細介紹的電源都是電解質的水溶液作為離子傳遞的通道,因此學生頭腦中形成構成原電池一定要有電解質的“水溶液”的定式。事實上,除了“水溶液”作離子導體的,還有熔融態電解質、固體電解質、有機高分子材料等類型,關鍵是否能夠傳遞離子構成回路。
【例1】(2015江蘇,10)一種熔融碳酸鹽燃料電池原理示意如圖。下列有關該電池的說法正確的是( )

B.電極A上H2參與的電極反應為H2+2OH--2e-
D.電極B上發生的電極反應為O2+2CO2+4e-
答案:D
說明:該電池環境是熔融碳酸鹽,是鹽類熔化后形成的熔融體,屬于一種非水體系。它的電極反應物分別為CO、H2混合氣體和O2,電極不參與電極反應。由于導電陰離子是,故A極電極反應式是,如果寫作CO2+3H2O,就中了“水溶液”的槍了。同理B極電極反應式是,而非
通過上述分析可見,不能將構成原電池的條件“固化”,面對那些形形色色的電源,需從原電池本質出發去分析和理解它們的工作原理。原電池之所以使化學能能轉化為電能,源頭是自發的氧化還原反應,正極發生還原反應。負極發生氧化反應,這是原電池構成的內因。外部條件是內電路有離子導體,外電路有電子導體,構成閉合回路。
二、電解池中的幾個疑問
1.只有離子才能在電極上放電嗎?
選修4《化學反應原理》中,以電解CuCl2溶液學習電解原理以及書寫電極方程式,尤其是各種資料中提供的耳熟能詳的離子放電順序,使學生形成了只有離子在電極上放電的觀點。電解池原理告訴我們,陽極發生氧化反應失去電子、陰極發生還原反應得到電子,以維持回路的電子定向移動。所以我們要從放電的實質理解和應用:離子、活潑電極,甚至氣體分子都可以在陽極失去電子;除離子外,中性氣體分子也可在陰極得到電子,有時甚至出現多種微粒同時放電的情況。我們應打破定式,要接受開放性的放電微粒觀。
【例2】(2016全國Ⅰ,28節選)NaClO2是一種重要的殺菌消毒劑,也常用來漂白織物等,其一種生產工藝如下:

“電解”中陰極反應的主要產物是___________________。
答案:NaClO2或ClO-2
說明:據統計河北考生答H2的占比約為60%,如果認為他們機械地按照教材中所說的陽離子在陰極放電,即↑,那么,這也僅是一種膚淺的歸因。深層一點地說,這是他們脫離了工業流程的實際情況,沒有看清流程中物質的轉化關系;再深層的是,他們沒有把握住電極放電的本質,陰極放電實質就是氧化劑得電子,由于氧化性。也就是說,電極放電的微粒不一定只是離子,分子同樣也能放電。
2.電解時陽(陰)離子能在陽(陰)極放電嗎?兩極反應一定按離子放電順序進行嗎?
學習電解時,繞不開離子的放電順序。很多資料上說:陽極為惰性電極時,溶液中為陰離子放電,失電子能力為S2->I->Br->Cl->NO-3>SO>CO;陰極為溶液中的陽離子放電,得電子能力為Ag+>Hg2+>Fe3+>Cu2+>H+(指酸的電離)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水的電離)>Al3+>Mg2+>Na+>Ca2+>K+。所以,根據離子放電順序可判斷出兩個電極發生的反應。但在實際中常出現與之難以解釋的情況,這種似乎“異常”的實驗事實,也在近幾年的高考試卷中以考題的形式展示在我們面前。
【例3】(2014北京,28節選)用FeCl3酸性溶液脫除H2S后的廢液,通過控制電壓電解得以再生。某同學使用石墨電極,在不同電壓(x)下電解pH=1的0.1mol·L-1FeCl2溶液,研究廢液再生機理。記錄如下(a、b、c代表電壓值)

序號電壓/V 陽極現象檢驗陽極產物Ⅰx≥a電極附近出現黃色,有氣泡產生有Fe3+、有Cl 2Ⅱa>x≥b電極附近出現黃色,無氣泡產生有Fe3+、無Cl 2Ⅲb>x>0無明顯變化無Fe3+、無Cl 2
(3)Ⅱ中雖未檢測出Cl2,但Cl-在陽極是否放電仍需進一步驗證。電解pH=1的NaCl溶液做對照實驗,記錄如下:
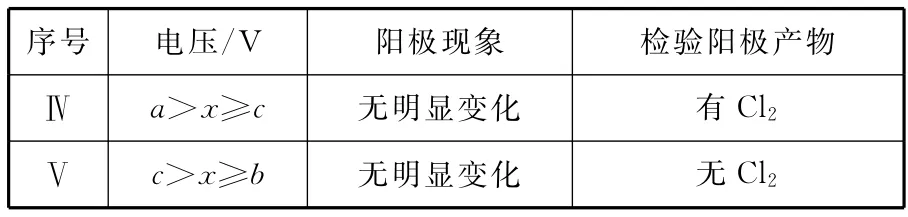
序號電壓/V 陽極現象檢驗陽極產物Ⅳa>x≥c無明顯變化有Cl 2Ⅴc>x≥b無明顯變化無Cl 2
②與Ⅱ對比,得出的結論:_____________________(寫出兩點)。
答案:(3)②通過控制電壓,證實了產生Fe3+的兩種原因都成立 通過控制電壓,驗證了Fe2+先于Cl-放電
解析:(3)②與Ⅱ對比可知,Ⅳ中電解FeCl2時,電壓較大(a>x≥c)的時候,Cl-放電產生氯氣,即還原性Cl->Fe2+,Fe3+是由氯氣氧化Fe2+得到的;電壓較小(c>x≥b)的時候,Cl-不放電,即還原性Fe2+>Cl-,同時也說明了Fe3+是由Fe2+直接放電得到的。故結論有兩點:通過控制電壓,證實了產生Fe3+的兩種原因都成立;通過控制電壓,驗證了Fe2+先于Cl-放電。
從本題表述的實驗過程和實驗現象可以看出:Fe2+和Cl-這兩種離子在溶液中的放電是能夠改變先后順序的,不是一成不變的。其實,電解中離子放電是一個復雜的過程,它不僅與溶液中離子得失電子的能力、離子的濃度有關系,與電壓的高低也有關系。一般教材中為了突出某個問題,常強調對之有較大影響的某個因素。在特定的條件下,這種處理方法尚可,若隨意應用有時會出現差錯。
(作者單位:河北省清河中學)

