沉默MACC1基因對人卵巢癌耐藥細胞增殖、凋亡和侵襲的影響
鄧佑興,史惠蓉,李霞,張瑞濤(鄭州市婦幼保健院,鄭州45005;鄭州大學第一附屬醫院)
?
沉默MACC1基因對人卵巢癌耐藥細胞增殖、凋亡和侵襲的影響
鄧佑興1,史惠蓉2,李霞2,張瑞濤2
(1鄭州市婦幼保健院,鄭州450052;2鄭州大學第一附屬醫院)
目的 觀察應用基因沉默技術抑制人卵巢癌耐藥細胞結腸癌轉移相關基因1(MACC1)表達后,細胞增殖、凋亡和侵襲能力的變化及其分子機制。方法 將人卵巢癌耐藥細胞株SKOV-3/DDP分成空質粒組和轉染組,分別轉染空質粒p-super-EGFP、重組質粒p-super-EGFP-MACC1 shRNA,另取未經處理的SKOV-3/DDP細胞作為空白對照組。采用RT-PCR方法檢測各組MACC1 mRNA表達,Western blotting法檢測MACC1蛋白表達,MTT法檢測細胞增殖能力,流式細胞術檢測細胞凋亡情況,體外黏附試驗檢測細胞體外黏附力,Transwell小室檢測細胞侵襲能力,Western blotting法測定C-met、ERK1/2、p-ERK1/2蛋白表達。結果 與空白對照組和空質粒組比較,轉染組MACC1 mRNA和蛋白表達減少,細胞48、72 h增殖能力減弱,細胞凋亡率增加,體外黏附和侵襲能力減弱,C-met、p-ERK1/2蛋白表達增加(P均<0.05),而空白對照組和空質粒組各指標差異無統計學意義(P均>0.05)。結論 MACC1基因表達抑制后,SKOV-3/DDP的增殖、黏附和侵襲能力減弱,細胞凋亡增加,這可能與HGF/C-met和ERK通路受抑制有關。
卵巢癌;結腸癌轉移相關基因1;細胞增殖;細胞凋亡;細胞侵襲
卵巢癌的病死率居婦科惡性腫瘤首位。由于卵巢居于盆腔深部,卵巢癌常缺乏早期特異性癥狀,絕大部分卵巢癌患者就診時已是晚期[1]。卵巢癌復發、轉移是影響晚期卵巢癌患者預后的重要因素。結腸癌轉移相關基因1(MACC1)是一種與結腸癌密切相關的基因,與結腸癌的增殖和轉移密切相關[2]。研究表明,胃癌[3]、乳腺癌[4]、肝癌[5]等多種腫瘤中MACC1基因存在異常高表達,MACC1可促進腫瘤生長、侵襲。但是MACC1對卵巢癌耐藥細胞增殖、凋亡和侵襲的影響及其分子機制,目前少見報道。肝細胞生長因子(HGF)/C-met信號傳導通路是與惡性腫瘤生長、轉移相關的信號通路,ERK通路是與惡性腫瘤細胞增殖、惡性轉化和侵襲有關的通路。2014~2016年,我們采用RNA干擾技術沉默卵巢癌耐藥細胞系SKOV-3/DDP中MACC1基因表達,觀察卵巢癌耐藥細胞體外增殖、凋亡和侵襲能力的變化,并檢測HGF/C-met通路蛋白C-met和ERK通路蛋白ERK1/2、p-ERK1/2表達,探討其可能的分子機制。
1 材料與方法
1.1 材料 人卵巢癌耐藥細胞株SKOV-3/DDP購自中國醫學科學院腫瘤細胞庫。真核熒光表達質粒p-super-EGFP-1和重組質粒p-super-EGFP-MACC1 shRNA由鄭州大學第一附屬醫院婦產科實驗室構建;RevertAid First Strand cDNA購自加拿大Formentas公司;DNA&siRNA InterferinTM轉染試劑購于美國Polyplus Transfection公司;Matrigel基質膜購于美國BD公司;MTT購自美國Sigma公司;胎牛血清購自美國Hyclone公司;Annexin V-FITC凋亡檢測試劑盒購自南京凱基公司;兔抗人MACC1抗體購自英國Abcam公司;兔抗人C-met、兔抗人ERK1/2、p-ERK1/2抗體購自北京博奧森公司;兔抗人MMP-2抗體、兔抗人MMP-9抗體、兔抗人β-actin抗體、兔抗人caspase-3抗體、兔抗人cleaved caspase-3抗體及羊抗兔單克隆IgG購自美國Cell Signaling Technology公司。
1.2 細胞培養與分組處理 將SKOV-3/DDP細胞分別加入含10%胎牛血清的RPMI1640培養液中,37 ℃、5% CO2、飽和濕度培養箱中常規培養、傳代。待細胞培養至70%~80%融合時,提取細胞用于實驗。使用質粒小量提取試劑盒提取重組質粒,應用DNA&siRNA InterferinTM轉染試劑進行細胞轉染。將細胞分成空質粒組和轉染組,分別轉染空質粒p-super-EGFP、重組質粒p-super-EGFP-MACC1 shRNA。另取未經處理的SKOV-3/DDP細胞作為空白對照組。
1.3 細胞MACC1 mRNA表達檢測 采用RT-PCR方法。取對數生長期細胞,TRIzol試劑盒提取細胞總RNA,反轉錄合成cDNA。以β-actin為內參基因,設計并合成引物。MACC1基因上游引物5′-CCTTCGTGGTAATAATGCTTCC-3′,下游引物5′-AGGGCTTCCATTGTATTGAGGT-3′,產物696 bp;β-actin上游引物5′-GGCGGCACCACCATGTACCCT-3′,下游引物5′-AGGGGCCGGACTCGTCATACT-3′,產物220 bp。PCR反應條件:94 ℃ 3 min,94 ℃ 30 s、53 ℃ 30 s、72 ℃ 30 s循環35次,最后72 ℃ 5 min,4 ℃終止。1.5%瓊脂糖凝膠電泳,凝膠成像系統觀察、拍照,Image J軟件分析PCR圖像。以MACC1與β-actin灰度值的比值代表MACC1 mRNA的相對表達量。實驗重復3次。
1.4 細胞MACC1蛋白表達檢測 采用Western blotting法。取對數生長期細胞,RIPA法提取總蛋白。10%SDS-PAGE電泳,轉移至PVDF膜加入一抗(兔抗人MACC1 1∶500,兔抗人β-actin 1∶1 000),4 ℃孵育過夜,加入二抗(羊抗兔1∶1 000)室溫孵育1 h,ECL化學發光法顯色。以β-actin作為內參,采用Image J軟件分析特異性蛋白條帶灰度值。
1.5 細胞增殖能力觀察 采用MTT法。將三組細胞分別以5×103/孔接種至96孔板,在37 ℃、5% CO2條件下培養。于培養24、48、72 h后加入5 mg/mL MTT 10 μL,繼續培養4 h。棄上清,加入100 μL DMSO,酶標儀測定A490分光光度值,繪制細胞增殖曲線。
1.6 細胞凋亡觀察 采用FCM法。分別將3組細胞接種至6孔板。培養至70%~80%融合后,收集細胞,PBS沖洗,4 ℃離心,500 μL binding buffer懸浮細胞,再加入5 μL Annexin V-FITC混勻,加入400 μL PI,混勻后室溫避光反應15 min。用流式細胞儀測定細胞凋亡情況。
1.7 細胞體外黏附能力觀察 采用細胞黏附實驗。將Matrigel利用無血清的RPMI1640配成0.04 μg/μL的人工基底膜膠。96孔板中每孔覆以50 μL Matrigel并風干,每孔加入1×105/mL的SKOV-3/DDP細胞,37 ℃、5% CO2濕度的培養箱中培養2 h。每孔加入MTT 10 μL后繼續培養4 h后,分別在每孔加入200 μL DMSO,振蕩10 min后在酶標儀490 nm處讀取吸光度A值,以A值大小表示黏附細胞的數量多少。每組設3個復孔,實驗重復3次。
1.8 細胞侵襲能力觀察 收集3組細胞制成細胞懸液,調整細胞密度為2×105/mL。Transwell上室先預鋪稀釋的Matrigel,取200 μL細胞加入Transwell上室,下室中加入500 μL含5% FBS的RPMI1640培養液,培養24 h后取出小室,固定,染色,濕棉簽輕輕擦去膜上細胞,封固。每張膜中間部分和周圍部分各隨機取5個視野,光學顯微鏡下計數每個視野內的細胞數,取平均值。以侵襲細胞的相對數目來表示腫瘤細胞的侵襲能力。
1.9 HGF/C-met通路蛋白C-met和ERK通路蛋白ERK1/2、p-ERK1/2表達檢測 方法同1.4。一抗兔抗人C-met(1∶100),兔抗人ERK1/2(1∶100),兔抗人p-ERK1/2(1∶100),兔抗人β-actin(1∶1 000),二抗(羊抗兔1∶1 000)。
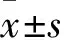
2 結果
2.1 三組MACC1 mRNA和蛋白表達比較 轉染組MACC1 mRNA和蛋白表達均低于其他兩組(P均<0.05),轉染組和空質粒組MACC1 mRNA和蛋白表達比較差異均無統計學意義(P均>0.05)。見表1。
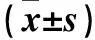
表1 三組MACC1 mRNA和蛋白表達比較
2.2 三組細胞增殖能力比較 轉染組、空質粒組、空白對照組24 h時的細胞增殖A值分別為0.192±0.001、0.211±0.002、0.210±0.002,組間比較差異均無統計學意義(P均>0.05)。48、72 h時轉染組A值低于其他兩組(P均<0.05),空白對照組與空質粒組間比較差異無統計學意義(P均>0.05)。
2.3 三組細胞凋亡率比較 轉染組、空質粒組和空白對照組的細胞凋亡率分別為15.74%±0.60%、4.52%±0.64%、3.72%±0.54%。轉染組細胞凋亡率高于其他兩組(P均<0.05),空白對照組和空質粒組比較差異無統計學意義(P>0.05)。
2.4 三組細胞體外黏附能力比較 轉染組、空質粒組、空白對照組的A值分別為0.335±0.002、0.449±0.001、0.451±0.003,轉染組低于其他兩組(P均<0.05),空白對照組與空質粒組比較差異無統計學意義(P>0.05)。
2.5 三組細胞侵襲能力比較 轉染組、空質粒組和空白對照組的穿膜細胞數分別為(22.57±3.71)、(61.56±3.80)、(61.25±3.72)個。轉染組穿膜細胞數少于其他兩組(P均<0.05),空質粒組與空白對照組比較差異無統計學意義(P>0.05)。
2.6 三組C-met、ERK1/2、p-ERK1/2表達比較 轉染組C-met、p-ERK1/2表達較其他兩組減少(P均<0.05),三組ERK1/2表達比較差異無統計學意義(P均>0.05)。見表2。
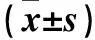
表2 三組C-met、ERK1/2、p-ERK1/2表達比較
注:與轉染組比較,*P<0.05。
3 討論
MACC1最早是在結腸癌中發現的一個新的基因,參與結腸癌的發生、發展過程,可以作為預示結腸癌轉移和預后的因子[6]。隨后研究者在膀胱癌[7]、膽囊癌[8]、膠質瘤[9]中也發現了MACC1的存在,其與腫瘤血管的生成、生長、凋亡、侵襲轉移等生物學行為密切相關。Zhou等[10]發現,宮頸癌組織中MACC1表達高于正常宮頸組織,MACC1高水平與盆腔淋巴結轉移、復發和低生存率顯著相關。Xu等[7]應用RNAi技術抑制膀胱癌中MACC1表達后,膀胱癌細胞增殖和侵襲能力減弱。華方方等[11]研究發現,宮頸癌SiHa細胞中MACC1表達下調可顯著抑制細胞增殖,改變細胞周期分布,減弱細胞侵襲能力。Wang等[8]發現,下調MACC1顯著抑制膽囊癌細胞生長和細胞侵襲。本研究顯示,與空白對照組和空質粒組比較,轉染組MACC1 mRNA和蛋白表達較減少,細胞48、72 h增殖能力減弱,凋亡率增加,體外黏附和侵襲能力減弱。表明采用基因沉默技術抑制SKOV-3/DDP中MACC1基因表達,能夠降低MACC1基因和蛋白表達,減弱卵巢癌細胞增殖能力,增加癌細胞凋亡,減弱癌細胞體外黏附和侵襲能力。提示MACC1在卵巢癌耐藥細胞的增殖、凋亡和侵襲中發揮重要作用。
MACC1對腫瘤細胞的增殖、凋亡以及侵襲轉移的作用是通過復雜的信號通路完成的。研究表明,HGF/C-met信號傳導通路是一個明確的與惡性腫瘤生長、轉移相關的信號通路,MACC1基因可通過與MET基因啟動子結合,調控MET基因的活性和C-met蛋白的表達,激活HGF/C-met通路;C-met蛋白酪氨酸殘基磷酸化后,導致細胞內多條信號通路包括ERK通路的級聯激活,最終促進細胞增殖、血管生成以及上皮-間質轉化、細胞侵襲,引起腫瘤生長和轉移[2]。另外,MACC1蛋白可通過自身SH3結構域以及酪氨酸、絲/蘇氨酸激酶磷酸化位點作用于生長因子受體蛋白相關的信號通路,激活Ras-Rho-RacG蛋白家族成員,參與ERK通路的調節[12,13]。因此,猜測MACC1可能通過HGF/C-met信號通路和ERK信號通路參與對腫瘤細胞生物學行為的調節。
Stein等[2]在結腸癌細胞中轉染外源性MACC1,發現HGF介導的結腸癌細胞播散作用可被ERK通路抑制劑PD98059或UO126抑制,提示外源性MACC1高表達可激活ERK通路。Wang等[14]發現沉默MACC1基因后,胰腺癌細胞增殖和侵襲能力減弱,ERK通路被抑制。本研究結果顯示,與空白對照組和空質粒組比較,轉染組C-met、p-ERK表達減少。表明采用基因沉默技術抑制SKOV-3/DDP中MACC1基因表達,能夠降低HGF/C-met信號通路關鍵因子C-met、ERK信號通路關鍵因子p-ERK蛋白表達。提示MACC1對SKOV-3/DDP細胞增殖、凋亡及侵襲的調節可能是通過HGF/C-met信號通路和ERK信號通路來完成的。
綜上所述,MACC1可能通過調節HGF/C-met信號通路和ERK1/2信號通路以及多種通路的最終共同效應分子,對卵巢癌細胞的增殖、凋亡以及體外侵襲進行調控。
[1] Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2009[J]. CA Cancer J Clin, 2009,59(4):225-249.
[2] Stein U, Walther W, Arlt F, et al. MACC1, a newly identified key regulator of HGF-MET signaling, predicts colon cancer metastasis[J]. Nat Med, 2009,15(1):59-67.
[3] Burock S, Herrmann P, Wendler I, et al. Circulating metastasis associated in colon cancer 1 transcripts in gastric cancer patient plasma as diagnostic and prognostic biomarker[J]. World J Gastroenterol, 2015,21(1):333-341.
[4] Huang Y, Zhang H, Cai J, et al. Overexpression of MACC1 and its significance in human Breast Cancer Progression[J]. Cell Biosci, 2013,3(1):16.
[5] Ji D, Lu ZT, Li YQ, et al. MACC1 expression correlates with PFKFB2 and survival in hepatocellular carcinoma[J]. Asian Pac J Cancer Prev, 2014,15(2):999-1003.
[6] Stein U, Smith J, Walther W, et al. MACC1 controls Met: what a difference an Sp1 site makes[J]. Cell Cycle, 2009,8(15):2467-2469.
[7] Xu ST, Ding X, Ni QF, et al. Targeting MACC1 by RNA interference inhibits proliferation and invasion of bladder urothelial carcinoma in T24 cells[J]. Int J Clin Exp Pathol, 2015,8(7):7937-7944.
[8] Wang Y, Hong Q, Wang J, et al. Downregulated expression of metastasis associated in colon cancer 1 (MACC1) reduces gallbladder cancer cell proliferation and invasion[J]. Tumour Biol, 2014,35(4):3771-3778.
[9] Sun L, Li G, Dai B, et al. Silence of MACC1 expression by RNA interference inhibits proliferation, invasion and metastasis, and promotes apoptosis in U251 human malignant glioma cells[J]. Mol Med Rep, 2015,12(3):3423-3431.
[10] Zhou X, Xu CJ, Wang JX, et al. Metastasis-associated in colon cancer-1 associates with poor prognosis and promotes cell invasion and angiogenesis in human cervical cancer[J]. Int J Gynecol Cancer, 2015,25(8):1353-1363.
[11] 華方方,夏永華,王慧玲,等.小干擾RNA沉默結腸癌轉移相關基因1的表達對宮頸癌SiHa細胞增殖細胞周期和侵襲能力的影響[J].中華腫瘤雜志,2014,36(7):496-500.
[12] Pawson T, Nash P. Assembly of cell regulatory systems through protein interaction domains[J]. Science, 2003,300(5618):445-452.
[13] Li SS. Specificity and versatility of SH3 and other proline-recognition domains: structural basis and implications for cellular signal transduction[J]. Biochem J, 2005,390(Pt3):641-653.
[14] Wang G, Kang M, Lu W, et al. MACC1: A potential molecule associated with pancreatic cancer metastasis and chemoresistance[J]. Oncol Lett, 2012,4(4):783-791.
Effects of MACC1 silencing on proliferation, apoptosis, and invasion of human ovarian cancer drug-resistant cell line
DENGYouxing1,SHIHuirong,LIXia,ZHANGRuitao
(1MaternalandChildHealthCareHospitalofZhengzhou,Zhengzhou450052,China)
Objective To observe the proliferation, apoptosis, and invasion changes of human ovarian cancer drug-resistant cell line after metastasis-associated in colon cancer-1 (MACC1) silencing by using gene silencing technique and its possible mechanism. Methods The human ovarian cancer drug-resistant SKOV-3/DDP cells were divided into the empty plasmid group and the transfection group, which were transfected with p-super-EGFP and p-super-EGFP-MACC1 shRNA. In addition, the untreated SKOV-3/DDP cells were taken as the control group. The expression of MACC1 mRNA was detected by RT-PCR,Western blotting was used to detect the expression of MACC1 protein, MTT assay was used to detect cell proliferation, flow cytometry was used to detect the apoptosis, the adhesion test was used to detect the adhesion of cells in vitro, Transwell chamber was used to detect cell invasion, and the protein expression of C-met, ERK1/2 and p-ERK1/2 was detected by Western blotting.Results Compared with the blank control group and empty plasmid group, the MACC1 mRNA and protein levels were lower, the proliferation ability decreased at 48 and 72 h, apoptosis rate increased, the adhesion and invasion abilities increased, the expression of C-met, p-ERK1/2, MMP-2, MMP-9, and Caspase-3 decreased, and the expression of cleaved caspase-3 protein increased in the transfection group (allP<0.05). There was no statistically significant difference between the blank control group and empty plasmid group (allP>0.05).Conclusion Silencing MACC1 gene inhibits the proliferation, adhesion, and invasion abilities of SKOV-3/DDP cells, and promotes apoptosis, which may be related to the inhibition of HGF/C-met and ERK1/2 pathway.
ovarian carcinoma; metastasis-associated in colon cancer-1; cell proliferation; apoptosis; cell invasion
鄧佑興(1987-),女,住院醫師,主要研究方向為婦科腫瘤。E-mail: dengyouxing1987@163.com
史惠蓉(1956-),女,主任醫師,主要研究方向為婦科腫瘤。E-mail: huirongshi2011@163.com
10.3969/j.issn.1002-266X.2017.26.006
R737.31
A
1002-266X(2017)26-0021-04
2017-02-18)

