3MA對Ce6-PDT誘導結腸癌SW620細胞凋亡及自噬的影響
楊楷楨,古麗努爾·阿卜杜熱合曼,羅夢雨,康玲(新疆醫科大學公共衛生學院,烏魯木齊830011)
?
·論著·
3MA對Ce6-PDT誘導結腸癌SW620細胞凋亡及自噬的影響
楊楷楨,古麗努爾·阿卜杜熱合曼,羅夢雨,康玲
(新疆醫科大學公共衛生學院,烏魯木齊830011)
目的 探討自噬抑制劑3-甲基腺嘌呤(3MA)對Ce6-PDT誘導結腸癌SW620細胞凋亡及自噬的影響。方法 取對數生長期SW620細胞,分為空白對照組、單純光照組、Ce6-PDT組和3MA-Ce6-PDT組,Ce6-PDT組加入不同濃度Ce6(0.125、0.25、0.5、1.0、2.0、4.0、8.0 μg/mL),3MA-Ce6-PDT組給予1.0 μg/mL的Ce6+5 mmol/mL的3MA。采用MTT法測算細胞存活率;AnnexinV-PE/7-ADD染色及羅丹明123聯合流式細胞儀檢測細胞凋亡率和細胞線粒體膜電位變化;吖啶橙染色聯合熒光顯微鏡觀察細胞自噬體形成;蛋白免疫印跡法檢測細胞凋亡相關蛋白Caspase-3、B細胞淋巴瘤/白血病基因-2(Bcl-2)及自噬相關蛋白LC3Ⅱ/Ⅰ表達。結果 Ce6-PDT組細胞存活率與Ce6濃度濃度呈負相關(r=-0.820,P<0.01),細胞凋亡率與Ce6濃度呈正相關(r=0.845,P<0.01)。選取細胞存活率和細胞凋亡率約為50%時Ce6濃度1 μg/mL為后續給藥濃度。在Ce6濃度達到1 μg/mL時,線粒體膜電位隨Ce6濃度增加而降低(P<0.01)。空白對照組和單純光照組幾乎沒有亮紅色熒光產生,Ce6-PDT組中有大量亮紅色熒光出現,3MA-Ce6-PDT組中出現亮紅色熒光的數量較Ce6-PDT組減少。與Ce6-PDT組相比,3MA-Ce6-PDT組細胞存活率降低、細胞凋亡率升高、自噬相關蛋白表達降低、凋亡相關蛋白表達增加(P均<0.05)。結論 Ce6-PDT可引起結腸癌SW620細胞發生凋亡和自噬,3MA會促進Ce6-PDT誘導的結腸癌細胞SW620凋亡。
結腸腫瘤;細胞自噬;細胞凋亡;光動力治療;二氫卟吩e6;3-甲基腺嘌呤
結腸癌晚期患者居多,治愈率低、轉移率及病死率高,目前缺乏有效的防治措施[1]。光動力療法(PDT)是一種新型的癌癥治療手段,應用特殊的光敏劑能靶向定位于生長異常的組織中,之后暴露于特定波長光源,產生活性氧物質,如單線態氧或其他自由基等,從而達到殺傷腫瘤細胞的一種潛在腫瘤治療方法[2]。自噬是發生于所有真核細胞中的一個進化上相對保守的過程,細胞可通過自噬分解部分受外界刺激而損傷的細胞器和非正常的蛋白質等,并通過各種方式循環后加以利用[3,4]。近年來研究發現,自噬與惡性腫瘤、遺傳性疾病及神經變性疾病等多種疾病有關[5]。研究資料顯示,自噬在PDT誘發腫瘤細胞死亡中起重要作用,但自噬在腫瘤發生發展過程中所扮演的角色及與細胞凋亡間的關系仍不明確[6]。2015年7月~2017年2月,我們通過分析Ce6-PDT誘導SW620細胞死亡過程中,是否會誘導細胞發生自噬,并通過自噬抑制劑3-甲基腺嘌呤(3MA) 的使用,初步探討Ce6-PDT誘導SW620細胞死亡中自噬對細胞凋亡的影響。
1 材料與方法
1.1 材料 光敏劑二氫卟吩e6(Ce6)購自美國Frontier Scientifici公司,細胞器探針(線粒體探針,溶酶體探針和內質網探針)均購自美國Life Technologies公司,噻唑藍(MTT),吖啶橙,羅丹明123和自噬抑制劑3MA購自美國Sigma公司。Annexin V-PE凋亡檢測試劑盒購自美國BD公司,Caspase-3、Bcl-2和LC3抗體購自美國CST公司。半導體激光儀購自西北大學光電子技術重點實驗室。
1.2 光敏劑準備、細胞培養及分組 將Ce6在避光條件下溶解于PBS緩沖液(pH=7.4)中,濃度為2 mg/mL,過濾除菌后-20 ℃避光保存備用。將人結腸癌細胞SW620培養于含1%青霉素-鏈霉素混合液、1 mmol/mL L-谷氨酰胺、10%胎牛血清的Leibovitz′s L-15培養基中,于CO2恒溫細胞培養箱中培養,待細胞生長至對數生長期時進行實驗。實驗分為空白對照組、單純光照組、Ce6-PDT組和3MA-Ce6-PDT組,Ce6-PDT組加入不同濃度Ce6(0.125、0.25、0.5、1.0、2.0、4.0、8.0 μg/mL)的無血清培養基饑餓培養12 h后進行光照,3MA-Ce6-PDT組加入含1.0 μg/mL的Ce6+5 mmol/mL的3MA無血清培養基饑餓培養12 h后進行光照。實驗中避光,各項實驗均遵循重復性原則。
1.3 光動力處理 將單純光照組、Ce6-PDT組和3MA-Ce6-PDT組細胞進行孵育,使用半導體激光儀垂直照射,光照波長650 nm,輸出功率32 mW,照射劑量6 J/cm2。
1.4 細胞存活率檢測 取對數生長期人結腸癌細胞SW620接種至96孔培養板中,每孔200 μL,細胞密度為3×104/mL。細胞分組和干預同1.2,每孔加入20 μL MTT溶液(5 mg/mL,即0.5%MTT),37 ℃培養箱繼續培養4 h,終止培養,小心吸去孔內培養液,每孔加入150 μL二甲基亞砜溶液(DMSO),置搖床上低速振蕩5 min。于酶聯免疫檢測儀490 nm處測量各孔的光密度值(OD值)。細胞存活率=(實驗組OD值/對照組OD值-1)×100%。
1.5 細胞凋亡率檢測 取對數生長期人結腸癌細胞SW620接種至6孔培養板中,每孔2 mL細胞懸液,細胞密度為4×105/mL。細胞分組和干預同1.2,胰酶消化后收集各組細胞,用4 ℃預冷的PBS洗滌細胞2次,4 ℃ 1 000 r/min、離心5 min,每組細胞加入1×Binding Buffer 100 μL重懸細胞,取細胞懸液100 μL于5 mL流式管中,加入Annexin V/PE 5 μL和7-AAD 5 μL,混勻避光、室溫反應15 min,加入1×Binding Buffer 400 μL,混勻。流式細胞儀檢測細胞凋亡情況。
1.6 線粒體膜電位檢測 取對數生長期人結腸癌細胞SW620接種至6孔培養板中,每孔2 mL細胞懸液,細胞密度為4×105/mL。選取細胞存活率和細胞凋亡率約為50%時Ce6濃度1 μg/mL為后續給藥濃度。細胞分組和干預同1.2,胰酶消化后收集各組細胞,用4 ℃預冷的PBS洗滌細胞1次,4 ℃ 1 000 r/min、離心5 min,每組細胞加入100 μL羅丹明123染液(濃度為5 μg/mL)重懸細胞,避光、室溫反應30 min,4 ℃ 1 000 r/min、離心5 min,收集細胞,PBS洗滌細胞2次,應用流式細胞儀檢測線粒體膜電位。
1.7 細胞自噬檢測 取對數生長期人結腸癌細胞SW620接種至6孔培養板中,每孔2 mL細胞懸液,細胞密度為4×105/mL。細胞分組和干預同1.2,將6孔培養板內原培養基棄去,加入PBS緩沖液漂洗細胞2次,每孔加入2 mL吖啶橙染液(濃度為5 μg/mL),避光、室溫反應20 min后棄去6孔板內吖啶橙染液,每孔再重新加入1 mL PBS緩沖液,分別用倒置熒光顯微鏡的藍光和紅光激發,選取合適的視野,觀察自噬小體并拍照。
1.8 凋亡相關蛋白Bcl-2和Caspase-3及自噬相關蛋白LC3表達檢測 消化離心后收集各組細胞,置于RIPA裂解液中裂解。采用BCA蛋白定量試劑盒進行蛋白質濃度的測定。取40 μg蛋白經SDS-PAGE凝膠電泳后,轉至PVDF膜,充分干燥。5%脫脂牛奶封閉1 h,一抗(LC3、Caspase-3、Bcl-2及GADPH,稀釋比例1∶1 000)孵育過夜,連接辣根過氧化物酶的二抗孵育(稀釋比例1∶5 000)后,ECL顯色發光定影,Image Lab軟件分析條帶灰度。

2 結果
2.1 Ce6-PDT對結腸癌細胞SW620存活率的影響 空白對照組、單純光照組、Ce6-PDT組(0.125、0.25、0.5、1.0、2.0、4.0、8.0 μg/mL Ce6)SW620細胞存活率分別為100%、84.08%、66.09%、61.83%、50.99%、46.40%、44.21%、40.08%、33.88%,Ce6-PDT組細胞存活率與空白對照組、單純光照組比較,P均<0.01。Ce6-PDT組SW620細胞存活率隨Ce6濃度的增加而降低,與Ce6濃度呈負相關(r=-0.820,P<0.01)。
2.2 Ce6-PDT對結腸癌細胞SW620凋亡的影響 空白對照組、單純光照組、Ce6-PDT組(0.125、0.25、0.5、1.0、2.0、4.0、8.0 μg/mL Ce6)細胞凋亡率分別為(3.70±1.45)%、(5.93±0.75)%、(10.90±3.98)%、(13.67±0.33)%、(30.47±6.38)%、(52.70±9.03)%、(64.70±3.64)%、(74.33±4.36)%、(72.55±3.75)%,Ce6-PDT組細胞凋亡率與空白對照組、單純光照組比較,P均<0.01。Ce6-PDT組SW620細胞凋亡率與Ce6濃度呈正相關(r=0.845,P<0.01)。
2.3 Ce6-PDT對SW620細胞線粒體膜電位的影響 空白對照組、單純光照組、Ce6-PDT組(0.125、0.25、0.5、1.0、2.0、4.0、8.0 μg/mL Ce6)線粒體膜電位分別為91.97±0.94、83.57±7.08、68.23±8.56、85.77±4.40、82.90±5.80、54.90±4.60、46.23±4.61、22.36±5.67、20.90±2.55,(1、2、4、8 μg/mL Ce6)Ce6-PDT組細胞線粒體膜電位與空白對照組、單純光照組比較,P均<0.01。
2.4 各組細胞凋亡相關蛋白Bcl-2和Caspase-3表達比較 見表1。
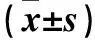
表1 各組細胞凋亡相關蛋白Caspase-3、Bcl-2蛋白表達比較
注:與空白對照組比較,*P<0.05。
2.5 Ce6-PDT對SW620細胞自噬的影響 空白對照組和單純光照組幾乎無亮紅色熒光產生,而Ce6-PDT組隨著Ce6濃度增加,出現越來越多的亮紅色熒光。空白對照組、單純光照組、Ce6-PDT組(0.125、0.25、0.5、1.0、2.0、4.0、8.0 μg/mL Ce6)自噬相關蛋白LC3表達量分別為0.45±0.06、0.49±0.02、0.62±0.03、0.77±0.01、0.82±0.05、0.92±0.03、1.10±0.04、1.20±0.06、1.26±0.03,Ce6-PDT組與空白對照組相比,P均<0.05。
2.6 自噬抑制劑3MA聯合Ce6-PDT對SW620細胞自噬的影響 空白對照組和單純光照組中幾乎無亮紅色熒光出現,Ce6-PDT組中有大量亮紅色熒光出現,3MA-Ce6-PDT組中出現亮紅色熒光的數量較Ce6-PDT組減少。空白對照組、單純光照組、Ce6-PDT組、3MA-Ce6-PDT組LC3蛋白表達量分別為1.43±0.03、1.57±0.03、2.88±0.01、0.80±0.36,3MA-Ce6-PDT組與Ce6-PDT組相比,P<0.05。
2.7 自噬抑制劑3MA聯合Ce6-PDT對SW620細胞存活率和凋亡的影響 單純光照組、3MA-Ce6-PDT組與Ce6-PDT組細胞存活率分別為85.67%、52.93%、38.39%,三組間兩兩比較,P均<0.05。空白對照組、單純光照組、3MA-PDT組與Ce6-PDT組細胞凋亡率分別為1.6%、7.6%、37.0%、70.7%。3MA-PDT組與Ce6-PDT組比較,P<0.05。空白對照組、單純光照組、3MA-PDT組與Ce6-PDT組凋亡相關蛋白Bcl-2的表達量分別為0.53、0.64、0.56、1.02。凋亡相關蛋白Caspase-3的表達量分別為0.29、0.83、1.25、2.80。與Ce6-PDT組相比,3MA-Ce6-PDT組Bcl-2、Caspase-3蛋白表達均增加(P均<0.05)。
3 討論
PDT是一種新興的姑息治療腫瘤方法,利用光敏劑特異結合腫瘤細胞的性質,加之適當波長光激活光敏劑產生具有殺傷作用的活性氧(ROS),從而達到治療腫瘤的目的。光敏劑定位于線粒體誘導凋亡的基本途徑:PDT引起線粒體應激反應,導致線粒體損傷,且引起線粒體內膜通透性增加,伴隨線粒體膜電位的下降及細胞色素C的釋放,最終致細胞發生凋亡[7]。凋亡早期表現是線粒體膜電位下降,一旦線粒體膜電位發生損耗,細胞則會進入不可逆的凋亡過程[8]。有研究[9]表明,PDT或聲動力療法可誘導腫瘤細胞發生凋亡,且大多涉及到線粒體相關途徑的凋亡。Bcl-2蛋白家族在線粒體凋亡調控中發揮重要作用。Bcl-2蛋白亞家族中Bax和Bak蛋白是促凋亡因子,相反Bcl-xL和Bcl-2蛋白則是抗凋亡因子[10]。在凋亡被激活時,部分定位于線粒體膜上的活化Bax由可溶性形式轉變為膜結合形式,導致細胞色素C的釋放和細胞凋亡,而Bcl-2則能抑制這些反應進程[11]。Caspase-3作為凋亡的關鍵性蛋白,其激活隨后會致PARP的裂解并致細胞凋亡。本研究發現,隨Ce6濃度的增加,細胞凋亡率隨之增加,同時在Ce6濃度達到1 μg/mL時,細胞線粒體膜電位逐漸降低;Western blotting檢測結果發現,Ce6濃度在0.125、0.25、0.5和1 μg/mL時,Bcl-2蛋白表達量比Caspase-3蛋白表達量高,而在Ce6濃度達2、4和8 μg/mL時,Bcl-2蛋白表達量比Caspase-3蛋白表達量低,同時線粒體膜電位檢測結果發現,在Ce6濃度為0.25和0.5 μg/mL時,線粒體膜電位的升高可能是Bcl-2蛋白表達升高所致。
自噬是自噬體的形成及與溶酶體融合從而導致細胞蛋白和胞質細胞器降解的一個動態過程,是一種新型的細胞死亡類型[12]。自噬與微管相關蛋白LC3的脂化相關。LC3參與自噬后期步驟后的隔離膜形成[13]。因此,LC3Ⅱ與LC3Ⅰ蛋白表達量的比值通常作為自噬的特異性指標。本研究結果發現,隨著Ce6濃度的增加,自噬體的數量逐漸增多,LC3Ⅱ/LC3Ⅰ值亦逐漸增加,我們推測Ce6-PDT可能會誘導結腸癌SW620細胞發生自噬。
自噬與凋亡間存在一個復雜的“cross-talk”,且二者存在諸多具有相同功能的調節蛋白。自噬可能延遲或拮抗細胞發生凋亡,從而抑制腫瘤細胞凋亡的發生,抑制自噬可能會提高腫瘤細胞對凋亡信號的敏感性。當自噬被3MA、LY294002或渥曼青霉素等自噬抑制劑所抑制時,可能會促進細胞發生凋亡。本研究發現,3MA-Ce6-PDT組細胞存活率比Ce6-PDT組低,而細胞凋亡率升高,Caspase-3蛋白表達增加同時Bcl-2蛋白表達增加,可見,自噬在Ce6-PDT誘導結直腸癌SW620細胞過程中起到抗凋亡從而保護細胞的作用。
綜上所述,Ce6-PDT可引起結腸癌SW620細胞發生凋亡和自噬,3MA會促進Ce6-PDT誘導的結腸癌細胞SW620凋亡。
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017,67(1):7-30.
[2] Kim JH, Park JM, Roh YJ, et al. Enhanced efficacy of photodynamic therapy by inhibiting ABCG2 in colon cancers[J]. BMC Cancer, 2015,15(2):504-512.
[3] Gottlieb RA, Mentzer RM Jr.Autophagy: an affair of the heat[J]. Heart Fail Rev, 2013,18(5):575-584.
[4] Dutta D, Xu J, Kim JS, et al. Upregulated autophagy protects cardiomyocytes from oxidative stress-induced toxicity[J]. Autophagy, 2013,9(3):328-344.
[5] 侯妮,劉娜,韓佳,等.3-MA通過抑制自噬反應提高結腸癌5-FU的化療效果[J].西安交通大學學報(醫學版),2016,37(1):50-53.
[6] Li J, Yang D, Wang W, et al. Inhibition of autophagy by 3-MA enhances IL-24-induced apoptosis in human oral squamous cell carcinoma cells[J]. J Exp Clin Cancer Res, 2015,34(1):97-109.
[7] Li KT, Chen Q, Wang DW, et al. Mitochondrial pathway and endoplasmic reticulum stress participate in the photosensitizing effectiveness of AE-PDT in MG63 cells[J]. Cancer Med, 2016,5(11):3186-3193.
[8] 石靜,卿晨.線粒體膜電位改變與細胞凋亡[J].中國民族民間醫藥,2014,7(13):20-21.
[9] Li Y, Wang P, Zhao P, et al. Apoptosis induced by sonodynamic treatment by protoporphyrin IX on MDA-MB-231 cells[J]. Ultrasonics, 2012,52(4):490-496.
[10] Gogvadze V, Orrenius S, Zhivotovsky B. Mitochondria as targets for chemotherapy[J]. Apoptosis, 2009,14(4):624-640.
[11] Wang X, Liu Q, Wang Z, et al. Role of autophagy in sonodynamic therapyinduced cytotoxicity in S180 cells[J]. Ultrasound Med Biol, 2010,36(11):1933-1946.
[12] Cassel M, de Paiva Camargo M, Oliveira de Jesus LW, et al. Involution processes of follicular atresia and post-ovulatory complex in a characid fish ovary: a study of apoptosis and autophagy pathways[J]. J Mol Histol, 2017,48(3):243-257.
[13] Li M, Gao P, Zhang JP. Crosstalk between autophagy and apoptosis: potential and emerging therapeutic targets for cardiac diseases[J]. Int J Mol Sci, 2016,17(3):332-350.
Effects of 3MA on apoptosis and autophagy of Ce6-PDT-induced colorectal cancer cells SW620
YANGKaizhen,Gulinuer·Abudureheman,LUOMengyu,KANGLing
(CollegeofPublicHealth,XinjiangMedicalUniversity,Urumqi830011,China)
Objective To investigate the effects of autophagy inhibitor 3-methyladenine (3MA) combined with Ce6-PDT on the apoptosis and autophagy of human colorectal cancer SW620 cells, and to provide theoretical and practical basis for autophagy inhibitors improving sensitivity of Ce6-PDT in treatment of colorectal cancer. Methods SW620 cells in the logarithmic phase were divided into the blank control group, negative control group, Ce6-PDT group, and 3MA-Ce6-PDT group. Cells in the Ce6-PDT group were treated with different concentrations of Ce6 (0.125, 0.25, 0.5, 1.0, 2.0, and 8.0 μg/mL), and cells in the 3MA-Ce6-PDT group were treated with 1.0 μg/mL Ce6 + 5 mmol/mL 3MA. Cell viability was detected by using MTT. The apoptosis and cell mitochondrial membrane potential changes were detected by using AnnexinV-PE/7-ADD and Rho123 combined with flow cytometry. Formation of autophagosome was observed by using fluorescence microscopy with Acridine orange staining. The expression of apoptosis-related proteins Caspase-3, B-cell lymphoma/leukemia-2 (Bcl-2) and autophagy-related protein LC3Ⅱ/Ⅰ was detected by Western blotting. Results In the Ce6-PDT group, the cell viability was negatively correlated with Ce6 concentration (r=-0.820,P<0.01); the apoptosis rate was positively correlated with the concentration of Ce6 (r=0.845,P<0.01); When the cell survival rate and apoptosis rate were 50%, 1 μg/mL Ce6 was taken as the concentration of the subsequent administration. When the Ce6 concentration reached 1 μg/mL, the mitochondrial membrane potential decreased with the increase of Ce6 concentration (P<0.01). There was almost no bright red fluorescence in the blank control group and the negative control group. There was a large amount of bright red fluorescence in the Ce6-PDT group. The number of bright red fluorescence in the 3MA-Ce6-PDT group was significantly lower than that in the Ce6-PDT group. Compared with the Ce6-PDT group, the cell viability decreased (P<0.05), the apoptosis rate increased (P<0.05), mitochondrial membrane potential decreased (P<0.05), the expression of autophagy-related protein decreased (P<0.05), and the expression of apoptosis-related protein increased in the 3MA-Ce6-PDT group (P<0.05). Conclusions Ce6-PDT induces the apoptosis and autophagy of colorectal cancer cells SW620. 3MA may promote the apoptosis of Ce6-PDT-induced colorectal cancer cells.
colonic neoplasms; cell autophagy; apoptosis; photodynamic therapy; chlorin e6; 3-methyladenine
新疆維吾爾自治區自然科學基金-醫學聯合基金項目(2014211C003)。
楊楷楨(1991-),男,碩士,主要研究方向為腫瘤的光動力防治。E-mail:1556394640@qq.com
康玲(1973-),女,副教授,主要研究方向為腫瘤的光動力防治。E-mail:540802213@qq.com
10.3969/j.issn.1002-266X.2017.25.001
R735.3
A
1002-266X(2017)25-0001-04
2017-04-15)

