植物激素對馬鈴薯試管苗生長的影響
何小謙,黃凱,李德明,王娟,李亞杰,王瑞英,羅磊,姚彥紅
(1.甘肅定西百泉馬鈴薯有限公司,甘肅定西743000;2.定西市農業科學研究院,甘肅定西743000)
植物激素對馬鈴薯試管苗生長的影響
何小謙1,2,黃凱2*,李德明2,王娟2,李亞杰2,王瑞英2,羅磊2,姚彥紅2
(1.甘肅定西百泉馬鈴薯有限公司,甘肅定西743000;2.定西市農業科學研究院,甘肅定西743000)
為研究不同種類植物激素對脫毒馬鈴薯試管苗促進壯苗的應用效果,以馬鈴薯品種‘定薯1號’、‘大西洋’、‘夏坡蒂’和‘費烏瑞它’為試驗材料,采用MS基本培養基、MS培養基上添加不同種類植物激素(吲哚乙酸(IAA),0.1 mg/L;6-芐氨基嘌呤(6-BA),0.1 mg/L;吲哚丁酸(IBA),0.1 mg/L)進行馬鈴薯試管苗的壯苗培育。在選出合適的植物激素后,再測試不同濃度植物激素(0.1,0.2,0.5和1.0 mg/L)對壯苗的影響。結果表明,IBA對促進壯苗效果最好。‘定薯1號’和‘費烏瑞它’試管苗促進壯苗最佳培養基為MS+1.0 mg/L IBA,而‘大西洋’和‘夏坡蒂’試管苗促進壯苗最佳培養基則為MS+0.5 mg/L IBA。
馬鈴薯;試管苗;植物激素;濃度
馬鈴薯(Solanum tuberosum L.)在種植過程中易受病毒侵染,病毒在塊莖內經過幾代積累可使品種的種性發生退化,嚴重影響馬鈴薯的產量、品質等性狀[1,2]。因此,要采取有效措施進行馬鈴薯種薯的脫毒處理,其最普遍方法為利用莖尖脫毒技術繁育試管苗[3-5],進行原原種生產,使種薯不攜帶或很少帶有病毒。但是,馬鈴薯試管苗隨著繼代次數的增加、繼代時間的延長和外源生長延緩劑在植物體內的累積,試管苗也會發生退化,影響試管苗的繁殖速度、移栽成活率和種薯的生產潛力[6-8]。本試驗從基本培養基入手,添加一定種類和濃度的植物激素,針對不同品種進行培養基的優化配比,尋找適宜不同品種試管苗生長的最佳濃度組合,旨在增加試管苗茁壯程度,減少幼苗在移栽過程中的死亡,提高對環境條件的適應性,為當地大面積種薯生產提供健壯組培苗。
1 材料與方法
1.1 試驗材料
1.1.1 供試材料
‘大西洋’、‘定薯1號’、‘夏坡蒂’和‘費烏瑞它’4個馬鈴薯品種試管苗。
1.1.2 培養基和培養條件
壯苗培養基:在MS培養基中添加0.1 mg/L吲哚乙酸(IAA)、6-芐氨基嘌呤(6-BA)、吲哚丁酸(IBA),尋找4個馬鈴薯品種壯苗適宜的激素類型,再設置濃度梯度,篩選出馬鈴薯試管苗壯苗的最佳培養基組合。
培養條件:溫度23~25℃,光照16 h/d,光照2 000~3 000 lx(光照/黑暗=16 h/8 h)。
1.2 試驗設計與方法
1.2.1 馬鈴薯試管苗壯苗激素的篩選
在MS培養基中分別加入0.1 mg/L IAA、0.1 mg/L IBA和0.1 mg/L 6-BA,以MS培養基作為對照,每瓶接種6個馬鈴薯莖段,每個處理5次重復,培養30 d后篩選出‘大西洋’、‘定薯1號’、‘夏坡蒂’和‘費烏瑞它’4個馬鈴薯品種各自的最佳壯苗激素種類。
1.2.2 馬鈴薯試管苗壯苗最佳激素的最佳濃度篩選
以MS作為基本培養基,并設置不同濃度梯度的馬鈴薯試管苗壯苗最佳激素。選擇健壯且長勢較齊的‘大西洋’、‘定薯1號’、‘夏坡蒂’和‘費烏瑞它’4個品種的馬鈴薯試管苗接種在培養基上,每瓶接種6個試管苗莖段,每個處理2次重復,培養30 d后找到最佳激素的最佳適用濃度。
1.2.3 數據處理
接種后30 d統計株高、莖粗、葉片數目等,計算平均株高、成活率和生根率。成活率=成活株數/接種株數,生根率=生根數目/接種株數。試驗數據采用Excel 2010和SPSS 17.0軟件處理,多重比較采用Duncan's新復極差法進行分析。
2 結果與分析
2.1 IBA、6-BA和IAA對馬鈴薯試管苗壯苗的影響
‘大西洋’試管苗在加有3種激素的培養基上植株長勢均優于對照(MS)處理。在IBA處理下效果最好,與其他處理之間均存在顯著差異;在6-BA和IAA處理下幼苗株高差異不顯著。‘定薯1號’在加有IBA的培養基上植株表現較好,與對照處理差異不顯著,在加有6-BA培養基上效果最差,與其他3種激素處理均存在顯著差異。‘夏坡蒂’試管苗長勢在加有IBA和IAA培養基處理下長勢較好,6-BA處理最差,各處理之間差異顯著。‘費烏瑞它’試管苗長勢在加有IBA的培養基上長勢最好,IAA處理下次之,6-BA處理與對照長勢相當,效果最差,二者之間差異不顯著,但與其余2個處理差異顯著(表1)。
‘定薯1號’試管苗在MS+(IBA或IAA)培養基上長勢較好,成活率在90%~98%,二者差異不顯著。‘費烏瑞它’試管苗在MS和MS+6-BA培養基上成活率在82%~88%,二者差異不顯著。‘大西洋’試管苗在MS+IBA培養基上成活率較高,在MS+ IAA培養基上成活率次之,二者相差9個百分點,差異顯著。‘夏坡蒂’試管苗在MS+IBA培養基上成活率為96%,與其他處理差異顯著,其他處理成活率同樣較高,在86%~88%,但差異不顯著(表2)。
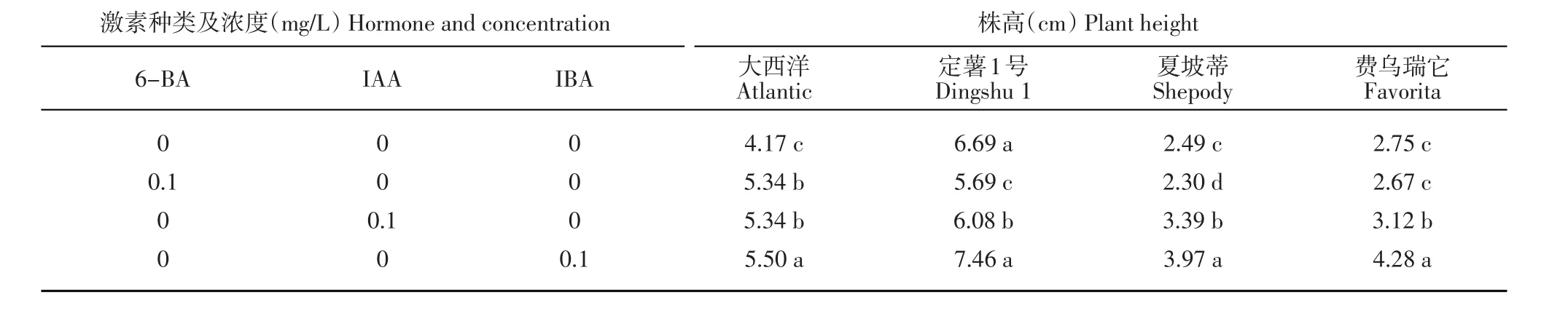
表1 不同激素種類對馬鈴薯試管苗株高的影響Table 1 Effects of different hormones on plant height of in vitro plantlets
‘定薯1號’試管苗在4種培養基上均表現出較高的生根率,各處理間差異不顯著。‘夏坡蒂’試管苗在MS+6-BA培養基上生根率為80%,相對較差,在其他3種培養基上生根率均達100%。‘大西洋’和‘費烏瑞它’試管苗在MS+(IBA或IAA)培養基上生根率均達100%,二者差異不顯著。‘大西洋’試管苗在MS和MS+6-BA培養基上生根率分別為60%和 58%,二者差異不顯著。‘費烏瑞它’試管苗在MS培養基上生根率為74%,與其他處理差異顯著(表3)。
綜上所述,‘大西洋’、‘定薯1號’、‘夏坡蒂’和‘費烏瑞它’馬鈴薯試管苗在MS和MS+(IAA,或IBA,或6-BA)4種培養基中,其試管苗的株高、成活率及生根率表現不同,但在MS+IBA處理下,各品種試管苗的生長情況均優于其他3個處理,因此,再對MS+IBA培養基設置梯度濃度,篩選出馬鈴薯試管苗壯苗的最佳培養基組合。
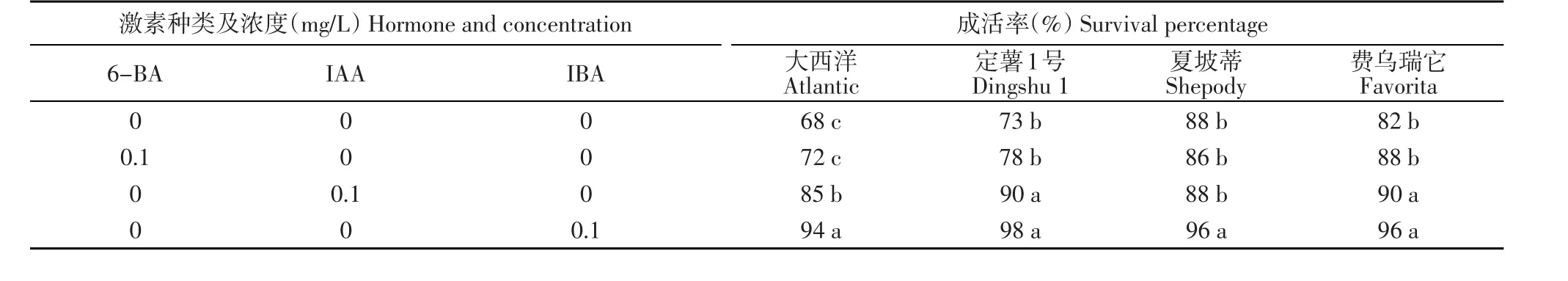
表2 不同激素種類對馬鈴薯試管苗成活率的影響Table 2 Effects of different hormones on survival percentage of in vitro plantlets
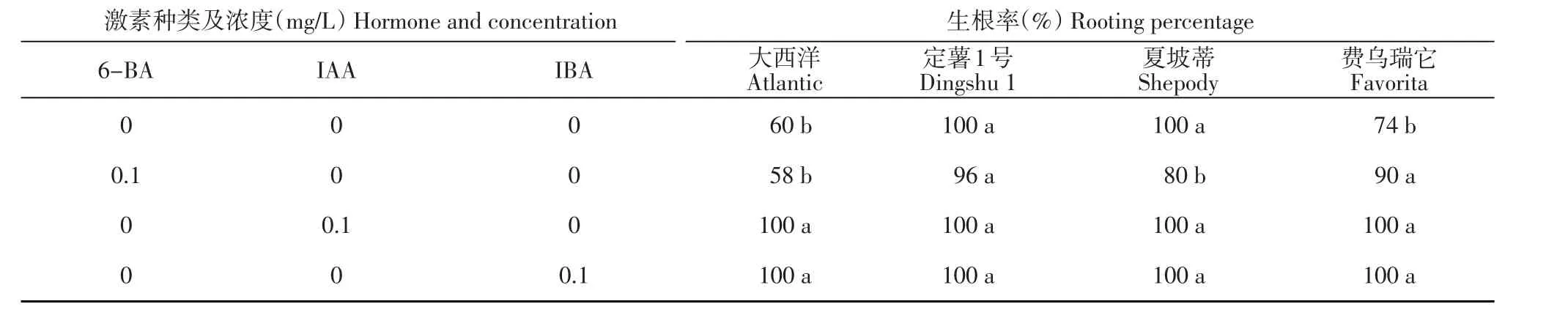
表3 不同激素種類對馬鈴薯試管苗生根率的影響Table 3 Effects of different hormones on rooting percentage of in vitro plantlets
2.2 不同濃度IBA對馬鈴薯試管苗壯苗的影響
‘大西洋’試管苗在MS+0.2 mg/L IBA培養基上幼苗長勢最高為4.22 cm,與各處理間差異顯著,MS+1.0 mg/L IBA處理次之,MS+0.1 mg/L IBA處理最差。‘定薯1號’在MS+0.1 mg/L IBA培養基上幼苗平均株高最大,其次為MS+1.0 mg/L IBA處理,但二者之間差異不顯著,幼苗長勢最差為MS+ 0.5 mg/L IBA處理,與其余處理之間均存在顯著性差異。‘夏坡蒂’試管苗在4種培養基上長勢較其他品種都比較弱,在MS+(0.2,0.5,1.0)mg/L IBA培養基上幼苗株高差異不顯著,但這3個處理與MS+ 0.1 mg/L IBA處理存在顯著差異。‘費烏瑞它’試管苗在MS+1.0 mg/L IBA培養基上平均株高最大,與其他處理差異顯著,其次是MS+(0.2,0.5)mg/L IBA培養基,二者之間差異不顯著,但與其他處理均存在顯著性差異(表4)。
‘大西洋’在MS+0.5 mg/L IBA的培養基上幼苗的平均莖粗最大為2.26 mm,其次為MS+0.1 mg/L IBA和MS+0.2 mg/L IBA,二者之間差異不顯著,當IBA濃度增加到1.0 mg/L時,試管苗平均莖粗反而減小,與其他處理差異顯著。‘定薯1號’在MS+0.1 mg/L IBA培養基上試管苗平均莖粗最大,達2.38 mm,在MS+(0.1,0.5,1.0)mg/L IBA處理下,差異不顯著,與MS+0.2 mg/L IBA處理存在顯著差異。‘夏坡蒂’在MS+0.1 mg/L IBA培養基上幼苗最粗,與其他處理差異顯著,隨著IBA濃度增加,試管苗的平均莖粗呈減小趨勢。對‘費烏瑞它’莖粗作用效果最好的是1.0 mg/L IBA,其次是0.5 mg/L,二者之間差異顯著,效果最差的為MS+(0.1,0.2)mg/L IBA,二者之間差異不顯著(表5)。

表4 不同IBA濃度對馬鈴薯試管苗株高的影響(cm)Table 4 Effects of different concentrations of IBA on plant height of in vitro plantlets
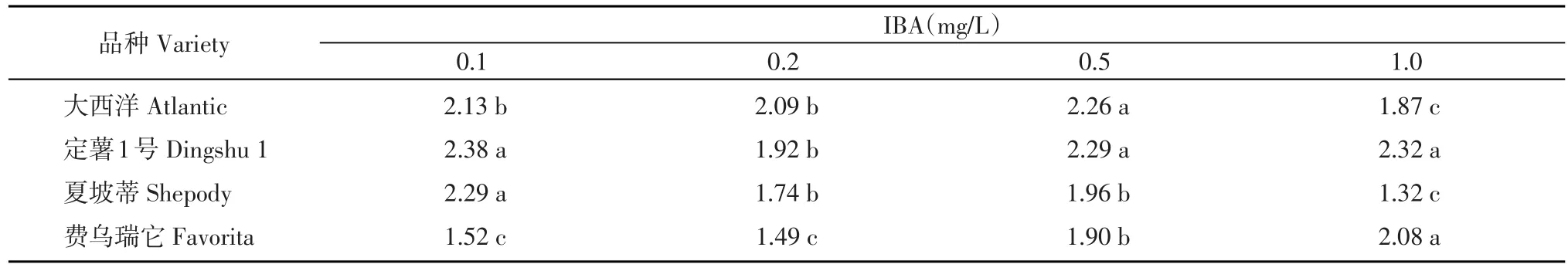
表5 不同IBA濃度對馬鈴薯試管苗莖粗的影響(mm)Table 5 Effects of different concentrations of IBA on stem diameter of in vitro plantlets
‘大西洋’試管苗在MS+0.5 mg/L IBA的培養基上葉片數最多,在MS+0.2 mg/L IBA的培養基上葉片數次之,二者之間差異不顯著,之后隨著IBA濃度的增加而減少。‘定薯1號’試管苗在MS+0.5 mg/ L IBA處理下葉片數最多,與MS+0.2 mg/L IBA和MS+1.0 mg/L IBA處理下葉片數差異不顯著,MS+ 0.1 mg/L IBA處理葉片數最少,與其他各處理之間均存在顯著差異。‘夏坡蒂’在IBA濃度為0.5 mg/L時葉片數目最多,0.2 mg/L時葉片數減少,但二者之間差異不顯著,在MS+1.0 mg/L IBA處理下葉片數最少。‘費烏瑞它’試管苗在MS+0.5 mg/L IBA處理下葉片數最多,與其他各處理均存在顯著差異,在MS+0.1 mg/L IBA和MS+0.2 mg/L IBA處理下,試管苗葉片數最少,二者差異不顯著(表6)。
‘大西洋’和‘費烏瑞它’試管苗在各IBA梯度濃度下,試管苗全部成活,成活率達到100%。‘定薯1號’試管苗成活率隨著IBA濃度的增加呈‘先增高后降低’的變化趨勢。‘夏坡蒂’在低IBA濃度下,試管苗成活率達100%,隨著IBA濃度的繼續增大,試管苗成活率反而降低(表7)。
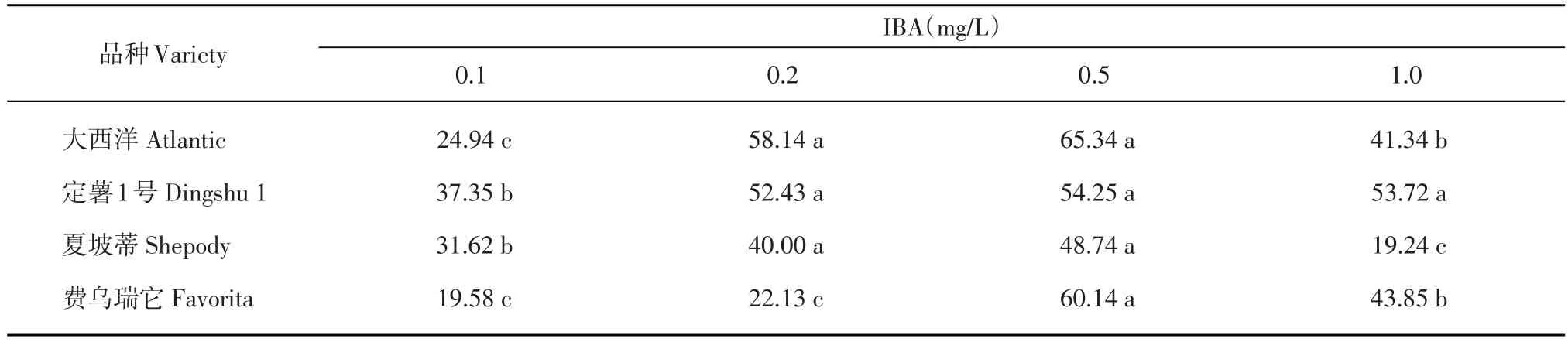
表6 不同IBA濃度對馬鈴薯試管苗葉片數的影響(片)Table 6 Effects of different concentrations of IBA on leaf numbers of in vitro plantlets(piece)

表7 不同IBA濃度對馬鈴薯試管苗成活率影響(%)Table 7 Effects of different concentrations of IBA on survival percentage of in vitro plantlets
3 討論
試管苗經過快繁培養后需要進行移栽,試管苗是否健壯直接影響移栽的成活率[9,10],試管苗根、莖、葉片的長勢直接反映試管苗的健壯程度,試管苗的株高、莖粗、葉片數目等都是重要的衡量指標。試管苗在不同處理下植株的株高、莖粗以及葉片數目存在明顯差異,前人的研究已得到證實。高新一和王玉英[11]認為在培養基中加入50 mg/L CCC、2~3 mg/L PP333、10 mg/L B9可使細弱的馬鈴薯組培苗變的粗壯,不影響試管苗繁殖的速度。彭峰等[12]認為不同激素NAA、IBA和GA及其組合可對組培苗不定芽生根與壯苗產生影響。據前人報道,不添加任何生長調節劑可以產生健壯的試管苗[13-15]。本試驗發現,在無任何植物激素的MS培養基上,試管苗確實可以長根,但是生根條數目少而短,根和植株均非常細弱,苗質差,當添加一定濃度的生長素后,平均根條數增加,根系粗壯,幼苗長勢較好,對生長更有利。在馬鈴薯試管苗壯苗試驗中,本試驗研究了單一因子IAA、IBA、6-BA對‘大西洋’、‘定薯1號’、‘費烏瑞它’和‘夏坡蒂’4個馬鈴薯品種試管苗壯苗的影響,結果表明,‘大西洋’試管苗壯苗最佳培養基為MS+0.5 mg/L IBA;‘定薯1號’試管苗壯苗最佳培養基為MS+1.0 mg/L IBA;‘夏波蒂’試管苗壯苗最佳培養基為MS+0.5 mg/L IBA;‘費烏瑞它’試管苗壯苗最佳培養基為MS+ 1.0 mg/L IBA。其他IBA濃度對試管苗壯苗培養的效果均不理想,而且植株有黃褐化、落葉現象。
[1]孫茂林.云南薯類作物的研究和發展[M].昆明:云南科技出版社,2003.
[2]吳林科,郭志乾,王曉瑜.優質馬鈴薯生產技術[M].銀川:寧夏人民出版社,2005.
[3]韋瑩.馬鈴薯組織培養及試管薯形成的研究[D].桂林:廣西大學,2007.
[4]張輔達,孫憲昀.馬鈴薯莖尖培養脫毒研究進展[J].中國馬鈴薯,2004,18(2):69-71.
[5]葉彥,繆樹華.長期繼代培養馬鈴薯愈傷的植株再生[J].應用與環境生物學報,1995,1(1):26-33.
[6]增田芳雄,勝見允行,今關英雅.植物激素[M].北京:科學出版社,1978.
[7]韓善華,鄭國昌.馬鈴薯幼莖(芽)愈傷組織的誘導和植株再生[J].試驗生物學報,1982,15(4):10-15.
[8]鄭萍,朱淑婉,王火旭,等.馬鈴薯脫毒試管苗促壯研究[J].北方園藝,2008,13(1):186-188.
[9]唐巍,楊映根,郭仲琛,等.馬鈴薯微型薯誘導的激素調節[J].應用與環境生物學報,1996,2(4):347-351.
[10]李娟,程智慧,張國裕.馬鈴薯葉片高效再生體系的建立[J].西北植物學報,2004,24(4):610-614.
[11]高新一,王玉英.植物無性繁殖實用技術[M].北京:金盾出版社,2003.
[12]彭峰,陳嫣嫣,郝日明,等.彩色馬蹄蓮組培苗壯苗生根及移栽措施研究[J].江蘇農業科學,2008,10(1):126-128.
[13]冉毅東,王蒂,戴朝曦.用組培法誘導試管微型薯的研究[J].馬鈴薯雜志,1991,5(4):194-196.
[14]Moe R,Fjeld T,Mortensen L M.Stem elongation and keeping quality in poinsettia(Euphorbia pulcherrima Willd)as affected by temperature and supplementary lighting[J].Scientia Horticulturae, 1992,33(5):127-136.
[15]Choveaux N A,Staden J V.The effect of 1-napthalene acetic acid on the endogenous cytokinin content of aseptically cultured bark segments of Salix babylonica[J].Plant and Cell Physiology,1981, 22(7):1207-1214.
Effect of Plant Hormone on Growth of in vitro Plantlets of Potato
HE Xiaoqian1,2,HUANG Kai2*,LI Deming2,WANG Juan2,LI Yajie2,WANG Ruiying2,LUO Lei2,YAO Yanhong2
(1.Gansu Dingxi Baiquan Potato Co.,Ltd.,Dingxi,Gansu 743000,China; 2.Dingxi Academy of Agricultural Sciences,Dingxi,Gansu 743000,China)
In vitro potato plantlets of'Dingshu 1','Atlantic','Favorita'and'Shepody'were inoculated into MS medium and MS media added with plant hormone of IBA(0.1 mg/L),6-BA(0.1 mg/L)and IAA(0.1 mg/L)to understand plant hormone effects on production of robust in vitro plantlets.After identification of a specific plant hormone,the plant hormone was tested again at various levels of 0.1,0.2,0.5 and 1.0 mg/L for their effects on the growth of in vitro plantlets.IBA had the best effect.The optimal medium for the growth of in vitro plantlets of'Dingshu 1'and'Favorita' was MS+1.0 mg/L IBA,while for'Atlantic'and'Shepody'MS+0.5 mg/L IBA was optimal.
potato;in vitro plantlet;plant hormone;concentration
S532
B
1672-3635(2017)04-0201-05
2016-01-18
甘肅省科技重大專項(1502NKDA003);甘肅省農業科學院院地科技合作項目(2014GAAS08);現代農業產業技術體系專項資金(CARS-10)。
何小謙(1960-),男,推廣研究員,主要從事馬鈴薯脫毒種薯繁育及示范推廣工作。
黃凱,研究實習員,主要從事馬鈴薯育種研究。E-mail:455182499@qq.com。

