30 209例舒血寧注射液安全性醫院集中監測研究
姜俊杰+謝雁鳴 張寅+黎明全 趙玉斌+溫澤淮 李學林 易丹輝+張一開
[摘要]為獲得杏雪舒血寧注射液的不良反應特征及發生率等安全性信息,采用多中心、大樣本醫院集中監測的設計方法,在全國27家醫療機構中,以使用舒血寧注射液的住院患者為研究對象,進行用藥周期的全程監測。監測主要內容為患者的一般信息、診斷信息、用藥信息、不良事件信息。結果共納入使用舒血寧注射液的患者30 209例,發生不良反應34例,不良反應發生率0113%,屬于偶見不良反應。不良反應發生特征為頭痛、頭暈、皮膚瘙癢、心悸、惡心等。基于以上結果,說明杏雪舒血寧注射液的安全性良好。
[關鍵詞]舒血寧注射液; 醫院集中監測; 不良反應; 安全性
Intensive hospital monitoring of Shuxuening injection in 30 209 cases
JIANG Junjie1, XIE Yanming1*, ZHANG Yin1, LI Mingquan2, ZHAO Yubin3, WEN Zehuai4,
LI Xuelin5, YI Danhui2, ZHANG Yikai6
(1 Institute of Basic Medical Sciences, Chinese Academy of Traditional Chinese Medicine, Beijing 100700, China;
2Affiliated Hospital of Changchun University of Traditional Chinese Medicine, Changchun 130618, China;
3Shijiazhuang Hospital of Traditional Chinese Medicine, Shijiazhuang 052560, China;
4Guangdong Province Traditional Chinese Medical Hospital, Guangzhou 511740, China;
5The First Affiliated Hospital of Henan University of Traditional Chinese Medicine, Zhengzhou 452486, China;
6 College of Statistics, Renmin University of China, Beijing 100872, China)
[Abstract] In order to obtain the characteristics and incidence of adverse reactions of Shuxuening injection (Xingxue), the design method of a multicenter, large sample intensive monitoring in the hospitals was adopted The hospitalized patients with use of Shuxuening injection from 27 medical institutions were enrolled as the research subjects to monitor their entire process of treatment cycle The main content of monitoring included the patients general information, diagnostic information, medication information, and adverse event information A total of 30 209 patients with Shuxuening injection were enrolled; adverse reactions occurred in 34 cases, with an incidence of 0113%, which belonged to the rare adverse reactions Adverse reactions were characterized by headache, dizziness, pruritus, palpitations, nausea, et al All the above results showed that Xingxue Shuxuening injection had high safety in clinical application
[Key words]Shuxuening injection; intensive hospital monitoring; adverse reactions; safety
杏雪舒血寧注射液(以下簡稱“舒血寧”)的成分是銀杏葉提取物,功能是擴張血管、改善微循環,可用于缺血性心腦血管疾病,冠心病、心絞痛、腦栓塞、腦血管痙攣等。關于舒血寧注射液的安全性問題,既往諸多學者進行了安全性文獻分析、回顧性分析等[12]。文獻分析及不良反應被動監測數據分析,均可發現舒血寧的不良反應信號,但均有一定的局限性,來源于多個文獻的數據質量參差不齊,無法獲得較為準確的不良反應(adverse reaction,ADR)數據。被動監測數據分析無法計算ADR發生率,且存在低報、漏報的缺點。然而,大樣本醫院集中監測研究可獲取舒血寧注射液全部用藥患者信息及發生不良反應患者信息,可計算ADR發生率,并得出不良反應發生特征,因此,本研究基于多中心、大樣本的醫院集中監測設計方法,在全國27家醫療機構進行舒血寧注射液醫院集中監測研究,為舒血寧注射液安全合理用藥提供科學依據。endprint
1資料與方法
11監測設計本研究為多中心、大樣本、醫院集中監測的設計方法。
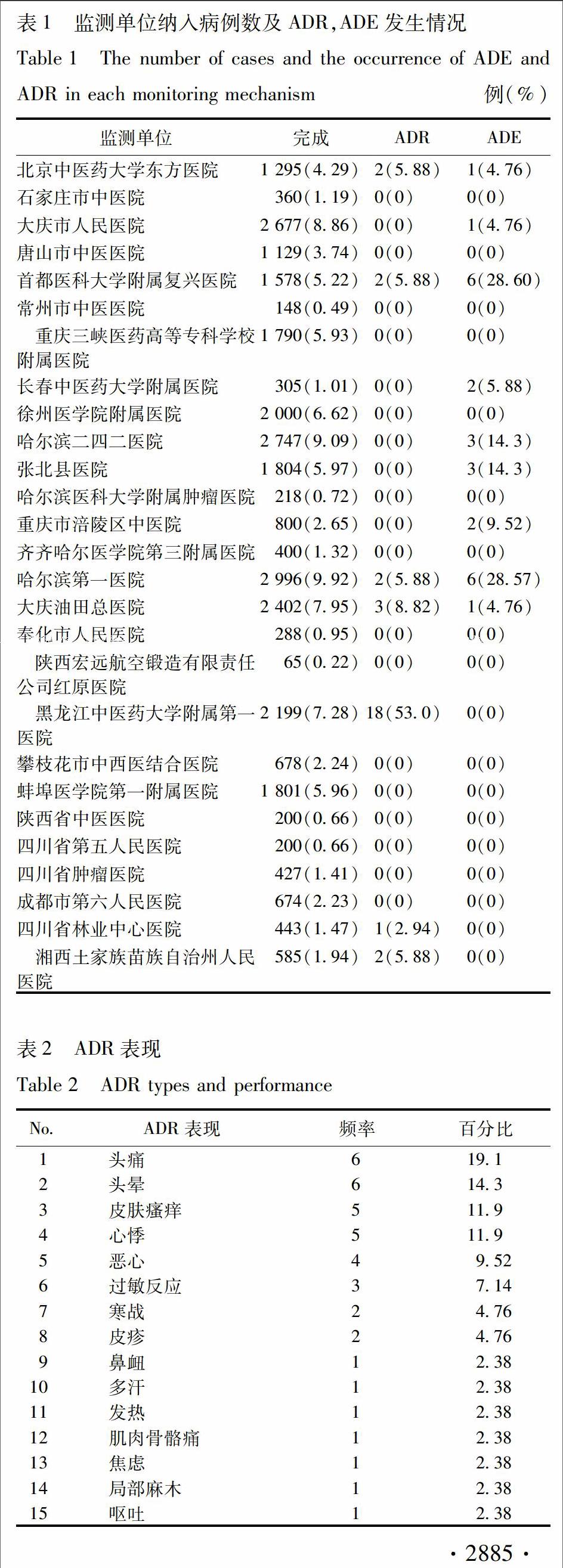
12監測機構本研究在全國共設有27家監測機構,其中,北京中醫藥大學東方醫院為負責單位,其余26家為監測參加單位,包括石家莊市中醫院、大慶市人民醫院、唐山市中醫醫院、首都醫科大學附屬復興醫院、常州市中醫醫院、重慶三峽醫藥高等專科學校附屬醫院、長春中醫藥大學附屬醫院、徐州醫學院附屬醫院、哈爾濱二四二醫院等。
13監測對象2012年10月—2015年11月期間,在監測機構使用舒血寧注射液的住院患者。各監測醫院所使用的舒血寧注射液均是由黑龍江珍寶島藥業股份有限公司生產的不同批次產品。
14樣本量根據國際通用“三例原則”,監測前確定樣本量是3萬例。
15監測周期用藥期間全程觀察。
16監測形式及內容本監測的形式分為2種,一是由臨床醫師觀察,并由臨床醫師填寫監測表;二是由臨床醫師觀察,繼而將觀察結果上報藥師,由藥師填寫監測表。監測表分為A,B 2個表。A表包括一般信息、診斷信息、用藥信息、聯合用藥信息,每個病例均需填寫;B表是不良事件相關信息,發生不良事件的患者需要填寫。A,B表具體內容是:①一般信息:包括性別、年齡、生命體征、個人過敏史、家族過敏史等;②診斷信息:包括西醫診斷、中醫診斷、合并疾病;③用藥信息:包括舒血寧的使用方式、用藥天數、藥物劑量、溶媒、溶媒用量、注射室溫、配液放置時間、注射持續時間、滴速;④聯合用藥信息:合并用藥名稱、注射前使用的注射劑名稱、注射期間使用的注射劑名稱、注射后使用的注射劑名稱、注射前后是否沖管、注射前后是否更換輸液器。⑤不良反應/事件信息:不良反應/事件名稱、發生時間、癥狀、體征、臨床檢驗;不良反應/事件結果、轉歸、預后;懷疑藥品、溶媒、輸液器、并用藥品的名稱、批準文號、通用名、生產廠家、批號、用法用量、室溫等;關聯性評價結果等。
17質量控制質量控制主要從以下7個方面實施:監測中心、監測人員、監測進度、原始文件、電子數據、檔案管理、質量管理。其中,原始文件和電子數據是質量控制的重要內容。原始文件方面,主要是防止漏報病例以及監測表的填寫質量檢查。通過調取醫院信息系統數據中研究時間范圍內使用舒血寧的病例數,與實際登記例數相對照的方法,檢查是否有漏報情況。原始文件質量方面,通過與原始病歷對照溯源進行檢查,要求具備規范性、及時性、準確性、真實性。電子數據要求與紙質監測表內容一致。
18數據管理本研究的數據采集工具是監測表,并建立了專有網絡平臺數據庫,網址為wwwcrpcmcom。采用獨立雙人雙份數據錄入的形式,并由計算機執行差異校驗功能,解決錄入間的不一致。數據的現場核查主要指核對源數據(住院病歷)與監測表或電子數據的一致性。在收集數據結束之后,對所有數據進行整體核查與清理,包括清除重復數據、修改錯誤數據和疾病名稱、藥物名稱不標準的數據,繼而,鎖定數據庫,用于統計分析。
19不良反應因果判斷方法按照國家藥品不良反應監測中心2011年公布的《藥品不良反應報告和監測管理辦法》(衛生部第81號令),對不良反應、不良事件、嚴重不良反應進行判斷,并采用6級不良事件關聯性評價對不良事件與舒血寧的關聯性做出評價,包括肯定、很可能、可能、可能無關、待評價、無法評價。關聯性評價結果為待評價、無法評價的,結合臨床資料重新評價。最終,評價結果是肯定、很可能、可能的屬于不良反應,評價結果是可能無關的屬于不良事件。本監測采用三級不良反應判讀方法,首先是一級判讀,由監測者完成;其次是二級判讀,由監測機構不良反應判讀專家委員會完成;再次是三級判讀,由行業不良反應專家委員會完成。三級判讀后,確定舒血寧最終的不良反應及不良事件。
110倫理審查與國際注冊本監測已通過倫理審查,審查機構是中國中醫科學院中醫臨床基礎醫學研究所倫理委員會,倫理批件(201215)。并于美國臨床試驗注冊網wwwclinicaltrialsgov通過注冊,注冊號是NCT01752946。
111數據標準化由于監測數據來源于多家醫院,為便于分析,需要對數據庫的相關信息進行標準化。參照西醫《國際疾病分類標準編碼》(ICD10)疾病分類[3]對西醫診斷進行規范化;參照《中華人民共和國國家標準——中醫病證分類與代碼》(GB/T156571995)[4]對中醫診斷標準化;參照2015年《中國藥典》[5]對藥品名稱進行標準化;參照《WHO不良反應術語集》對不良反應/事件名稱及所屬系統進行標準化。
112統計方法對于計數資料,采用描述方法分析頻數及百分比;對于計量資料,采用分段描述頻數和百分比的方式,Excel輔助作圖。采用SAS 93進行統計分析。
2結果
21監測完成情況及ADR發生率本監測由27家單位參加,共納入30 209例使用舒血寧的病例,發生ADR 34例,ADE 21例,ADR發生率0113%。27家監測單位納入病例數及ADR,ADE發生情況見表1。
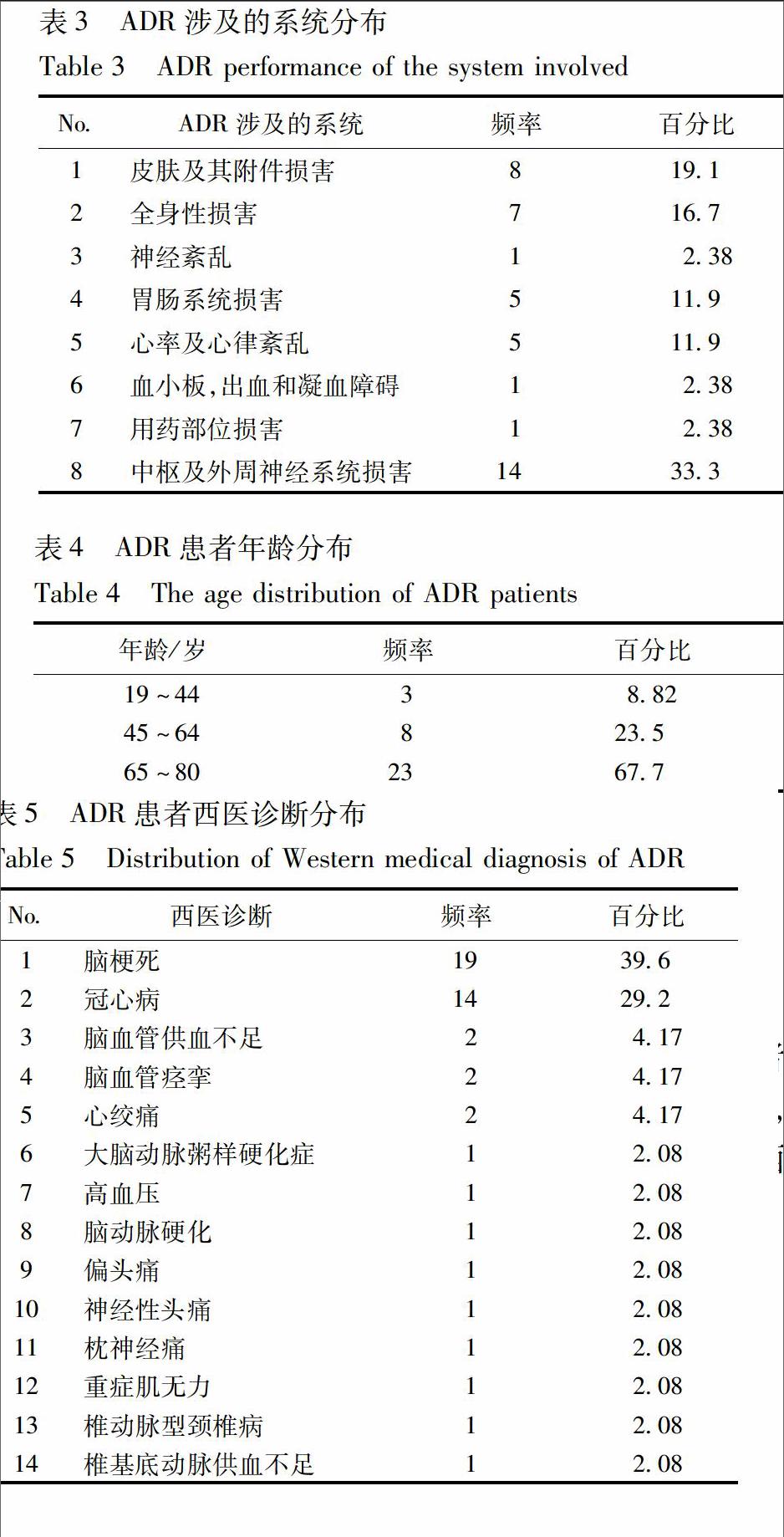
22ADR及ADE表現1個ADR病例可能有多種ADR或ADE表現,因此34例ADR病例發生了40例次,分別是頭痛、頭暈、皮膚瘙癢、心悸、惡心等,見表2。21例病例發生ADE 25例次,21例ADE的確定是經過不良反應的三級判讀,如19所述,發生原因是疾病的發展進程,或是合并用藥所致,與舒血寧用藥無關。ADE表現分別是心悸4例次、惡心4例次、頭痛2例次、頭暈2例次、死亡2例次、腹痛1例次、寒戰1例次、流感樣癥狀1例次、腦出血1例次、嘔吐2例次、皮疹1例次、上呼吸道感染1例次、手臂血管發紅1例次、胃功能紊亂2例次。ADR所涉及的系統包括皮膚及其附件損害、全身性損害等,見表3。
23年齡及性別34例ADR病例中,中老年人占多數,男性13例,女性21例。年齡分布見表4。endprint
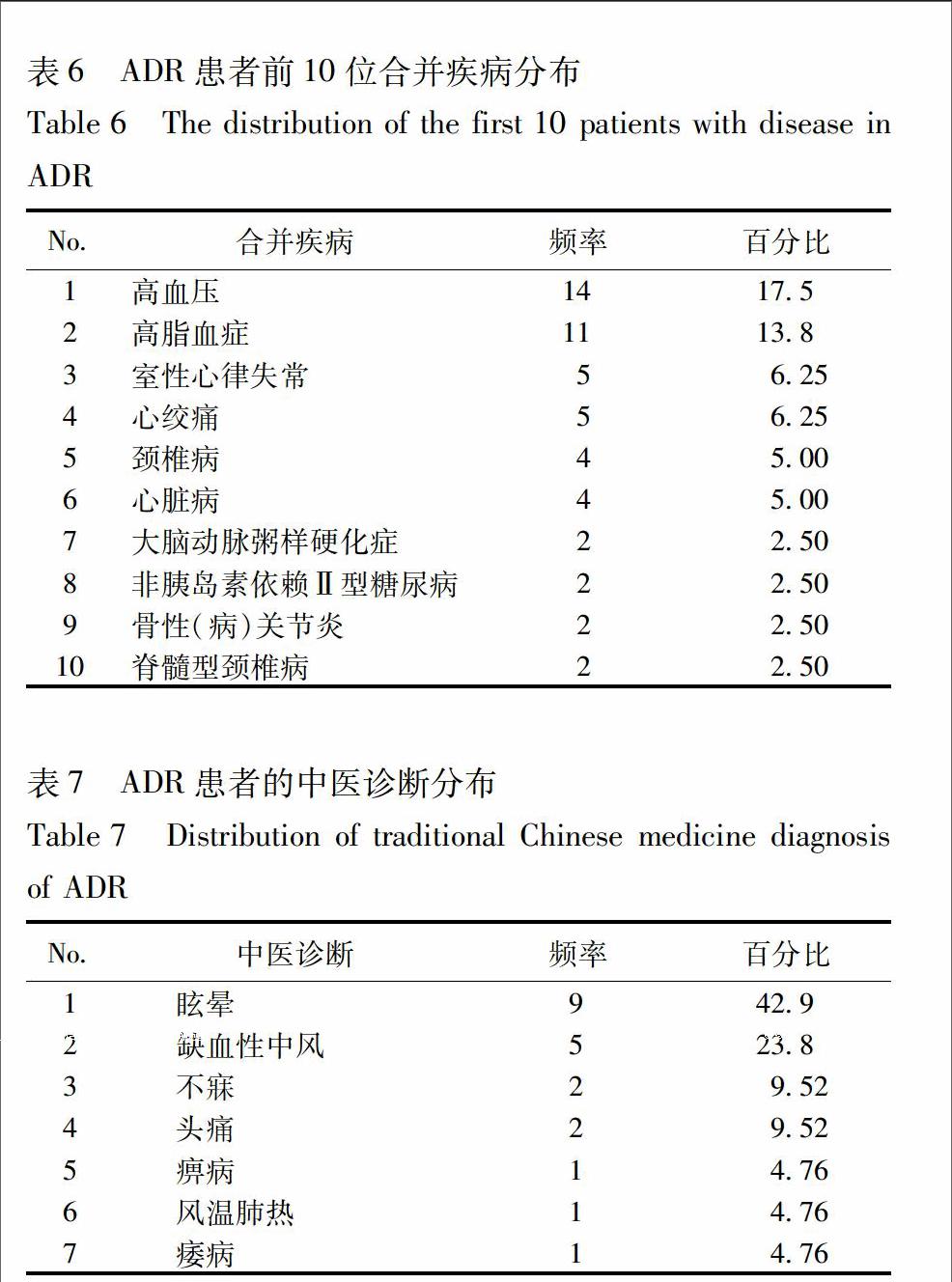
25中醫診斷34例ADR患者的中醫診斷是眩暈、缺血性中風、不寐、頭痛等分布見表7。
26過敏史34例發生ADR的患者中,21例無過敏史,13例有過敏史,過敏原均為藥物,包括青霉素類、磺胺類等西藥為主。
27舒血寧用藥特征34例發生ADR的患者中,使用舒血寧的用藥天數方面,1~2 d的11例,3~7 d 的9例,8~14 d 8例,14 d以上的6例;用藥方式均為靜脈滴注;溶媒方面,5%葡萄糖注射液20例,09%生理鹽水13例,果糖注射液1例,其他溶媒1例;溶媒用量方面,250 mL的16例,150 mL的15例,100 mL的2例,20 mL的1例;單次用藥劑量均為20 mL;注射室溫方面,25~26 ℃的8例,20~24 ℃的23例,20 ℃以下的1例;配液放置時間方面,0~10 min的24例,11~20 min的4例,21~45 min的6例;滴速方面,30滴/min以下的1例,30~40滴/min的28例,40~60滴/min的5例;注射前沖管的18例,未沖管16例;注射前均未更換輸液器;注射后沖管的18例,未沖管16例;注射后均未更換輸液器。
28合并用藥發生ADR的患者合并用藥紅花黃色素注射劑、腦蛋白水解物注射劑、天麻素注射劑等見表8。
3討論
本監測結果表明:30 209例使用舒血寧注射液的病例中,發生ADR 34例,不良反應發生率是113‰,屬于偶見不良反應,說明舒血寧注射液的安全性良好。34例ADR病例中,頭痛6例,頭暈6例,皮膚瘙癢5例,心悸5例,惡心4例,過敏反應3例等。引起不良反應可能的原因如下:①成分:舒血寧注射液主要成分是黃酮類化合物、白果總內酯、蛋白質、多肽、揮發油、酚酸類、色素、樹脂等[6],多為大分子致敏物質,進入人體后,可能作為抗原引發過敏反應。因此,要注意用藥期間的監測,發現問題及時解決。②患者機體情況:研究發現,發生ADR的患者年齡多為65~80歲的老年人。老年人由于肝腎功能減退,腎小球濾過率和腎小管分泌能力降低、腎血流量明顯減少而影響體內藥物的排泄,同時組織器官功能減退,靶器官對某些藥物作用的敏感性增高,且老年人存在原患疾病多、用藥多和營養欠佳的因素均能誘發ADR的發生,所以給老年人用藥應謹慎。③合并用藥:舒血寧的功能是擴張血管,改善微循環,本研究發現,發生ADR病例使用的合并用藥包括紅花黃色素注射劑、奧扎格雷鈉注射劑、舒血寧注射劑等,以上藥物與舒血寧的作用相近,分析出現不良反應的原因可能是藥理作用疊加。因此,功能相近的2種注射液應避免連用,如必須聯用,需根據患者的體質及疾病特點調整用藥劑量,避免使用高劑量,并做好用藥監護。以上影響因素的分析僅為可能的情況,若明確不良反應影響因素,仍需前瞻性的機制探討相關試驗加以驗證。
既往關于舒血寧不良反應的文獻報道眾多,其中,楊薇等[7]針對國家藥品不良反應監測中心2005年1月1日—2012年12月31日使用舒血寧后發生ADR的9 601 例報告進行的分析,采用了2種不同的統計方法進行ADR預警,報告率比例法探測到的ADR信號為頭暈、心悸、靜脈炎和嘔吐,貝葉斯置信傳播神經網絡法探測到的信號為頭暈和靜脈炎。陳紅玉等[8]對2015年10月以前的舒血寧注射液安全性文獻做了系統分析,發現不良反應特征主要是頭暈、頭痛、惡心、腹脹、皮疹等。本研究結果與上述2種研究結果均顯示:舒血寧的不良反應特征是頭暈、頭痛等。另外,舒血寧注射液說明書中,不良反應中也記載了頭暈、頭痛等神經系統癥狀。因此,頭暈頭痛等神經系統癥狀可能是舒血寧注射液的主要不良反應表現。但從方法角度來看,楊薇等[7]采用的是國家自發呈報系統數據分析,該研究無法提供使用舒血寧的整體患者信息,沒有分母,不能計算不良反應發生率;陳紅玉等[8]采用的是文獻系統分析的方法,納入文獻方法學質量評價較低,可能存在選擇性偏倚。而本研究為前瞻性大樣本注冊登記式的醫院集中監測研究,可計算不良反應發生率,并且,獲得的安全性信息相對來說更為準確。
本研究亦存在一定的局限性。首先,在不良反應判讀方面,可能存在一定的低估問題。①漏報輕度不良反應:本監測為醫生或藥師主導的研究,因無法在用藥期間時刻觀察患者,可能會出現漏報輕度不良反應的情況;②低估實驗室指標異常情況:研究涉及的實驗室指標相對較少,有可能會低估實驗室檢查異常值方面的不良事件/反應;③無法觀測遠期不良反應:由于觀察僅限于用藥期間,并不涉及隨訪,因此,對于遠期產生的不良反應無法觀測到。其次,在偏倚控制中,本研究為非隨機抽樣,選取的研究醫院為舒血寧用量較大的醫院,可能存在一定的選擇性偏倚,無法代表廣泛人群;同時,由于門診患者較難得到相應的安全性數據,所以納入的門診患者較少,可能會造成一定的偏倚;另外,各監測醫院對ADR因果關系的判斷及輕重程度的判斷方面,因監測者知識結構的不同存在測量偏倚等。
綜上所述,通過前瞻性、大樣本、醫院集中監測研究,發現舒血寧注射液的安全性良好,不良反應特征為頭暈、頭痛、皮膚瘙癢、心悸、惡心等,不良反應發生率是113‰,屬于偶見不良反應,不良反應影響因素可能是舒血寧注射液的藥物成分、患者機體情況、合并用藥等。通過以上研究,獲得舒血寧注射液的安全性信息,以期為臨床安全合理用藥起到積極的提示作用。
[參考文獻]
[1]黃瑋舒血寧注射液致不良反應的文獻分析與評價[J]中國醫院用藥評價與分析,2015,15(3):407
[2]毛柳英,曹俊嶺,魯勁松,等1265例舒血寧不良反應回顧性分析[J]世界中西醫結合雜志,2016,11(3):352
[3]董景五疾病和有關健康問題的國際統計分類第1卷[M].北京: 人民衛生出版社,2008
[4]陳佑邦,潘筱秦,金棣生,等中醫病證分類與代碼[M]北京: 中國標準出版社,1995
[5]中國藥典一部[S]2015
[6]劉璐舒血寧注射液質量及化學成分研究[D]北京:北京中醫藥大學,2015
[7]楊薇,謝雁鳴,向永洋基于SRS數據的舒血寧注射液不良反應關聯分析[J]中國中藥雜志,2014,39(18):3616
[8]陳紅玉,謝雁鳴,廖星,等舒血寧注射液治療心血管疾病安全性的系統評價[J]中國中西醫結合雜志,2017,37(3):283
[責任編輯張燕]endprint

