微生態制劑對斷奶仔豬生長性能、器官重及其胃腸道發育的影響
李雪莉,王超,虞徳夫,丁立人,朱偉云,杭蘇琴
(南京農業大學消化道微生物研究室,江蘇 南京 210095)
微生態制劑對斷奶仔豬生長性能、器官重及其胃腸道發育的影響
李雪莉,王超,虞徳夫,丁立人,朱偉云,杭蘇琴*
(南京農業大學消化道微生物研究室,江蘇 南京 210095)
通過給蘇淮斷奶仔豬飼喂微生態制劑(植物乳桿菌為主)研究其對斷奶仔豬生長性能、器官重及其胃腸道發育的影響,分析仔豬生長性能與器官重、小腸形態、腸道pH的相關性,探討微生態制劑緩解仔豬斷奶應激的可能機制。選取健康、胎次和體重相近[(9.34±0.33) kg]的144頭28日齡蘇淮斷奶仔豬,隨機分為對照組(基礎日糧)、抗生素組(基礎日糧+抗生素)、微生態制劑組(基礎日糧+微生態制劑),每組6個重復,每個重復8頭仔豬。預試期為3 d,試驗于32日齡開始,59日齡結束時屠宰采樣。結果表明,與對照組相比,微生態制劑可顯著提高斷奶仔豬平均日增重(ADG)和平均日采食量(ADFI)(P<0.05),降低料重比(F/G)和腹瀉率(P<0.05);顯著提高(P<0.05)斷奶仔豬脾臟相對重量;顯著增加斷奶仔豬十二指腸絨毛高度(P<0.05),顯著降低十二指腸、空腸、回腸絨隱比(P<0.05),十二指腸、空腸、回腸隱窩深度有下降趨勢,但差異不顯著(P>0.05);顯著降低(P<0.05)斷奶仔豬盲腸、結腸pH。與抗生素組相比,微生態制劑組對各指標無顯著影響(P>0.05)。相關性分析顯示,ADG增加與肝臟相對重量增加顯著相關(P<0.05);ADFI增加與十二指腸和脾臟相對重量、回腸絨隱比增加顯著相關(P<0.05),與結腸和盲腸pH、回腸隱窩深度降低顯著相關(P<0.05);F/G降低與結腸相對重量增加呈顯著相關(P<0.05);腹瀉率下降與十二指腸相對重、脾臟相對重量、十二指腸和空腸絨隱比增加呈顯著相關(P<0.05)。由此看出,微生態制劑可通過增加器官重,改善腸道形態,降低胃腸道pH,提高斷奶仔豬生長性能、降低腹瀉率,緩解斷奶應激對仔豬的影響,該微生態制劑具有替代抗生素的潛力。
微生態制劑;斷奶仔豬;生長性能;相對器官重量;胃腸道發育
斷奶是養豬生產中的重要時期。此時,由于仔豬營養、免疫、生理等發生改變,易引起仔豬采食量、體重下降、嚴重腹瀉等臨床應激,影響仔豬生長和經濟效益[1],抗生素作為促進生長、預防疾病、降低死亡率的主要飼料添加劑廣泛應用于斷奶仔豬日糧中[2],但是近年來抗生素濫用造成細菌耐藥性、藥物殘留等問題日益嚴峻,嚴重危害人類健康。因此,尋找抗生素替代品越來越重要[3]。微生態制劑又稱為益生菌制劑、活菌制劑,可通過調節腸道微生物區系改善機體健康[4]。有報道指出,微生態制劑在改善動物生產性能、防止腹瀉等疾病方面具有促進作用,是抗生素最佳替代品之一[5]。Lee等[6]研究表明,日糧中添加枯草芽孢桿菌能夠改善斷奶仔豬生長性能。龔路峰等[4]研究表明,斷奶仔豬日糧中添加微生態制劑可顯著提高斷奶仔豬日增重和仔豬免疫力,降低料肉比和腹瀉率。然而,也有報道指出,斷奶仔豬日糧中添加益生菌對生長性能無顯著影響[7]。益生菌的種、屬及菌株間存在差異,不同菌株的特性、代謝產物、作用機理亦不同。因而,對每株潛在益生菌及相關產品進行深入研究是十分必要的[8]。因此,本研究旨在通過給斷奶仔豬日糧中添加微生態制劑(植物乳桿菌為主),研究其對斷奶仔豬生長性能、相對器官重、小腸形態及腸道pH的影響,通過分析斷奶仔豬生長性能與相對器官重、小腸形態、腸道pH的相關性,初步評價微生態制劑對仔豬斷奶應激的緩解作用,并為其在斷奶仔豬生產上的應用提供理論依據。
1 材料與方法
1.1 試驗設計和試驗飼糧
本試驗于2015年10-11月在江蘇省某豬場進行,選取體重相近[(9.34±0.33) kg],144頭28日齡蘇淮斷奶仔豬,隨機分為基礎日糧組(對照組),抗生素組(基礎日糧+200 mg/kg硫酸粘桿菌素+200 mg/kg恩拉霉素,純度均為10%),微生態制劑無抗組(基礎日糧+200 mg/kg植物乳桿菌為主的復合微生態制劑,有效活菌數為1×109CFU/g,購自山東寶來利來生物工程股份有限公司)。每組6個重復,每個重復8頭仔豬。試驗于仔豬32日齡開始,59日齡結束,共28 d。采集器官、組織、食糜等樣品,進行分析。仔豬斷奶后的日糧組成及營養水平見表1。試驗期間仔豬自由飲水、采食。按照豬場常規免疫、消毒程序飼養管理。
1.2 樣品采集與處理
器官樣品:仔豬屠宰后,分離肝臟、脾臟、胰臟、胃、小腸(十二指腸、空腸、回腸)、大腸(盲腸、結腸),吸掉血液,剔除脂肪后分別稱重,用于器官相對重量的分析。
食糜樣品:采集胃、十二指腸、空場、回腸、盲腸及結腸內容物,用于胃腸道pH值的測定。
腸道組織樣品:根據腸道組織學分區分離出十二指腸、空腸、回腸各腸段組織2 cm。生理鹽水沖洗腸內容物后,常溫固定于4%多聚甲醛中,經石蠟切片后,用于腸道組織形態學的分析。
1.3.1 體重和采食量 于28日齡及59日齡晨飼前以重復為單位對仔豬進行個體稱重,記錄給料量及剩料量,以計算平均日增重(average daily gain,ADG)、平均日采食量(average daily feed intake,ADFI)和料重比(feed/gain,F/G)F/G=[F/(Wt-W0)][9],Wt為試驗結束仔豬平均體重,W0為試驗開始仔豬平均體重,F為試驗期間飼料攝入量,G為試驗期間仔豬平均體增重。
1.3.2 腹瀉率 準確記錄每個重復仔豬每日腹瀉總頭數,每天每頭仔豬發生腹瀉為1頭次,每個重復腹瀉總頭次除以腹瀉仔豬頭數,算每個處理的平均值,即為試驗期各處理腹瀉率。腹瀉率(%)=[每重復仔豬總腹瀉頭次/(供試豬總頭數×試驗天數)][10]×100。
1.3.3 器官相對重量 于59日齡從對照組、微生態制劑組和抗生素組各重復隨機選擇1頭仔豬稱重后屠宰,分離所需器官分別稱重,計算器官相對重量。器官相對重量=[器官重量(g)/仔豬宰前活重(kg)][11]。
1.3.4 腸道組織形態測定 仔豬屠宰后,將各腸段結扎后分離,分別取處理后的相應腸段,切片,常規HE染色(南京奧青生物技術有限公司),選定合適視野計量仔豬十二指腸、空腸、回腸的絨毛高度,隱窩深度并計算絨隱比,每個指標測定3個重復。
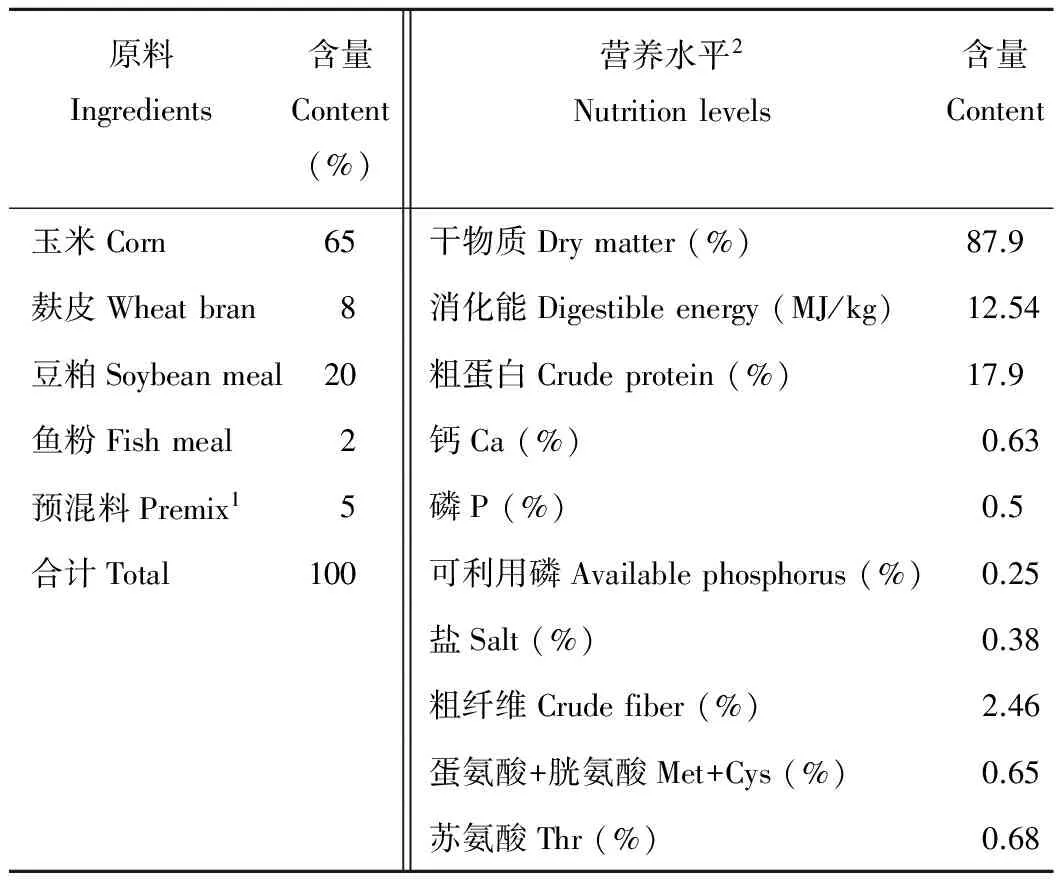
表1 基礎日糧組成及營養水平(飼喂基礎)
1每kg預混料中所含:維生素A 120 kIU,維生素D310 kIU,維生素E 400 IU,維生素K340 mg,維生素B150 mg,維生素B250 mg,維生素B630 mg,煙酸 500 mg,葉酸 15 mg,泛酸 250 mg,水分 10%,氯化鈉 8%~13%,氯化膽堿 5000 mg,鐵 1500 mg,銅 900 mg,錳 300 mg,鋅 1600 mg,碘 3.5 mg,硒 2.5 mg,鈣 10%~18%,總磷 2.0%,賴氨酸 0.56%。2營養水平為計算值。
1Per kg of premix contains: vitamin A 120 kIU, vitamin D310 kIU, vitamin E 400 IU, vitamin K340 mg, vitamin B150 mg, vitamin B250 mg, vitamin B630 mg, nicotinic acid 500 mg, folic acid 15 mg, pantothenic acid 250 mg,water 10%, NaCl 8%-13%, choline chloride 5000 mg, Fe 1500 mg, Cu 900 mg, Mn 300 mg, Zn 1600 mg, I 3.5 mg, Se 2.5 mg, Ca 10%-18%, TP 2.0%, lysine 0.56%.2 Nutrient levels were calculated values.
1.3.5 胃腸道pH測定 分離胃腸道,采集各腸段內容物, 使用Sartorius PB-21酸度計(德國, pH0~14)對胃、空腸、回腸、盲腸、結腸內容物pH進行測定,每個樣品測定3個重復。
1.4 統計分析
試驗數據經Excel 2007初步處理后,采用SPSS 20.0軟件中的單因素(One-way ANOVA)模型分析,Tukey S-B test比較差異顯著性,P<0.05為差異顯著。采用HemI 1.0.3.3軟件對生產性能與器官重、小腸形態及胃腸道pH進行相關性分析。
[12]Still,Pakistani economists disagree as to whether their country can fully take advantage of the opportunity.Some note that it is unclear whether the agreement will help Pakistan overcome a 50 percent trade imbalance with China.
2 結果與分析
2.1 微生態制劑對斷奶仔豬生長性能及腹瀉率的影響
與對照組相比,飼糧中添加微生態制劑可顯著增加(P<0.05)斷奶仔豬ADG、ADFI (表2),顯著降低(P<0.05)F/G和腹瀉率,抗生素組與微生態制劑組的ADG、ADFI、腹瀉率均無顯著差異(P>0.05)。
2.2 微生態制劑對斷奶仔豬器官相對重量的影響
與對照組相比,微生態制劑組和抗生素組可顯著提高(P<0.05)斷奶仔豬脾臟相對重量(表3),胃、十二指腸、空腸、回腸、盲腸、結腸、肝臟、腎臟、胰臟相對重量有增加的趨勢,但無顯著變化(P>0.05),與抗生素組相比,微生態制劑對各臟器影響均不顯著(P>0.05)。

表2 微生態制劑對斷奶仔豬生產性能及腹瀉率的影響
注: 同行數據后所標字母相異表示差異顯著(P<0.05),所標字母相同表示差異不顯著(P>0.05)。下同。
Note: Different letters in the same row mean significant differences between the treatments (P<0.05), same letters in the same row mean not significant differences between treatments (P>0.05). The same below.
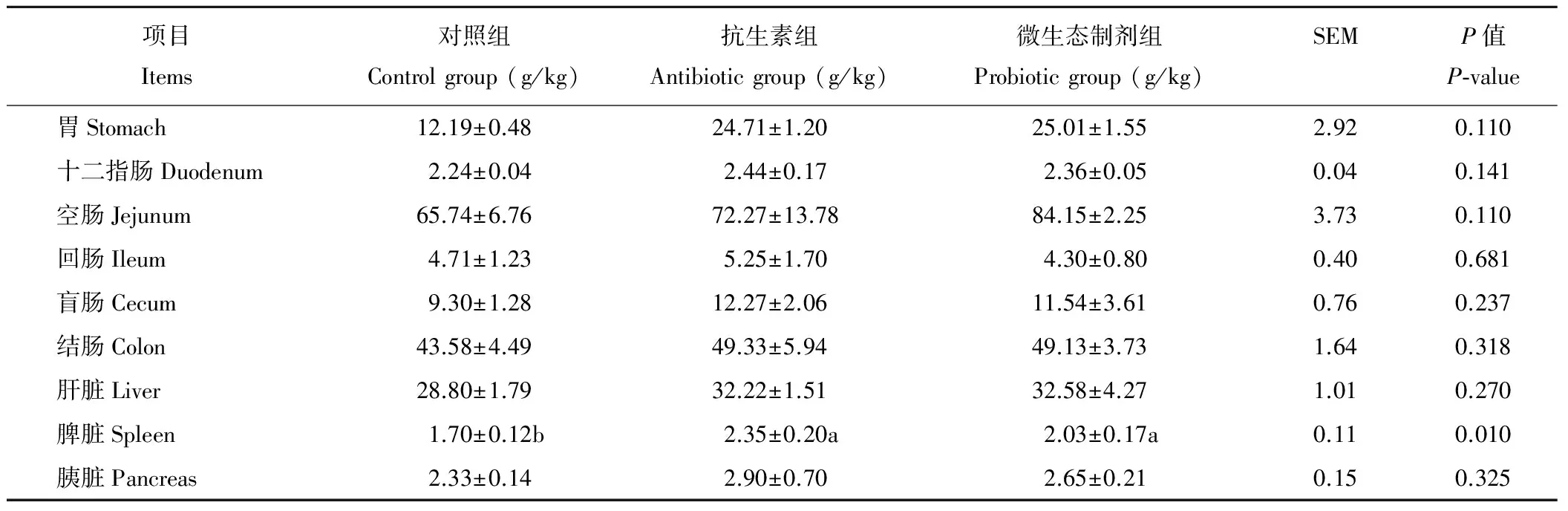
表3 微生態制劑對斷奶仔豬器官相對重量的影響
2.3 微生態制劑對斷奶仔豬小腸形態的影響
與對照組相比,微生態制劑組可顯著增加斷奶仔豬十二指腸絨毛高度(P<0.05),顯著提高十二指腸、空腸、回腸絨隱比(P<0.05),十二指腸、空腸、回腸的隱窩深度有下降趨勢,但差異不顯著(P>0.05),抗生素組可顯著提高空腸和回腸絨隱比(表4)。與抗生素組相比,微生態制劑組除仔豬十二指腸絨毛高度顯著增加(P<0.05)外,其他指標均無顯著變化(P>0.05)。
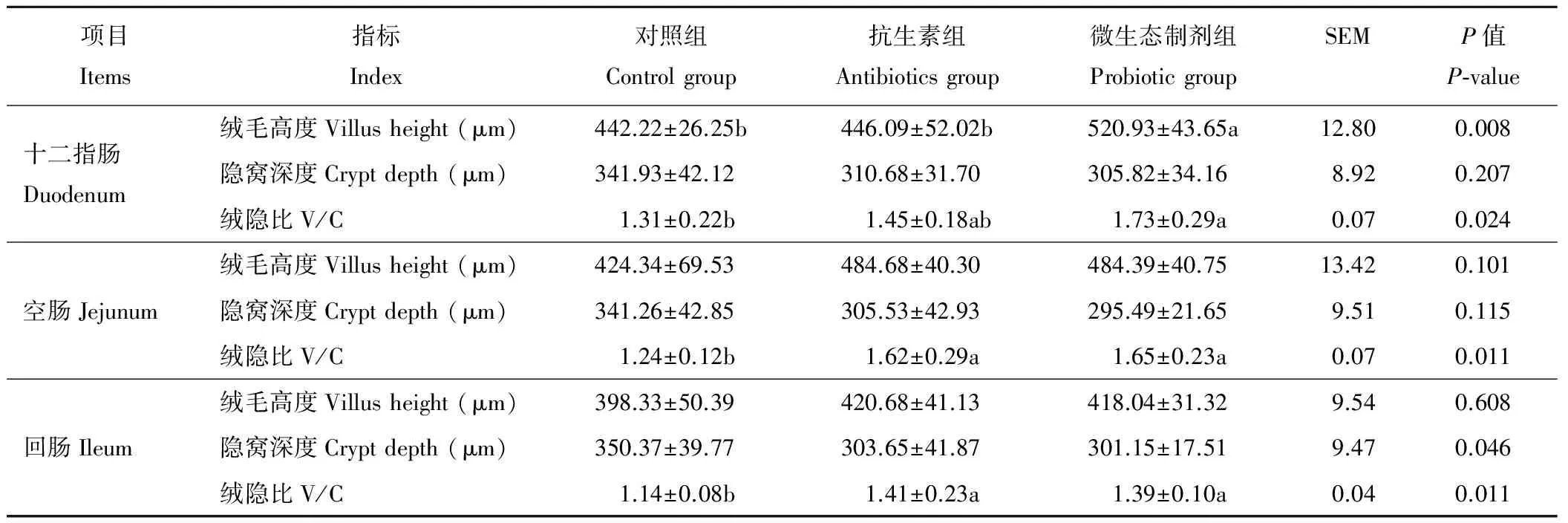
表4 微生態制劑對斷奶仔豬小腸形態的影響
2.4 微生態制劑對斷奶仔豬胃腸道pH的影響
與對照組相比,微生態制劑組可顯著降低(P<0.05)盲腸和結腸的pH(表5),胃、空腸、回腸pH有降低的趨勢,抗生素組可顯著降低盲腸pH(P<0.05),其中胃、空腸、回腸、結腸pH均有降低的趨勢(P>0.05)。與抗生素組相比,飼糧中添加微生態制劑對胃、空腸、回腸、盲腸、結腸pH均無顯著影響(P>0.05)。
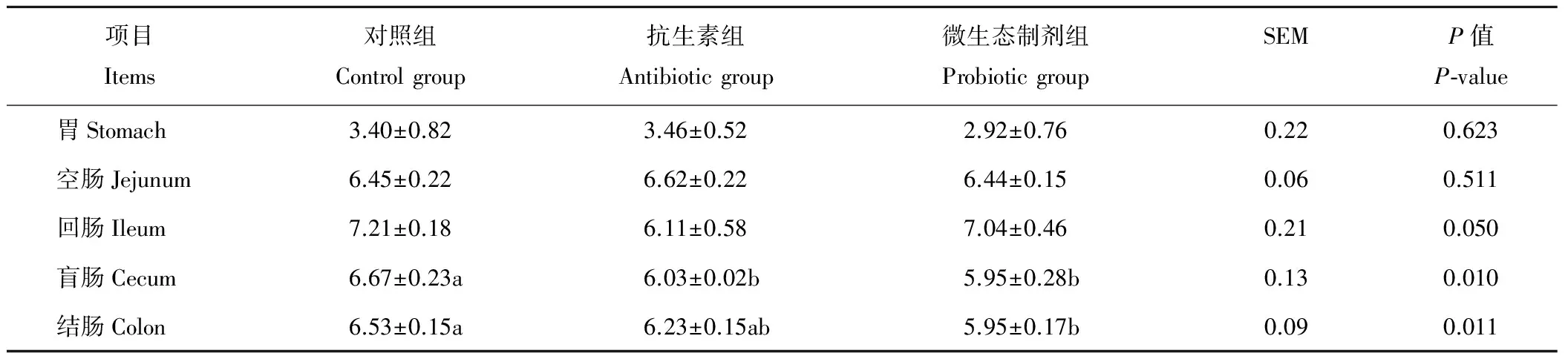
表5 微生態制劑對斷奶仔豬胃腸道pH的影響
2.5 仔豬生長性能與小腸形態變化、器官重、腸道pH的相關性
如圖1所示,飼糧中添加微生態制劑可顯著增加斷奶仔豬ADG、ADFI(P<0.05),顯著降低F/G和腹瀉率(P<0.05)。對仔豬生產性能與胃腸道pH、器官重、腸道形態變化(絨毛高度、隱窩深度、絨隱比)進行相關性分析發現,ADG增加與肝臟相對重量呈正相關(P<0.05);ADFI增加與十二指腸相對重量、回腸絨隱比、脾臟相對重量增加呈正相關(P<0.05),與結腸和盲腸pH、回腸隱窩深度降低呈負相關(P<0.05);F/G降低與結腸重呈負相關(P<0.05);腹瀉率下降與十二指腸相對重、脾臟相對重量、十二指腸和空腸絨隱比增加呈負相關(P<0.05)。
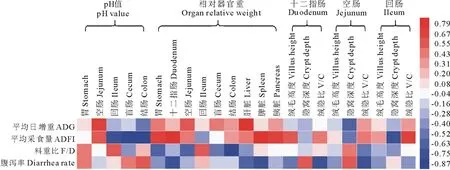
圖1 斷奶仔豬生長性能與相對器官重、小腸形態、胃腸道pH的相關性Fig.1 Correlation of the growth performance and organ relative weight gastrointestinal pH,small intestine morphology of weaned piglets
3 討論
3.1 微生態制劑對斷奶仔豬生產性能和腹瀉率的影響
本研究表明,飼糧中添加微生態制劑能顯著增加斷奶仔豬ADG、ADFI,顯著降低F/G、腹瀉率,說明微生態制劑能夠改善仔豬生長性能,降低腹瀉率。王國強等[12]報道指出仔豬斷奶1周,飼糧中添加0.10%微生態制劑可顯著提高日增重和飼料轉化率,降低斷奶仔豬腹瀉率及死亡率。Hu等[13]研究表明,日糧中添加枯草芽孢桿菌KN-42可有效地改善斷奶仔豬生產性能,降低腹瀉率。Zhao等[14]研究表明,日糧中添加1%的微生態制劑(羅伊氏乳桿菌和植物乳桿菌,有效活菌數1×109CFU/kg)可降低斷奶仔豬的腹瀉評分(降低腹瀉率)。Suo等[15]研究表明,日糧中添加植物乳桿菌ZJ316可降低斷奶仔豬腹瀉率。結合本試驗結果分析微生態制劑發揮促生長作用可能是通過改善腸道形態[16]、增加腸道有益菌的數量,減少有害菌的數量[17],從而改善動物健康。在本試驗中,抗生素與微生態制劑發揮相似的作用,其原因可能是抗生素通過控制動物的亞臨床感染,抑制不利于動物生長的微生物代謝,減少微生物對宿主養分競爭,使動物腸壁變薄、促進營養物質吸收[18]。
3.2 微生態制劑對斷奶仔豬器官相對重量的影響
脾臟是最大的周圍淋巴器官,是機體重要的免疫器官,主要通過自身大量免疫細胞分泌免疫抗體來參與體液和細胞免疫[19]。縣怡涵等[16]研究表明,日糧中添加植物乳桿菌和干酪乳桿菌可顯著增加35日齡仔豬脾臟等臟器的器官指數,而對胃腸道器官指數無顯著影響。王永等[20]研究發現,飼糧中添加屎腸球菌可顯著提高斷奶仔豬脾臟重量和脾臟指數,但對肝臟無顯著影響。本研究結果與之相似。本試驗發現,微生態制劑組可顯著增加斷奶仔豬脾臟相對重量,該處理組對肝臟及胃腸道器官相對重量均無顯著影響。這說明微生態制劑可促進仔豬脾臟的發育,其原因可能是微生態制劑所含益生菌株通過合成維生素、氨基酸、有機酸、醇類等物質,促進免疫器官的發育,而作為良好的免疫激活劑,微生物可促進免疫器官生長發育[21]。抗生素組較微生態制劑組脾臟相對重量有下降趨勢,但差異不顯著,其原因可能是抗生素通過抑制免疫反應,從而抑制免疫器官發育[22],其具體原因仍需深入研究。為了研究相對器官重增加與微生態制劑改善生產性能是否有關,對其進行了相關性分析,結果表明,脾臟相對重量的增加與ADFI增加呈正相關、與腹瀉率的下降呈負相關,肝臟相對重量的增加與ADG的增加呈正相關。
3.3 微生態制劑對斷奶仔豬小腸形態的影響
小腸是機體營養物質消化吸收的主要場所。Yang等[23]研究表明植物乳桿菌能夠顯著改善EscherichiacoliK88攻毒造成十二指腸、空腸絨毛高變短、隱窩深度增大等腸粘膜損傷的問題。Suo等[15]研究表明植物乳桿菌可改善斷奶仔豬十二指腸、空腸和回腸的形態結構。本研究顯示,日糧中添加微生態制劑可顯著增加十二指腸絨毛高度以及十二指腸、空腸、回腸絨隱比,與抗生組相比,微生態制劑組顯著提高十二指腸絨毛高度,說明微生態制劑可促進小腸對營養物質的吸收。其機制可能與益生菌能夠保護腸道結構、改善腸道功能以及促進腸道上皮細胞更新、改善微生態區系有關[16]。而抗生素對腸道形態的影響可能與其能夠增加斷奶仔豬采食量、減少腸道內有害細菌和毒素(氨、胺和某些揮發性脂肪酸等),降低腸道免疫激活和腸壁炎癥的發生有關[24]。為研究小腸形態改變與微生態制劑改善生產性能是否相關,對二者的相關性進行了分析,發現回腸絨隱比增加與ADFI增加直接相關;十二指腸、空腸絨隱比增加與腹瀉下降直接相關。
3.4 微生態制劑對斷奶仔豬胃腸道pH的影響
胃腸道pH是維持機體消化系統正常生理功能的關鍵因素之一,對動物消化吸收發揮重要作用。有報道指出仔豬斷奶后由于日糧結構等因素發生改變,胃腸道內容物pH升高,胃蛋白酶活化受阻,從而降低動物機體對營養物質的消化利用[25]。辛娜等[26]研究表明,斷奶仔豬日糧中添加0.75%芽孢桿菌制劑可顯著降低盲腸和空腸pH。王凱等[27]研究表明,仔豬日糧中添加乳酸菌能夠顯著降低盲腸和結腸內容物pH,其他腸段pH有下降趨勢,但差異不顯著。本研究結果表明,日糧中添加微生態制劑可顯著降低盲腸和結腸內容物pH,胃和其他腸段pH有下降趨勢,差異不明顯。與抗生素組相比,各腸段pH差異均不顯著。其原因可能是乳酸菌等有益菌發酵糖類產生大量乳酸、乙酸和丁酸,降低腸道pH[28]。為進一步研究胃腸道pH變化與微生態制劑改善斷奶仔豬生產性能的關系,對其相關性進行分析,結果證明盲腸、結腸pH降低與ADFI增加呈正相關。
4 結論
斷奶仔豬日糧中添加微生態制劑(植物乳桿菌為主),可增加脾臟相對重量,促進十二指腸絨毛高度發育,降低小腸絨腺比,降低盲腸、結腸pH,提高ADG和ADFI,降低F/G和腹瀉率。說明微生態制劑具有促生長、抗腹瀉的作用,具有替代抗生素緩解仔豬斷奶應激的潛力,但仍需進行深入研究。
References:
[1] Lall S J P, Bosi P, Smidt H,etal. Weaning-A challenge to gut physiologists. Livestock Science, 2007, 108(1/3): 82-93.
[2] Cromwell G L. Why and how antibiotics are used in swine production. Animal Biotechnology, 2002, 13(1): 7-27.
[3] Thacker P A. A review. Journal of Animal Science and Biotechnology, 2013, 4(1): 1-12.
[4] Gong L F. Study on Effects of Probiotics on Production Performance and Immune Function of Weaning Piglets[D]. Changsha: Hunan Agriculture University, 2010. 龔路峰. 微生態制劑對斷奶仔豬生產性能和免疫功能的影響[D]. 長沙: 湖南農業大學, 2010.
[5] Li X F, Wang W M, Zheng Q H,etal. Effect of probiotics replacing of antibiotic on production and gastrointestinal microflora. Animal Husbandry and Veterinary Medicine, 2008, 40(10): 55-57. 李小飛, 王為民, 鄭秋紅, 等. 微生態制劑替代抗生素對豬生產性能和胃腸道微生物數量的影響. 畜牧與獸醫, 2008, 40(10): 55-57.
[6] Lee S H, Ingale S L, Kim J S,etal. Effects of dietary supplementation withBacillussubtilisLS 1-2 fermentation biomass on growth performance, nutrient digestibility, cecal microbiota and intestinal morphology of weanling pig. Animal Feed Science & Technology, 2013, 188(1/2): 78-84.
[7] Frantz N Z, Nelssen J L, Derouchey J M,etal. Effects of a Prebiotic, Inulin, and a Direct Fed Microbial on Growth Performance of Weanling Pigs[C]. Kansas: Kansas State University, 2003.
[8] Nagpal R, Kumar A, Kumar M,etal. Probiotics, their health benefits and applications for developing healthier foods: a review. Fems Microbiology Letters, 2012, 334(1): 1-15.
[9] Li C B. The Perfomance and Microbial Community of Piglets before and After Weaning Response toLactobacillusplantarumandLactobacilluscasei[D]. Nanjing: Nanjing Agricultural University, 2014. 李晨博. 植物乳桿菌和干酪乳桿菌對仔豬生長相關指標及其腸道微生物菌群多樣性的影響[D]. 南京: 南京農業大學, 2014.
[10] Fang Z G. Effect of Different Fat Sources in Diet on Intestinal Development and Intestinal Microbiota of Piglets[D]. Nanjing: Nanjing Agricultural University, 2012. 房正國. 不同脂肪來源的日糧對仔豬腸道發育及腸道微生物區系的影響[D]. 南京: 南京農業大學, 2012.
[11] Liu Y L, Huang J J, Fan W,etal. Effect of L-arginine on growth performance, blood biochemical measurements and visceral weight of weaned pigs after lipopolysaccharide challenge. Chinese Journal of Animal Nutrition, 2008, 20(2): 140-145. 劉玉蘭, 黃晶晶, 范偉, 等. L-精氨酸對脂多糖刺激斷奶仔豬生產性能、血液生化指標和內臟器官重量的影響. 動物營養學報, 2008, 20(2): 140-145.
[12] Wang G Q, Zhang T W, Liu C Q,etal. Probiotics, their health benefits and applications for developing healthier foods: a review. Feed Reasearch, 2016, (10): 24-27. 王國強, 張天偉, 劉超齊, 等. 微生態制劑對哺乳仔豬生長性能及糞便中微生物區系的影響. 飼料研究, 2016, (10): 24-27.
[13] Hu Y, Dun Y, Li S,etal. Effects ofBacillussubtilisKN-42 on growth performance, diarrhea and faecal bacterial flora of weaned piglets. Asian Australasian Journal of Animal Sciences, 2014, 27(8): 1131-1140.
[14] Zhao P Y, Kim I H. Effect of direct-fed microbial on growth performance, nutrient digestibility, fecal noxious gas emission, fecal microbial flora and diarrhea score in weanling pigs. Animal Feed Science & Technology, 2014, 200(1): 86-92.
[15] Suo C, Yin Y, Wang X,etal. Effects ofLactobacillusplantarumZJ316 on pig growth and pork quality. Bmc Veterinary Research, 2012, 8(1): 1-12.
[16] Xian Y H, Zhao X Y, Li C B,etal. Effects ofLactobacillusplantarumandLactobacilluscaseion growth performance, organ index and intestinal morphology of piglets. Chinese Journal of Animal Nutrition, 2015, 27(12): 3805-3811. 縣怡涵, 趙秀英, 李晨博, 等. 植物乳桿菌和干酪乳桿菌對仔豬生長性能、器官指數及小腸形態的影響. 動物營養學報, 2015, 27(12): 3805-3811.
[17] Takahashi S, Egawa Y, Simojo N,etal. Oral administration ofLactobacillusplantarumstrain Lq80 to weaning piglets stimulates the growth of indigenousLactobacillito modify theLactobacillalpopulation. Journal of General & Applied Microbiology, 2007, 53(6): 325-332.
[18] Xiao Z D. Comparison study of feed probiotics and feed antibiotics. Journal of Jilin Agricultural University, 2002, 24(3): 1-6. 肖振鐸. 飼用益生素與抗生素的比較研究. 吉林農業大學學報, 2002, 24(3): 1-6.
[19] Li Z F, Zhang S. The progress and prospect of fundamental research of the spleen. Journal of Xi’an Jiaotong University: Medical Sciences Editon, 2008, 29(1): 1-6. 李宗芳, 張澍. 脾臟的基礎研究進展與展望. 西安交通大學學報: 醫學版, 2008, 29(1): 1-6.
[20] Wang Y, Yang W R, Zhang G G. Effects ofEnterococcusfaeciumon growth performance, intestinal flora and immune function of weaner piglets. Chinese Journal of Animal Nutrition, 2013, 25(5): 1069-1076. 王永, 楊維仁, 張桂國. 飼糧中添加屎腸球菌對斷奶仔豬生長性能、腸道菌群和免疫功能的影響. 動物營養學報, 2013, 25(5): 1069-1076.
[21] Macpherson A J, Harris N L. Interactions between commensal intestinal bacteria and the immune system. Nature Reviews Immunology, 2004, 4(6): 478-485.
[22] Roura A E, Homedes J, Klasing K C. Prevention of immunologic stress contributes to the growth-permitting ability of dietary antibiotics in chicks. Journal of Nutrition, 1992, 122(12): 2383-2390.
[23] Yang K M, Jiang Z Y, Zheng C T,etal. Effect ofLactobacillusplantarumon diarrhea and intestinal barrier function of young piglets challenged with enterotoxigenicEscherichiacoliK88. Journal of Animal Science, 2014, 92(4): 1496-1503.
[24] Efird R C, Armstrong W D, Herman D L. The development of digestive capacity in young pigs: effects of age and weaning system. Journal of Animal Science, 1982, 55(6): 1380-1387.
[25] Lu J J, Xu Z R. Approach on the mechanisms of effects of chlortetracycline in the diet on intestinal morphology in weaning piglets. Acta Agriculturae Zhejiangensis, 2007, 19(1): 15-19. 盧建軍, 許梓榮. 日糧抗生素影響斷奶仔豬腸道結構的機理研究. 浙江農業學報, 2007, 19(1): 15-19.
[26] Xin N, Zhang N F, Diao Q Y,etal. Effects of bacillus preparation on growth performance and gastrointesinal development of weaned piglets. Acta Veterinaria et Zootechnica Sinica, 2012, 43(6): 901-908. 辛娜, 張乃鋒, 刁其玉, 等. 芽孢桿菌制劑對斷奶仔豬生長性能、胃腸道發育的影響. 畜牧獸醫學報, 2012, 43(6): 901-908.
[27] Wang K, Ma J L, Lai T,etal. Effects ofLactobacilluson intestinal physical indices of weaned piglets. Chinese Journal of Veterinary Medicine, 2008, 44(9): 21-23. 王凱, 馬金磊, 賴婷, 等. 乳酸菌劑對斷奶仔豬腸道生理指標的影響. 中國獸醫雜志, 2008, 44(9): 21-23.
[28] Ogawa M, Shimizu K, Nomoto K,etal. Inhibition ofinvitrogrowth of Shiga toxin-producingEscherichiacoliO157: H7 by probioticLactobacillusstrainsdue to production of lactic acid. International Journal of Food Microbiology, 2001, 68(1): 135-140.
Effects of probiotics on the growth performance, organ relative weight, and intestine development of weaned piglets
LI Xue-Li, WANG Chao, YU De-Fu, DING Li-Ren, ZHU Wei-Yun, HANG Su-Qin*
LaboratoryofGastrointestinalMicrobiology,NanjingAgriculturalUniversity,Nanjing210095,China
The objective of this study was to investigate the effects of probiotics on the growth performance, relative organ weight, and intestinal development of weaned piglets, to determine whether probiotics can ease the weaning transition. A total of 144 Suhuai weaned piglets (9.34±0.33 kg) at an age of 28 days were randomly assigned to three groups; control group (basal diet), antibiotics group (basal diet+antibiotics), and probiotic group (basal diet+probiotic). Each group had six replicates, with eight piglets per replicate. The experiment started at 32 days after birth and ended at 59 days after birth. At 59 days, one piglet from each replicate was slaughtered for sampling. Compared with the control, the probiotic treatment significantly increased the average daily gain (ADG) and average daily feed intake (ADFI), and decreased the feed/gain ratio (F/G) and diarrhea rate after weaning (P<0.05). It also significantly increased ADG of the spleen and improved villus development in the duodenum, and reduced the villus height/crypt depth (V/C) of the duodenum, jejunum, and ileum after weaning (P<0.05). Compared with the control, the probiotic treatment significantly decreased the pH of the cecum and colon. A correlation analysis showed that the increased ADG was associated with increased relative weight of the liver. The increased ADFI was strongly related to the increased relative weight of the duodenum and spleen and the increased V/C of the jejunum. The decreased F/G was correlated with the increased relative weight of the colon. The decreased diarrhea rate was correlated with the increased relative weight of the duodenum and spleen, and with the increased V/C of the duodenum and jejunum. The findings imply that a probiotic can relieve weaning stress in piglets by improving their growth performance and decreasing the diarrhea rate via their effects on small intestine morphology, organ relative weight, and gastrointestinal pH. Probiotics could be used as alternatives to antibiotics during the weaning of piglets.
probiotics; weaned piglets; growth performance; organ relative weight; intestine development
10.11686/cyxb2016438
http://cyxb.lzu.edu.cn
2016-11-22;改回日期:2017-03-10
農業部公益性行業專項(201403047)和蘇淮豬安全生產無抗生物飼料工程技術開發與應用 [CX(15)100603]資助。
李雪莉(1990-),女,河北東光人,在讀碩士。E-mail:2015805086@njau.edu.cn *通信作者Corresponding author. E-mail:suqinhang69@njau.edu.cn
李雪莉, 王超, 虞徳夫, 丁立人, 朱偉云, 杭蘇琴. 微生態制劑對斷奶仔豬生長性能、器官重及其胃腸道發育的影響. 草業學報, 2017, 26(8): 192-199.
LI Xue-Li, WANG Chao, YU De-Fu, DING Li-Ren, ZHU Wei-Yun, HANG Su-Qin. Effects of probiotics on the growth performance, organ relative weight, and intestine development of weaned piglets. Acta Prataculturae Sinica, 2017, 26(8): 192-199.

