表皮干細胞復合羊膜構建組織工程皮膚修復糖尿病難愈創面的可行性分析
狄海萍 李曉亮 薛繼東 李強 曹大勇 韓大偉 夏成德(鄭州市第一人民醫院 燒傷中心 河南 鄭州 450000)
表皮干細胞復合羊膜構建組織工程皮膚修復糖尿病難愈創面的可行性分析
狄海萍 李曉亮 薛繼東 李強 曹大勇 韓大偉 夏成德
(鄭州市第一人民醫院 燒傷中心 河南 鄭州 450000)
目的 對表皮干細胞復合羊膜構建組織工程皮膚修復糖尿病難愈創面的可行性進行分析和探討。方法 選取60只體質量250~300 g的雄性SD大鼠,建立糖尿病SD大鼠創面模型,分離培養大鼠皮膚表皮干細胞(ESCs),使用5-溴脫氧尿嘧啶(5-BrdU)對其進行標記。使用隨機數表法將大鼠分為A、B、C組,A組大鼠皮膚創面接受羊膜負載BrdU標記的ESCs組織工程皮膚移植;B組大鼠皮膚創面接受羊膜移植;C組大鼠皮膚創面不接受處理。觀察3組大鼠皮膚創面的愈合情況。結果 A組大鼠治療7、14 d后的PCNA陽性細胞積分光密度平均值以及創面愈合率均高于B、C組,差異有統計學意義(P<0.05)。結論 表皮干細胞復合羊膜構建組織工程皮膚修復糖尿病難愈創面安全可行。
表皮干細胞;羊膜;糖尿病;難愈創面
現今我國糖尿病患者發病人數逐年遞增,預計2025年糖尿病患者人數將達6 000萬。因血管和神經發生病變,糖尿病患者極易出現潰瘍,不斷擴大,且糖尿病患者后期生活中可能會遭遇不同程度的事故而需要接受手術治療,以上因素均會造成程度不同的“難愈創面”。糖尿病創面難愈為目前常見的臨床難題,本研究以60只雄性SD大鼠為對象,分析探討表皮干細胞復合羊膜構建組織工程皮膚修復糖尿病難愈創面的可行性。
1 資料與方法
1.1 一般資料 選取60只體質量250~300 g的雄性SD大鼠作為本次研究對象,大鼠是由南昌大學試驗動物科學部提供,實驗過程中所有對大鼠進行的操作與處置均符合動物倫理學的相關標準。研究所用材料如下:美國K19抗體;Sigma Ⅳ型膠原;鏈脲佐菌素(streptozocin,STZ);5-BrdU(Adooq Bioscience);β1整合素(英國abcam);BrdU抗體(中國北京中杉金橋公司);胰蛋白酶-EDTA(美國Gibco公司);角質細胞無血清培養基、胎牛血清。
1.2 方法 隨機抽取40只大鼠建立糖尿病模型,剩下20只行表皮干細胞分離培養。糖尿病模型建立方法如下:禁食16 h以上,對禁食完畢的大鼠體質量進行測量[1];抽取大鼠尾部空腹靜脈血,測定血糖濃度;將0.1 mol的pH 4.5檸檬酸鈉緩沖液加入STZ與檸檬酸的混合液中,搖勻配制成注射液;過濾除菌處理后對大鼠進行一次性腹腔注射,65 mg/kg;注射72 h后,使用穩步血糖測定儀對大鼠隨機體質量、血糖、毛發顏色變化等進行檢測;每周測量1次大鼠血糖,若大鼠在連續3次的血糖檢測中,血糖值均≥16.7 mmol/L,同時臨床表現出消瘦、多飲、多食、多尿的“一少三多”癥狀,則認為該大鼠為DM大鼠[2]。
表皮干細胞的分離培養方法:無菌條件下剝離大鼠全層背部皮膚;刀片徹底清除皮膚結締組織與皮下組織,漂洗;將皮片剪成面積為0.3 cm×0.5 cm的大小,置入培養瓶;培養瓶內加入0.02%濃度的EDTA以及0.25%濃度的胰蛋白酶,體積比為5∶1;4 ℃冰箱中保存、消化過夜;磷酸鹽緩沖液稀釋Ⅳ型膠原,并將稀釋后的液體培養板上均勻涂抹,風干備用;取出皮條片并將適量的胎牛血清滴于其上[3];200目篩網過濾表皮層,1 000 r/min的速度離心5 min,分離血清,制成細胞懸液;培養20 min后取出,加入10%的胎牛血清以及10 μg/L的表皮生長因子,37 ℃恒溫培養箱中培養;細胞70%~80%融合后,以1∶3的比例傳代;細胞β1整合素以及K19接受免疫細胞化學法的檢測,若均呈現陽性,則鑒定為ESCs[4]。皮膚創面的修復:A組大鼠行經體外培養擴增、羊膜負載、ESCs組織工程皮膚移植的修復;B組大鼠行羊膜修復;C組大鼠創面不接受任何干預。
1.3 觀察指標 觀察大鼠皮膚創面愈合情況,計算大鼠皮膚創面的愈合面積,皮膚愈合面積百分率=(皮膚創面初始面積-治療后皮膚愈合面積)/皮膚創面初始面積×100%。400倍光學顯微鏡下觀察HE染色切片等,大鼠陽性細胞積分光密度的平均值采用Image-proplus 6.0軟件測量。
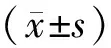
2 結果
2.1 皮膚創面愈合情況 治療7、14 d后,A組大鼠皮膚創面愈合率均明顯高于B、C組,差異有統計學意義(P<0.05)。見表1。

表1 3組大鼠治療7、14 d后皮膚創面愈合情況比較
注:與B、C組比較,aP<0.05。
2.2 PCNA陽性細胞積分光密度平均值 A組大鼠治療7、14 d后的PCNA陽性細胞積分光密度平均值與B、C組比較,差異有統計學意義(P<0.05)。見表2。
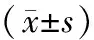
表2 3組大鼠治療7、14 d后PCNA陽性細胞積分光密度平均值比較
注:與B、C組比較,bP<0.05。
3 討論
羊膜位于胎盤最內層,為具有一定彈性的半透明薄膜,結構與人眼結膜組織相似,其內包含多種能夠促進結膜細胞增殖、角膜上皮細胞生長的物質,早在100多年前便作為一種敷料廣泛應用于外科的臨床治療中。多項研究證明羊膜為構建皮膚理想的組織工程支架材料,一方面能加速負載細胞的生長,有效控制炎癥,促進潰瘍愈合;一方面能誘導纖維血管組織長入,并可在機體新生皮膚生長成熟后自動降解,對人體幾乎無不良影響[5]。
羊膜為半透明的薄膜,含有多種促進細胞增殖的營養成分,可為細胞的分化、增殖提供豐富營養,促進細胞生長和繁殖。表皮干細胞作為皮膚組織的特異性干細胞,有強大的增殖及多向分化的潛能,是皮膚組織發生、創面修復及改建的關鍵性細胞。在創面愈合過程中,創面的再上皮化依賴表皮細胞的增殖等生物學行為的正常發揮,從創面愈合過程中表皮干細胞動態變化來看,表皮干細胞數量少和活性低是導致糖尿病創面愈合延遲的重要原因。本研究中,接受因表皮干細胞復合羊膜構建組織工程皮膚修復的A組治療7、14 d后的創面愈合率均顯著高于接受羊膜移植的B組以及未接受任何處理的C組,差異有統計學意義(P<0.05);此外,A組大鼠治療7、14 d后PCNA陽性細胞積分光密度平均值亦明顯高于B、C組,差異有統計學意義(P<0.05)。結果表明,表皮干細胞復合羊膜構建組織工程皮膚修復是提高糖尿病難愈創面治療效果的有效途徑,ESCs能夠主動參與到糖尿病的創面修復過程中,有效發揮促上皮化作用,加速創面好轉。
綜上所述,表皮干細胞復合羊膜構建組織工程皮膚修復糖尿病難愈創面效果顯著,安全可靠,具有高度可行性,值得臨床進一步推廣和使用。
[1] 劉德伍,鐘清玲,劉繁榮,等.表皮干細胞復合羊膜構建組織工程皮膚修復糖尿病難愈創面[J].透析與人工器官,2010,21(3):12-14,46.
[2] 劉愛軍,黃錦桃,李海標,等.ES細胞源性表皮干細胞與類真皮構建組織工程皮膚的體內分化[J].解剖學研究,2006,28(3):161-164,封二.
[3] 黃文琪,可金星,陶忠芬,等.掃描電鏡在人羊膜負載豬骨髓間充質干細胞生長形態學研究中的應用[J].電子顯微學報,2004,23(4):319.
[4] 聶剛,亓俊華,姜南雁,等.高濃度葡萄糖對小鼠表皮干細胞增殖的影響[J].醫學研究雜志,2014,43(10):99-103.
[5] 陸樹良,謝挺,牛軼雯,等.糖尿病合并創面難愈的機制研究[J].藥品評價,2011,8(7):17-21.
Feasibility analysis of tissue engineering skin constructed by epidermal stem cells and amniotic membrane for the repair of diabetic refractory wound
Di Haiping, Li Xiaoliang, Xue Jidong, Li Qiang, Cao Dayong, Han Dawei, Xia Chengde
(BurnCenter,theFirstPeople’sHospitalofZhengzhou,Zhengzhou450000,China)
Objective To analyze the feasibility of tissue engineering skin constructed by epidermal stem cells and amniotic membrane for the repair of diabetic refractory wound. Methods A total of 60 male SD rats with body mass of 250 to 300 g were selected and established diabetic wound model. Rat skin epidermal stem cells (ESCs) were isolated and cultured, and labelled by 5- bromodeoxyuridine (5-BrdU). All the rats were divided into group A, B and C according to a random number table method. Group A
the transplantation of amniotic membrane-loaded and BrdU-labeled ESCs tissue engineering skin, Group B received amniotic membrane transplantation, and Group C did not accept the deal. The wound healing of 3 groups of rats was observed. Results The PCNA positive cells, integral optical density, mean value and wound healing rate of group A were higher than those in group B and C 7 and 14 d after treatment, and the differences were statistically significant (P<0.05). Conclusion Tissue engineering skin constructed by epidermal stem cells and amniotic membrane is feasible for the repair of diabetic refractory wound.
epidermal stem cell; amniotic membrane; diabetes; refractory wound
夏成德,E-mail:xcdeyxyj@126.com。
R 641
10.3969/j.issn.1004-437X.2017.16.009
2016-11-25)

