一項在歐洲和中國進行的新型胃泌素釋放肽前體(ProGRP)免疫檢測多中心評估研究
1 前言
腫瘤標志物作為肺癌兩種主要亞型[非小細胞肺癌(non-small cell lung cancer, NSCLC)和小細胞肺癌(small cell lung cancer, SCLC)]的鑒別手段,已經在肺癌患者中得到廣泛研究,進而改善了診斷和治療選擇[1-5].NSCLC占所有新發肺癌病例的80%左右,SCLC占20%左右.SCLC不同于NSCLC,其具有神經內分泌分化、較高腫瘤生長速度和較早轉移[6,7],因此需要采取不同的治療方法.在這兩種亞型中,NSCLC更有可能在早期被診斷,此時手術可以提供最好的治愈機會[8].SCLC的早期診斷非常少見,意味著手術并非常見治療手段,但其對放射治療和化療高度敏感[7].SCLC患者常復發,然而近年來,其5年生存率保持不變[9].初診時,肺癌亞型的鑒別診斷對于確保采取適當治療干預至關重要.
腫瘤活檢是肺癌組織學鑒別診斷的重要組成部分.然而,由于許多SCLC存在于粘膜下層,組織精確取樣可能存在困難,所以活檢無法幫助疾病早期發現[10].當被診斷為處于疾病局限期時,約20%的SCLC患者可以通過接受積極化學治療和放射治療實現長期生存率,而確診為晚期時,僅為5%[10].血漿或血清樣本中腫瘤標志物的分析較組織學鑒別診斷明顯更具優勢,包括發現早期SCLC的能力,以及提高生存率的機會.
神經元特異性烯醇化酶(NSE)和胃泌素釋放肽前體(ProGRP)已被證明是SCLC最有價值的腫瘤標志物[11,12].雖然長久以來,NSE作為被推薦的SCLC腫瘤標志物[13],在組織檢查中NSE也可以染色高達80% NSCLC組織,但僅20%-30% NSCLC患者的血清中NSE升高[14].此外,NSE敏感性較低,特別是對于病變局限于一側胸腔或同側縱隔的患者[15].由于NSE存在于血小板和紅細胞中,因此必須排除溶血樣本,并且樣本的快速儲存至關重要[14].ProGRP可準確鑒別NSCLC和SCLC[16,17],ProGRP濃度在其他惡性疾病或良性病癥中很少升高,而在腎功能不全、肺神經內分泌腫瘤(NET)和甲狀腺髓樣癌(MCT)患者中表現高濃度[16-22].
在2 0 0 9年,報道了首個全自動化P r o G R P ARCHITECT檢測(Abbott Laboratories, Wiesbaden,Germany)的評估[23].由于在ARCHITECT檢測中,ProGRP在血清中穩定性差,研究認為原因是凝血酶誘導的蛋白水解,因此將血漿樣本作為推薦的源材料[24,25].Elecsys? ProGRP檢測(Roche Diagnostics GmbH, Penzberg,Germany)是一種新的免疫檢測法,旨在定量測定人血清和血漿中ProGRP的水平.由于Elecsys? ProGRP檢測中的兩種單克隆抗體與相對耐內切蛋白酶酶切的ProGRP肽表位結合[16,17,26](補充圖S1),因此可以使用血清樣本以及血漿樣本.在本文中,我們報告了歐洲和中國多個中心的Elecsys? ProGRP檢測的技術和臨床性能.
2 材料和方法
2012年8月-2013年9月期間,在3個歐洲研究中心(Amsterdam、Barcelona和Bonn)和北京的2個中國研究中心[北京協和醫院(PUMCH)和北京宣武醫院]對Elecsys?ProGRP檢測進行了評估.在臨床研究工作開始之前,從各機構獲得了倫理批準/豁免.所有研究中心均遵照赫爾辛基宣言(修訂版Tokyo、Venice、Hong Kong和Fortaleza 2013)和國際協調會議關于臨床試驗管理規范進行研究.該研究的目的是評估Elecsys? ProGRP檢測在不精密度、穩定性、方法學比較和SCLC鑒別診斷能力方面的性能.
2.1 檢測說明 Elecsys? ProGRP檢測是一種電化學發光免疫檢測,其使用生物素化的ProGRP特異性小鼠單克隆抗體和釕標記的ProGRP特異性小鼠單克隆抗體捕獲和檢測人血清和血漿中的ProGRP.該檢測采用ProGRP CalSet(Roche Diagnostics)進行定標,并可溯源至ARCHITECT ProGRP檢測.使用兩個水平的PreciControl ProGRP(Roche Diagnostics)進行質量控制.定標液和質控液均包含重組ProGRP.
2.2 樣本來源、制備和處理 樣本均來自先前未經治療的活動性病變患者,其具有足夠的樣本用于分析.未進一步使用人口學或組織學選擇標準.肺癌組織學分類根據1999年世界衛生組織指南[27].SCLC和NSCLC的鑒別診斷基于形態學特征以及腫瘤CD56陽性和/或突觸素免疫組化.根據國際指南確定肺癌分期(TNM)[28].
所有研究中心均采集樣本并進行檢測.另外一個德國中心(Institut für Klinische Pharmakologie GmbH, Kiel)提供了來自表觀正常人群的樣本,作為參考隊列.由于SCLC在患者群體中的患病率低,鑒別診斷主要基于來自歐洲樣本庫的患者血清樣本,而在中國樣本為前瞻性采集(2013年1月-9月).
所有3個歐洲中心和PUMCH均使用血清進行臨床評價.宣武醫院使用EDTA-K2原始管進行血漿采集.在Bonn和Amsterdam使用EDTA-K2和血清分離管(SST)進行穩定性實驗.此外,Amsterdam在本實驗中使用快速血清管(RST)進行血清采樣.RST的內壁涂有凝血酶,以促進快速凝血.所有研究均在cobas? e411和e601分析儀上進行.
2.3 統計分析 使用WinCAEv(基于Windows的計算機輔助評價)軟件程序采集所有分析數據.使用MACRO軟件程序收集人口統計學和臨床資料.在Roche Diagnostics Penzberg的生物統計學部門采用SAS(統計分析軟件9.2版)和R(版本2.13.2)進行所有使用臨床信息的統計分析.對于目視檢查主數據集確定的異常值,進行重新測定.
2.4 技術評估
2.4.1 實驗室間調查 通過 Roche R&D(-30 pg/mL、-200 pg/mL和-1,500 pg/mL)制備3個EDTA血漿樣本池,并分發到所有5個研究中心,以評估這3個濃度范圍內實驗室間回收率和日間變異性差異.同時,PreciControl ProGRP的兩個水平也被用作樣本材料.在各實驗室中,10天內單次測定每個樣本.每個樣本的回收率百分比計算為測定濃度/所有實驗室中位數X100.
2.4.2 根據臨床實驗室標準協會EP5-A2的不精密度 通過臨床實驗室標準協會(CLSI)EP5-A2指南[29]評估不精密度.由歐洲中心制備的三個樣本池的目標濃度范圍分別為7 pg/mL-60 pg/mL、61 pg/mL-1000 pg/mL和1,001 pg/mL-5,000 pg/mL.取約27 mL的血清或血漿,制備84X300 μL等分試樣.將樣本在-20oC下儲存,并在相應的測定日使用.通過根據CLSI EP5-A2方差分量模型對數據進行建模,獲得了重復性和中間精密度估值.以日間、批間和重復性方差分量進行建模.基于總方差估計,給出了中間精密度估值,作為變異系數(CV).
2.4.3 樣本材料的穩定性 經機構審查委員會批準,從提供知情同意書的患者處獲得相應的血清和血漿樣本.理想狀態下,樣本中ProGRP的濃度超過100 pg/mL;然而,由于獲得知情同意書和樣本存在困難,本研究納入了一些低于此濃度的樣本.至少從每位患者體內獲取3 mL血清和3 mL血漿,以制備9份300 μL等分試樣.在取樣1 h內進行測定,作為基線測定值,并室溫下1 h、2 h、3 h和4 h后,以及在2oC-8oC下3 h、6 h、24 h和48 h分別進行測定.首先在ARCHITECT儀器上進行測定,然后在30 min內,在cobas?儀器上進行測定.在同一批次中檢測血清和血漿.回收率百分比計算為實際濃度/基線濃度X100.
2.4.4 方法學比較 使用ARCHITECT ProGRP檢測和Fujirebio微量滴定板酶聯免疫吸附劑ProGRP檢測(Fujirebio Diagnostics, Japan)獲得比較結果.理想情況下,血漿樣本應用于ARCHITECT儀器,以及血清樣本用于Fujirebio檢測.誤差率為1的Deming回歸用于估計回歸線[30].通過Bootstrap方法獲得截距和斜率的置信區間(CI)[31].
2.4.5 矩陣比較 從2012年第三季度-2013年第一季度的常規取樣收集了匹配的血清和血漿標本,并在2013年第一季度冷凍至分批測定.數周采集樣本以涵蓋整個測量范圍(3 pg/mL-5,000 pg/mL).
3 臨床評估
3.1 參考范圍確定 對于ProGRP參考范圍計算,根據基于對健康檢查問卷的回答以及葡萄糖、膽堿酯酶、肌酐、C-反應蛋白和血紅蛋白水平等基礎臨床化學參數的結果,在來自5個歐洲中心和2個中國中心的健康人群隊列,以及從Kiel中心招募的表觀正常人群隊列中進行比較.在Kiel中心采集了三種樣本類型:血清、EDTA-K2血漿和肝素鋰血漿.來自Kiel的樣本在-80oC下儲存于Roche Penzberg樣本庫中,并在Bonn進行測定.Amsterdam、Barcelona和Bonn僅采集血清樣本.中國PUMCH采集血清和EDTA-K3血漿樣本,而宣武醫院僅采集EDTA-K2血漿樣本.在R軟件中使用類型=3方法計算分位數.關于Hahn和Meeker的方法,CI是非參數[32].
3.2 鑒別診斷 NSCLC和SCLC惡性病變隊列是主要焦點,表觀正常人群、肺部良性病變患者(如慢性阻塞性肺病、結核、肺炎和哮喘)、其他良性疾病患者(即急性和慢性炎性、肝、腎、自身免疫和代謝疾病)和其他惡性疾病患者作為對照隊列.對于惡性病變隊列,必須進行臨床分期(cTNM)或病理分期(pTNM)以及國際抗癌聯盟(UICC)分期,并記錄轉移數量和轉移部位.還應記錄取樣日期、初診日期、組織學結果、人口數據和吸煙習慣(目前吸煙者、過去吸煙者或從不吸煙者).
平行測量肌酐與ProGRP,慢性腎臟病流行病學協作組(CKD-EPI)公式被[33,34]用于估算腎小球濾過率(eGFR),以闡明腎功能不全對ProGRP濃度的影響.選擇≥0 mL/min/1.73 m2(CKD 3期)作為截斷值,因為在CKD3期以上患者中ProGRP水平顯著升高(補充圖S2).統計分析基于受試者工作特征(ROC)曲線和曲線下面積(AUC)計算,其中CI基于DeLong方法[35].還計算了特異性為95%時的敏感性,以及敏感性為95%時的特異性.
4 結果
4.1 技術評估 實驗室間研究合并樣本的CV范圍為1.2%-4.9%.約-30 pg/mL和-200 pg/mL合并樣本的回收率范圍為94%-106%.實驗室間的-1,500 pg/mL樣本的回收率變化較大,Bonn中心(104%)和Amsterdam中心(85%)之間的回收率差異大約為20%.
3個歐洲中心人血清池樣本和2個對照樣本的中間不精密度范圍為2.2%(95%CI: 1.8%-2.7%)至6.0%(95%CI:4.7%-8.4%)CV(補充表S1),與報道的ARCHITECT ProGRP檢測(血清和血漿CV為2.2%-5.7%)數據相當[23].批內不精密度范圍為1.1%(95%CI: 0.9%-1.4%)至3.0%(95%CI:2.5%-3.8%)CV.
在來自Amsterdam的9個樣本和來自Bonn的10個樣本中評價樣本穩定性,ProGRP濃度范圍為18 pg/mL-4,259 pg/mL.使用血漿和血清樣本在cobas?檢測上獲得了同樣的回收率 ,當存儲在室溫下超過4 h(在4 h時的回收率中位數:血漿為98%,SST為102%,RST樣本為99%)或在2oC-8oC下超過48 h(在48 h時的回收率中位數:血漿為97%,SST為101%,RST樣本為101%)(圖1).在-20oC下保存12周的血漿和血清樣本中也證明了ProGRP良好的穩定性(補充圖S3).相反,使用ARCHITECT檢測,血清中ProGRP隨時間推移回收率降低(在4 h時的回收率中位數:SST為90%,RST樣本為69%),正如之前所報道,血漿和血清樣本的結果不相當[24].
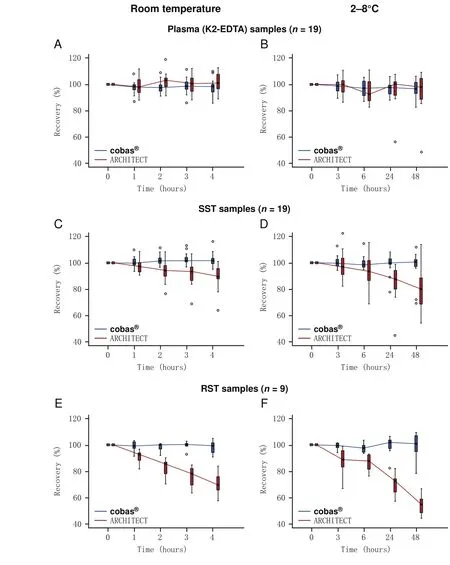
Fig 1 Median ProGRP recovery frompatient samples taken in Amsterdam (n=9) and Bonn (n=10),incubated at room temperature over 4 hours (A, C, E) or at 2 °C-8 °C over 48 hours (B, D, F) and measured on the cobas? or ARCHITECT instruments.Note: Reprinted with permission from the copyright holder ?2015 Elsevier B.V.圖 1 在Amsterdam(n=9)和Bonn(n=10)獲得的患者樣本的ProGRP回收率中位率,在室溫下孵育超過4 h(A、C、E)或2 °C-8 ℃下孵育超過48 h(B、D、F),并在cobas?或ARCHITECT儀器上測定.注:本圖得到版權所有者?2 0 15 Elsevier B.V.復制許可

Fig 2 A: Method comparison: ARCHITECT versus cobas? using plasma samples up to a ProGRP concentration of 500 pg/mL; B: Matrix comparison: serum versus plasma samples on cobas?; C: Method comparison: Fujirebio versus cobas? using serum samples.Note: Reprinted with permission from the copyright holder ?2015 Elsevier B.V.圖 2 A:方法比較:使用血漿樣本的ARCHITECT與cobas?比較,直到ProGRP濃度為500 pg/mL;B:矩陣比較:在cobas?上的血清與血漿樣本比較;C:方法比較:使用血清樣本的Fujirebio與cobas?比較.注:本圖得到版權所有者?2015 Elsevier B.V.復制許可
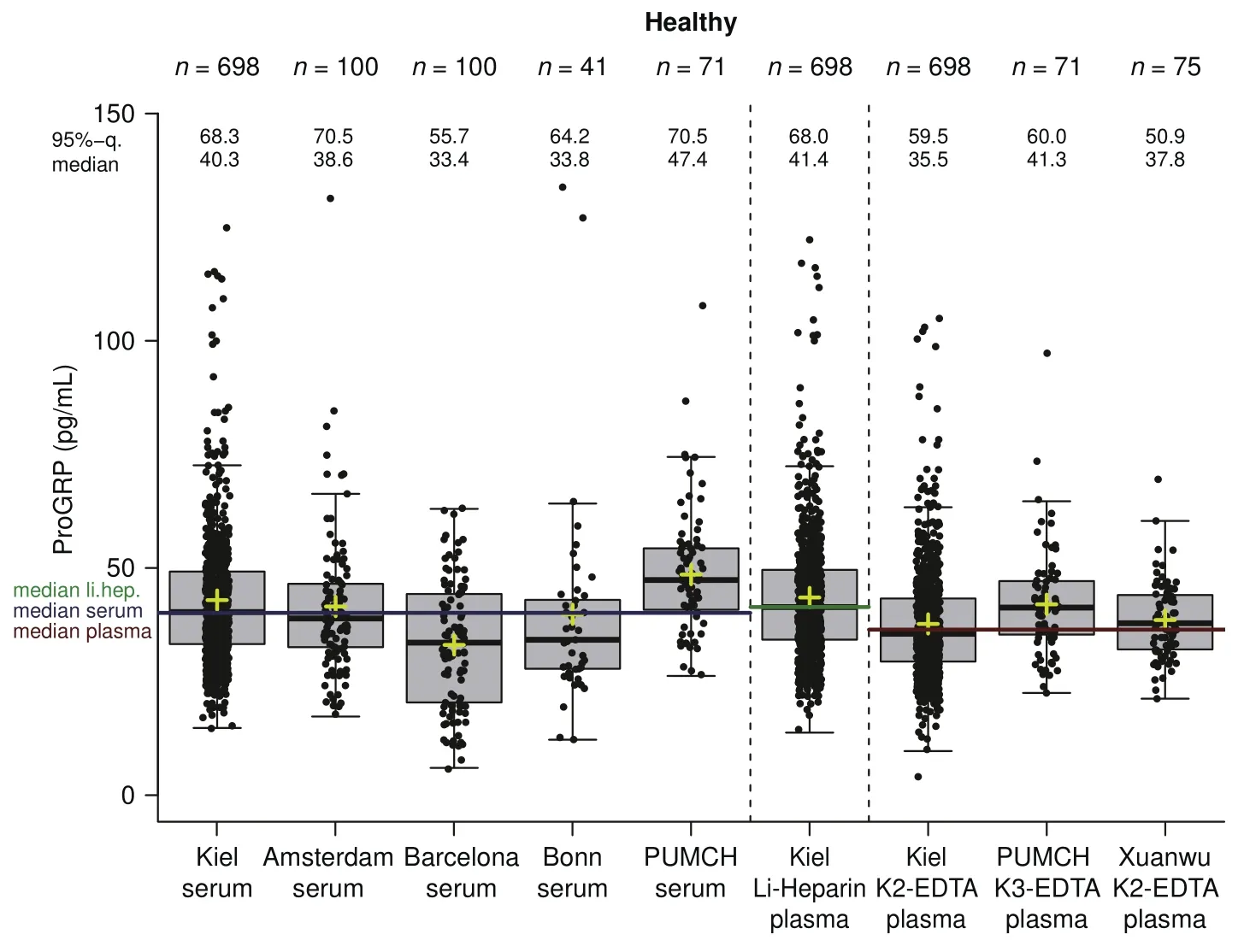
Fig 3 Reference range distribution of ProGRP in serum and plasma samples from healthy individuals for all sites. The yellow crosses represent the mean.Note: Reprinted with permission from the copyright holder ?2015 Elsevier B.V.圖 3 在所有中心健康人群的血清和血漿樣本中ProGRP的參考范圍分布.黃色十字架代表平均值.注:本圖得到版權所有者?2015 Elsevier B.V.復制許可
使用血漿樣本的ProGRP濃度高達500 pg/mL,ARCHITECT和cobas?檢測的相關性如圖2A所示.所有中95心合并的斜率和截距分別為1.02(953%91CI: 0.96-1.08)和-2.72 pg/mL(95%CI: -5.22-0.66),相關系數分別為0.96(補充表S2).在3 pg/mL-5,000 pg/mL的整個測定范圍內,所有中心報告了類似的發現(數據未顯示).在所有中心,在cobas?檢測中,ProGRP濃度高達500 pg/mL時,血清和血漿樣本間的相關性為:斜率為0.93(95%CI: 0.89-0.98),截距為2.35 pg/mL(95%CI: -0.21-4.60),相關系數為0.97(圖2B).在Barcelona中心,矩陣比較的斜率顯著高于其他中心.其原因未知,但認為與臨床無關,并突出了現場檢測的變異性.通過使用ProGRP濃度為500 pg/mL的血清樣本,可以獲得Fujirebio和cobas?檢測之間相關性的可比結果(圖2c).在所有中心,斜率為1.33(95%CI: 1.15-1.47),截距為-4.18 pg/mL(95%CI: -10.50-2.95),相關系數為0.84.
4.2 臨床評估 來自每個患者隊列和每個中心的樣本數顯示在表1中.
參考范圍隊列由平均年齡為48歲[標準差(SD)16歲]的1,085例表觀正常人群組成.NSCLC隊列包括852例平均年齡64歲(SD 12歲)的患者,SCLC隊列由207例平均年齡62歲(SD 11歲)的患者組成.
在參考范圍隊列中,肝素鋰血漿中第95百分位數ProGRP濃度為68 pg/mL(95%CI: 63.7-74.5),EDTA血漿中為60 pg/mL(95%CI: 55.8-65.3),血清樣本中為66 pg/mL(95%CI: 62.4-72.6)(圖3).這些數據與ARCHITECT檢測(血清為63 pg/mL;EDTA血漿為65 pg/mL)的參考范圍值相當[36],但高于之前報道的Fujirebio檢測(血清中43 pg/mL)[37].在歐洲和中國中心之間沒有觀察到ProGRP濃度中位數的顯著差異.
ProGRP在SCLC和NSCLC之間表現出良好的鑒別診斷能力,在NSCLC隊列中AUC為0.90(95%CI: 0.87-0.93),敏感性為78.3%,特異性為95%.ProGRP的分布如圖4所示.雖然SCLC隊列中的ProGRP濃度在中國中心中趨于更高(數據未顯示),但是歐洲和中國中心的NSCLC和SCLC隊列中沒有觀察到臨床相關的中心效應.未注意到年齡、性別或吸煙習慣對ProGRP濃度的臨床相關影響(數據未顯示).基于NSCLC隊列的95%特異性,將SCLC(n=207)與NSCLC(n=852)區分的臨床鑒別診斷截斷值計算為84 pg/mL(95%CI: 76.9-98.8).
ProGRP值在局限期與廣泛期SCLC患者的樣本中具有差異(中位數分別為351 pg/mL和757 pg/mL;P=0.002,3)(補充圖S4).在NSCLC隊列中95%的固定特異性下,鑒別局限期SCLC與NSCLC的敏感性為71.7%(AUC為85.6;95%CI: 80.3-90.9),鑒別廣泛期SCLC的敏感性為83.5%(AUC為93.0;95%CI: 89.8-96.3).在SCLC患者中,雖然I期和II期SCLC患者的樣本量較少(數據未顯示),但UICC疾病分期與ProGRP水平之間的相關性顯著.在所有中心,ProGRP在除外腎臟疾病的良性疾變患者(中位數為38 pg/mL),以及除外腎臟疾病,肺MCT或NET的其他惡性腫瘤患者(中位數為40 pg/mL)中濃度較低.與3個歐洲中心[AUC 0.89(95%CI: 0.85-0.92);NSCLC隊列中特異性為95%時敏感性為76.9%)]相比,在兩個中國中心[AUC 0.94(95%CI: 0.89-0.99);特異性為95%時敏感性為83.8%]中,ProGRP顯示出更高的SCLC和NSCLC鑒別診斷能力,雖然不具有統計學意義,可能是由于中國隊列的樣本量較少(圖5).
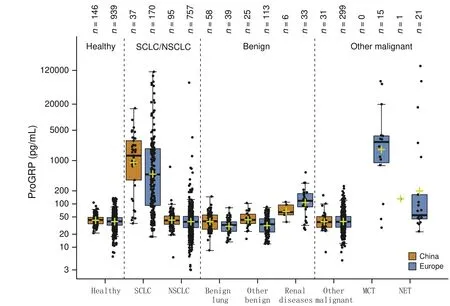
Fig 4 ProGRP concentrations in different clinical cohorts in China and Europe. The yellow crosses represent the mean.Note: Reprinted with permission from the copyright holder ?2015 Elsevier B.V.圖 4 中國和歐洲中心不同臨床隊列的ProGRP濃度.黃色十字架代表平均值.注:本圖得到版權所有者?2015 Elsevier B.V.復制許可

表 1 每個中心的每個隊列的樣本數C.MTab 1 Sample numbers for each cohort from each site
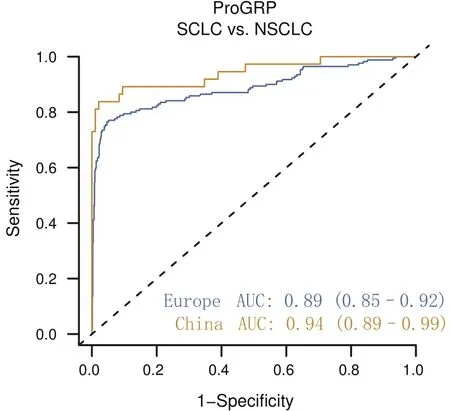
Fig 5 ROC curves of ProGRP (eGFR≥30 mL/min/1.73 m2) for SCLC versus NSCLC for European and Chinese sites. Europe SCLC (n=170),NSCLC (n=757); China SCLC (n=37), NSCLC (n=95).Note: Reprinted with permission from the copyright holder ?2015 Elsevier B.V.圖 5 歐洲和中國中心ProGRP(eGFR≥30mL/min/1.73 m2)用于SCLC與NSCLC相比的ROC曲線.歐洲SCLC(n=170),NSCLC(n=757);中國SCLC(n=37),NSCLC(n=95).注:本圖得到版權所有者?2015 Elsevier B.V.復制許可
5 討論
在多個歐洲和中國中心進行的Elecsys? ProGRP檢測的多中心評估顯示出良好的不精密度、穩定性和特異性.中間不精密度值范圍為CV:2.2%-6.0%,與ARCHITECT ProGRP檢測報道的數據相當[23].批內不精密度范圍為CV:1.1%-3.0%.值得注意的是,Elecsys? ProGRP檢測在EDTA血漿和血清樣本中等同進行,在一定范圍的儲存條件下回收率保持不變.存儲樣本并不總是被認為與新鮮樣本一樣可靠,但我們的數據表明ProGRP在存儲和新鮮組織中均保持穩定.相比之下,血清中ProGRP的回收率隨ARCHITECT檢測時間下降,正如之前所報道的,在血漿和血清樣本中獲得不同的結果[24].
研究報告的ARCHITECT檢測分析的血清樣本相關的穩定性問題,研究認為部分歸因于血清樣本中的凝血酶,因此血漿被鑒定為首選源材料[24].相對于ARCHITECT檢測,Elecsys? ProGRP檢測在血清中具有較好的穩定性,最有可能與ProGRP肽上的抗體結合位點有關.Elecsys? ProGRP檢測中的兩個單克隆抗體與耐內切蛋白酶酶切的表位結合[16,17,26],而ARCHITECT檢測中的兩個單克隆捕獲抗體直接結合凝血酶酶切位點(補充圖S1).
在ProGRP濃度高達500 pg/mL(斜率1.02,截距-2.72 pg/mL)所有中心中,并在整個測定范圍內,ARCHITECT和cobas?檢測在血漿中均顯示出良好的相關性.同時證實在cobas?檢測中,ProGRP濃度高達500 pg/mL(斜率為0.93,截距為2.35 pg/mL)時,并在整個測定范圍內,血清和血漿之間表現出良好的相關性.在所有中心,ProGRP濃度高達500 pg/mL(斜率為1.33,截距為-4.18 pg/mL)的血清樣本中,Fujirebio和cobas?檢測之間也存在良好的相關性.值得注意的是,Bonn和Barcelona實驗室的樣本沒有均勻地涵蓋測量范圍,該范圍內大多數樣本的ProGRP濃度均低于500 pg/mL.ARCHITECT和cobas?檢測在整個測定范圍方面的差異小于ARCHITECT和Fujirebio ProGRP檢測(斜率為0.93,Passing-Bablok回歸;相關系數為0.99)之間相關性的差異[36].
在Elecsys? ProGRP檢測中,所測定的表觀正常人群的ProGRP參考范圍與ARCHITECT檢測的參考范圍的結果相當[36].來自Barcelona和Bonn的樣本中的ProGRP濃度比其他中心的略低.
ProGRP在血清中顯示出明確的SCLC和NSCLC鑒別診斷能力,在NSCLC隊列中,特異性為95%時,敏感性為78%,如先前所述ARCHITECT ProGRP檢測的結果[16,17,21,36].在NSCLC和SCLC隊列中,各中心間無臨床相關差異.此外,未見年齡、性別或吸煙習慣的臨床相關影響.本研究為專門針對中國患者的ProGRP檢測的首次評價,并且證明了不同種族之間的結果的重復性.
盡管早期SCLC患者的數量很少,如先前研究所報道的,與局限期SCLC患者相比,廣泛期SCLC患者的ProGRP濃度較高[25,38].此外,研究還發現腫瘤大小(根據UICC分期)與ProGRP濃度之間存在相關性.正如研究所預期,NSCLC、良性肺病、其他良性疾病或其他惡性腫瘤(不包括腎臟疾病、肺的MCT和NET)患者的ProGRP濃度較低.因為僅發現來自肺或原發灶未知的NET患者的ProGRP水平升高[22],ProGRP可能是定位原發部位未知NET的有效診斷工具.在所有歐洲和中國中心,eGFR≥30 mL/min/1.73 m2(CKD 3期)患者血清中,ProGRP對于SCLC和NSCLC均表現出良好的鑒別診斷能力,但在eGFR<30 mL/min/1.73 m2患者中應注意解讀ProGRP結果.
許多研究中已經確立了ProGRP作為生物標志物鑒別SCLC與其他類型肺癌的臨床應用[12,16,20,21,39-42].在對11項臨床試驗中納入的5146例患者進行的薈萃分析中,ProGRP在SCLC診斷中的敏感性和特異性分別為0.716(95%CI:0.688-0.743)和0.921(95%CI: 0.909-0.932)[40].Elecsys? ProGRP檢測的臨床表現與這些結果完全一致.該Elecsys?ProGRP檢測多中心評估的數據表明,ProGRP是SCLC的特異性腫瘤標志物,可用于肺癌的鑒別診斷.Elecsys?ProGRP檢測在血清中的穩定性增加,在臨床實驗室常規使用中具有明顯的優勢,因為血清是腫瘤標志物檢測的首選樣本.目前正在進行一項對ProGRP在治療監測中的應用研究,以及在相同采集樣本中測定和分析其他腫瘤標志物(CEA、NSE、CYFRA 21-1)的研究.
本文的補充數據可以在網上找到(http://dx. doi.org/10.1016/j.cca.2014.09.015.)
利益沖突
Catharina M. KORSE、Xiuyi ZHI、Xiaotong ZHANG、Ling QIU、Daan van den BROEK、José M. ESCUDERO、Jens STANDOP、Mu HU和Rafael MOLINA沒有聲明利益沖突.Stefan HOLDENRIEDER已經收到了Roche講座的酬金.Andrea GEISTANGER、Birgit WEHNL和Marcus-Rene LISY是Roche DIAGNOSTICS雇員.
致謝
我們感謝Christine ENGEL的生物統計支持.感謝Roche DIAGNOSTICS提供了對該手稿的第三方書面協助的支持.

