N-(2-丙酸)-芳甲酰腙二對甲基芐基錫配合物的合成、晶體結構及生物活性
張志堅蔣伍玖劉洋鄺代治庾江喜朱小明譚宇星
N-(2-丙酸)-芳甲酰腙二對甲基芐基錫配合物的合成、晶體結構及生物活性
張志堅蔣伍玖劉洋鄺代治庾江喜朱小明譚宇星*
(衡陽師范學院化學與材料科學學院,功能金屬有機材料湖南省普通高等學校重點實驗室,衡陽421008)
二對甲基芐基二氯化錫分別與N-(2-丙酸)-對硝基苯甲酰腙及N-(2-丙酸)-對叔丁基苯甲酰腙反應,合成了2個取代二芐基錫配合物(C1、C2),通過元素分析、IR、UV-Vis、1H NMR、13C NMR、119Sn NMR、X射線單晶衍射以及熱重分析等表征了配合物結構。測試了配合物對癌細胞H460、HepG2、MCF7以及正常人體肝細胞HL7702的體外抑制活性;在Tris-HCl緩沖溶液中,以EB作為熒光探針,用熒光光譜法初步研究了配合物與小牛胸腺DNA的相互作用。結果表明:配合物C1、C2對3種癌細胞都有較好的抑制作用,配合物C2對HL7702的細胞毒性遠小于C1;配合物C1、C2與小牛胸腺DNA作用均是插入結合作用所致。
有機錫配合物;酰腙;合成;晶體結構;生物活性
0 引言
在20世紀60年代末,順鉑抗癌作用的發現及臨床應用,開辟了金屬配合物抗癌藥物研究的新領域。隨著人們對金屬配合物藥理作用認識的進一步深入,新的高效、低毒、具有抗癌活性的金屬化合物不斷被合成出來[1-4]。自1980年Crowe[5]首次報道二烴基錫化合物具有抑制癌細胞增殖作用以來,有機錫化合物在抗癌藥物領域受到了人們的廣泛關注[6-8],與其他結構類型的有機錫化合物相比,二烴基錫化合物通常具有更好的抗癌活性[9-10]。因此,利用具有生物活性基團的配體同二烴基錫反應制備新型有機錫配合物并研究其抗癌活性,這一工作就顯得更加重要。
酰腙類化合物是由酰肼和醛酮縮合而得的產物,分子中有酰基氧、亞胺基氮和其他取代基上的配位原子,且由于酰腙基團存在酮式和烯醇式,使酰腙化合物表現出多樣的配位形式和較強的生物活性[11-13]。近年來,國內外許多研究人員發現酰腙類化合物具有抗癌、殺菌、殺蟲、消炎等多種活性[14-16],且其代謝產物均低毒或無毒。
因此,本文采用二對甲基芐基二氯化錫與N-(2-丙酸)-芳甲酰腙反應,合成了2個取代芐基錫配合物,初步研究了配合物對癌細胞及正常人體細胞的體外抑制活性,以及與小牛胸腺DNA的相互作用,為篩選具有更多、更高生物活性以及新型、高效、低毒、廣譜的金屬抗癌藥物提供一定的理論基礎。
1 實驗部分
1.1 儀器和試劑
IR用日本島津Prestige-21紅外光譜儀(4 000~400 cm-1,KBr壓片)測定;1H、13C和119Sn NMR用 Bruker AVANCE-500核磁共振儀測定;元素分析用PE-2400元素分析儀測定;晶體結構用Bruker SMART APEXⅡCCD單晶衍射儀測定;熒光光譜用日本日立F-7000熒光光譜儀測定;紫外光譜用日本島津公司UV-2550型紫外-可見光譜儀測定;熱重用德國NETZSCH TG 209 F3熱重分析儀;熔點用北京泰克X-4雙目體視顯微熔點測定儀測定(溫度計未經校正)。
N-(2-丙酸)-芳甲酰腙和二對甲基芐基二氯化錫參考文獻[17-18]方法合成。溴化乙錠(EB)、小牛胸腺DNA、三羥甲基氨基甲烷(Tris)為Sigma-Aldrich公司產品,其它試劑均為分析純,溶劑參考文獻[19]方法純化,水為超純水。Tris-HCl(0.01mol·L-1)緩沖溶液通過稱取一定量Tris用0.1 mol·L-1的鹽酸溶液調至pH值為7.40,使用前配制;小牛胸腺DNA的純度通過比較260和280 nm處的吸光度來確定(A260/A280=1.8~1.9),用所需pH值條件下緩沖溶液配制,濃度通過測定260 nm處的吸光度計算而得(ε260=6 600 L· mol-1·cm-1),其儲備液置于4℃保存;溴化乙錠溶液通過稱取適量溴化乙錠固體,用pH=7.40的Tris-HCl(0.01 mol·L-1)緩沖溶液配制。
1.2 配合物的合成
于50 mL圓底燒瓶中,加入1 mmol N-(2-丙酸)-對硝基苯甲酰腙或N-(2-丙酸)-對叔丁基苯甲酰腙,1 mmol二對甲基芐基二氯化錫,30 mL甲醇,攪拌回流10 h。冷卻,過濾,蒸除溶劑,用甲醇重結晶,得淡黃色晶體C1或C2。

圖1 配合物的合成Fig.1 Synthesis of the complexes
配合物C1:產率75%。m.p.118~120℃(dec)。元素分析(C54H58N6O12Sn2):實測值(計算值,%):C,53.21 (53.14);H,4.73(4.79);N,6.92(6.89)。IR(KBr,cm-1):3 084,3 022 ν(Ar-H),2 920 ν(C-H),1 637 ν(C=N),1 616,1 327 ν(COO),1 527 ν(C=N-N=C),1 209 ν(C-O),590 ν(Sn-O),555 ν(Sn-O-Sn),503 ν(Sn-N),460ν(Sn -C)。1H NMR(500 MHz,CDCl3):δ 8.28(d,J=8.7 Hz,2H),8.10(d,J=8.7 Hz,2H),6.83~6.77(m,8H),3.28(s,4H),2.15(s,6H),2.07(s,3H)。13C NMR(125 MHz,CDCl3):δ 172.65,169.20,153.66,149.85,139.14,135.15, 133.15,129.63,128.91,128.21,123.21,50.82,36.43,20.86,12.94。119Sn NMR(Me4Sn,187 MHz,CDCl3):δ -636.40。
配合物C2:產率71%。m.p.118~120℃(dec)。元素分析(C31H38N2O4Sn):實測值(計算值,%):C,59.89(59.92);H,6.17(6.16);N,4.51(4.51)。IR(KBr,cm-1): 3 045,3 020 ν(Ar-H),2 960,2 866 ν(C-H),1 666 ν(C =N),1 606,1 392 ν(COO),1 581 ν(C=N-N=C),1 205 ν(C-O),596 ν(Sn-O),540 ν(Sn-O-Sn),503 ν(Sn-N),460 ν(Sn-C)。1H NMR(500 MHz,CDCl3):δ 7.95(d,J= 8.3 Hz,2H),7.47(d,J=8.3 Hz,2H),7.29(d,J=7.8 Hz,1H),7.19(d,J=7.8 Hz,1H),6.87(m,6H),3.10(s,4H),2.20(s,6H),2.11(s,3H),1.38(s,9H)。13C NMR(125 MHz,CDCl3):δ 174.71,155.83,138.48,135.03,132.65, 129.27,129.23,129.10,128.40,127.96,125.20,50.89,35.09,31.20,21.24,20.91,13.06。119Sn NMR(Me4Sn,187 MHz,CDCl3):δ-509.34。
1.3 晶體結構測定
選取尺寸為0.20 mm×0.18 mm×0.18 mm(C1)和0.23 mm×0.21 mm×0.21 mm(C2)的配合物晶體,在Bruker SMART APEXⅡCCD單晶衍射儀上,采用經石墨單色化的Mo Kα射線(λ=0.071 073 nm),以φ~ω掃描方式收集衍射數據。全部數據經Lp因子和多重掃描吸收校正。晶體結構由直接法解出,全部非氫原子坐標在差值Fourier合成中陸續確定,氫原子H6A(C1),H4(C2)為差值Fourier合成給出氫原子在晶胞中的位置坐標,其余為理論加氫法給出氫原子在晶胞中的位置坐標。對氫原子和非氫原子分別采用各向同性和各向異性熱參數進行全矩陣最小二乘法修正,全部結構分析計算工作采用SHELX-97程序系統完成[20]。
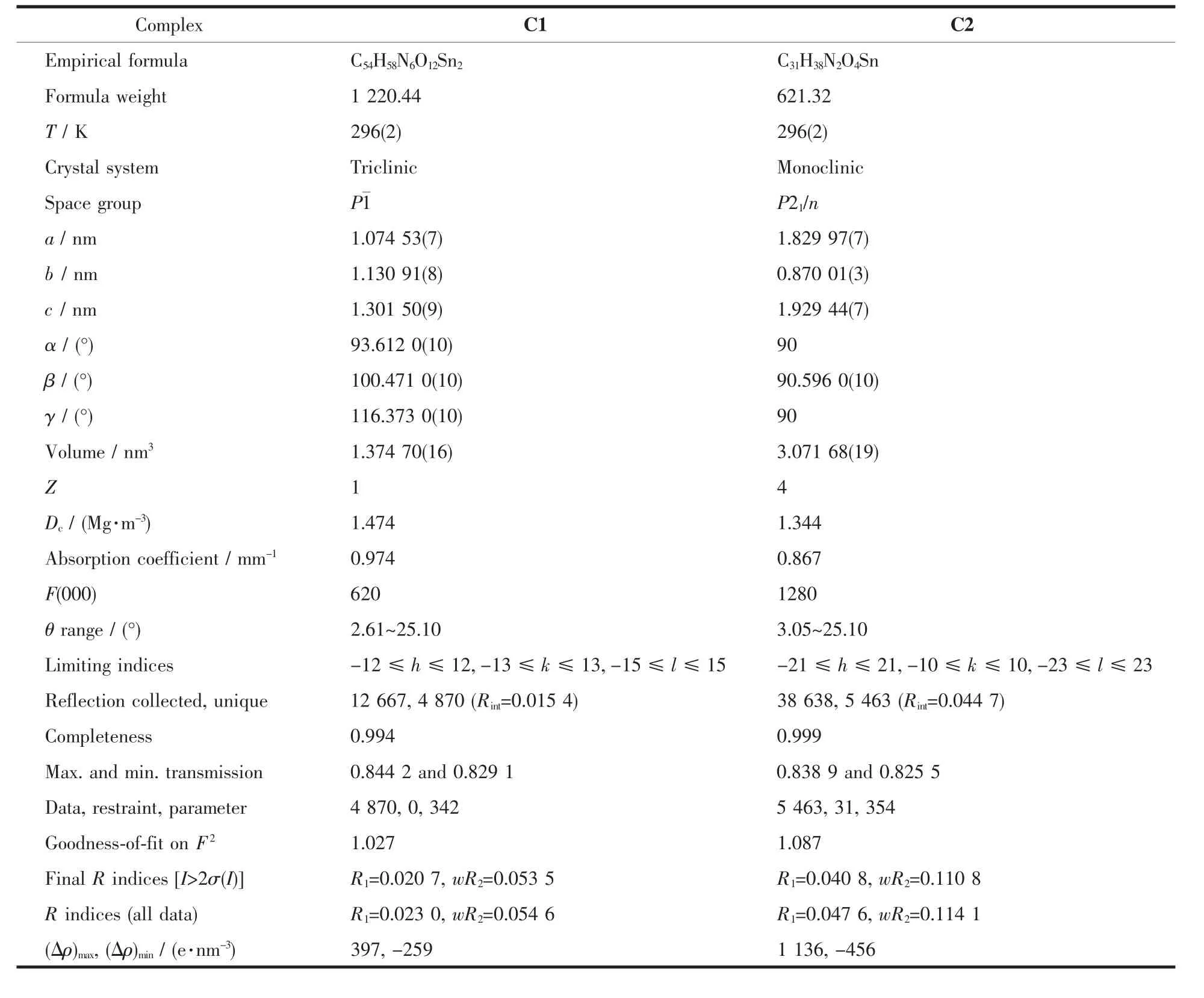
表1 配合物的晶體學數據Table1 Crystallographic data of complexes C1 and C2
CCDC:1547502,C1;1547503,C2。
1.4 紫外光譜測定
在室溫下,用DMSO分別配置濃度為1×10-4mol·L-1的C1、C2溶液,25℃下分別測試它們的紫外-可見吸收光譜,樣品測試均使用測日本島津公司UV-2550型紫外-可見光譜儀。
1.5 體外抗癌活性測定
將待測藥物溶于少量DMSO,用水稀釋至所需濃度,保持最終wDMSO<0.1%。MCF7、HepG2、H460細胞株取自美國組織培養庫(ATCC),HL-7702細胞株購自中國科學院生物化學與細胞生物學研究所。HL-7702細胞株用含10%胎牛血清,2%L-谷氨酰胺的RPMI 1640(GIBICO公司)培養基,MCF7、HepG2、H460細胞株用含10%胎牛血清的RPMI 1640(GIBICO公司)培養基,在5%(體積分數)CO2、37℃飽和濕度培養箱內進行體外培養。體外抗癌藥敏試驗是通過MTT法測定。數據處理使用Graph Pad Prism version 7.0程序,化合物IC50通過程序中具有S形劑量響應的非線性回歸模型進行擬合得到。
1.6 與DNA相互作用實驗
在5 mL容量瓶中分別加入小牛胸腺DNA、EB及不同濃度的配合物溶液,混勻,25℃下放置3.5 h,分別掃描熒光光譜,激發波長為258 nm,發射波長見圖譜,激發和發射光譜掃描狹縫寬度均為5.0 nm。
2 結果與討論
2.1 譜學研究
從配合物C1和C2的紅外譜圖中可以看出,C1和C2中羧基的反對稱伸縮振動峰和對稱伸縮振動峰分別出在1 616,1 385 cm-1和1 606,1 392 cm-1處,反對稱伸縮振動頻率和對稱伸縮振動頻率之差分別為231和214 cm-1,表明2個配合物中的羧酸根均是以單齒形式與Sn配位[21]。此外,C1和C2配位鍵的特征峰ν(Sn-O)、ν(Sn-O-Sn)、ν(Sn-N)和ν(Sn-C)分別位于590、555、503、460 cm-1和596、540、503、460 cm-1處[22-23],表明有機錫配合物的形成,并且初步證實2個配合物有著相似的化學結構。
在1H NMR譜中,配合物各組峰的積分面積之比與預期結構的各組質子數相對吻合[24];從譜圖中可以看到,配合物C1和C2中與錫原子相連的對甲基芐基的亞甲基質子分別出峰在δ=3.28,3.10,其峰形是由一個正常的單峰和一對小衛星峰組成。究其原因,這是由于119Sn-H耦合的結果[25],其耦合常數JSn-H分別為111.0和89.7 Hz;2個配合物的其它氫質子出峰也基本保持一致,進一步說明了2個配合物具有相似的化學結構。在13C NMR譜中,其各組峰與理論推測結構碳原子數相吻合[24],與X射線單晶衍射結果一致。在119Sn NMR譜中,C1和C2分別在-636.40和-509.34處呈現一個單峰,表明2個配合物中均僅存在一種單一的有機錫化合物。
2.2 晶體結構

圖2 配合物C1的分子結構圖(橢球率30%)Fig.2 Molecular structure of complex C1 with 30% probability ellipsoids

圖3 配合物C2的分子結構圖(橢球率30%)Fig.3 Molecular structure of complex C2 with 30% probability ellipsoids
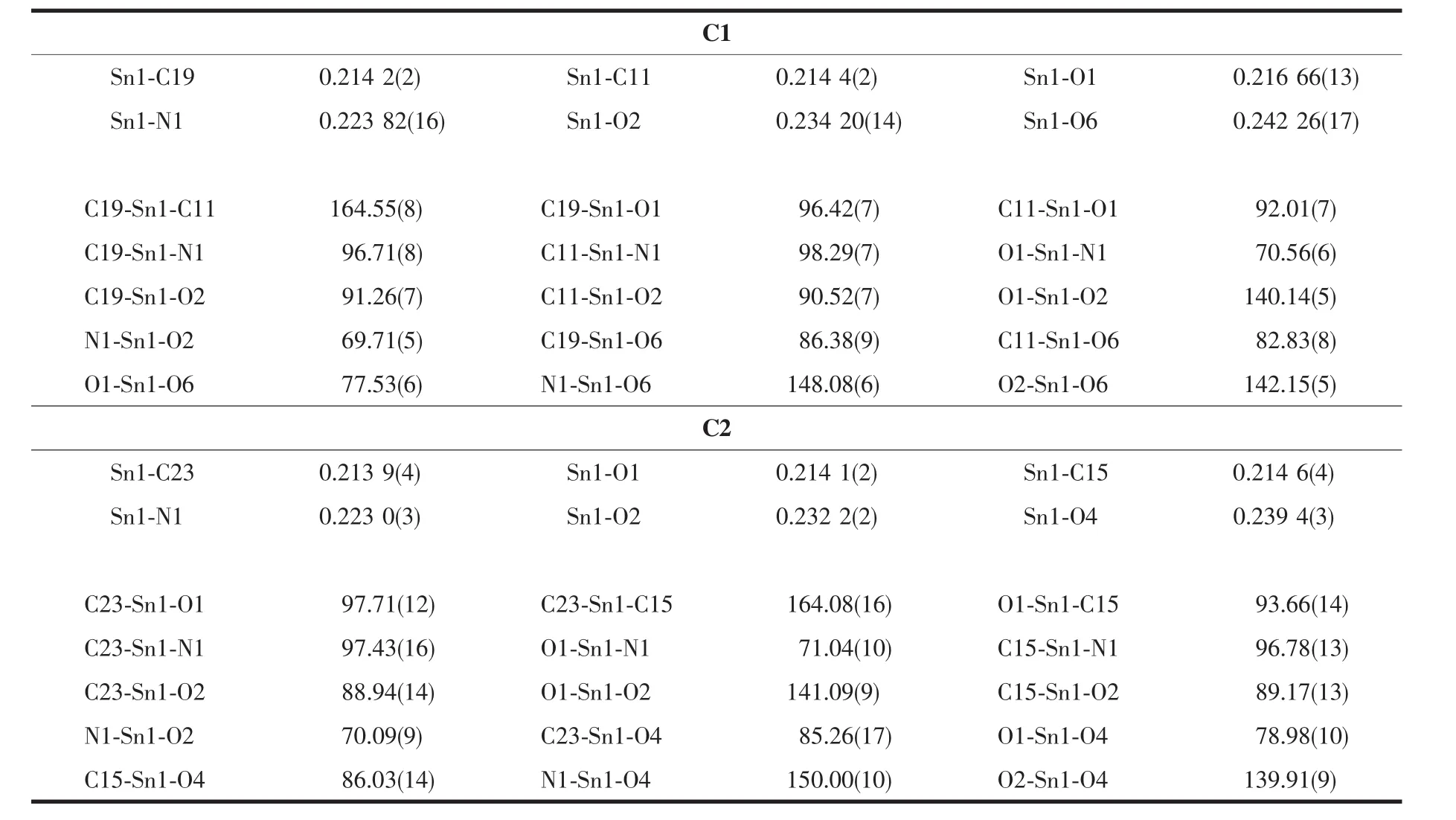
表2 配合物的部分鍵長和鍵角Table2 Selected bond lengths(nm)and bond angles(°)of the complexes
配合物的主要鍵長和鍵角數據列于表2,分子結構見圖2、3。2個配合物均為雙錫核分子,存在1個Sn2O2平面中心四元環,環的中心就是分子的對稱中心。四元環由羧基氧原子以μ-橋聯配位Sn原子,且與2個錫原子的鍵長不等,其中C1中Sn1-O2 0.234 20(14)nm,C2中Sn1-O2 0.232 2(2)nm,均屬于正常Sn-O共價鍵長;而C1中Sn1-O2i0.270 3(15) nm,C2中Sn1-O2i0.283 51(25)nm,大于Sn-O共價鍵長,但是小于錫原子與氧原子范氏半徑之和,比文獻報道[26-27]相似配合物的Sn-O略長。
在配合物C1結構中,Sn1與來自配體中的2個氧原子O1和O2,1個亞氨基氮原子N1,1個配位甲醇氧原子O6,來自2個對甲基芐基中的亞甲基碳原子C11和C19以及來自另一個配體分子中的O2i等配位,形成七配位五角雙錐構型。O1、O2、O6、N1、O2i占據了赤道平面的5個位置,2個亞甲基碳原子C11和C19則占據了該平面兩側的軸向位置,軸向C11-Sn1-C19鍵角為164.55(8)°,比180°小了15.45°,且赤道平面的5個原子與中心錫原子的鍵長不等(dSn1-O1=0.216 66(13)nm;dSn1-O2=0.234 20(14)nm;dSn1-O6=0.242 26(17)nm;dSn1-N1=0.223 82(16)nm;dSn1-O2i=0.270 3(15)nm),其差值為0.007 16~0.053 64 nm,且鍵角也不相等(∠O1-Sn1-O6=77.53(6)°;∠O1-Sn1-N1=70.56(6)°;∠N1-Sn1-O2=69.71(5)°;∠O2-Sn1-O2i=65.27°;∠O6-Sn1-O2i=76.95°),因此該配合物中心錫原子為七配位畸變五角雙錐構型。配合物C2與C1分子結構類似,鍵參數差異不大,中心錫原子也為七配位畸變五角雙錐構型。在2個配合物結構中,Sn-N鍵長為:C1:0.223 82(16)nm,C2:0.223 0(3) nm,與文獻報道相似[28-29]。
2.3 熱穩定性研究
為了研究配合物的熱穩定性,采用NETZSCH TG 209 F3熱重分析儀,在空氣氛下,加熱速度為20℃·min-1,氣體流速為20 mL·min-1,在40~800℃范圍內對配合物進行熱重測試。如圖4、5所示,隨溫度的升高,配合物發生相似的失重過程。在初始階段40~170℃,配合物C1失重為5.52%(理論值:5.24%),C2為5.26%(理論值:5.15%),分別對應配合物失去2個配位甲醇分子;配合物C1、C2的中間失重階段均無明顯的平臺階段,在170~800℃范圍內連續失重,對應配合物分子失去2個N-(2-丙酸)-芳甲酰腙配體及4個對甲基芐基,最終穩定在約24.55%(C1)和24.23%(C2),殘余物與SnO2的計算含量24.58%(C1)及24.14%(C2)吻合。上述熱分析結果表明配合物C1、C2分別在120、135℃之前可穩定存在。
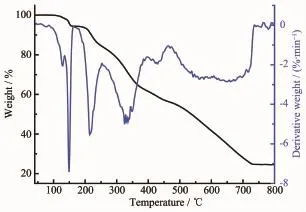
圖4 配合物C1的熱重分析Fig.4 Thermogravimetric analysis curve of complex C1
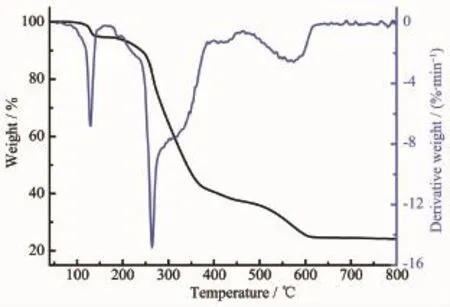
圖5 配合物C2的熱重分析Fig.5 Thermogravimetric analysis curve of complex C2
2.4 紫外光譜
配合物C1、C2的紫外-可見吸收光譜如圖6所示。配合物C1、C2分別在348和326 nm處有較大吸收,推測其原因,是由于配合物C1中苯環上的取代基(硝基)是生色基團,使得其吸收峰向長波方向移動;而C2中苯環上取代基(叔丁基)中C-H與苯環產生超共軛效應,也使苯環的吸收帶紅移,吸收強度增大,但是這種助色作用相對較弱[30]。

圖6 配合物C1、C2的紫外-可見光譜圖Fig.6 UV-Vis of the complexes
2.5 體外抗癌活性研究
表3列出了配合物C1、C2和卡鉑對體外培養癌細胞NCI-H460(人肺癌細胞)、HepG2(人肝癌細胞)、MCF7(人乳腺癌細胞)以及HL7702(正常人體肝細胞)的抑制活性。從表中數據可知,配合物C1、C2對3種癌細胞都有較好的抑制作用,尤其是配合物C2對H460和MCF7的抑制作用均優于卡鉑,對HepG2的抑制作用與卡鉑相當;在對正常人體細胞毒性試驗中,配合物C1、C2對HL7702細胞毒性均大于卡鉑,但配合物C2對HL7702的細胞毒性遠小于C1,故配合物C2有望進一步化學優化作為抗癌藥物的候選化合物;分析配合物C1、C2在正常人體細胞毒性試驗中差異原因可能與配體分子中苯環上取代基有關[31-32]。
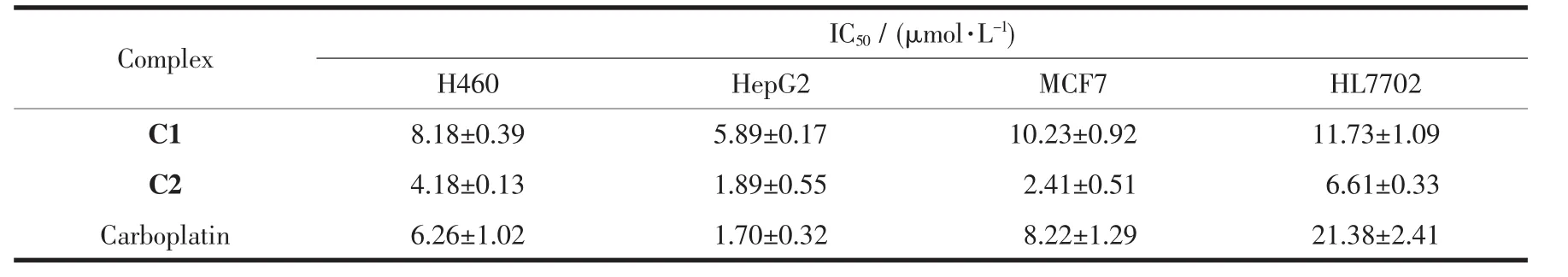
表3 配合物對癌細胞的體外抑制活性Table3 Inhibition action of complexes to cancer cell in vitro
2.6 配合物與DNA-EB作用的熒光光譜研究
溴化乙錠(EB)是一種熒光染料,但其本身的熒光很弱。在DNA溶液中,EB能平行地嵌入到雙螺旋DNA內部的堿基對之間,從而使熒光顯著增強。當配合物與EB的DNA溶液共存時,便會發生競爭反應,配合物可能把EB從DNA雙螺旋中擠出,導致熒光強度發生猝滅,因而EB可用作DNA結構的熒光探針[33]。
圖7、8分別為不同濃度的配合物C1及C2對EB-DNA復合體系的熒光淬滅曲線。加入配合物C1或C2后,DNA-EB體系的熒光均明顯降低,說明配合物C1或C2的存在使DNA-EB體系的熒光產生了猝滅。根據經典Stern-Volmer方程[34]:I0/I=1+Ksqr,由曲線擬合推斷其作用屬于靜態猝滅[35],分別計算出配合物C1、C2與DNA作用的猝滅常數Ksq為3.16和1.99,比文獻[36-37]報道的結合常數大,其大小定量地反映出配合物與DNA插入作用的能力。通過比較結合常數可以看出配合物C1、C2與DNA存在較強的插入作用,推測可能是配合物的中心錫原子與DNA分子中的堿基基團配位結合,配合物中的端基配體芳環插入到DNA的堿基對中,競爭了EB與DNA的結合,把EB從DNA分子的堿基對中擠出。結合配合物對癌細胞的體外抑制活性分析,配合物C1、C2的抗腫瘤活性與DNA的結合能力相關,殺死腫瘤細胞很可能是通過配體和有機錫的協同效應[38]與DNA相互鍵合所致[33]。
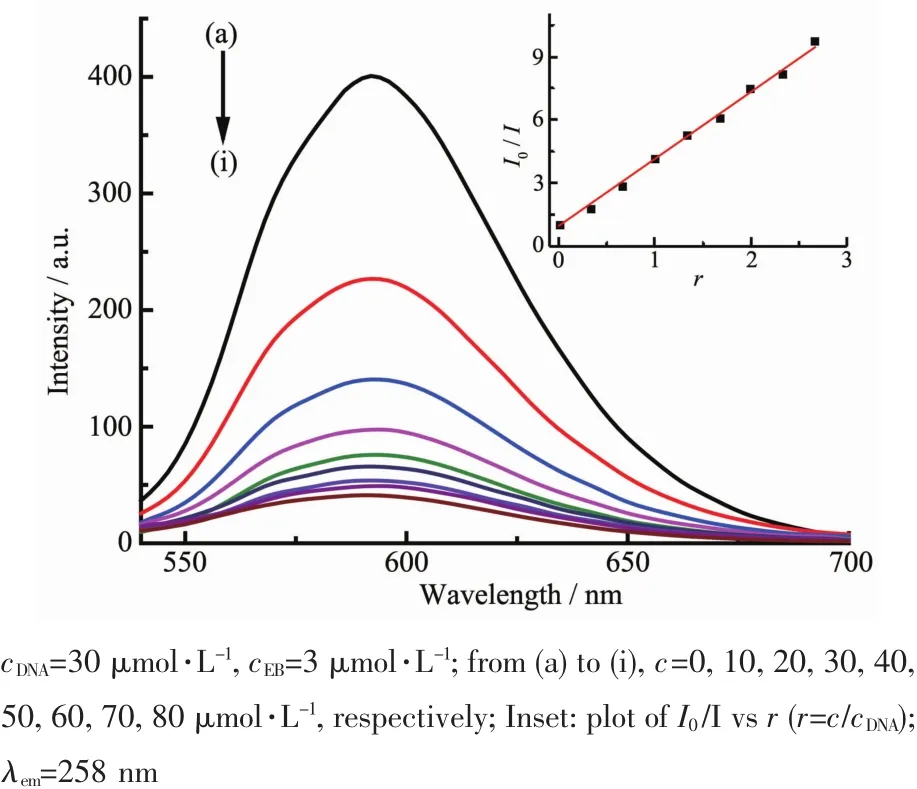
圖7 配合物C1與EB-DNA體系相互作用的熒光光譜圖Fig.7 Effect of complex C1 on the fluorescent spectra of EB-DNA system
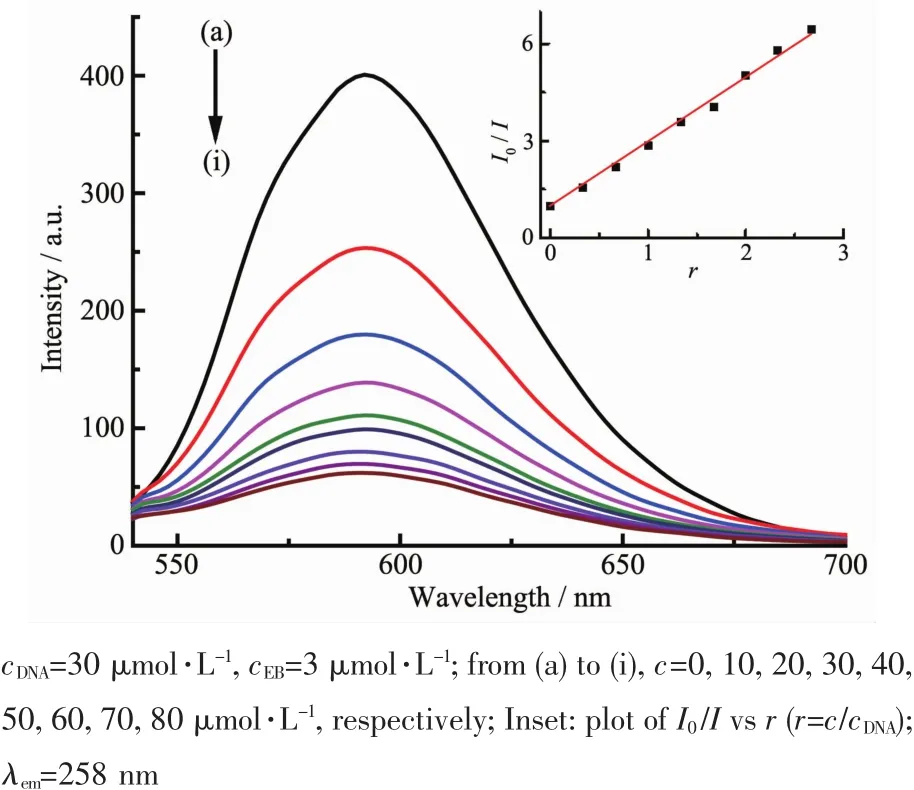
圖8 配合物C2與EB-DNA體系相互作用的熒光光譜圖Fig.8 Effects of complex C2 on the fluorescent spectra of EB-DNA system
3 結論
二對甲基芐基二氯化錫分別與N-(2-丙酸)-對硝基苯甲酰腙及N-(2-丙酸)-對叔丁基苯甲酰腙反應,合成了2個取代芐基錫配合物(C1、C2)。結構分析表明,兩個配合物分子均為雙錫核分子,以Sn2O2四元環為中心對稱,且錫原子與配位原子形成七配位畸變五角雙錐構型。熱分析結果表明,在空氣氛下,配合物C1在120℃、C2在135℃以下可穩定存在。研究了配合物C1、C2對癌細胞H460、HepG2、MCF7以及正常人體肝細胞HL7702的體外抑制活性,結果表明配合物C1、C2對3種癌細胞都有較好的抑制作用,并且C2對HL7702的細胞毒性遠小于C1,故配合物C2有望作為抗癌藥物的候選化合物;在Tris-HCl緩沖溶液中,以EB作為熒光探針,用熒光光譜法初步研究了配合物與小牛胸腺DNA的相互作用,結果表明配合物C1、C2與小牛胸腺DNA作用是插入結合作用所致。
Supporting information is available at http://www.wjhxxb.cn
[1]Albert J,Bosque R,Crespo M,et al.Dalton Trans.,2015,44 (30):13602-13614
[2]Fang S,Chen L,Yu M,et al.Org.Biomol.Chem.,2015,13 (16):4714-4726
[3]Zou B Q,Lu X,Qin Q P,et al.RSC Adv.,2017,7(29):17923-17933
[4]Yan B R,Lü X Y,Du H,et al.Chem.Pap.-Chem.Zvesti, 2016,70(7):983-993
[5]Crowe A J,Smith P J.Atassi Ghanem.Chem.-Biol.Interact., 1980,32(1/2):171-178
[6]Xuan H,Zhang J,Wang Y,et al.Bioorg.Med.Chem.Lett., 2016,26(2):570-574
[7]Salam M A,Hussein M A,Ramli I,et al.J.Organomet.Chem., 2016,813:71-77
[8]Tabassum S,Yadav S,Arjmand F.Inorg.Chim.Acta,2014, 423B:38-45
[9]Sirajuddin M,Ali S,McKee V,et al.RSC Adv.,2014,4(101): 57505-57521
[10]Roy M,Roy S,Singh K S,et al.New J.Chem.,2016,40(2): 1471-1484
[11]Ferreira I P,Piló E D L,Recio-Despaigne A A,et al.Bioorg. Med.Chem.,2016,24(13):2988-2998
[12]Mohanraj M,Ayyannan G,Raja G,et al.J.Photochem. Photobiol.B,2016,158:164-173
[13]Sedaghat T,Ebrahimi Y,Carlucci L,et al.J.Organomet. Chem.,2015,794:223-230
[14]HAN Jie(韓杰),ZHOU Xiao-Xia(周曉霞),CHEN Si-Bao(陳思寶),et al.Chin.J.Org.Chem.(有機化學),2014,34(4): 741-748
[15]REN Zheng(任爭),KANG Yu-Hua(康玉華),SHI Zhen-Yu (石貞玉),et al.Acta Pharm.Sin.(藥學學報),2010,45(9): 1109-1115
[16]Foscolos A S,Papanastasiou I,Foscolos G B,et al.Med. Chem.Commun.,2016,7(6):1229-1236
[17]HE Shui-Yang(何水樣),CAO Wen-Kai(曹文凱),CHEN Jun-Li(陳軍利),et al.Chem.J.Chinese Universities(高等學校化學學報),2002,23(6):991-995
[18]Sisido K,Takeda Y,Kinugawa Z,et al.J.Am.Chem.Soc., 1961,83(3):538-541
[19]Armarego W L F,Chai C L L.Purification of Laboratory Chemicals.6th Ed.Oxford:Butterworth-Heinemann,2009.
[20]Sheldrick G M.SHELXTL Version 5.03,Siemens Analytical X-ray Division,Madison,Wisconsin,USA,1994.
[21]Deacon G B,Phillips R J.Coord.Chem.Rev.,1980,33:227-250
[22]Jiang W J,Yang N F,Kuang D Z,et al.Chin.J.Struct. Chem.,2011,30(9):1327-1331
[23]Yang Y,Hong M,Xu L,et al.J.Organomet.Chem.,2016, 804:48-58
[24]Pretsch E,Buhlmann P,Martin B.Structure Determination of Organic Compounds:Tables of Spectral Data.4th Ed. Berlin and Heidelberg:Springer-Verlag,2009.
[25]Hong M,Yin H,Chen S,et al.J.Organomet.Chem.,2010, 695(5):653-662
[26]Baba H S,Dietz C,Lutter M,et al.Organometallics,2015, 34(23):5555-5565
[27]Wagner M,Zobel B,Dietz C,et al.Organometallics,2015, 34(23):5602-5608
[28]Jímenez-Pérez V M,Camacho-Camacho C,Güizado-Rodríuez M,et al.J.Organomet.Chem.,2000,614-615:283-293
[29]Hong M,Yin H,Chen S,et al.J.Organomet.Chem.,2010, 695(5):653-662
[30]Williams D H,Fleming I,Translated by ZHANG Yan(張艷), QIU Di(邱頔),SHI Wei-Feng(施衛峰),et al.Spectroscopic Methods in Organic Chemistry.6th Ed(有機化學中的光譜方法.6版).Beijing:Peking University Press,2015.
[31]Effenberger K,Breyer S,Schobert R.Eur.J.Med.Chem., 2010,45(5):1947-1954
[32]Dandawate P,Khan E,Padhye S,et al.Bioorg.Med.Chem. Lett.,2012,22(9):3104-3108
[33]ZHAO Guo-Liang(趙國良),SHI Xia(施霞),ZHANG Jun-Ping(張均平),et al.Sci.China:Chem.(中國科學:化學), 2010,40(10):1525-1535
[34]XUJin-Gou(許金鉤),WANGZun-Ben(王尊本).Fluorescence Analysis.3rd Ed(熒光分析法.3版).Beijing:Science Press, 2006:64-70
[35]SHAO Ying(邵鶯),TONG Jing-Jing(童晶晶),WU Zhu-Hong (吳祝宏),et al.J.Changzhou Univ.:Nat.Sci.Ed.(常州大學學報:自然科學版),2016,28(6):38-43
[36]ZHENG Jian-Hua(鄭建華),LIU Jun(劉俊),XIAO Yao(肖堯), et al.Chin.J.Appl.Chem.(應用化學),2015,32(5):562-569
[37]ZHAO Guo-Liang(趙國良),SHEN Jin-Bei(沈金杯),SHI Xia (施霞),et al.Chinese J.Inorg.Chem.(無機化學學報),2012, 28(5):959-964
[38]Yin H,Liu H,Hong M,et al.J.Organomet.Chem.,2012, 713(15):11-19
Syntheses,Crystal Structures and Biological Activity of N-(2-Propionic acid)-aroyl Hydrazone Di-p-methylbenzytin Complexes
ZHANG Zhi-JianJIANG Wu-JiuLIU YangKUANG Dai-Zhi YU Jiang-XiZHU Xiao-MingTAN Yu-Xing*
(Key Laboratory of Functional Organometallic Materials of Hengyang Normal University,College of Hunan Province, College of Chemistry and Material Science,Hengyang Normal University,Hengyang,Hunan 421008,China)
Two substituted benzyltin complexes(C1,C2)has been synthesized via the reaction of N-(2-propionic acid)-aroyl hydrazone with di-p-methylbenzytin dichloride.The complexes C1 and C2 have been characterized by IR,UV-Vis,1H NMR,13C NMR119Sn NMR spectra,elemental analysis and the crystal structures have been determined by X-ray diffraction.In vitro antitumor activities of both complexes were evaluated by the 3-(4,5-dimethylthiazoly-2-yl)-2,5-diphenyltetrazolium bromide(MTT)assay against three human cancer cell lines(H460, HepG2,MCF7)and a human cell line(HL7702).Two complexes exhibit strong antitumor activity,moreover,C2 is less toxic than C1.The result of EB fluorescent probe shows the interaction between complexes and calf thymus DNA is intercalation.CCDC:1547502,C1;1547503,C2.
organotin complex;hydrazone;synthesis;crystal structure;biological activity
O614.43+2
A
1001-4861(2017)09-1603-08
10.11862/CJIC.2017.198
2017-05-04。收修改稿日期:2017-08-01。
湖南省自然科學基金(No.2017JJ3003,2016JJ4008,2016JJ5004)和湖南省功能金屬有機材料高校重點實驗室開放基金項目(No.GN16K03)資助。
*通信聯系人。E-mail:358050086@qq.com

