聯合補充維生素D、膠原肽和鈣對成骨細胞發育的影響
朱小語,陳曉文,許 丹,律 穎,許雅君,2
(1 北京大學公共衛生學院,北京 100191;2食品安全毒理學研究與評價北京市重點實驗室,北京 100191)
聯合補充維生素D、膠原肽和鈣對成骨細胞發育的影響
朱小語1,陳曉文1,許 丹1,律 穎1,許雅君1,2
(1北京大學公共衛生學院,北京 100191;2食品安全毒理學研究與評價北京市重點實驗室,北京 100191)
目的:觀察聯合補充維生素D、膠原肽和鈣對MC3T3-E1成骨細胞增殖及對骨保護素細胞內核因子κB受體活化因子配體(receptor activator of NF-κB ligand,RANKL)、骨保護素(Osteoprotegerin,OPG)基因表達的影響。方法:α-MEM培養基培養MC3T3-E1細胞。檢測Ca2+(20 μg/mL)、維生素D(0、10-12、10-11mol/L)、膠原肽(0、50、100μg/mL)三者交互作用劑量對MC3T3-E1細胞增殖的作用及RANKL、OPG mRNA表達。結果:維生素D、膠原肽和鈣交互劑量作用下細胞增殖水平無明顯差異。維生素D聯合鈣能夠明顯降低RANKL mRNA表達水平,提高OPG mRNA表達水平,降低RANKL/OPG比值。而膠原肽聯合鈣對RANKL以及 OPG mRNA表達無明顯影響。結論:維生素D聯合鈣可通過抑制小鼠成骨細胞RANKL mRNA表達、促進OPG mRNA表達,從而促進骨的形成,抑制骨的吸收。維生素D和鈣聯合補充膠原肽,對成骨細胞RANKL,OPG mRNA表達并無明顯影響。
MC3T3-E1;維生素D;膠原肽;RANKL;OPG
骨質疏松癥作為常見慢性非傳染性疾病,已成為全球主要公共衛生問題[1]。骨的發育受骨形成和骨吸收雙向影響,并在多種代謝通路調節下維持平衡和穩定。維生素D、膠原肽和鈣作為維持機體健康的重要營養物質,在骨骼發育上起到至關重要的作用[2]。聯合補充維生素D和鈣,具有預防骨質疏松的作用[3-4]。同時,膠原肽在促進鈣磷等礦物質吸收和調節骨骼發育中發揮重要作用[5-6]。體外試驗表明,單獨補充小分子肽類,能夠通過調節骨保護素/核轉錄因子κB受體活化因子配體系統,間接抑制破骨細胞數量及功能[7]。聯合補充小分子多肽和鈣,同樣促進成骨細胞OPG mRNA表達、抑制RANKL mRNA表達,抑制骨吸收[8]。
然而,目前并未有關于維生素D、膠原肽和鈣三者聯合作用的相關實驗報道。為此,本研究采用體外培養成骨細胞為實驗模型,探討聯合補充維生素D、膠原肽和鈣三者對成骨細胞增殖以及RANKL、OPG基因表達的影響,為骨質疏松臨床干預研究提供新思路。
1 材料與方法
1.1 受試物
維生素D3:總脫鈣化固醇,購自Sigma公司,批號47763;膠原肽:Peptan水解膠原肽,平均分子量2 000D;鈣:氯化鈣,Sigma公司購得,批號C7902-500G。
1.2 儀器與試劑
Real time PCR儀(CFX9600,Bio-Rad,美國)、酶標儀(DNM-9602G,北京普朗技術有限公司)、MC3T3-E1細胞(中國醫學科學院基礎醫學研究所基礎醫學細胞中心)、Maxima SYBR Green/Rox qPCR Master Mix(Fermentas,K0222)、TRIzol(Invitrogen,15596018)、α-MEM(Hyclone,SH3026501B)、FBS(Sciencell,0510-500ML)、青霉素-鏈霉素溶液(Beyotime,C0222)、DMSO(Applichem,A3672.0100)、MTT(beyotime,C0009)。
1.3 細胞培養
小鼠MC3T3-E1細胞在含10%胎牛血清、100U/mL青霉素和100μg/mL鏈霉素的α-MEM培養基中培養,置于37°C、5%CO2的體積分數的孵育箱中孵育。每2天更換1次培養基,待細胞基本融合后傳代。
1.4 細胞增殖實驗
MTT法檢測細胞增殖分化能力,以7×103細胞/孔密度接種至96孔板中,每孔200μL,孵育16h后,吸棄培養液,各組設6個復孔,每孔加入受試物200μL,終質量濃度如表1。孵育箱培養24h,每孔加入MTT液20μL,繼續孵育4h后輕輕吸棄上清液,每孔加入150μL DMSO,水平搖勻,酶聯免疫檢測儀490nm波長處測定各孔吸光度值,結果以OD490表示。
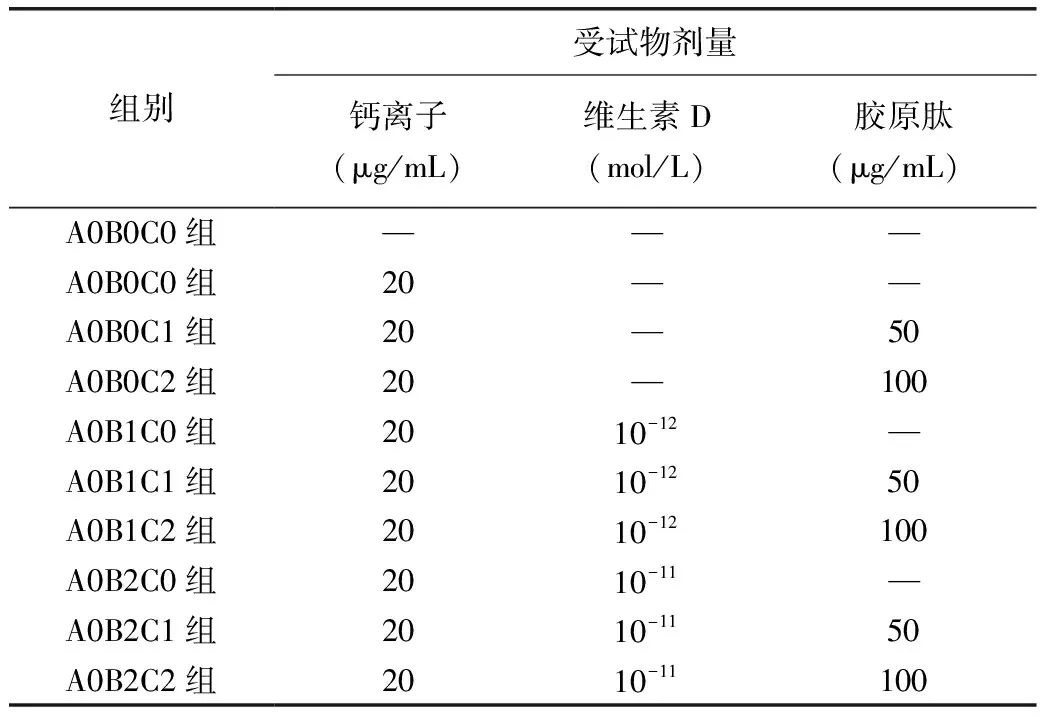
表1 各組受試物劑量
1.5 RANKL和OPG基因表達水平檢測
細胞經72h干預后將其裂解,受試物終質量濃度同表1,Trizol法提取細胞總mRNA。用Maxima SYBR Green試劑盒將總mRNA反轉錄為cDNA,而后采用real-time PCR法檢測RANKL、OPG基因表達水平,GAPDH為參照基因。各組各基因樣本重復3次,25ul體系進行試驗,基因相對表達量用2-ΔΔCt法進行計算。成骨細胞目的基因引物序列如表2所示。

表2 成骨細胞中目的基因引物序列
1.6 統計分析
2 結果與分析
2.1 細胞增殖實驗
如圖1所示,維生素D、膠原肽和鈣三者交互作用干預下,隨著受試物劑量的增加,成骨細胞增殖作用數值有上升趨勢,但無統計學差異。
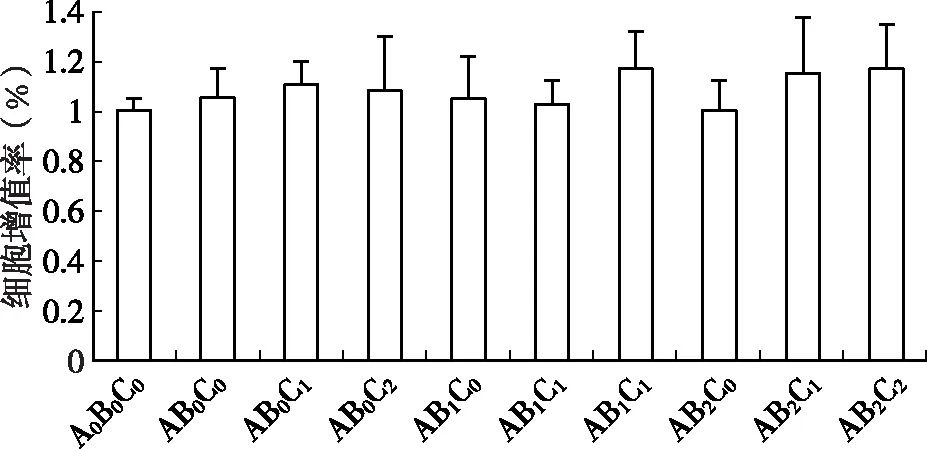
圖1 維生素D、膠原肽和鈣對細胞增殖率的影響
2.2 RANKL和OPG基因表達水平檢測
表3為各劑量組RANKL/OPG mRNA相對表達量數值,圖3分別列出維生素D基因表達水平[圖2(1)、(3)、(4)],以及膠原肽基因表達水平[圖2(2)、(5)、(6)]。圖2(3)可見,與對照組相比10-12mol/L和10-11mol/L劑量組維生素D,RANKL mRNA表達水平明顯降低;圖2(4)可見,與空白對照組相比,維生素D 10-12mol/L和10-11mol/L劑量組OPG mRNA表達水平明顯增高,差別有統計學意義。且在維生素D的干預下,與對照組相比各劑量組的RANKL/OPG比值明顯下降。
然而,膠原肽50μg/mL和100μg/mL劑量組在RANKL mRNA表達水平,OPG mRNA表達水平以及RANKL/OPG比值上與對照組均無明顯差別,如圖2(2)、(5)、(6)所示。
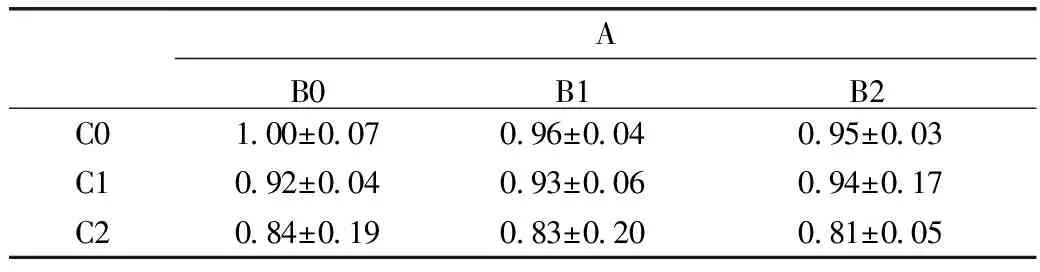
表3 維生素D、膠原肽和鈣對RANKL/OPG mRNA表達量的影響
MC3T3-E1細胞培養基在添加鈣的基礎上,加入不同劑量濃度的維生素D與膠原肽,以觀察二者對于骨發育相關基因表達的影響。維生素D與膠原肽在兩因素兩水平交互作用分析中交互作用有意義,而二者單獨作用顯示維生素D的單獨效應差異有統計學意義,膠原肽的單獨效應差異不顯著。如圖3(1)所示,隨維生素D劑量的增加,RANKL/OPG比值呈降低趨勢,而3(2)中隨著膠原肽劑量的增加,RANKL/OPG比值并無明顯統一的變化趨勢。
3 討論
骨代謝在骨形成和骨吸收過程中維持動態平衡,BMP/Smads、Wnt/β-catenin、RANKL/RANK/OPG、TGF-β、FGF、PDGF、Akt2等信號系統均在骨代謝過程中起到重要的信號調節作用[9-10]。其中,RANKL/RANK/OPG信號系統作為影響骨吸收的重要通路,參與到骨重建過程當中[11]。
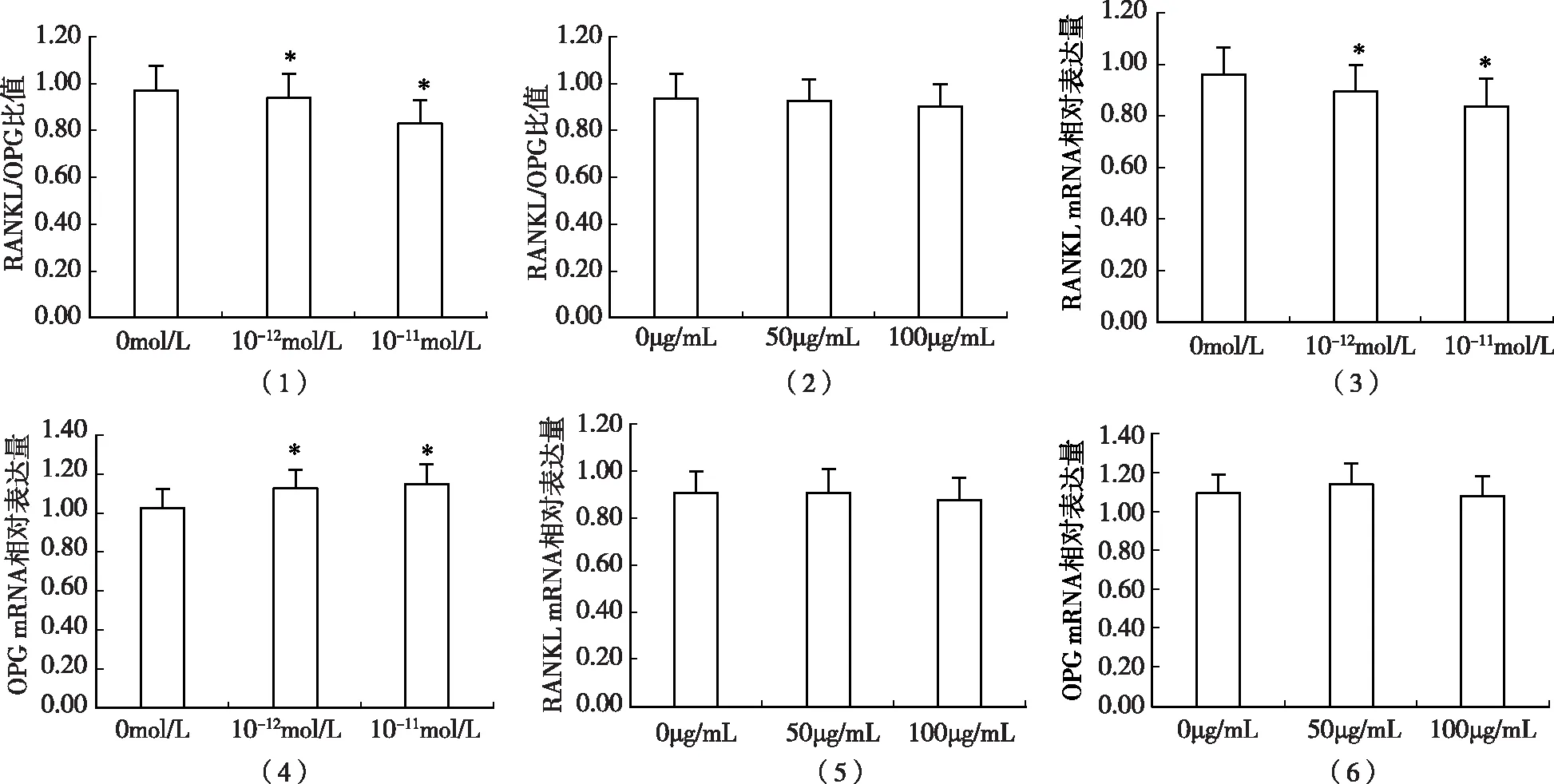
圖2 維生素D、膠原肽和鈣對成骨細胞骨發育相關基因表達的影響
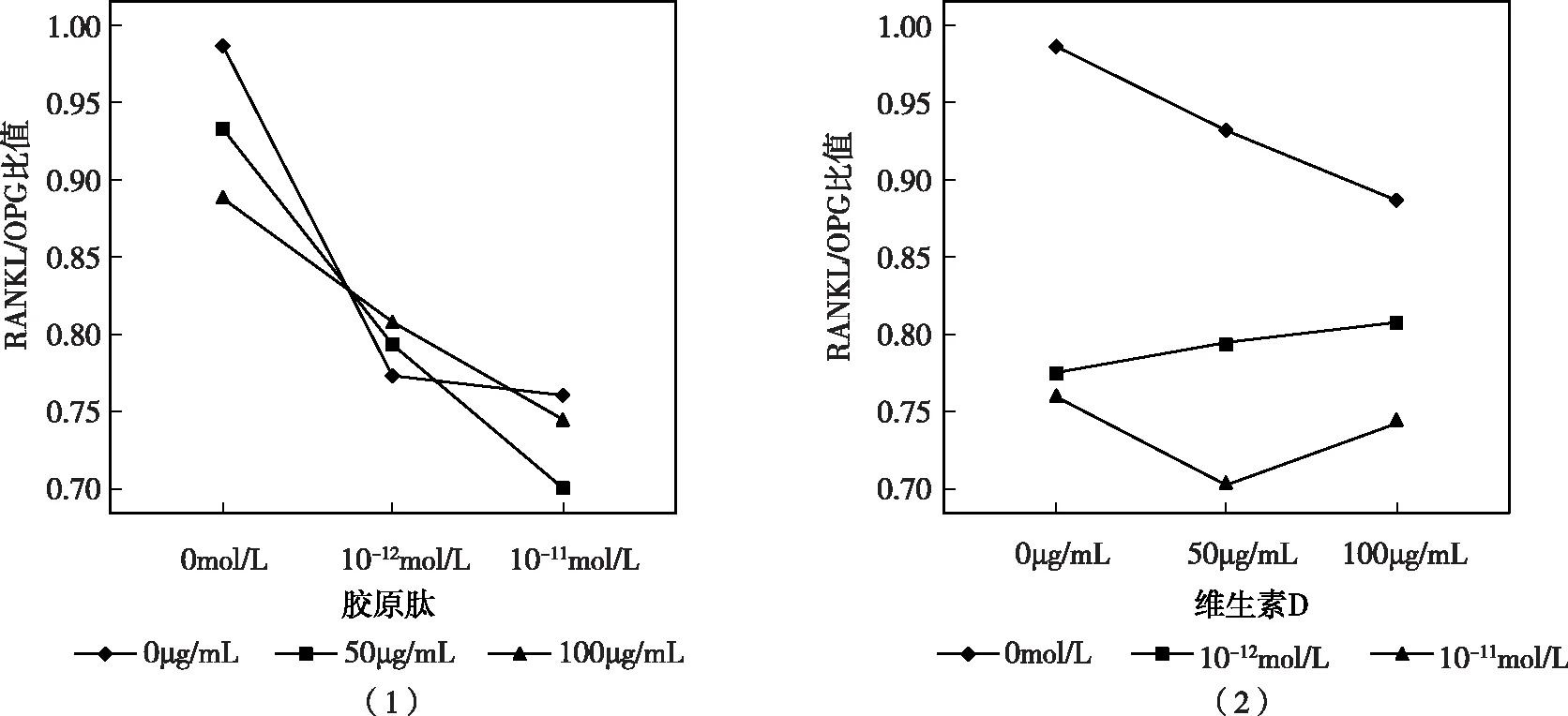
圖3 維生素D、膠原肽和鈣對RANKL/OPG mRNA相對表達量的交互作用影響
本研究以不同劑量濃度的膠原肽、維生素D聯合鈣干預MC3T3-E1細胞,測定RANKL、OPG mRNA表達水平,RT-PCR結果表明,維生素D和膠原肽具有交互作用,可以在聯合鈣的基礎上有效降低RANKL/OPG比值。單獨效應中,維生素D與鈣聯合,OPG mRNA表達明顯增加,RANKL mRNA表達顯著降低。而膠原肽與鈣聯合,對RANKL和OPG mRNA表達均無明顯影響。維生素D作用結果同李長春等人關于1,25(OH)2D3誘導體外細胞成骨分化研究結果一致,表明維生素D與鈣聯合作用,可能與調節維生素D受體表達,間接影響RANKL、OPG基因的表達有關[12]。此外,Erin Gaffney-Stomberg[13]等人在對440名志愿者進行的隨機雙盲安慰劑對照試驗中,發現聯合補充維生素D和鈣可通過調節鈣敏感受體和甲狀旁腺素水平,有效降低RANKL/OPG基因表達水平,將本細胞實驗結果在人群實驗中得到證實。然而,膠原肽與鈣的聯合作用結果同魏麗[8]等人的研究并不一致,膠原肽對RANKL、OPG基因表達的作用并不明顯,可能與聯合作用劑量有關,仍有待進一步研究。
4 結論
維生素D與鈣聯合作用,可通過影響RANKL/RANK/OPG系統平衡,抑制成骨細胞RANKL mRNA表達、促進OPG mRNA表達,抑制破骨細胞分化,抑制骨吸收。維生素D和鈣聯合補充膠原肽,對成骨細胞RANKL、OPG mRNA表達并無明顯影響。◇
[1]Golob AL,Laya MB.Osteoporosis:screening,prevention,and management.[J].Med Clin North Am,2015(99):587-606.
[2]Beto JA.The role of calcium in human aging.[J].Clinical Nutritional Research,2015(4):1-8.
[3]Boonen S,Lips P,Bouillon R,et al.Need for additional calcium to reduce the risk of hip fracture with vitamin D supplementation:evidence from a comparative meta-analysis of randomized controlled trials[J].Journal of Clinical Endocrinology and Metabolism,2007(92):1415-1423.
[4]Lips P,Gielen E,van Schoor NM.Vitamin D supplements with or without calcium to prevent fractures.BoneKEy Reports,2014(512):1-6.
[5]Guillerminet F,Beaupied H,et al.Hydrolyzed collagen improves bone metabolism and biomechanical parameters in ovariectomized mice:An in vitro and in vivo study.[J].Bone,2010(46):827-834.
[6]Xu Y,Han X,Li Y.Effect of marine collagen peptides on long bone development in growing rats.[J].J Sci Food Agric,2010(90):1485-91.
[7]吳昆鵬,楊巧珠,等.小分子肽對成骨前體細胞MC3T3-E1骨保護素和核轉錄因子κB受體活化因子配體表達的影響[J].中國組織工程研究與臨床康復,2011,15(24):4375-4378.
[8]魏麗,劉盟,等.蓇密鈣片與馬鹿角多肽對成骨細胞增殖分化的研究[J].中國骨質疏松雜志,2010,6(8):563-570.
[9]熊燕琴,周筠,等.骨代謝信號通路的研究進展[J].中國骨質疏松雜志,2014,20(2):200-204.
[10]曾羿,沈彬.分子信號通路在骨質疏松防治中的研究進展[J].中國骨質疏松雜志,2014,20(3):305-309.
[11]Boyce BF,Xing L.Functions of RANKL/RANK/OPG in bone modeling and remodeling[J].Arch Biochem Biophys,2008(473):139-46.
[12]李長春,孫蓮蓮,等.1,25(OH)2D3在牙乳頭干細胞成骨分化中的作用[J].天津醫藥,2014,42(5):421-423.
[13]Erin Gaffney-Stomberg,Laura J.Lutz,et al.Calcium and vitamin D supplementation maintains parathyroid hormone and improves bone density during initial military training:A randomized,double-blind,placebo controlled trial[J].Bone,2014(68):45-56.
(責任編輯 李婷婷)
Effects of Combined Supplementation of Vitamin D,Collagen Peptides and Calcium on Development of Osteoblasts
ZHU Xiao-yu1,CHEN Xiao-wen1,XU Dan1,LV Ying1,XU Ya-jun1,2
(1Peking University Health Science Center,Beijing 100191,China;2Beijing Key Laboratory of Toxicological Research and Risk Assessment for Food Safety, Beijing 100191, China)

MC3T3-E1;vitamin D;collagen peptide;RANKL;OPG
北京市科技創新基地培育與發展專項(項目編號:Z151100001615035)。
許雅君(1976— ),女,博士,教授,研究方向:營養與疾病。
并列第一作者:朱小語(1990— ),女,碩士研究生,研究方向:營養與疾病;陳曉文(1989— ),男,碩士研究生,研究方向:營養與疾病。

