應用CRISPR/Cas9慢病毒系統(tǒng)建立Nestin基因敲除的小鼠腎足細胞系
王璐萍 陶穎莉 黃平?
應用CRISPR/Cas9慢病毒系統(tǒng)建立Nestin基因敲除的小鼠腎足細胞系
王璐萍 陶穎莉 黃平?
目的 基于CRISPR/Cas9系統(tǒng)構建穩(wěn)定敲除Nestin基因的條件永生性小鼠腎足細胞株(mouse podocyte,MP)。方法 利用Cas9過表達慢病毒構建條件性永生小鼠足細胞Cas9過表達穩(wěn)轉細胞系(CAS9/MP)。設計Nestin基因的3個位點(KO1、KO2、KO3),并構建3對靶向Nestin基因的sgRNA寡核苷酸序列,將其連接進GV371質粒中,測序驗證后,包裝慢病毒顆粒,感染構建好的CAS9/ MP,嘌呤霉素篩選(Puromycin)陽性克隆細胞,Cruiser TM酶切檢測CAS9-sgRNA對目的基因的剪切活性。結果 成功構建了CAS9/MP及GV371-Nes-sgRNA重組載體,CruiserTM酶法驗證表明,CAS9-sgRNA2具有剪切活性。結論 建立能穩(wěn)定敲除Nestin基因的CRISPR/Cas9 慢病毒系統(tǒng),成功獲得Nestin敲除的MP穩(wěn)轉細胞株。為進一步研究Nestin在足細胞中的作用機制奠定基礎。
CRISPR/Cas9 Nestin基因敲除 小鼠腎足細胞
足細胞附著于腎小球基底膜(GBM)的外側,是一種具有復雜細胞骨架系統(tǒng)的高度分化的上皮細胞,是腎小球濾過屏障的有效組成部分[1]。足細胞損傷參與多種腎臟疾病的發(fā)生、發(fā)展[2-4]。巢蛋白(Nestin)作為第Ⅵ類中間絲細胞骨架蛋白,主要表達于足細胞胞漿及初級足突,對維持足細胞的形態(tài)和功能具有重要作用[5]。抑制Nestin可明顯減少足細胞足突數(shù)量[6]。研究表明,細胞骨架蛋白的改變參與了足細胞的損傷過程[7-8]。2015年7月至2016年1月作者應用CASCRISPR/Cas9慢病毒系統(tǒng)構建穩(wěn)定沉默Nestin基因的條件永生性小鼠腎足細胞株,為深入研究Nestin基因在糖尿病腎臟病足細胞中的作用奠定基礎。
1 材料與方法
1.1 主要材料及試劑 (1)細胞株和慢病毒載體:條件性永生小鼠足細胞(mouse podocyte)購自中國醫(yī)學科學院基礎醫(yī)學研究所北京協(xié)和醫(yī)學院基礎學院基礎醫(yī)學細胞中心(3111C0001CCC000230),CAS9蛋白慢病毒質粒(LV-Cas9-Puro)、GV371載體(LV-sgRNA-EGFR)、293T細胞、DH5a細胞購自上海吉盛醫(yī)學科技有限公司。(2)實驗試劑:1640培養(yǎng)基及胎牛血清、胰酶購于四季青公司。Polybrene助感染試劑、Enhanced Infection Solution感染增強劑、慢病毒包裝試劑盒。DNA Marker 、逆轉錄及熒光定量PCR試劑盒(TaKaRa)。T4 DNA連接酶、Bbs I購自New England Biolabs(NEB)公司,質粒抽提試劑盒購自Qiagen 公司,Lipofectamine? 2000 試劑購自Invitrogen公司。本實驗Nestin靶點的設計、寡核苷酸序列、所有引物由上海吉凱基因設計合成。
1.2 方法 (1)CAS9過表達穩(wěn)轉細胞株的構建:在細胞轉染前一天,將處于對數(shù)生長期的小鼠腎足細胞胰酶消化,完全培養(yǎng)基制成(3~5)×104個/ml細胞懸液接種于6孔板中,接種體積2ml/孔,感染時細胞密度20%/孔,分為CON組和OE組,感染條件為Eni.S,MOI為15。感染當天OE組加入Lenti-CAS9慢病毒顆粒15μl進行目的細胞感染實驗。感染3d后進行Puromycine篩選,Puromycin維持濃度2.00μg/ml。qPCR法檢測兩組LV-Cas9-Puro表達豐度,內參基因GAPDH:上游引物序列TGGTGAAGGTCGGTGTGAAC,下游引物序列GCTCCTGGAAGATGGTGATGG,擴增片段為231bp;目的基因LV-Cas9-Puro:上游引物序列GCTGAAAACCTATGCCCACC,下游引物序列GATTGTCTTGCCGGACTGCT,擴增片段為133bp。(2)

表1 靶向Nestin 基因的sgRNA寡核苷酸鏈合成序列

表2 慢病毒感染293T細胞48h培養(yǎng)液病毒顆粒滴度
2 結果
2.1 構建CAS9小鼠腎足細胞穩(wěn)定株 當CON組和OE組細胞密度為80%時,Trizol法提取兩組細胞總RNA,反轉錄成cDNA后qPCR法檢測結果顯示,OE組LV-Cas9-Puro表達豐度是CON組的9731.012 倍(P<0.05)(見圖1),成功構建CAS9小鼠腎足細胞穩(wěn)定株。

圖1 CON組和OE組LV-CAS9的表達豐度(P<0.05)
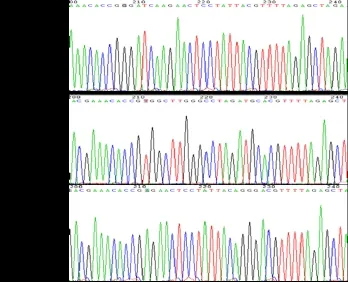
圖2 靶向Nestin基因的Nes-sg RNA的載體測序結果
2.2 重組質粒載體的檢測 重組質粒載體LV-NessgRNA1 、LV-Nes-sgRNA2和LV-Nes-sgRNA3的測序重組質粒基因測序結果顯示,在酶切位點之間插入的片段位置、方向及序列與sgRNA一致,重組質粒構建成功(見圖2)。合成sgRNA寡核苷酸鏈并構建載體:根據(jù)sgRNA設計原則設計3對靶向Nestin基因的sgRNA,在正義鏈模板的5′端添加CACC;反義鏈模板的5′端添加AAAC同時C'端添加C。合成后的寡核苷酸單鏈先通過退火形成雙鏈,連接至Bbs I 酶切線性化的GV371質粒中(GV371-sgRNA1、GV371-sgRNA2、和GV371-sgRNA3),轉化到感受態(tài)細胞大腸桿菌菌株DH5a,用去內毒素質粒小提試劑盒提取質粒,并測序驗證。見表1。(3)Lv-Nes-sgRNA慢病毒顆粒的包裝:將重組病毒質粒LV-Nes-sgRNA1、LV-NessgRNA2和LV-Nes-sgRNA3及包裝質粒混合物Lenti-Easy Packaging Mix分別進行高純度無內毒素抽提,按Invitrogen公司Lipofectamine 2000使用說明進行共轉染293T細胞,培養(yǎng)48h后,收集富含慢病毒顆粒的細胞上清液,濃縮純化后用熒光法測定病毒滴度。見表2。(4)細胞培養(yǎng)和細胞轉染:用包裝好的Lv-NessgRNA慢病毒顆粒去感染CAS9小鼠腎足細胞穩(wěn)轉株。CAS9/MP用含10%胎牛血清的1640培養(yǎng)基于5%CO2,37℃恒溫培養(yǎng)。轉染前24h,取對數(shù)期細胞以(3~5)×104/ml接種到12孔板培養(yǎng),轉染16h后換液,轉染72h后進行Puromycine篩選,Puromycin維持濃度1.00μg/ml。將其分為:NC組(陰性對照組)、PC組(陽性對照組)、KO1組(LV-Nes-sgRNA1組)、KO2組(LV-Nes-sgRNA2組)和KO3組(LV-Nes-sgRNA3組)(5)CruiserTM檢測CAS9-sgRNA的剪切活性:設計包含sgRNA目標序列的Nestin基因片段的PCR擴增引物(上游引物:TCAGAGGGGTCTGAGTCTGCT,下游引物:AGGCTGAGATGATGAGAGTCAC)。CAS9過表達小鼠腎足細胞感染慢病毒后,收集細胞,抽提細胞混合克隆基因組。PCR擴增退火(上、下游引物:各1μl,2×Taq Plus Master Mix:25μl,Genomic DNA:2μl,ddH2O 22μl),獲得雜交DNA產物,自然冷卻至<40℃,加入CruiserTM酶切15~20min,酶切PCR反應體系(PCR產物:2~3μl,Detecase Buffer:2μl,Detecase:1μl,Add ddH2O to 10μl),45℃反應20min后立即向上述10μl體系內加入2μl Stop Buffer,隨后將全部樣品進行2%瓊脂糖凝膠電泳檢測。
2.3 Nestin靶向序列的篩選 將陰性對照病毒、LVNes-sgRNA1、LV-Nes-sgRNA2和LV-Nes-sgRNA3分別瞬時轉染至CAS9小鼠腎足細胞穩(wěn)定株,72h后,轉染了LV-Nes-sgRNA的CAS9/MP細胞多數(shù)表達綠色熒光,表明質粒轉染CAS9/MP細胞成功(見圖3)。7d后提取基因組DNA進行PCR擴增,結果顯示PCR檢測到目的大小條帶且KO2靶點檢測出活性(見圖4)。
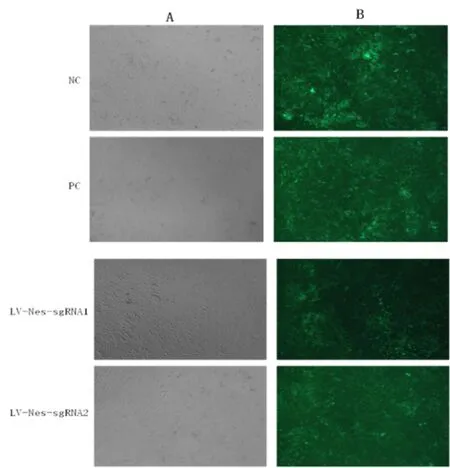
圖3 LV-Nes-sgRNA感染CAS9/MP細胞
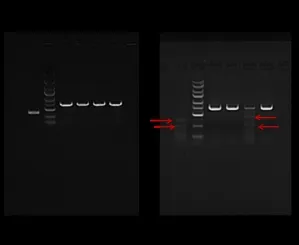
圖4 CruiserTM 篩選活性sgRNA
3 討論
基因組編輯技術為了解特定基因的功能提供基礎,傳統(tǒng)基因敲除以ZFN及TALEN技術的應用較為廣泛,但其操作時間長,對實驗要求高,篩選工作量大,易出錯成為其發(fā)展的瓶頸[9]。規(guī)律成簇間隔短回文重復序列及其相關系統(tǒng)(CRISPR/Cas system)存在于大約50%的細菌和90%的古細菌基因組中[10-11],是抵御外來噬菌體、質粒或其他移動元件侵染的獲得性免疫系統(tǒng)[12-14]。CRISPR/CAS系統(tǒng)依賴于CAS和crRNA形成的蛋白核酸復合物對DNA序列上PAM(protospacer adjacent motif)區(qū)域的識別,利用這一特性對基因組特定位點進行基因組編輯[15]。CRISPR/Cas9系統(tǒng)具有簡單靈活、特異性高、細胞毒性低等特點,可以對特定基因組位點進行切割置換[16]。目前已有研究基于CRISPR/Cas9技術成功實現(xiàn)了對動物、細胞、植物單基因、雙基因及多基因的敲除[17]。本研究構建Nestin基因敲除的MP穩(wěn)轉細胞株,是深入研究Nestin基因功能及其在糖尿病腎臟病中的作用機制的基礎。
[1] Haraldsson B,Nystrom J,Deen WM.Properties of the glomerular barrier and mechanisms of proteinuria.Physiol Rev,2008,88(2):451.
[2] Sasaki H,Kimura J,Nagasaki K,et al.Sasaki N5.Mouse chromosome 2 harbors genetic determinants of resistance to podocyte injury and renal tubulointerstitial fibrosis.BMC Genet,2016,17(1):69.
[3] Koga K,Yokoi H,Mori K,et al.Mukoyama M.MicroRNA-26a inhibits TGF-β-induced extracellular matrix protein expression in podocytes by targeting CTGF and is downregulated in diabetic nephropathy.Diabetologia,2015,58(9):2169-2180.
[4] Tae-Sun Ha.High-glucose and advanced glycosylation end products increased podocyte permeability via PI3-K/Akt signaling.Journal of Molecular Medicine,2010,88:391-400.
[5] Su W,Fang C,Yang HC,et al.Expression of nestin in human kidney and its clinical significance.Zhonghua Bing Li Xue Za Zhi, 2008,37(5):309-312.
[6] Su W,Chen J,Yang H,et al.Expression of Nestin in the podocytes of normal and diseased human kidneys.Chinese Journal of Pathology, 2007,22(5):1761-1767.
[7] 劉巍,段惠軍,張悅,等.中間絲蛋白Nestin在不同病程糖尿病大鼠腎組織中的表達.中國組織化學與細胞化學雜志,2011, 4:301-305.
[8] Xifeng Sun,Yongli Chu,Chun Zhang,et al.Effect of TRPC6 knockdown on puromycin aminonucleoside-induced podocyte injury.Journal of Huazhong University of Science and Technology-Medical Sciences,2012,32(3):340-345.
[9] Thomas G,Charles A,Carlos F.ZFN,TALEN,and CRISPR/Cas based methods for genome engineering.Trends Biotechnol,2013, 31(7): 397-405.
[10] Cédric Noraisa, Annick Moisanb, Christine Gaspinb, et al.Diversity of CRISPR systems in the euryarchaeal Pyrococcales.RNA Biology, 2013,10(5):659-670.
[11] Lillestol R,Redder P,Garrett RA.A putative viral defence mechanism in archaeal cells.Archaea,2006,2(1):59-72.
[12] Grissa I,Vergnaud G,Pourcel C.The CRISPRdb database and tools to display CRISPRs and to generate dictionaries of spacers and repeats.BMC Bioinformatics,2007,8(1):172.
[13] Luhan Yang, Prashant Mali, Caroline Kim-Kiselak, George Church.CRISPR-Cas-Mediated Targeted Genome Editing in Human Cells, 2014.
[14] Makarova KS,Aravind L,Wolf YI, et al.Unification of Cas protein families and a simple scenario for the origin and evolution of CRISPR-Cas systems.Biology Direct,2011,6(1):38.
[15] Hwang WY,Fu Y,Reyon D,et al.Efficient genome editing in zebrafish using a CRISPR-Cas system.Nature Biotechnology, 2013, 31(3):227-229.
[16] Fu Y, Foden JA, Khayter C, et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells.Nature Biotechnology,2013,31(9):822-826.
[17] Hai T,Teng F,Guo R,et al. One-step generation of knockout pigs by zygote injection of CRISPR/Cas system.Cell Res, 2014, 24:372-375.
Objective To establish mouse podocytes Nestin gene knockout cell lines stably based on CRISPR/Cas9 system. Methods Using Cas9 overexpression of lentivirus to build Cas9 overexpression of conditional permanent resident mouse podocytes cell lines.Three gene loci of Nestin(KO1、KO2、KO3)and three pairs of sgRNAs targeting Nestin were designed and inserted in GV371 vector to construct GV371-Nes-sgRNA expression vector for knockout.After sequenced and packed lentivirus particles,then used them to transfect the built CAS9 overexpress MPC.Then puromycin was used to screen positive cells.The enzyme of Cruiser TM to verify CAS9- sgRNA' shear of targeting gene activity. Results Cas9/MP and recombinant plasmid of GV371-Nes-sgRNA was constructed successfully.Cruiser TM verified that the knockout activity of CAS9-sgRNA2 was the maximum. Conclusion The stable MP cell lines of Nestin-knockout are successfully generated by CRISPR/Cas9 system,which provides the foundation for further studying the functions of Nestin gene.
CRISPR/Cas9 Nestin gene knockout Mouse podocyte
浙江省自然科學基金(LY13H290016)
310053 浙江中醫(yī)藥大學第一臨床醫(yī)學院
310006 浙江省中醫(yī)院
*通信作者

