抗草甘膦轉基因玉米外源基因ddPCR拷貝數分析
余桂容,張 維,杜文平,宋 軍,陳 謙,徐利遠*
抗草甘膦轉基因玉米外源基因ddPCR拷貝數分析
余桂容1,張 維2,杜文平1,宋 軍1,陳 謙1,徐利遠1*
(1.四川省農業科學院生物技術核技術研究所,四川成都 610066;2中國農業科學院生物技術研究所,北京 100081)
【目的】本研究是從前期獲得的100余份轉基因抗除草劑草甘騰玉米品系中,挑選T抗-1等14個轉基因玉米品系進行拷貝數檢測。【方法】采用一種新型的拷貝數分析方法——微滴數字PCR技術(droplet digital PCR,簡稱ddPCR),設計特異引物對外源抗草甘騰基因2mG2-epsps進行絕對定量分析。【結果】供試的14份轉基因材料中10份是單拷貝品系。同時,通過引物探針特異性試驗、葉片基因組DNA的PCR抑制和濃度檢測、轉基因玉米的外源基因2mG2-epsps的實時PCR檢測和基因組DNA的酶切等系列研究,建立穩定的轉基因玉米拷貝數分析的ddPCR檢測體系。【結論】微滴數字PCR技術為這批轉基因玉米的下一步轉基因生物安全評價提供了重要參數,同時建立了轉基因玉米(geneticallymodified maize)外源基因拷貝數ddPCR分析方法。
轉基因玉米;草甘騰抗性;外源基因;拷貝數;微滴數字PCR(ddPCR)
【研究意義】自1996年轉基因農作物商業化種植20多年以來,全球轉基因農作物種植面積迅猛發展,隨著轉基因技術的廣泛應用,如何準確、精確地確定轉基因生物的外源基因拷貝數,已經成為現今轉基因產品檢測技術研究的一個關鍵點[1]。無論國際還是國內在轉基因生物安全管理和安全評價過程中,外源基因拷貝數都是生物安全評價的重要評價參數。因為外源基因整合進入作物受體基因組的方式(插入位點、拷貝數和旁側序列等)會影響目的基因和功能蛋白的表達以及外源基因在受體中的遺傳穩定性,特別是整合的拷貝數多少影響尤為重要[2]。目前,大多數轉基因方法都是隨機整合進入受體基因組,而且大多數是以多拷貝的方式整合到受體基因組上。通常當外源基因以1~2個低拷貝數整合到受體基因組時可以高效的表達,而多拷貝數的整合會造成不穩定表達,甚至基因沉默[3]。因此,探明轉基因材料的外源基因拷貝數對于下一步的育種應用顯得尤為重要。【前人研究進展】微滴數字PCR(droplet digital PCR,ddPCR)是近年來興起的一種新的絕對定量技術,通過極度稀釋實現理論上的單分子擴增,然后用終點法PCR和泊松分布計算出樣品的原始濃度[4]。將含有模板、引物/熒光探針、耐熱DNA復制酶及其緩沖液的熒光PCR反應體系充分混勻之后等量均分為相互隔離的(大于10000個)油包水微滴,使每個模板獨立隨機地分配至微滴中;所有微滴同時在相同的規定條件下進行PCR擴增反應之后,根據設定的熒光閾值判斷每個微反應體系的擴增結果;依據微滴的陽性率和泊松分布公式計算得到ddPCR反應體系中的模板濃度。依據樣品DNA溶液中的外源基因序列(exogenousgene sequence)和玉米特異性基因(Species specific gene)的模板濃度之比,得到樣品中外源基因拷貝數。姜羽[5]等利用ddPCR分析轉基因生物外源基因拷貝數表明,微滴數字PCR方法是一種經濟、快速和準確的外源基因拷貝數分析新方法,靈敏度和準確性高,將會在拷貝數分析中廣泛應用。潘廣[6]等應用雙重數字PCR對轉基因玉米成分進行定量方法研究,建立了轉基因玉米T25雙重數字微滴式PCR定量方法。姜志軍[7]等以微滴數字PCR技術簡便快速的完成外源草甘膦抗性基因G23VEPSPS拷貝數的分析。同時,微滴數字PCR方法也在食品成分分析、臨床診斷、基因表達分析[8]、微生物檢測[9]、新一代測序驗證[10]等領域具有巨大優勢和應用潛力。苗麗[11-12]等利用微滴數字PCR分析肉制品中豬源性、牛源性、羊源性成分分析,檢測顯示該方法能夠準確檢測出不同樣品中不同肉源的含量。耿娟[13]等利用數字PCR進行產前診斷,可在介入性產前診斷及無創產前基因診斷胎兒非整倍體疾病和單基因疾病方面具有重要作用。【本研究切入點】ddPCR平臺已經用于測量轉基因產品成分的定量分析等[14],但基于ddPCR平臺的轉基因生物外源基因拷貝數的分析工作報道較少。本研究基于ddPCR平臺,建立了轉基因玉米外源基因拷貝數分析方法。【擬解決的關鍵問題】研究結果為為這批轉基因玉米的下一步轉基因生物安全評價提供了重要參數,為這批材料的進一步培育轉基因新品種奠定基礎,也為分析其他轉基因玉米品系外源基因拷貝數提供了新的方法和借鑒。
1 材料與方法
1.1 試驗材料
本研究以轉基因抗除草劑草甘膦玉米T抗-1等14個品系為研究對象,一個非轉基因玉米品系為陰性對照,共15份材料,樣品性質為玉米葉片。
樣品來源:四川省農業科學院生物技術核技術研究所2016年春季大田種植121份轉基因抗除草劑草甘膦玉米品系,經抗性篩選結合田間農藝性狀的綜合表現,挑選14個轉基因玉米品系進行拷貝數檢測,樣品編號見表1,外源基因都為2mG2-epsps,且使用同一載體。
抗除草劑草甘膦基因2mG2-epsps來源:中國農業科學院生物技術研究所林敏研究員課題組。
1.2 試劑與設備
ddPCRTMSupermix for probes,Droplet Generation Oil for Probes為美國BIO-RAD公司產品;內切酶為大連寶生物公司產品。其他常用試劑均是國產試劑;引物和探針由英濰捷基(上海)貿易有限公司合成。
Bio-Rad QX200 ddPCR微滴生成儀和讀數儀(美國Bio-Rad公司);7500 Real-Time PCR儀美國AB公司。高速離心機(美國Thermo公司);電子天平(北京賽多利斯科學儀器有限公司);紫外分光光度計(德國Eppendorf公司)。
1.3 測試方法
1.3.1 葉片基因組DNA提取 DNA提取采用Murray和Thompson等的CTAB法,略做修改。
1.3.2 引物與探針的設計 根據插入基因序列信息,為了使擴增片段能代表完整可表達的2mG2-epsps基因,將引物探針設置在2mG2-epsps基因和前導肽的結合區,進行同源序列比對,運用Primer Express 5.0軟件設計數字PCR引物和探針。引物和探針序列見表2。
為了使擴增片段能代表可完整可表達的2mG2-epsps基因,將引物探針設置在2mG2-epsps基因和前導肽的結合區。
玉米內參基因引物和探針:根據文獻,玉米Hmg基因為單拷貝基因,其引物和探針位置如下所示:

表1 玉米葉片樣品編號Table 1 The number of corn leaf sample
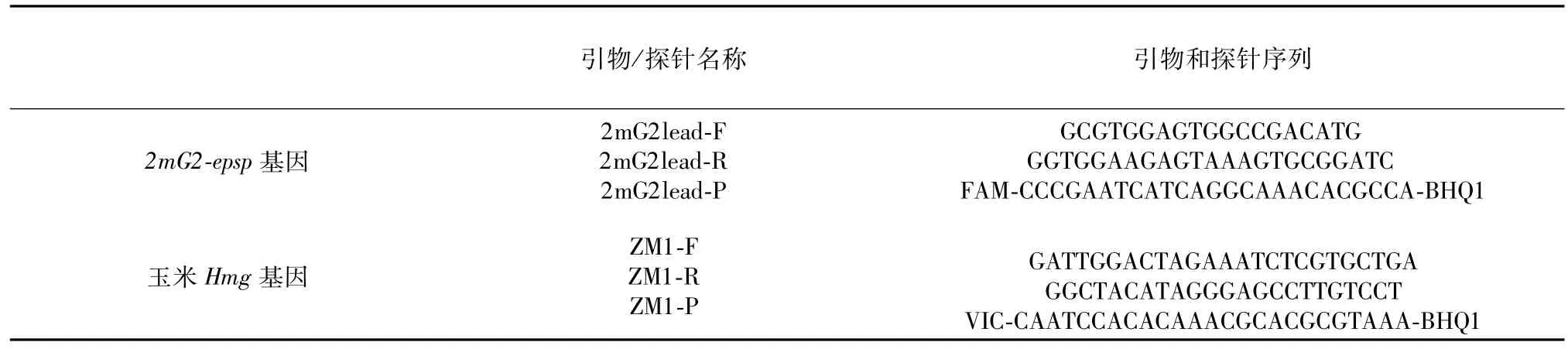
表2 引物和探針序列Table 2 Primer and probe sequences for ddPCR assays
1.3.3 轉基因玉米的外源基因實時PCR檢測 實時熒光PCR反應體系為25μl:ABI Taq man PCR mastermix 12.5μl,上、下游引物各1μl(10μmol),探針1μl(10μmol),DNA模板(10~100 ng/μl)5 μl,滅菌雙蒸水補足體系。反應循環參數為:50℃/ 2 min;95℃/10 min;95℃/15s,60℃/1 min,40個循環。
1.3.4 基因組DNA的酶切 經對外源基因的分析,選擇Sal I對基因組進行酶切,Sal I的酶切位點為:G/TCGAC。
酶切體系:Sal I(takara)1μl,10×Buffer 2μl,DNA 5μl,ddH2O 12μl,酶切條件:37℃60 min,95℃10 min。
1.3.5 Hmg基因和2mG2-epsps基因濃度的ddPCR檢測 采用玉米Hmg基因和轉基因2mG2-epsps的引物探針分別擴增玉米14個樣品酶切后DNA。
微滴式數字PCR反應體系為:ddPCRTMSupermix for Probes 10μl,上、下游引物各1μl(10μmol/ L),探針1μl(10μmol/L),DNA模板(10~100 ng/ μl)5μl,加雙蒸水補足總體積至20μl。
將生成的微滴全部轉入96孔熒光PCR反應板中,進行PCR擴增。熒光PCR包括3個步驟:95℃預變性10 min;94℃變性30 s,60℃退火1 min,50個循環;98℃固化微滴10 min。最后用微滴分析儀對擴增產物進行計數分析。
2 結果與分析
2.1 引物探針特異性實驗
采用轉基因玉米2mG2-epsps基因的引物/探針對陰性對照和14個樣品的DNA進行實時PCR擴增。陰性對照和陽性樣品的擴增結果顯示,2mG2-epsps基因的引物探針特異性良好,除陽性樣品外,空白和陰性樣品均沒有出現擴增(圖1)。以上結果說明表2中的引物和探針均能有效擴增靶基因。這些引物和探針可以用于后續的微滴式數字PCR定量檢測實驗。
2.2 葉片基因組DNA的PCR抑制和濃度檢測
采用玉米內參Hmg基因的ZM1引物/探針對陰性對照和14份樣品的DNA進行實時PCR擴增。擴增結果表明,所有樣品DNA溶液沒有明顯擴增抑制,濃度和純度適于后續ddPCR檢測(圖2)。
2.3 轉基因玉米的外源基因2mG2-epsps的實時PCR檢測
為了確定樣品中轉基因玉米2mG2-epsps基因的存在,采用2mG2-epsps基因的特異性引物/探針對14個樣品的DNA進行實時PCR擴增。擴增結果顯示,樣品中存在靶基因,需進行后續ddPCR測試(圖3,表3)。
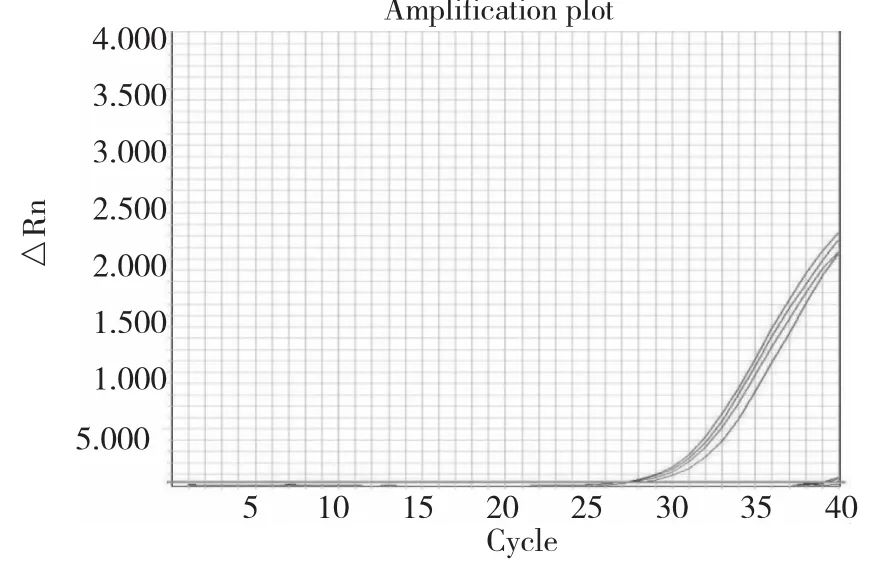
圖1 2mG2-epsps基因的引物探針特異性試驗Fig.1 Specific test of2mG2-epsps primer probe
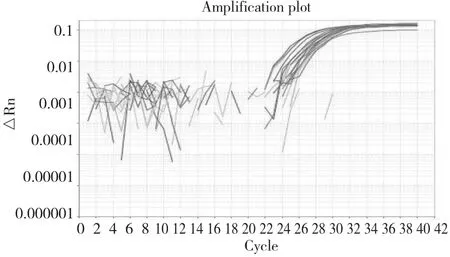
圖2 玉米內參Hmg基因的實時PCR擴增結果Fig.2 Real-time PCR amplification of HMG gene in maize
圖3 轉基因玉米2mG2-epsps基因的實時PCR擴增結果Fig.3 Real-timePCRamplificationof2mG2-epspsgeneintransgenic maize
2.4 基因組DNA的酶切
轉基因玉米樣品中外源基因可能存在串連重復現象,如不進行酶切,可能將串連重復片段視為單個拷貝。為避免此問題,對轉基因玉米樣品DNA進行酶切消化。從圖4可見,玉米樣品DNA已消化完全,原液中的線粒體片段已消失不見。酶切溶液可用于后續ddPCR測試。
圖4 轉基因玉米樣品T抗-1的DNA的酶切電泳圖譜Fig.4 TheDNAenzymedigestionelectrophoresisofgeneticallymodifiedcornsamplesTkang-1
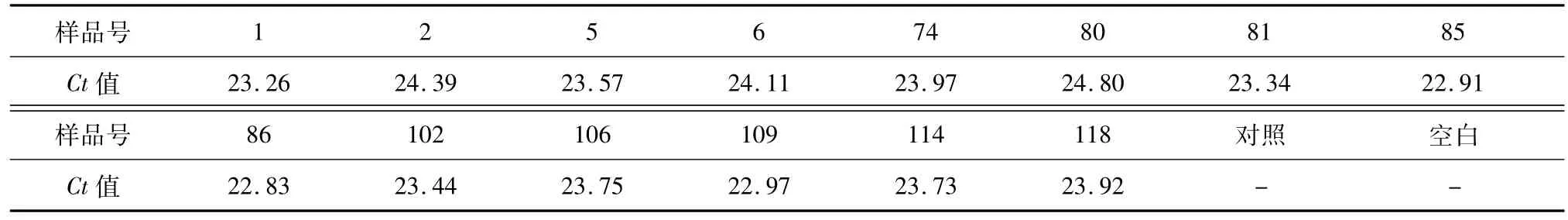
表3 玉米葉片樣品DNA的2mG2-epsps基因的實時PCR擴增Ct值Table3 Real-timePCRamplificationof2mG2-epspsgeneofDNAinleafsampleofmaize
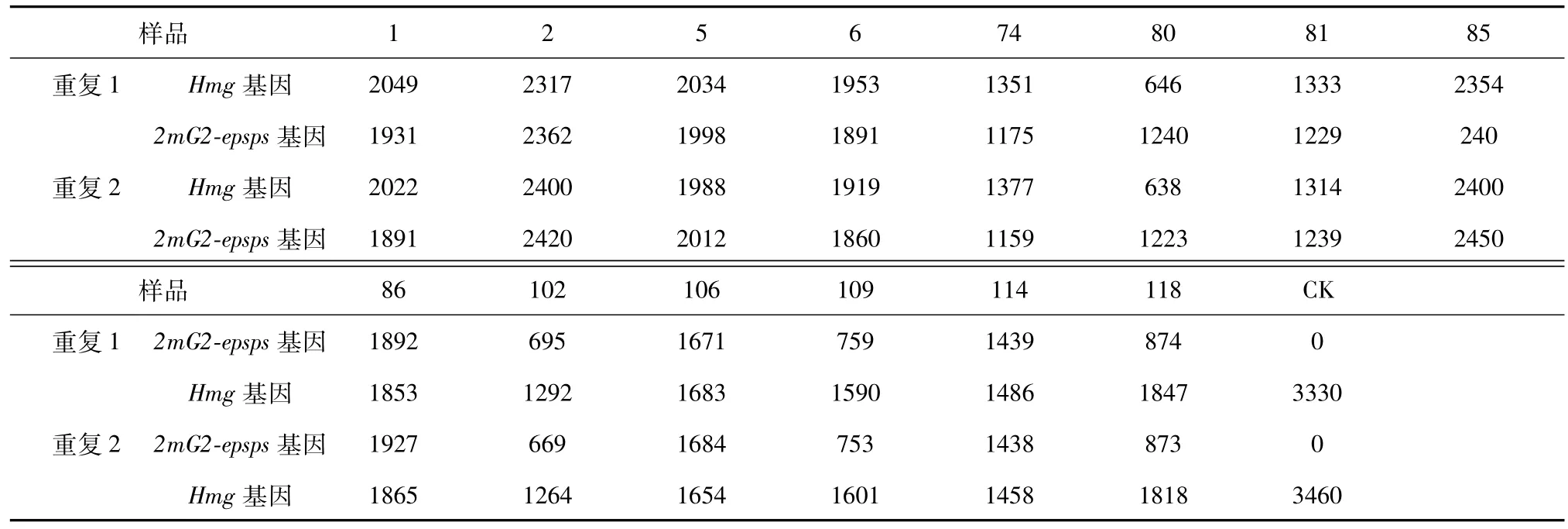
表4 轉基因玉米DNA的Hmg/2mG2-epsps基因拷貝數的ddPCR檢測值單位(copies/μl)Table4 ThecopynumberofthegeneticallymodifiedmaizeHmgand2mG2-epspsgenebyddPCRunit(copies/μl)

表5 轉基因玉米DNA的Hmg/2mG2-epsps基因拷貝數比值Table5 TheratioofthecopynumberingeneticallymodifiedmaizeHmgand2mG2-epspsgene

圖5 玉米不同品系1Hmg基因和2mG2-epsps基因的ddPCR熱點圖(2mG2-epsps基因(左圖)和Hmg基因(右圖)的ddPCR熱點圖)Fig.5 The ddPCR heap map of1 Hmg gene and 2mG2-epsps gene in differentmaize lines The ddPCR heapmap of2mG2-epsps gene(left)and Hmg gene(right)
2.5 玉米樣品Hmg基因和2mG2-epsps基因拷貝數的ddPCR檢測
由表4轉基因玉米DNA的Hmg/2mG2-epsps基因拷貝數的ddPCR檢測值和表5基因拷貝數比值可見樣品重復度非常好,14個樣品中有10個是單拷貝。
采用QX200 ddPCR微滴生成儀和讀數儀(美國Bio-Rad公司)及玉米Hmg基因和2mG2-epsps基因引物探針,對14個轉基因陽性玉米樣品中Hmg/ 2mG2-epsps基因拷貝數進行檢測。微滴熒光檢測儀的檢測結果見ddPCR熱點圖(圖5)。
所有反應的拷貝數在合理范圍內(100~4000 copies/μl),2次重復實驗的結果相近,實驗重復性良好。從熱點圖中可分析,每個反應的陰性微滴和陽性微滴的熒光值區分明顯。實驗檢測的數據質量良好。
3 討 論
研究外源基因在受體基因組上的拷貝數的方法有多種,得到公認的經典方法是傳統的qRT-PCR、Southern blot,這2種方法已經較成熟應用于轉基因生物外源基因拷貝數的分析中,但這2種方法也存在一定缺陷。例如,Southern-blot方法分析時工作量大、周期長、操作要求高、準確性較差,特別是對于多拷貝基因的分析,結果容易偏小[15];qRT-PCR在分析外源基因拷貝數時必須依賴于標準曲線和已知拷貝數的基因,只是一種相對定量方法,且標準曲線的質量易受到DNA純度、引物和探針的濃度、反應抑制因子等諸多因素影響[16]。相對來說,本研究采用的ddPCR定量分析方法在特異性、靈敏度和重復性上面都優于前兩者,而且受DNA純度影響小,受引物間相互干擾小,與擴增效率無關,更節約時間、精力和實驗藥品,是一個新興崛起的分析方法。
另外,本研究參考前人的研究,采用轉基因玉米T抗-1等葉片基因組DNA為模板,而不是用種子的基因組DNA,消除了因種子胚乳3倍體帶來的轉基因質量百分比含量和計算含量的誤差,從而得以保證分析和比較ddPCR定量方法的準確性[5]。
在拷貝數分析應用方面,拷貝數研究需要極高的定量精度,以區別不同拷貝數之間的微小差異,而ddPCR具有高精確度的特點,通過精確計定量目標基因與參照基因(拷貝數為1的基因),并計算它們的比值,從而得到目標基因的拷貝數,對不同拷貝數的分辨精度遠高于qPCR和測序[17]。
ddPCR是一個擁有巨大潛力的新興技術,由于其獨特的技術優勢和應用前景,近幾年來其產業化發展相當迅速,應用也越來越得到重視。可以預見,在未來幾年內,ddPCR技術將會進一步發展與完善,應用范圍也會大大擴展,有望從一種小眾技術發展成為實驗室中的標準工具。
4 結 論
本研究通過引物探針特異性試驗、葉片基因組DNA的PCR抑制和濃度檢測、轉基因玉米的外源基因2mG2-epsps的實時PCR檢測和基因組DNA的酶切等系列研究,建立穩定的ddPCR體系,分析了轉基因玉米T抗-1等的2mG2-epsps基因,結果表明,所有供試的14個樣品中都檢出2mG2-epsps基因片段,其中10個樣品(T抗-1、2號、5號、6號、74號、81號、85號、86號、106號、114號)中2mG2-epsps基因和玉米內源Hmg基因拷貝數相同,是單拷貝材料;另外4個樣品(80號、102號、109號、118號)中玉米內源Hmg基因拷貝數是2mG2-epsps基因的2倍,為非純合體。
本文在國內首次建立了轉基因玉米品系T抗-1等微滴式數字PCR定量方法。而且多次重復研究顯示本研究所建立的玉米品系T抗-1等數字ddPCR定量方法特異性強、靈敏度高、結果重復性好,不依賴任何外部標準、能夠有效節省試劑和樣品,是一種精確、靈敏的轉基因生物外源基因拷貝數分析新方法。
[1]Zhang D,Guo J.The development and standardization of testing methods for genetically modified organisms and their derived products[J].Journal of Integrative Plant Biology,2011,53(7):539-551.
[2]Vaucheret H,Beclin C,Elmayan T,et al.Transgene induced gene silencing in plants[J].The Plant Journal,1998,16(6):651-659.
[3]萬 艷,李麗玲,陳小佳.應用實時熒光定量PCR檢測外源基因拷貝數的新方法[J].暨南大學學報(自然科學版),2009,30 (3):310-313.
[4]Hindson B,Ness K,Masquelier D,et al.High-through-put droplet digital PCR system for absolute quantitation of DNA copy number [J].Analytical Chemisty,2011,83(22):8604-8610.
[5]姜 羽,胡佳瑩,楊立桃.利用微滴數字PCR分析轉基因生物外源基因拷貝數[J].農業生物技術學報,2014,22(10):1298-1305.
[6]潘 廣,章桂明,黃 新.應用雙重數字PCR對轉基因玉米成分進行定量方法研究[J].植物檢疫,2016,30(3):365-71.
[7]姜志軍,江 穎,徐搖光,等.利用微滴數字PCR方法快速分析轉基因玉米中外源基因的拷貝數[J].生物技術進展,2016,6 (4):288-294.
[8]Jiang K,Ren C,Nair VD.MicroRNA-137 represses Klf4 and Tbx3 during differentiation ofmouse embryonic stem cells.Stem[J].Cell Research,2013,11:1299-1313.
[9]Kelley K,Cosman A,Belgrader P,et al.Detection of methicillin-resistant Staphylococcus aureus by a duplex droplet digital PCR assay [J].Journal of Clinical Microbiology,2013,51:2033-2039.
[10]Fresard L,Leroux S,Servin B,et al.Transcriptome-wide investigation of genomic imprinting in chicken[J].Nucleic Acids Research,2014,42(6):3768-3782.
[11]苗 麗.肉制品中羊源性成分微滴數字PCR法定量檢測方法的研究[J].食品工業科技,2016(4):73-76.
[12]苗 麗.微滴數字PCR法對肉制品中牛源和豬源成分的定量分析[J].食品工業科技,2016(8):187-191.
[13]耿 娟,尹愛華.數字PCR在產前診斷中的應用研究[J].中國產前診斷雜志,2016(1):54-58.
[14]Corbisier P,Bhat S,Partis L,et al.Absolute quantification of geneticallymodified MON810 maize(Zea mays L.)by digital polymerase chain reaction[J].Analytical and Bioanalytical Chemistry,2010,396(6):2143-2150.
[15]Yang L,Ding J,Zhang C,et al.Estimating the copy number of transgene in transformed rice by Real-time quantitative PCR[J]. Plant Cell Report,2005,23(10-11):759-763.
[16]Cankar K,?tebih D,Dreo T,et al.Critical points of DNA quantification by Real-time PCR-effects of DNA extraction method and sample matrix on quantification of genetically modified organisms [J].BMC Biotechnology,2006(6):37-52.
[17]詹 成,燕 麗,王 琳,等.數字PCR技術的發展和應用[J].復旦學報(醫學版),2015,42(6):786-789.
(責任編輯 李 潔)
Estimation of Exogenous Genes Copy Number of Genetically M odified Glyphosate-Resistant M aize by Droplet Digital PCR
YU Gui-rong1,ZHANGWei2,DUWen-ping1,SONG Jun1,CHEN Qian1,XU Li-yuan1*
(1.Institute of Biotechnology and Nuclear Techniques,Sichuan Academy of Agricultural Sciences,Sichuan Chengdu 610066,China;2. Biotechnology Research Institute,China Academy of Agricultural Sciences,Beijing 100081,China)
【Objective】The exogenousgene copy number of Tkang-1 etc.14 wasestimated geneticallymodifiedmaize based on the early stage of the geneticallymodifiedmore than 100maize(Zeamays L.)materialswith higher resistance and better comprehensive agronomic characters,in order to pass through the transgenic biosafety evaluation and fit in with the needsof breeding new transgenicmaize varieties.【Method】A new kind of analysismethod was adopted for the exogenous gene copy number——the droplet digital PCR technology(droplet digital PCR,ddPCR).And specific primer of exogenousgene2mG2-epsps was designed to analyze the copy number by absolutely quantitativemethod.【Result】The analysis showed that10 of14 transgenicmaterialswere single copies.At the same time,a stable test system was established for analyzing the exogenous gene copy number of geneticallymodified maize by the studying of designing specific primer of exogenous gene 2mG2-epsps,testing the PCR inhibitor and concentration of leafgenome,real time PCR-testing for the exogenous gene of the transgenicmaize,restricting genome DNA and so on.【Conclusion】This paper provided important parameters for the further transgenic biosafety evaluation of transgenicmaize,laid a strong foundation for breeding new transgenicmaize varieties and established the genetic copy number analysismethod of geneticallymodified maize.
Geneticallymodified maize;Glyphosate resistance;Exogenous gene;Copy number;Droplet digital PCR(ddPCR)
S513
A
1001-4829(2017)8-1707-06
10.16213/j.cnki.scjas.2017.8.003
2017-02-24
四川省農科院高新技術研究應用專項(2016GXTZ-001),轉基因生物新品種培育重大專項(2014ZX0800301B);四川省農科院財政基因工程項目(2016ZYPZ-003)
余桂容(1971-),女,四川榮縣人,副研究員,主要從事玉米基因工程育種,*為通訊作者:徐利遠,研究員,主要從事農作物遺傳育種研究,E-mail:yuguirong@163.com。

