CgRGS7調控膠抱炭疽菌分生抱子產量、附著胞形成及致病性
吳曼莉,胡 堅,張 楠,柯智健,柳志強,李曉宇
CgRGS7調控膠抱炭疽菌分生抱子產量、附著胞形成及致病性
吳曼莉,胡 堅,張 楠,柯智健,柳志強*,李曉宇
(海南大學熱帶農林學院,海南海口 570228)
【目的】G蛋白信號調控因子(regulators of G-protein signaling,RGS)是G蛋白信號轉導通路中的負調控因子,參與多個G蛋白信號通路介導的細胞內過程,目前對于膠抱炭疽菌相關RGS蛋白的生物學功能研究較少。【方法】本研究通過同源重組獲得CgRGS7基因的敲除突變體,并對其生物學功能進行初步分析。【結果】CgRGS7基因編碼620個氨基酸,具有7個跨膜結構域和1個RGS功能域。CgRGS7敲除突變體與野生型菌株相比,表現為分生抱子產量降低且抱子呈多端萌發,附著胞形成率下降以及致病性減弱。【結論】CgRGS7參與調控膠抱炭疽菌分生抱子產量,同時影響芽管的形態發育、附著胞形成及致病性。
膠抱炭疽菌;G蛋白信號調控因子;分生抱子;致病性
【研究意義】膠孢炭疽菌(Colletotrichum gloeosporioides)是絲狀病原真菌,能夠侵染多種木本植物,包括橡膠、香蕉、芒果等多種熱帶作物[1]。其中芒果炭疽病是由該病菌引起的侵染性病害,在芒果種植區常有發生,尤其在貯運期易引起果實腐爛,影響芒果外觀質量和品質[2-3]。膠孢炭疽菌不但寄主范圍廣泛,而且侵染方式多樣,目前對于該病菌分子致病機制的研究還不夠深入,從而也限制了相關防治技術的發展[1,4]。因此,深入解析膠孢炭疽菌致病基因,對于該病菌的防治具有的意義。
植物病原菌在侵染過程中,信號的識別及傳導起著重要的作用,其中G蛋白信號途徑是其感應外界信號并傳導到細胞內部的重要機制之一[5],當感受到胞外信號或是受到外界刺激時,G蛋白偶聯感受器被激活,促使Gα亞基空間構象做出改變,導致Gα與Gβγ分離,而游離的Gα和Gβγ能夠激活下游的靶蛋白,從而引起細胞內的多種生理活動。綜上,G蛋白在生物信號轉導網絡中有著重要的作用,其中的某個信號傳遞環節發生改變都可能影響到整個生物信號系統,進而引起相關生物學特性的改變。RGS蛋白負調控G蛋白信號轉導通路,其GAP作用能夠引起Gα-GTP的水解,導致G蛋白失去活性[6-7]。【前人研究進展】相關研究已證明,G蛋白信號途徑參與調控真菌的生長發育、生殖、致病等過程[8-9],但是目前開展膠孢炭疽菌相關RGS蛋白功能研究還較少。【本研究切入點】在前期研究中,本實驗室從膠孢炭疽菌中鑒定了10個含RGS結構域的蛋白。本研究選取了其中一個RGS基因進行克隆鑒定,比對結果顯示該基因與Magnaporthe oryzae中的MoRGS7基因同源,因此,將基因命名為CgRGS7。利用基因敲除的方法獲得該基因的敲除轉化子,通過一系列表型分析鑒定其所具有的生物學功能。【擬解決的關鍵問題】本研究旨在明確RGS蛋白在膠孢炭疽菌生長和侵染過程中的作用,為深入解析膠孢炭疽菌致病的分子機理奠定基礎。
1 材料與方法
1.1 供試材料
1.1.1 菌株及試劑 膠孢炭疽菌野生型(WT)保存于海南大學熱帶農林學院。MiniBEST Agarose Gel DNA Extraction Kit、MiniBEST Plasmid Purification Kit、限制性內切酶(Kpn I,Eco R I,Bam H I)及PCR相關試劑等均購自TaKaRa公司;其他試劑均為國產分析純。
1.1.2 培養基 PDA培養基:馬鈴薯200 g/L、葡萄糖20 g/L,瓊脂粉18 g/L。LB培養基:胰蛋白胨10 g、酵母粉5 g、NaCl 10 g,瓊脂粉18 g/L。CM培養基:胰化蛋白胨6 g、酵母提取物6 g、蔗糖10 g,瓊脂粉18 g/L。CZAPEK培養基:蔗糖30 g、NaNO33 g、MgSO40.5 g、K2HPO41 g、FeSO40.01 g、KCl0.5 g,瓊脂粉18 g/L。MM培養基:K2HPO47 g、KH2PO43 g、(NH4)2SO41 g、MgSO40.1 g、檸檬酸鈉0.5 g、葡萄糖5 g,瓊脂粉18 g/L。
1.2 試驗方法
1.2.1 CgRGS7基因的克隆及序列分析 膠孢炭疽菌總RNA提取采用TaKaRa MiniBEST Plant RNA Extraction Kit(TaKaRa,中國),利用PrimeScriptTMII 1st Strand cDNA Synthesis Kit(TaKaRa,中國)合成
cDNA。以膠孢炭疽菌野生型菌株的cDNA為模板,CgRGS7F和CgRGS7R(表1)為引物擴增目的基因,PCR產物連接pMD18-T載體轉化后提取質粒送公司進行測序。利用SMART(http://smart.embl-heidelberg.de/)工具對CgRGS7進行蛋白結構域分析,通過NCBI中BLASTp工具對CgRGS7進行蛋白同源性分析,用Clustal X(1.83)軟件進行多序列比對,利用MEGA5.0軟件以鄰近相接法(Neighborjoining,NJ)構建系統進化樹。
1.2.2 CgRGS7基因的敲除與驗證 以圖1的原理進行CgRGS7基因的敲除。膠孢炭疽菌基因組DNA提取方法參照文獻[10],以提取的基因組作為模板,通過CgRGS7上下游片斷引物[CgRGS7upF/ CgRGS7upR、CgRGS7downF/CgRGS7downR(表1)]分別進行CgRGS7基因的上下游序列擴增。利用試劑盒對擴增產物進行回收純化,再分次連接到質粒pCB1532(含氯嘧磺隆抗性基因Sur)上,通過電泳驗證無誤后即獲得敲除載體。將敲除載體經Eco R I酶切成線性化后轉入到膠孢炭疽菌野生型原生質體中,參照文獻的方法步驟進行原生質體制備及轉化[11]。敲除轉化子利用含有氯嘧磺隆的培養基進行篩選,隨后提取抗性轉化子的基因組DNA,分別根據基因上游片段的前段序列和下游片段的后段序列設計驗證引物CgRGS7UU和CgRGS7DD,并根據pCB1532的內部序列設計引物PI和PI1,利用3對引物(CgRGS7F+CgRGS7R、CgRGS7UU+PI、CgRGS7DD+PI1)(表1)對轉化子進行PCR鑒定,結果顯示,若利用引物CgRGS7F+CgRGS7R擴增結果無條帶,但引物CgRGS7UU+PI、CgRGS7DD+PI1能擴增出目的片段的轉化子即為目的基因敲除轉化子。

圖1 CgRGS7基因敲除原理Fig.1 Gene knockout principle of CgRGS7
1.2.3 敲除轉化子表型分析 ①營養生長及脅迫因子敏感性分析。無菌環境下,分別于PDA平板上接種膠孢炭疽菌野生型和敲除轉化子,7 d后用打孔器打取菌落邊緣、菌餅分別接種于PDA、CM、CZAPEK和MM培養基中。同時為了探究CgRGS7基因對膠孢炭疽菌滲透壓及氧化應激反應的影響,打取5 mm的菌餅分別接種于含有NaCl(濃度分別為0、0.5、0.8和1.0 mol/L)、H2O2(濃度分別為0、5、10和20 mmol/L)及0.01%SDS的MM平板上,28℃培養7 d后,觀察菌絲生長情況并測量菌落直徑,每組設3個重復。②分生孢子產量及萌發。野生型和敲除轉化子在PDA平板上28℃培養約9 d,用滅過菌的涂布棒輕掃菌落表面氣生菌絲后28℃光照培養3 d誘導產孢,取含有0.4%吐溫80的無菌水涂布平板,菌液經過濾制得孢子懸浮液,并用血球計數板進行孢子濃度計數,每處理設3個重復。取孢子懸浮液滴加于載玻片上,28℃保濕培養,于8 h后觀察孢子萌發情況,18 h后觀察附著胞形成情況。③致病性分析。選取無創傷且無病斑的芒果,用滅菌的大頭針在芒果表面形成小創口,無菌條件下于活化好的PDA平板上打取菌餅,分別接種在芒果的無傷口及有傷口的位置,每處理3個重復,28℃保鮮盒內保濕培養,5 d后觀察致病情況并記錄。
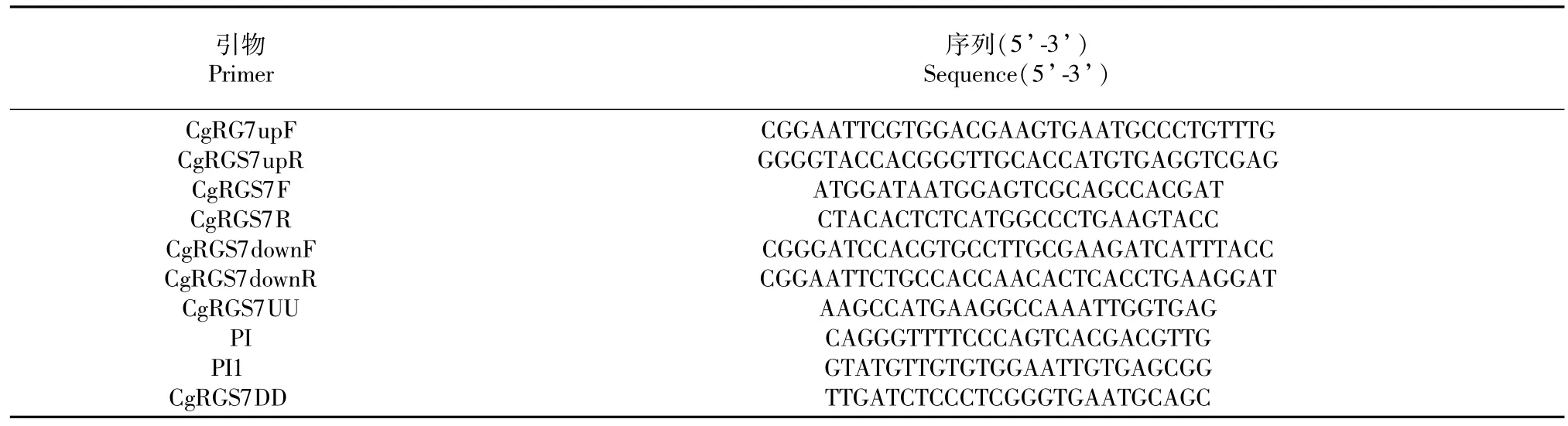
表1 引物名稱及序列Table 1 Primers and sequences
2 結果與分析
2.1 基因的克隆及序列分析
PCR擴增與pMD18-T載體連接,轉化后提取質粒送公司測序,結果表明CgRGS7基因開放閱讀框全長1860 bp,編碼620個氨基酸,在N末端含有7次跨膜結構域,C末端第397~508位氨基酸含有1個RGS功能域(圖2-A)。將CgRGS7在NCBI中進行BLASTp比對,通過MEGA5.0與不同真菌的RGS蛋白序列一起構建系統發育樹(圖2-B)。CgRGS7與C.gloeosporioides Nara gc5的RGS蛋白(XP-007278705)相似度達到95%,此外CgRGS7與C. salicis和C.sublineola同源蛋白相似性較高,分別為76%和69%。
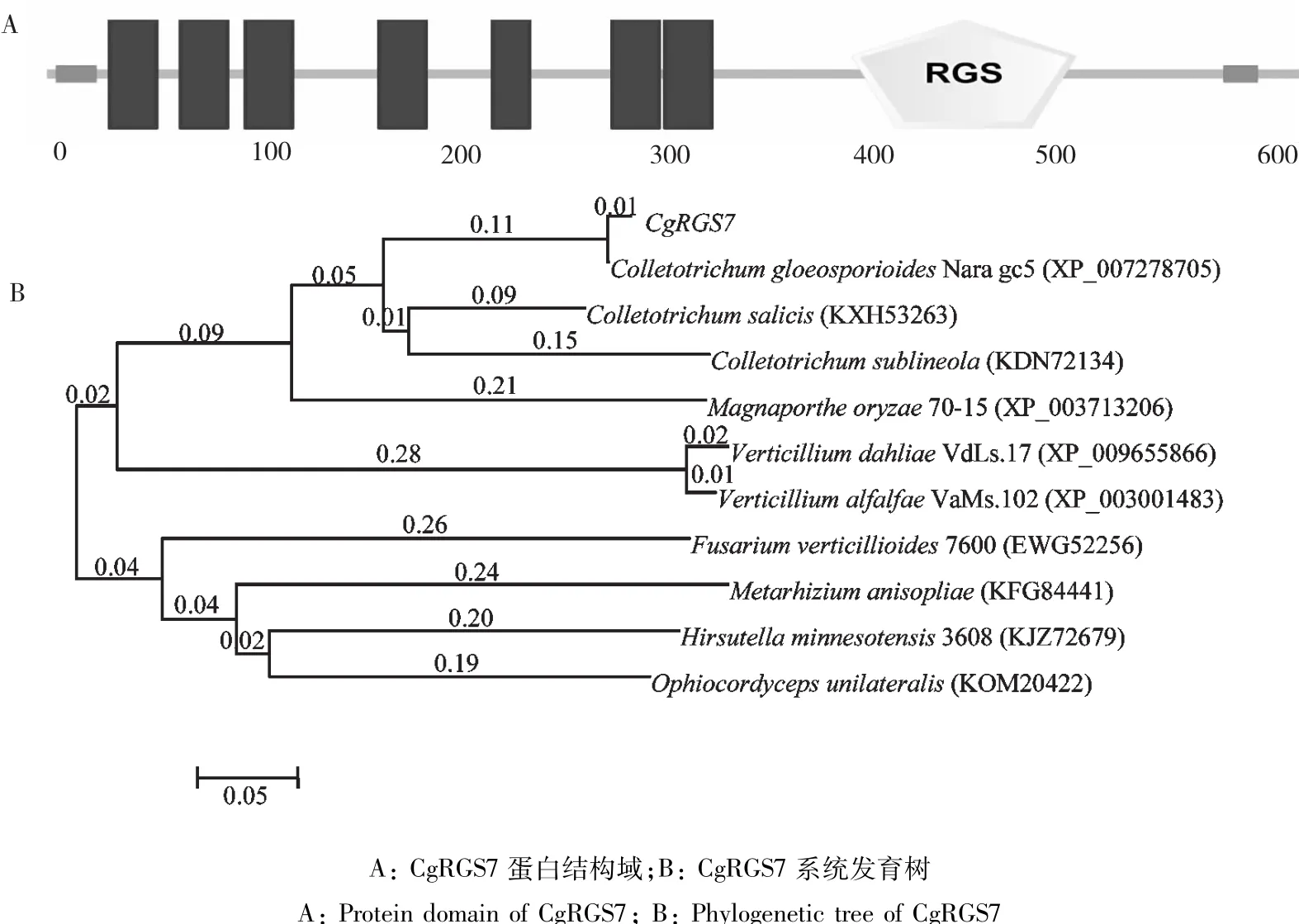
圖2 CgRGS7蛋白結構域和系統發育樹Fig.2 Protein domain and phylogenetic tree of CgRGS7

圖3 CgRGS7敲除突變體的驗證Fig.3 Verification of CgRGS7 gene knockoutmutant
2.2 CgRGS7基因的敲除與驗證
將CgRGS7基因的敲除載體經限制性內切酶Eco R I酶切線性化后轉入膠孢炭疽菌野生型原生質體中,共獲得156個轉化子,利用3對引物CgRGS7F+CgRGS7R、CgRGS7UU+PI、PI1+ CgRGS7DD(表1)進行篩選,其中第44號轉化子利用CgRGS7F+CgRGS7R引物不能擴增目的條帶,而通過CgRGS7UU+PI、PI1+CgRGS7DD引物能夠分別擴增出目的條帶(圖3),即確定第44號轉化子為陽性轉化子,將其命名為ΔCgRGS7-44。
2.3 突變體表型分析
2.3.1 營養生長及脅迫因子敏感性分析 為了探究CgRGS7基因對膠孢炭疽菌營養生長的影響,將野生型和ΔCgRGS7-44分別接種于PDA、CM、CZAPEK和MM培養基中,28℃培養7 d,在前3種培養基中,ΔCgRGS7-44與野生型在菌落形態和生長速率方面無明顯不同,但在MM培養基上敲除轉化子較野生型生長速率稍顯緩慢(圖4)。在脅迫因子敏感性試驗中,經抑制率計算分析,ΔCgRGS7-44在含不同濃度NaCl、H2O2和SDS的MM培養基上,生長形
態及速率與野生型相比均無顯著性差異。由此可見,CgRGS7基因的敲除對膠孢炭疽菌的營養生長及相關脅迫因子敏感性的影響不大。
2.3.2 分生抱子產量及萌發情況 經過血球計數板計數,在產孢量方面ΔCgRGS7-44與野生型相比有明顯對比,野生型分生孢子濃度平均為(8.16± 0.2×106)個/mL,敲除轉化子ΔCgRGS7-44分生孢子濃度為(5.17±1.04×104)個/mL,兩者之間差異顯著。此外,在分生孢子形態方面,野生型孢子單端萌發及少部分雙端萌發,ΔCgRGS7-44則是多端萌發(圖5),進而統計了兩者的孢子萌發率及附著胞形成率(表2),ΔCgRGS7-44孢子萌發率(8 h)約為85 %±4.3%,顯著大于野生型孢子萌發率。但是敲除轉化子的附著胞形成率較野生型有所延遲,18 h附著胞形成率為32.54%±3.75%,而野生型則達到68.07%±8.1%。由此可見,CgRGS7基因參與調控分生孢子的產量、芽管形態及附著胞的形成。
2.3.3 CgRGS7參與調控致病性 為了探究CgRGS7基因與膠孢炭疽菌致病力的關系,將野生型和ΔCgRGS7-44接種芒果果實,觀察其致病結果。如圖6所示,ΔCgRGS7-44在無傷口方式接種下幾乎無病斑形成;而以傷口方式接種時,與野生型相比,ΔCgRGS7-44所形成的病斑明顯減小,致病力減弱。由此說明,CgRGS7對膠胞炭疽菌的致病力有影響。

圖4 不同培養基對菌株生長的影響Fig.4 Effects of differentmedia on growth of strains

圖5 野生型與CgRGS7敲除突變體分生抱子萌發形態Fig.5 Conidium germination of wild type and CgRGS7 deletion mutant

表2 產抱量、萌發率和附著胞形成率Table 2 Conidium production,germination rate and appressorium formation rate
3 討 論
RGS蛋白是G蛋白信號轉導的負調節子,相關研究表明其在眾多生理生化過程中發揮著重要作用。本試驗利用同源重組的方法獲得了CgRGS7敲除轉化子,并對其在營養生長、滲透壓脅迫、氧化應激反應、分生孢子產生及萌發、及致病力等方面做了表型分析。結果表明,CgRGS7敲除轉化子在營養生長及NaCl、H2O2、SDS的壓力脅迫下,與野生型相比無顯著變化;但在分生孢子的產量、芽管生長、附著胞形成率以及致病力方面兩者存在顯著差異,敲除轉化子在產孢量及附著胞形成率方面均低于野生型菌株,致病力也減弱,這些結果與已報道的稻瘟病菌MoRGS7的功能有相似之處,張海峰等在M. oryzae中鑒定到8個RGS蛋白(MoRGS1~MoRGS8),結果分析顯示這些基因參與調控該病菌的營養生長、細胞壁完整性、附著胞分化和侵入等生理過程[12-13],其中MoRGS7不僅參與芽管的生長,影響附著胞形成率,還參與稻瘟病菌的侵染過程,造成ΔMoRGS7致病力減弱,進一步試驗顯示ΔMoRGS7致病性下降是因為附著胞侵入率下降和侵染菌絲不能擴展造成的。CgRGS7與稻瘟病菌的MoRGS7相似,均在N端含有7個跨膜結構域,在C端含有一個RGS功能域,推測CgRGS7敲除轉化子的分生孢子產量下降及附著胞形成率降低可能是造成其致病力減弱的主要原因,關于CgRGS7是否影響附著胞的侵入及侵染菌絲的擴展,還有待于進一步的試驗驗證。
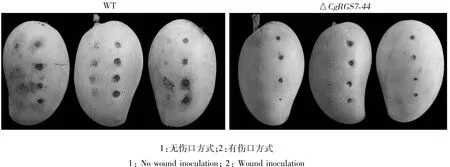
圖6 野生型與ΔCgRGS7-44致病力試驗Fig.6 Pathogenicity tests of wild type andΔCgRGS7-44
目前,在膠孢炭疽菌信號傳導途徑中鑒定的與致病相關的基因還較少,已報道的包括MAPK途徑中CgMEK1基因參與細胞分裂的極化及芽管的分化,其敲除突變體無附著胞形成,致病力喪失[14]; Cgl-slt2基因對營養菌絲生長和附著胞的形成有影響,其中敲除突變體的附著胞形成率明顯降低[1]。cAMP-PKA途徑中CgPKAC基因的敲除突變體附著胞形成緩慢及致病力減弱[15]。在以前的研究中,還發現G蛋白信號途徑中CgRGS2蛋白參與了膠孢炭疽菌的營養生長,分生孢子產量及萌發,氧化應激反應及細胞壁完整性,其敲除突變體致病力減弱[16],CgRGS4蛋白則影響該菌的營養生長,參與滲透壓響應及氧化應激反應,同時對黑色素產量有影響[17]。
4 結 論
本研究從膠孢炭疽菌中鑒定了一個RGS基因CgRGS7,表型分析發現其參與調控膠孢炭疽菌的分生孢子產生、附著胞形成及致病力,是該病菌一個新的致病因子。總的來說,目前關于膠孢炭疽菌致病機制研究尚處于起步階段,本研究為該病菌分子致病機理的研究奠定了一定的基礎。
[1]Yong H Y,Bakar FD A,Illias RM,etal.Cgl-SLT2 is required for appressorium formation,sporulation and pathogenicity in Colletotrichum gloeosporioides[J].Brazilian Journal of Microbiology,2013,44(4):1241-1250.
[2]畢方鋮,戴宏芬,孟祥春.農桿菌介導的芒果膠孢炭疽菌遺傳轉化及致病性缺陷突變體的篩選[J].熱帶農業科學,2014,34 (8):47-51.
[3]賈 靜,蒲金基,張 賀,等.芒果炭疽病菌環境pH信號調控基因PalF的克隆與分析[J].熱帶作物學報,2014,35(4):753-757.
[4]Cai Z Y,LiGH,Lin CH,et al.Identifying pathogenicity genes in the rubber tree anthracnose fungus Colletotrichum gloeosporioides through random insertional mutagenesis[J].Microbiological Research,2013,168:340-350.
[5]Li L,Shen G,Zhang ZG,etal.Canonical heterotrimeric G proteins regulatingmating and virulence of Cryptococcus neoformans[J].Molecular Biology of the Cell,2007,18(11):4201-4209.
[6]Siderovski D P,Willard FS.The GAPs,GEFs and GDIs of heterotrimeric G-Protein alpha subunits[J].International Journal of Biological Sciences,2005,1(2):51-66.
[7]Park A R,Cho A R,Seo JA,et al.Functional analyses of regulators of G protein signaling in Gibberella zeae[J].Fungal Genetics and Biology,2012,49(7):511-520.
[8]Yu JH.Heterotrimeric G protein signaling and RGSs in Aspergillus nidulans[J].Journal of Microbiology,2006,44(2):145-154.
[9]Wang Y,Geng Z,Jiang D,et al.Characterizations and functions of regulator of G protein signaling(RGS)in fungi[J].Applied Microbiology and Biotechnology,2013,97(18):7977-7987.
[10]Fang W G,Scully L R,Zhang L,et al.Implication of a regulator of G protein signalling(Bb RGS1)in conidiation and conidial thermotolerance of the insect pathogenic fungus Beauveria bassiana[J]. FEMSMicrobiology Letters,2008,279(2):146-156.
[11]Vries D L,Farquhar M G.RGS protein:more than just GAPs for heterotrimeric G protein[J].Trends in Cell Biology,1999,9(4): 138-144.
[12]Liu H,Suresh A,Willard F S,et al.Rgs1 regulatesmultiple Gα subunits in Magnaporthe,pathogenesis,asexual growth and thigmotropism[J].Embo Journal,2007,26(3):690-700.
[13]Zhang H,TangW,Liu K,et al.Eight RGSand RGS-like proteins orchestrate growth,differentiation,and pathogenicity of Magnaporthe oryzae[J].PLoSPathogens,2011,7(12):446-459.
[14]Kim Y K,Kawano T,Li D X,et al.A mitogen-activated protein kinase kinase required for induction of cytokinesis and appressorium formation by host signals in the conidia of Colletotrichum gloeosporioides[J].The Plant Cell,2000,12:1331-1343.
[15]Priyatno T P,Bakar F D A,Kamaruddin N,et al.Inactivation of the catalytic subunit of cAMP-dependent protein kinase A causes delayed appressorium formation and reduced pathogenicity of Colletotrichum gloeosporioides[J].The Scientific World Journal,2012,2012 (2):545784-545784.
[16]吳曼莉,李曉宇,張 楠,等.膠孢炭疽菌CgRGS2基因的克隆及生物學功能[J].微生物學報,2017(1):66-76.
[17]徐 爽,吳曼莉,柯智健,等.膠孢炭疽菌CgRGS4調控營養生長、滲透壓響應、氧化應激反應和致病性[J].浙江農業學報,2017(2):277-285.
(責任編輯 陳 虹)
CgRGS7 Regulation of Conidium Production,Appressorium Formation and Pathogenicity in Colletotrichum gloeosporioides
WU Man-li,HU Jian,ZHANG Nan,KE Zhi-jian,LIU Zhi-qiang*,LIXiao-yu
(Institute of Tropical Agriculture and Forestry,Hainan University,Hainan Haikou 570228,China)
【Objective】Regulators of G-protein signaling(RGS)were a kind of negative regulatory factor of G protein,which were involved in various G protein-mediated signaling pathways.At present,therewas little research on the biological functions of RGS in Colletotrichum gloeosporioides.【Method】In the present study,the gene-knockoutmutantof CgRGS7 wasobtained by homologous recombination,and itsbiological functionswere analyzed.【Result】The gene CgRGS7 encoded a 620-amino acids protein,containing seven membrane spaning domains and a RGS function domain.Comparing to thewild type,the knockoutmutantof CgRGS7 reduced conidium production withmulti-end germination and appressorium formation rate and pathogenicity.【Conclusion】CgRGS7 is involved in regulation of conidium production,germ tubemorphogenesis,appressorium formation rate and pathogenicity of C.gloeosporioides.
Colletotrichum gloeosporioides;Regulators of G-protein signaling;Conidium;Pathogenicity
S432.44
A
1001-4829(2017)8-1802-06
10.16213/j.cnki.scjas.2017.8.018
2016-09-10
國家自然科學基金(31560045);海南省重點研發計劃(ZDYF2016155)
吳曼莉(1992-),女,海南萬寧人,碩士研究生,主要研究方向為植物病原真菌學,E-mail:wumanli0331@163.com,*為通訊作者,E-mail:liuzhiqiang80@126.com。

