土荊芥醇提物對MCF-7細胞增殖的影響
朱曉換, 張杜宇, 鐘守慧, 任秋蓉, 王亞男*
(1. 四川師范大學 細胞生物學研究室, 四川 成都 610101; 2. 四川大學 生命科學學院, 四川 成都 610064)
土荊芥醇提物對MCF-7細胞增殖的影響
朱曉換1, 張杜宇2, 鐘守慧1, 任秋蓉1, 王亞男1*
(1. 四川師范大學 細胞生物學研究室, 四川 成都 610101; 2. 四川大學 生命科學學院, 四川 成都 610064)
為研究土荊芥醇提物對人乳腺癌MCF-7細胞增殖的抑制作用及其相關機制,采用MTT法檢測細胞增殖抑制率,Hochest染色觀察細胞核的形態變化,分光光度計法檢測抗氧化酶相對活性和丙二醛相對含量.結果表明:土荊芥醇提物對MCF-7細胞增殖具有顯著的抑制作用,且具有時間和濃度效應(P<0.01),作用12、24、48 h后,其IC50值分別是3.85、3.70和3.28 mg/mL;形態學觀察顯示,細胞核出現凋亡小體、染色質凝集、呈邊緣化分布等典型的凋亡特征;隨土荊芥醇提物濃度增大,超氧化物歧化酶和過氧化氫酶相對活性先升高后降低,丙二醛相對含量先升高,而后保持恒定,在質量濃度3.50 mg/mL時三者均達到最高值.結論:土荊芥醇取物抑制MCF-7細胞增殖是通過擾亂細胞抗氧化系統,誘導細胞氧化損傷,最終導致細胞凋亡.
土荊芥; 醇提物; MCF-7細胞; 細胞凋亡; 氧化損傷
土荊芥(ChenopodiumambrosioidesL.) 又名紅澤藍、臭草等,屬于藜科藜屬,為一年或多年生芳香性草本植物,原產于熱帶美洲,目前在我國廣泛分布[1].土荊芥的藥用價值始載于《生草藥性備要》,具有除濕、止痛、通經等功效,用于治療皮膚濕疹、蛇蟲咬傷、閉經等癥[2].近年來一些研究表明土荊芥提取物具有明顯的抗腫瘤作用,如土荊芥揮發油具有阻滯細胞周期、破壞細胞結構等毒性效應,抑制了人乳腺癌MCF-7細胞的增殖[3],導致人肝癌SMMC-7721細胞發生Caspase依賴性凋亡[4].許多藥用植物的醇提物也具有抗腫瘤功效,目前有關土荊芥醇提物的抗腫瘤效應的報道不一致,F. R. F. Nascimento等[5]研究表明土荊芥葉醇提物通過抑制腹腔內艾氏固體瘤和腹水瘤的形成,顯著提高了荷瘤小鼠存活率;而M. J. Ruffa等[6]研究顯示土荊芥醇提物對人肝癌HepG2細胞增殖沒有抑制作用,導致這一結果的原因可能是不同產地的土荊芥中含有的次生代謝物質不同.MCF-7細胞是從1名69歲的白人女性患者組織樣品中分離得到的乳腺癌細胞株,常用于研究腫瘤的發生機制.
土荊芥在四川省廣泛分布,具有較大的開發潛力.本研究以MCF-7細胞為受試細胞,以產自四川省成都市的土荊芥為材料,通過MTT法評價其醇提物對MCF-7細胞增殖的影響,為土荊芥資源的開發利用提供一定的理論依據.
1 材料與方法
1.1 受試細胞 人乳腺癌MCF-7細胞由四川大學華西醫院生物治療國家重點實驗室提供.
1.2 供試植株 實驗所用植株采集于四川省成都市郊區,經四川師范大學生命科學學院馬丹煒教授鑒定確認為藜科藜屬土荊芥ChenopodiumambrosioidesL..
1.3 實驗試劑 RPMI-1640培養基、胰蛋白酶、新生牛血清(成都哈里生物工程有限公司);噻唑藍(MTT, Biosharp 生物公司);Hoechst 33258(碧云天生物技術研究所,型號:C1011);二甲基亞砜(DMSO, Amresco生化公司);超氧化物歧化酶(SOD)WST-1 法測定試劑盒、過氧化氫酶(CAT)測定試劑盒、丙二醛(MDA)試劑盒(南京建成生物工程研究所).
1.4 實驗儀器 Spectra MaxMZ多功能細胞分析儀(美國Molecular Devices 公司);DM300型熒光顯微鏡(德國Leica公司) ;粉碎機SF-200(泰州市博精制藥機械有限公司);真空干燥機(北京博醫康實驗儀器有限公司);旋轉蒸發儀RE-52CS(上海雅榮生化儀器設備有限公司);循環水式多用真空泵SHB-Ⅲ(鄭州長城科工貿有限公司).
1.5 實驗方法
1.5.1 細胞培養 人乳腺癌MCF-7細胞培養于體積分數10%的新生牛血清、體積分數1%的青霉素(質量濃度100 U/mL)和鏈霉素(質量濃度100 μg/mL)組成的RPMI-1640培養液中,并置于37 ℃、體積分數5%CO2飽和濕度培養箱內.
實驗中所用的細胞均于前一天更換新鮮培養液,且處于對數生長期,每一實驗均重復3次.
1.5.2 土荊芥醇提物的提取 土荊芥植株于陰涼處晾干,制成干粉,20目篩子過篩,稱取15 g放入錐形瓶中,按3∶40比例加入體積分數50%的乙醇溶液,超聲波提取30 min,重復3次,收集濾液,用旋轉蒸發儀在40 ℃恒溫下濃縮,用真空冷凍干燥機冷凍干燥成粉末,即土荊芥醇提物[7].
土荊芥醇提取物得率=
提取物質量/土荊芥粉末質量×100%.
不同濃度的土荊芥醇提物是將其凍干粉用體積分數25%的乙醇配制而成.
1.5.3 MTT法檢測細胞增殖抑制率 人乳腺癌MCF-7細胞經胰蛋白酶消化離心后,以每孔100 μL,密度1×105個/mL接種于96孔板中.細胞貼壁后,更換200 μL質量濃度分別為 2.50、3.00、3.50、4.00、4.50、5.00 mg/mL土荊芥醇提物的新鮮培養液,各濃度設置5個重復,以體積分數25%的乙醇為溶劑對照,并設空白對照、陰性對照.
置于培養箱中培養24 h后,避光加入20 μL質量濃度5 mg/mL MTT溶液,作用4 h,吸去上清,加入150 μL二甲基亞砜.在波長490 nm處,用多功能細胞分析儀檢測吸光度(A)值,按以下公式計算細胞增殖抑制率:

1.5.4 Hochest染色觀察細胞核形態 將對數期的人乳腺癌MCF-7細胞以每孔2 mL,密度5×104個/mL接種于放有蓋玻片的六孔板中,置于CO2培養箱中培養.細胞貼壁后,更換2 mL質量濃度分別為2.50、3.50、5.00 mg/mL土荊芥醇提物的新鮮培養液,以體積分數25%的乙醇為溶劑對照,并設空白對照、陰性對照.
藥物作用24 h后,加入500 μL 固定液在4 ℃下作用10 min, PBS清洗2次,加入500 μL Hoechst 33258 染色液染色5 min,PBS清洗2次,取10 μL PBS緩沖液于潔凈載玻片上,將長有細胞的蓋玻片緩慢蓋于載玻片上,立即在暗室內熒光顯微鏡下觀察并拍照.
1.5.5 抗氧化酶活性和丙二醛(MDA)含量的測定將對數期的人乳腺癌MCF-7細胞以每瓶3 mL,密度3×105個/mL接種于50 mL培養瓶中,置于CO2培養箱中培養.細胞貼壁后,更換3 mL質量濃度分別為2.50、3.50、4.50、5.00 mg/mL土荊芥醇提物的新鮮培養液,以體積分數25%的乙醇為溶劑對照,并設空白對照、陰性對照.
藥物作用24 h后,按試劑盒說明書操作,分別測定細胞中超氧化物歧化酶(SOD)、過氧化氫酶(CAT)活性和MDA含量.
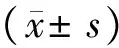
2 結果與分析
2.1 土荊芥醇提物得率 15 g土荊芥粉末經超聲波提取法得到1.529 g提取物,提取率為10.19%.
2.2 土荊芥醇提物抑制MCF-7細胞增殖 土荊芥醇提物對MCF-7細胞的MTT實驗結果見圖1.
由圖1可知土荊芥醇提物可顯著抑制MCF-7細胞的生長,且具有時間和濃度效應(P<0.01).當土荊芥醇提物質量濃度達到5.00 mg/mL,其對MCF-7細胞抑制率接近 80%,表明絕大部分MCF-7細胞已死亡.
應用Microsoft Excel 2010作回歸方程,土荊芥醇提物對MCF-7細胞作用時間為12、24和48 h 時,其半致死質量濃度IC50值分別為3.85、3.70、3.28 mg/mL.
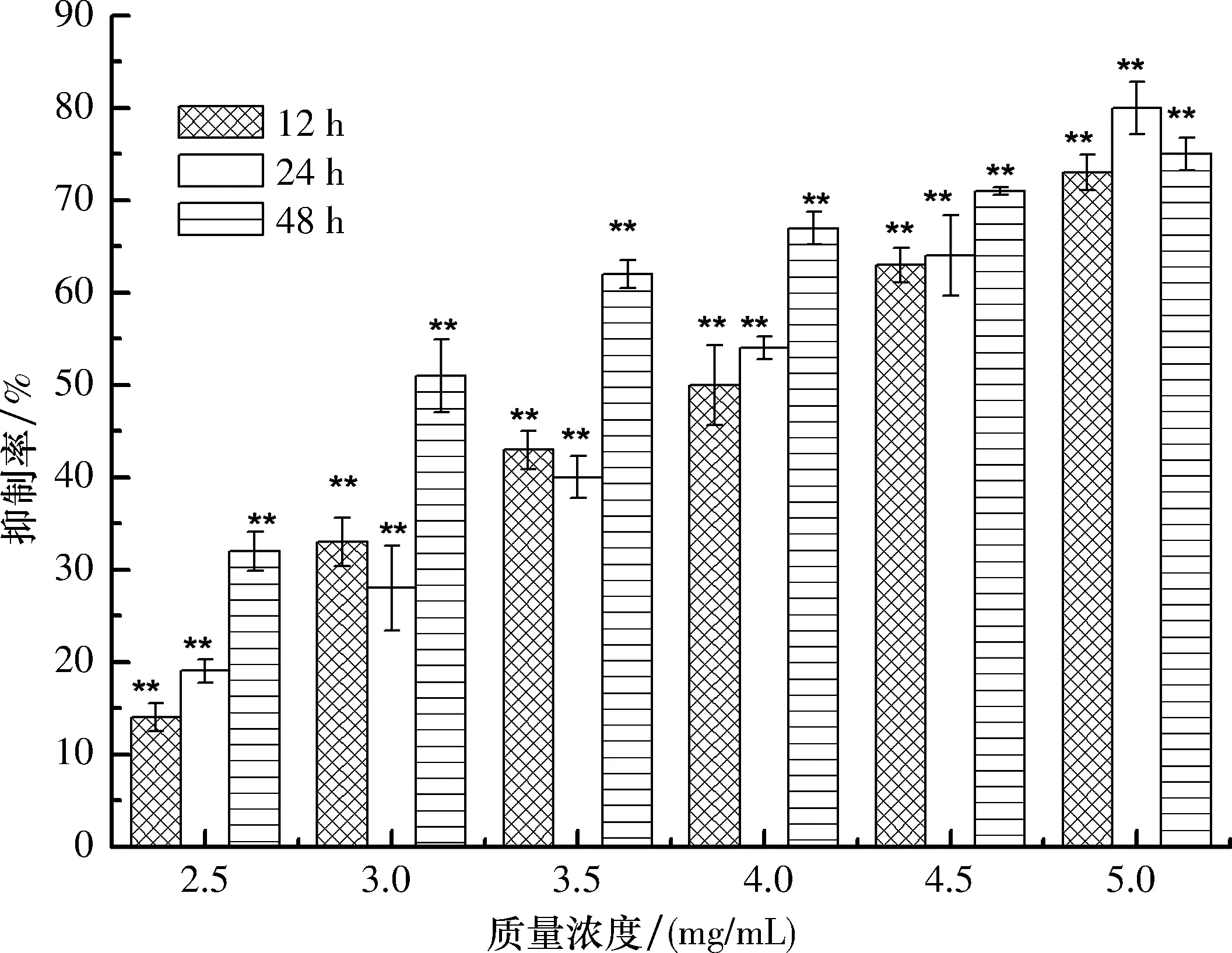
**:P<0.01
2.3 土荊芥醇提物誘導MCF-7細胞凋亡 土荊芥醇提物作用MCF-7細胞24 h后,經Hochest 33258染色,熒光顯微鏡下觀察細胞核形態,結果見圖2.對照組中細胞核染色均勻,呈正常的藍色(圖2A).土荊芥醇提物處理組細胞中染色質凝集,呈邊緣化,或呈碎塊狀致密濃染,細胞核周圍出現凋亡小體,表現出典型的凋亡特征(圖2B、C和D箭頭所示).隨著處理濃度的增大,凋亡小體的數目逐漸增多(圖2C),呈碎塊狀致密濃染的細胞核越來越多(圖2D).
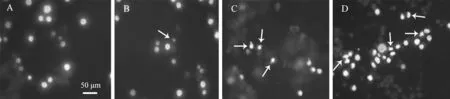
A、B、C、D土荊芥醇提物質量濃度分別為0、2.50、3.50、5.00 mg/mL
2.4 土荊芥醇提物誘導MCF-7細胞氧化損傷 不同劑量的土荊芥醇提物作用MCF-7細胞24 h后,對SOD、CAT相對活性和MDA相對含量的影響見圖3.
土荊芥醇提物可激活SOD、CAT活性,隨處理劑量升高,細胞中SOD、CAT相對活性均增高(P<0.01),在質量濃度3.50 mg/mL時達到最高值,分別為124.95%、22.39%.隨處理劑量的增加,MDA含量逐漸升高后趨于穩定(P<0.01),在3.50 mg/mL時達到最高值,為74.74%.結果表明,土荊芥醇提物干擾 MCF-7 細胞的抗氧化系統,誘導細胞發生氧化損傷.
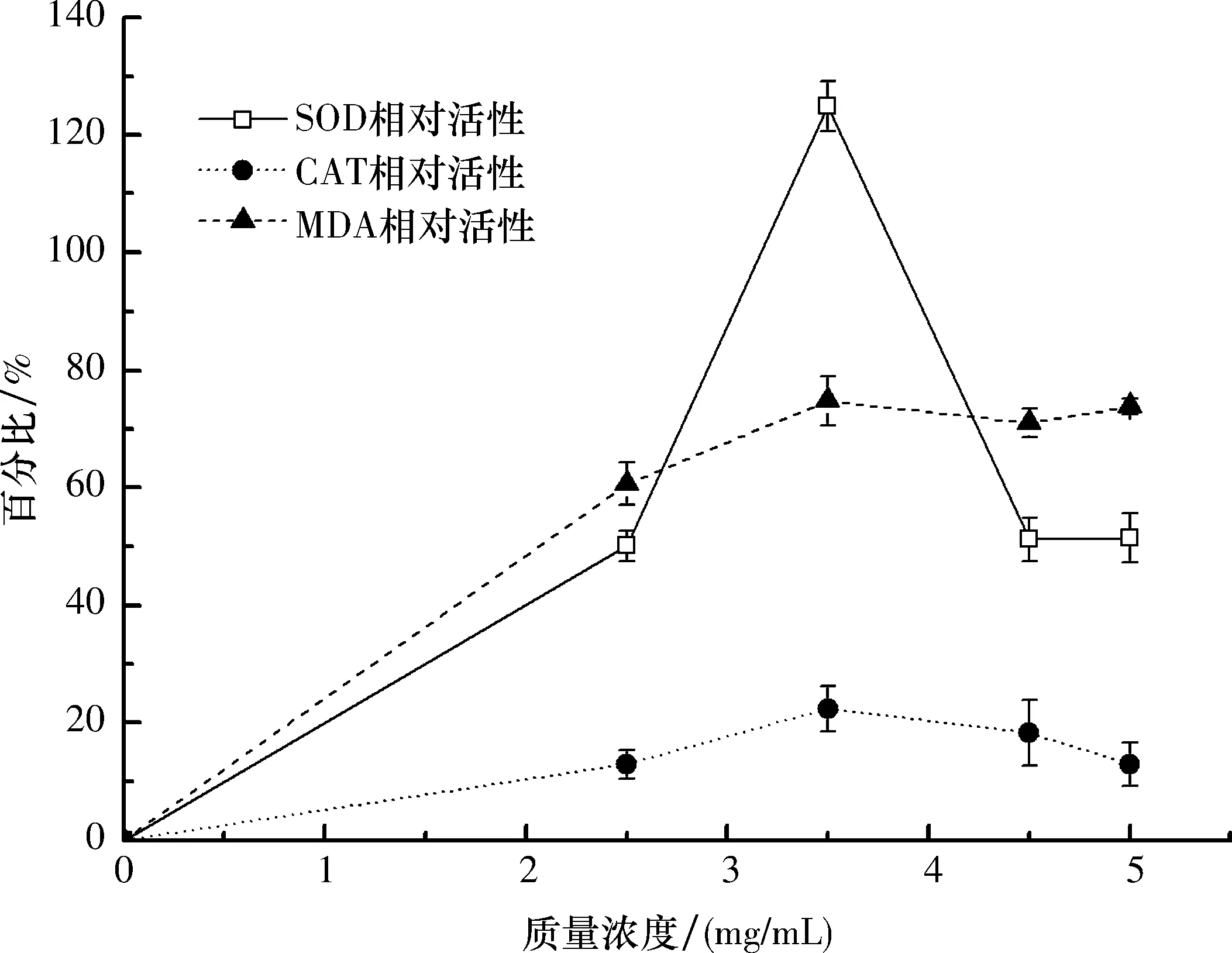
圖3 土荊芥醇提物對抗氧化酶相對活性和MDA相對含量的影響
3 討論
許多藥用植物的醇提物具有廣泛的抗腫瘤效應.文獻[8]發現阿魏菇醇提物能顯著抑制人食管癌Eca109細胞、人宮頸癌HeLa細胞、鼠黑色素瘤B16F10細胞和人乳腺癌MCF-7細胞的增殖.顏晰等[9]研究表明,連翹根醇提物通過JAK/STAT和ERK信號轉導通路,啟動線粒體內源途徑誘導食管癌TE-13細胞凋亡.文獻[10]發現土荊芥葉醇提物可增強小鼠體內巨噬細胞活性,提高機體免疫力,推測這可能是其具有抗腫瘤效應的原因之一.文獻[5]將質量分數5 mg/kg土荊芥葉醇提物注射到植入固體瘤或腹水瘤的小鼠體內,一定時間后測定固體瘤的生長狀況或腹水的體積和癌細胞數目,證明土荊芥葉醇提物能有效抑制Ehrlich固體瘤和腹水瘤的形成,從而提高荷瘤小鼠的存活率.本研究采用的土荊芥醇提物是用體積分數50%的乙醇從土荊芥全株制成的干粉中提取、濃縮、冷凍、干燥所得[7],其主要成分為黃酮類物質.本研究結果表明該醇提物顯著抑制了MCF-7細胞的增殖,處理24 h時,其IC50值為3.70 mg/mL,明顯低于土荊芥揮發油對MCF-7細胞的IC50值(9.45 μg/mL)[11],表明土荊芥醇提物的細胞毒性遠低于其揮發油的,其原因可能是由于醇提物和揮發油的有效成分差異較大造成的.
植物的次生代謝物質具有明顯的細胞毒性,當受到這些次生代謝物質作用時,細胞內會產生過量的過氧化氫(H2O2)、超氧陰離子(O2-)等活性氧(ROS)[12],導致質膜脂質過氧化生成的MDA,破壞蛋白質和核酸的結構[13],引起氧化損傷,導致細胞生長受阻.氧化損傷與細胞凋亡之間存在一定的關系.文獻[14]發現,人工半合成的4種大黃素蒽醌衍生物誘導細胞內 ROS增加,線粒體膜電位降低,從而抑制人口腔鱗癌KB細胞及其多藥耐藥株KBv200細胞生長,這一結果顯示大黃素蒽醌衍生物可能通過線粒體途徑誘導腫瘤細胞凋亡.化療藥物如長春新堿和順鉑同樣也是通過誘導氧化應激,引起腫瘤細胞凋亡[15].本研究結果表明,在土荊芥醇提物作用下,細胞的SOD和CAT相對活性先升高后下降,MDA相對含量升高,表明土荊芥醇提物引起了MCF-7細胞出現氧化應激,Hochest染色結果顯示細胞染色質固縮且呈邊緣化、出現凋亡小體等明顯的凋亡特征.由此可見,土荊芥醇提物抑制MCF-7細胞增殖是通過誘導細胞氧化損傷,從而導致細胞凋亡.
致謝 2016大學生創新創業訓練計劃項目和四川師范大學開放實驗項目對本文給予了資助,謹致謝意.
[1] 徐海根,強勝. 中國外來入侵物種編目[M] . 北京:中國環境科學出版社,2004.
[2] 中國藥科大學. 中藥辭海[M]. 第一卷. 北京:中國醫藥科技出版社,1993:232.
[3] 吳佳靚. 土荊芥揮發油及其主要成分對人乳腺癌細胞(MCF-7)的體外抗腫瘤活性[D]. 成都:四川師范大學,2014.
[4] 王亞男,朱曉換,馬慧,等. 土荊芥揮發油誘導人肝癌SMMC-7721細胞Caspase依賴性凋亡[J]. 中藥材,2016,39(5):1124-1128.
[5] NASCIMENTO F R F, CRUZ G V B, PEREIRA P V S, et al. Ascitic and solid ehrlich tumor inhibition byChenopodiumambrosioidesL. treatment[J]. Life Sciences,2006,78(22):2650-2653.
[6] RUFFA M J, FERRARO G , WAGNER M L, et al. Cytotoxic effect of Argentine medicinal plant extracts on human hepatocellular carcinoma cell line[J]. Ethnopharmacology,2002,79(3):335-339.
[7] 馮霞,趙欣. 不同容器發酵水豆豉乙醇提取物的抗氧化效果比較[J]. 現代食品科技,2016,32(7):1-8.
[8] 王為蘭,陳開旭,劉軍,等. 阿魏菇醇提物抗腫瘤功效及三萜類成分的提取[J]. 生物技術通報,2016(7):206-216.
[9] 顏晰. 連翹根醇提物抗腫瘤及免疫調節作用的實驗研究[D]. 石家莊:河北醫科大學,2012.
[10] CRUZ G V B, PEREIRA P V S, PATRICIO F J, et al. Increase of cellular recruitment, phagocytosis ability and nitric oxide production induced by hydroalcoholic extract fromChenopodiumambrosioidesleaves[J]. J Ethnopharmacology,2007,111(1):148-154.
[11] WU J L, MA D W, Wang Y N, et al. Cytotoxicity of essential oil ofChenopodiumambrosioidesL against human breast cancer MCF-7 cells[J]. Tropical J Pharmaceutical Research December,2013,12(6):929-933.
[12] PAN J, SHE M, XU Z X, et al. Farnesyl transferase inhibitors induce DNA damage via reactive oxygen species in human cancer cells[J]. Cancer Research,2005,65(9):3671-3681.
[13] OWEN R W, GIACOSA A, HULL W E, et al. Olive-oil consumption and health:the possible role of antioxidants[J]. Lancet Oncol,2000,1(2):107-112.
[14] 丁巖,梁永鉅,陸豫,等. 大黃素蒽醌衍生物介導KB及KBv200細胞氧化損傷的研究[J]. 中草藥,2004,11:63-66.
[15] GORRINI C, HARRIS I S, MAK T W. Modulation of oxidative stress as an anticancer strategy[J]. Nature Reviews Drug Discovery,2013,12(12):931-947.
(編輯 陶志寧)
The Effects of Ethanol Extract fromChenopodiumambrosioideson MCF-7 Cell Proliferation
ZHU Xiaohuan1, ZHANG Duyu2, ZHONG Shouhui1, REN Qiurong1, WANG Yanan1
(1.CellBiologyLaboratory,SichuanNormalUniversity,Chengdu610101,Sichuan; 2.CollegeofLifeScience,SichuanUniversity,Chengdu610064,Sichuan)
To investigate the effects of ethanol extract fromChenopodiumambrosioideson proliferation inhibition of human breast cancer cells MCF-7 and its relative mechanism, MTT assay, Hochest staining and Spectrophotometer method were applied to evaluate the ratio of cell proliferation inhibition, to visualize morphological changes of the nucleus, and the relative activities of cellular superoxide dismutase, catalase and relative content of malondialdehyde inC.ambrosioidesethanol extract treated MCF-7 cells. The results showed that the treatment of ethanol extract fromC.ambrosioidesresulted in the inhibition of MCF-7 cell proliferation in a dose- and time-dependent manner, and its IC50values were 3.85 mg/mL, 3.70 mg/mL, 3.28 mg/mL for 12 h, 24 h, 48 h, respectively. Morphological visualization revealed typical morphologic changes of apoptosis such as the emergence of apoptotic bodies, condensed chromatin and marginalization. With the increasing of the concentration of ethanol extract, relative activities of antioxidant enzymes, superoxide dismutase and catalase, were increased first and then decreased, the relative content of malondialdehyde was increased first and then kept constantly, the highest enzyme activities and MDA content were observed when the concentration of the ethanol extract increased to 3.50 mg/mL. Our results suggested that ethanol extract fromC.ambrosioidesinhibited the proliferation of MCF-7 cells through disrupting cell antioxidant system, inducing cell oxidative damage, and leading to apoptosis.
Chenopodiumambrosioides; ethanol extract; MCF-7 cells; apoptosis; oxidative damage
2016-06-30
四川省教育廳自然科學重點項目(16ZA0056)
R282
A
1001-8395(2017)04-0531-05
10.3969/j.issn.1001-8395.2017.04.017
*通信作者簡介:王亞男(1973—),女,副教授,主要從事細胞生物學和細胞毒理學的研究,E-mail:273218760@qq.com

