組蛋白去甲基化酶JMJD3研究進展
胡姍韓聰胡建宏朱海鯨
(1. 榆林學院生命科學學院,榆林 719000;2. 西北農林科技大學動物科技學院,楊陵 712100)
組蛋白去甲基化酶JMJD3研究進展
胡姍1,2韓聰1,2胡建宏2朱海鯨1
(1. 榆林學院生命科學學院,榆林 719000;2. 西北農林科技大學動物科技學院,楊陵 712100)
組蛋白甲基化狀態是有不同類型的甲基轉移酶和去甲基化酶來控制的。H3K27me2/3可以由多梳家族蛋白(如甲基轉移酶EZH2)控制形成,其去甲基化后可以催化基因表達。目前共鑒定出JMJD3和UTX兩種H3K27me3的去甲基化酶。大量研究發現,JMJD3可以促進細胞分化和衰老,參與調控腫瘤發生與發展。綜述了JMJD3在胚胎發育及腫瘤發生、發展中的作用及其調節機制,并對其在腫瘤診斷和治療方面的應用前景進行展望,旨為今后的研究工作奠定理論基礎。
JMJD3;H3K27me3;胚胎發育;細胞衰老;腫瘤發生
基因轉錄的表觀遺傳調控主要通過DNA甲基化和組蛋白修飾,組蛋白修飾包括甲基化、乙酰化和磷酸化等。組蛋白特異賴氨酸位點的甲基化修飾參與細胞分化、衰老、組織修復,在腫瘤及代謝性疾病的發生、發展中發揮了重要的作用[1-4]。組蛋白特異賴氨酸位點的甲基化修飾主要是由組蛋白賴氨酸去甲基化酶和組蛋白賴氨酸甲基轉移酶來調節的。組蛋白去甲基化酶主要分為LSD1 和JumonjiC(JmjC)家族兩類。LSD1 主要催化一甲基化和二甲基化的H3K4 和 H3K9去甲基化,JmjC家族的成員能催化一甲基化、二甲基化、三甲基化去甲基化[5]。H3K27的甲基化在基因組中分布廣泛,呈現一甲基化、二甲基化及三甲基化3種狀態。質譜研究表明,在胚胎干細胞中15%的H3K27呈現單甲基化狀態,50%呈現二甲基化狀態,15%呈現三甲基化狀態[6]。H3K27 三甲基化是基因轉錄抑制的標志,其去甲基化后可以激活基因表達[1,7],目前共鑒定出JMJD3與UTX兩種H3K27去甲基化酶,二者結構相似。本文綜述了JMJD3在細胞分化、衰老、胚胎發育及腫瘤發生、發展中的作用及其調節機制,對在腫瘤診斷和治療方面的應用前景進行展望,旨為今后的研究工作奠定理論基礎。
1 JMJD3的結構與催化機制
JMJD家族成員的C端和N 端都包含一個轉錄因子家族Jumonji小的特征結構域,分別稱為JmjC和JmjN。JmjC是 JMJD家族酶活性中心的組成之一,JmjN結構域與轉錄調節相關,因此該家族又被稱為包含JmjC結構域的組蛋白去甲基化酶家族[1]。JMJD家族成員包含一個鋅指結構,一個Fe2+離子結合位點和一個含有JmjC結構域的酮戊二酸依賴性的去甲基化酶活性結構域(圖1),屬于雙加氧酶家族[8]。目前,JmjC結構域的組蛋白賴氨酸去甲基化酶活性的催化機制已比較清楚。JmjC結構域在 Fe2+、α-酮戊二酸(2-OG)和O2的參與下,催化組蛋白賴氨酸殘基上甲基化氨基生成羥基化中間體,同時產生1 分子琥珀酸鹽和1 分子 CO2,隨后該中間體生成不穩定的半氨醛,并進一步分解為去甲基化賴氨酸和甲醛[8](圖2)。

圖1 JMJD3三級結構模型
在人中,大約有30 種蛋白含有JmjC結構域,根據整體的序列比對大致可以分成 JARID1、JHDM3、JHDM1、PHF8、JHDM2、UTX/UTY以及僅含JmjC結構域的蛋白質等7 個亞家族。一些含有JmjC結構域的JMJD有著不同的底物特異性(表1)。
JMJD3(Jumonji domain-containing protein 3),又被稱作KDM6B,是JMJD家族成員之一,JMJD3是含JmjC結構域的組蛋白去甲基化酶UTX/UTY 家族成員之一,與 UTX 有84% 的氨基酸序列相似度。人的 JMJD3 基因定位于 17p13.1,編碼 1 個含1682個氨基酸殘基的多肽[9]。JMJD3和 UTX均具有組蛋白去甲基化酶活性[10]。大量體內外研究發現,在細胞分化過程中,JMJD3和UTX表達量增加,許多發育相關基因(如HOX、Mashl、SP-B等)的啟動子區H3K27me3含量顯著減少,從而促進細胞分化;而當JMJD3的表達被抑制后,H3K27me3表達增加,部分分化相關基因(如SP-B、RUNX2、Bhlhb4)的表達被抑制,造成組織器官發育缺陷[2,11-12]。這說明JMJD3與H3K27位點的去甲基化密切相關,可能具有H3K27me2/3去甲基化酶活性。
JMJD3具有使非組蛋白去甲基化的去甲基化酶作用。JMJD3能夠催化Set7/9介導的腫瘤抑制蛋白RB 第810位賴氨酸甲基化位點去甲基化,抑制細胞周期蛋白激酶CDK4與RB蛋白的結合,降低RB蛋白的磷酸化水平,促進細胞衰老[3],該研究成果表明JMJD3 也可以催化非組蛋白去甲基化。
此外,JMJD3還可以作為轉錄因子直接調控靶標基因的轉錄。植物同源異型結構域鋅指蛋白20(PHF20)是細胞重編程的必要條件,缺乏PHF20的細胞無法去分化形成多能干細胞。Zhao等[13]發現JMJD3可以介導PHF20的泛素化降解失活,從而降低小鼠體細胞重編程為多能干細胞的效率。目前,關于JMJD3的非去甲基化酶作用機制尚不完善,需進一步研究。
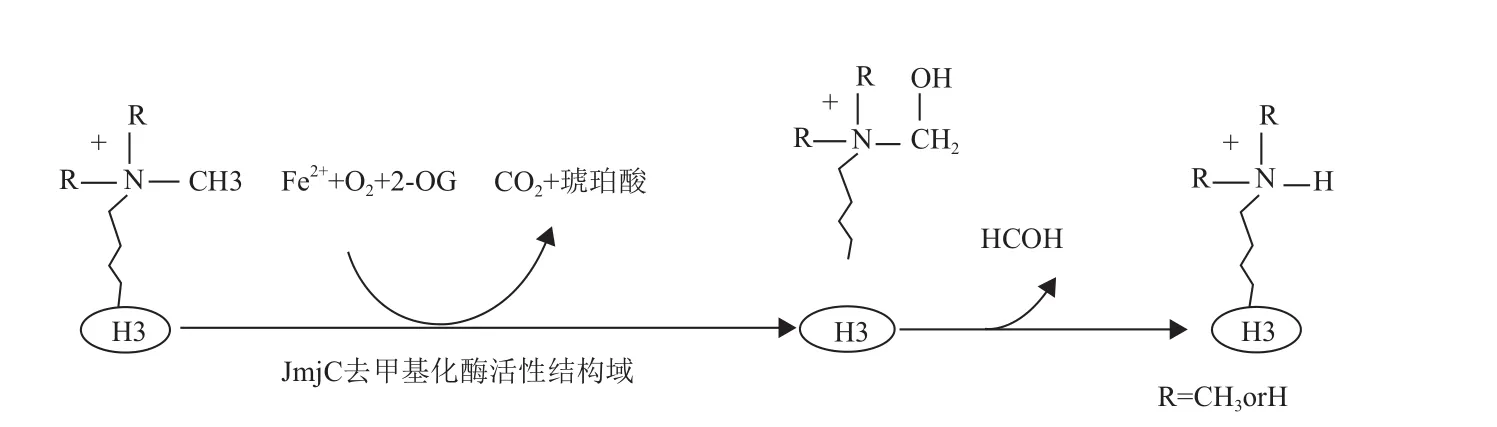
圖2 JmjC結構域的催化機制

表 1 部分 JMJD 家族成員的特異性底物及效應
2 JMJD3與胚胎發育
H3K27me3 被看作多能干細胞的標志之一,H3K27的去甲基化可作為基因轉錄去抑制化的一種重要方式[1,7]。目前,H3K27的去甲基化酶共鑒定出JMJD3與UTX兩種。H3K27的甲基化調節酶在胚胎發育的不同分化階段呈現動態變化[31-33],通過對不同基因的激活和抑制,調控細胞分化正常進行,從而保證胚胎的正常發育。
2.1 JMJD3與桑葚胚和囊胚形成
在豬胚胎發育過程中,H3K27組蛋白甲基轉移酶EZH2的表達在桑葚胚期達到高峰,H3K27me3表達較高,隨著細胞分化的進行,JMJD3表達增加,H3K27甲基化水平降低,進而激活與細胞發育相關Hox基因表達。在外胚層植入前的囊胚期,EZH2的表達量增高,導致JMJD3和UTX表達降低,H3K27甲基化水平增加[32],促進細胞的分化。Canovas等[33]研究發現JMJD3在牛成熟卵母細胞中有較高的轉錄水平,受精后JMJD3蛋白含量增加。與此同時,其mRNA水平卻降低,這種表達模式說明JMJD3為母體遺傳基因。另外,他們在孤雌激活的MⅡ卵母細胞中,干擾JMJD3的表達抑制植入前胚胎H3K27me3的表達,降低囊胚發育的速度。這些結果說明JMJD3在不同動物桑葚胚和囊胚發育時表達水平呈動態變化,促進細胞分化與胚胎發育。2.2 JMJD3與內胚層形成
內胚層主要可以發育為胃腸道、呼吸道、內分泌腺和泌尿系統等組織器官,在胚胎分化發育過程中,JMJD3可以調控內胚層的形成。研究發現,敲除人類胚胎干細胞中的JMJD3和UTX基因后,可以抑制胚胎干細胞向內胚層細胞的分化[24],說明JMJD3和UTX在內胚層發育中具有重要的調控作用,而這一作用可能是通過JMJD3與一些內胚層形成過程中重要的因子(如T-box轉錄因子、Eomes和Tbx3等)相互作用來實現的。在內胚層分化早期,TBX3與JMJD3結合于Eomes增強子區域,使其增強子靠近啟動子,激活Activin A信號通路,促使Eomes轉錄、表達,從而激活內胚層分化過程中的轉錄調控因子,促進內胚層分化[34](圖3-A)。在內胚層發育過程中,胚胎轉化生長因子Nodal可以激活Smad2/3,進而結合到H3K27me3沉默的靶基因上,然后Smad2/3招募JMJD3從而使H3K27me3去甲基化,最終激活靶基因的表達[35](圖3-B)。在小鼠胚胎肺發育的過程中,敲除JMJD3基因后導致小鼠肺發育不全,從而引起圍產期胎兒致死[3,36],說明JMJD3對肺的健康發育有至關重要的作用。JMJD3表達量的下調能夠明顯的降低與肺發育相關的關鍵性基因的表達,特別是表面活化蛋白SP-B的表達。JMJD3通過與轉錄因子Nkx2.1和表觀遺傳蛋白 Brg1相互作用來調節SP-B啟動子區域H3K27甲基化狀態,從而調節SP-B的表達,調節肺發育[2]。這些研究發現,表明了JMJD3在內胚層形成,特別是肺的發育過程中具有重要的調節作用。
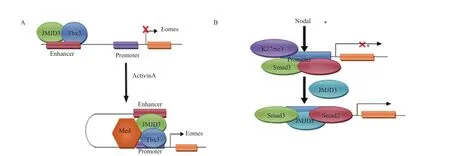
圖3 JMJD3可以分別與Tbx3和Smad2/3聯合調節內胚層發育
2.3 JMJD3與中胚層形成
JMJD3與中胚層發育也有著重要的關系,在胚胎干細胞分化為內胚層細胞的過程中,JMJD3可以補償部分UTX的功能[37]。中胚層可以發育為肌肉、脾臟、軟骨、骨骼、淋巴結、性腺、淋巴管、皮膚、腎臟、心臟、血管和骨髓等組織器官。在胚胎干細胞中缺乏JMJD3,可以顯著的增加中胚層調節因子Brachyury(T-box轉錄因子家族成員)啟動子區H3K27me3的數量,降低Brachyury的表達量,從而導致 β-鏈蛋白補充受損,而β-鏈蛋白是中胚層分化的首要調節因素[38],缺乏β-鏈蛋白后將導致無法形成中胚層。
在晚期中胚層分化期間,JMJD3對器官的發育有著至關重要的作用。將胚胎干細胞中JMJD3敲除,可以降低內皮細胞和心肌祖細胞的分化形成[38],使小鼠脾臟發育受損還可影響骨形成。在軟骨骨形成過程中,JMJD3可以通過去甲基化酶活性降低調節因子RUNX2啟動子區域H3K27me3的含量,激活RUNX2轉錄活性,從而促進骨形成[11]。在軟骨骨化期間,JMJD3在肥大前細胞和肥大軟骨細胞中表達較高,將JMJD3敲除后,可以導致骨化速度降低[39],但會增加成脂分化[40]。Huszar等[41]在骨髓間充質干細胞(BMSCs)分化過程中研究發現,miR-146a能抑制JMJD3的表達,是JMJD3的負調控因子。調節miR-146a表達水平,可以改變JMJD3和RUNX2表達水平,從而影響成骨分化。在牙齒發育的過程中,JMJD3 可以與骨形態生成蛋白BMP2 啟動子結合,解除H3K27me3表達抑制,促進牙向分化,敲除JMJD3可以減弱牙向分化[42]。這些研究均表明JMJD3在骨形成中必不可少。
免疫細胞(如B細胞、T細胞和巨噬細胞等)廣泛存在于由中胚層發育的骨髓、淋巴結、淋巴管等免疫組織器官中。在免疫細胞分化過程中,JMJD3扮演著重要的角色。JMJD3與B細胞分化有密切的聯系,與處于分化階段的記憶性B細胞相比,JMJD3轉錄靶基因在生發中心B細胞的表達水平顯著增加[43]。在T細胞分化過程中,JMJD3也有著重要的作用。Liu等[44]發現T細胞抗原受體(TCR)信號可以快速誘導JMJD3表達,敲除JMJD3基因可以抑制早期CD4+T細胞向Th17細胞分化,而過表達JMJD3能夠恢復Th17細胞的分化缺陷。另外,JMJD3能夠直接結合到Th17細胞的特征性轉錄因子Rorgt的啟動子區域,降低H3K27me3水平,激活Rorgt基因的表達。
巨噬細胞可以分為M1和M2兩個亞群,M1型具有清除病原體與促炎作用,而M2型具有免疫調節作用和組織修復能力。JMJD3對M1型巨噬細胞沒有明顯的影響,但在M2型巨噬細胞分化中是必不可少的。在巨噬細胞中JMJD3可以調節IRF4啟動子區域結合的組蛋白甲基化水平,調控IRF4的表達,從而調節M2型巨噬細胞相關的表面標記分子[36]。另外,在巨噬細胞中,炎癥相關信號的(如脂多糖LPS)刺激能夠激活NF-κB信號通路,后NF-κB信號通路關鍵蛋白與JMJD3啟動子區域保守的NF-κB結合位點結合,促進JMJD3基因表達。JMJD3通過對H3K27甲基化水平的調節,影響下游靶基因的轉錄表達,進而調節巨噬細胞的表型使其對炎癥刺激作出相應的反應[45]。
2.4 JMJD3與外胚層發育
外胚層的形成同樣受到JMJD3的調節。外胚層主要分化發育為神經系統和表皮。在胚胎干細胞分化成神經細胞時需要JMJD3的參與,在神經祖細胞分化的第8天JMJD3表達上調,在第26天時表達水平降低[32]。神經形成主要調控因子有Pax6、Sox1、Nestin等,JMJD3可以直接調控這3個因子的表達[32]。JMJD3也可以調控Shh表達,從而調控神經管的形成[5]。在RA誘導P19細胞向神經細胞方向分化過程中,JMJD3被募集到神經分化關鍵基因Mashl啟動子上使H3K27me3去甲基化,提高Mashl的表達量,促進神經分化[46]。在脊髓發育過程中,JMJD3與轉錄因子SMAD1/4相互作用,激活BMP信號的直接拮抗劑Noggin的表達,從而抑制BMP信號通路,確保BMP在脊髓發育過程中保持在合適的水平[47]。在視網膜神經元分化過程中JMJD3可以使Bhlhb4基因啟動子H3K27me3得含量降低,促進視網膜神經元分化[12]。TAp63是神經發育過程中的一種重要的促凋亡蛋白,JMJD3的超表達可以促進TAp63γ的表達,進而增強神經標記物β-III 微管蛋白表達[48]。這些研究表明JMJD3在神經系統發育中有重要的作用,不可或缺。
外胚層發育為表皮過程中,JMJD3也能夠調控相關基因的表達,從而調節表皮細胞的分化。在未分化細胞中,許多表皮分化相關基因(如IVL、S100A8和KRT1等)的啟動子區域富含H3K27me3標記。在Ca2+誘導分化的過程中,這些基因的啟動子區域結合上JMJD3或缺失多梳蛋白SUZ12可以使H3K27me3去甲基化,激活基因表達,促進角質細胞分化,促進表皮成熟。JMJD3過表達可導致表皮分化的提前成熟,而缺失會阻礙表皮分化[49]。
3 JMJD3與細胞衰老
細胞衰老是機體新陳代謝的自然現象,細胞衰老可能是由DNA損傷、癌基因誘導、染色質紊亂等因素引起。復制性衰老或者癌基因的誘導可以引起人二倍體成纖維細胞的細胞核內染色質重排,形成異染色質凝集,這一現象被稱為衰老相關的異染色質凝集(SAHF)[3]。復制性衰老與多梳蛋白復合物PcG蛋白(如EZH2)表達量下降、JMJD3表達量上調等因素相關。INK4b-ARF-INK4a基因共編碼p16(INK4a)、p15(INK4b)和p14(ARF)3個成員,3種蛋白均參與了細胞的衰老調節。而PcG蛋白和JMJD3參與調節p16基因的表達。在正常生長的細胞中,PcG蛋白可以使H3K27三甲基化從而抑制INK4a/Arf基因編碼的腫瘤抑制蛋白p16和p14表達[50]。在原癌基因BRAF和HRASV12的壓力下,JMJD3的表達水平大幅提高,2 h內提高大約4倍,在5 d的時候提高到12倍[51]。JMJD3可以與p16INK4a基因轉錄起始位點上游結合,降低H3K27甲基化水平和促進PcG蛋白CBX7、Bmil和SUZ12的解離,逆轉PcG蛋白對基因的抑制作用,激活基因表達,使腫瘤抑制蛋白p16表達量增加,進而抑制細胞增殖,促進細胞衰老[51-53]。
SAHF 的形成可以穩定細胞衰老的狀態,抑制腫瘤的發生。采用ChIP-seq方法研究發現,在形成SAHF的過程中,許多組蛋白的修飾都參與了這一過程,并且呈現出不同的分布情形,抑制性的組蛋白修飾H3K9me3位于SAHF凝集點的核心區域,H3K27me3 位于 H3K9me3 凝集點的外側,形成一個“環”環繞著 H3K9me3 凝集點[54-56]。Zhao等[3]研究發現JMJD3 是一個新的SAHF的誘導因子,其可以催化非組蛋白 RB 蛋白去甲基化,抑制細胞周期蛋白依賴性激酶4(CDK4)與RB蛋白的結合,降低了RB蛋白磷酸化水平,之后 RB 蛋白可與細胞周期調控蛋白E2F結合,使 E2F靶基因不能表達,從而促進細胞衰老形成 SAHF(圖4),說明JMJD3 誘導細胞衰老存在一條不依賴于 p16 的途徑。E2F能通過誘導ARF表達,其可抑制 p53 特異性泛素連接酶 MDM2活性,激活 p53 的表達,促進細胞衰老。
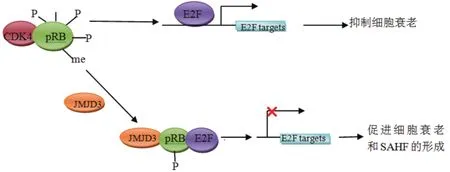
圖4 JMJD3在SAHF形成中的作用
細胞本身的組蛋白去乙酰化酶可以調節EZH2和JMJD3的表達。隨著人類多潛能干細胞的衰老,組蛋白去乙酰化酶的含量下降,伴隨而來的是JMJD3表達增多和EZH2表達減少,Jung等[50]研究發現,使用組蛋白去乙酰化酶抑制劑也可增加JMJD3的表達和衰老的發生,JMJD3 表達過多可加速細胞衰老。
4 JMJD3與腫瘤發生
正常的細胞衰老可以控制因DNA損傷或者癌基因刺激造成的生長失控和無限分裂增殖,防止腫瘤的發生。但當衰老調節失控時,細胞則會出現無限增殖,最終引發腫瘤發生[57]。多種人類腫瘤中存在頻繁的INK4b-ARF-INK4a 位點喪失現象,INK4b-ARF-INK4a 功能缺失是造成腫瘤發生的一個重要因素[58],JMJD3可以促進其編碼的抑癌性蛋白p16和p14表達。這說明JMJD3與腫瘤的發生發展有密切的關系。大量研究表明,在多種腫瘤的臨床標本和細胞系中出現H3K27me3含量增加的現象,如乳腺癌[59]、鼻咽癌[59]、前列腺癌[60]、多發性骨髓瘤[60]和胃癌[61]等。一方面提示H3K27me3水平增高可能成為一種新的腫瘤預測信號;另一方面則暗示H3K27去甲基化酶將具有癌癥抑制效應。楊琳等[62]證明了在急性髓性白血病HL-60、U937、NB4 三種細胞中H3K27me3 的含量均較高,去甲基化酶JMJD3 低表達。在HL-60細胞中過表達JMJD3后,H3K27me3含量降低,抑癌蛋白P15、P16 分子的表達上調,細胞增殖效率顯著降低。這說明在腫瘤細胞中上調JMJD3蛋白水平或酶活性能顯著降低H3K27me3水平,這會成為腫瘤治療的一個新方向。
但有研究發現在前列腺癌[8]、腎細胞癌[62]、原發性霍奇金淋巴瘤[63]、乳腺癌[64]、非霍奇金氏淋巴瘤[43]等腫瘤細胞中,出現了JMJD3過表達現象,這意味著JMJD3 基因在不同腫瘤中可能發揮不同的生物學功能。在腎透明細胞癌中,敲除JMJD3可以抑制腫瘤發生,其可以通過激活轉錄因子SLUG誘導上皮間質轉化(EMT)表達[62]。在乳腺癌中,JMJD3能夠調節抗凋亡基因BCL2啟動子區域的H3K27甲基化水平,從而提高BCL2的表達,促進腫瘤細胞增殖[64]。在原發的霍奇金淋巴瘤中,EBV原癌基因是導致霍奇金淋巴瘤發生的一個重要的誘導因素,能誘導生發中心B細胞中JMJD3的表達,促使JMJD3的轉錄靶基因高度富集,沉默JMJD3基因能恢復這些基因的H3K27甲基化水平[65]。這提示在這些腫瘤中JMJD3可能起著原癌基因的作用。
JMJD3作為H3K27me2/3的去甲基化酶,作用和EZH2相拮抗,理論上應該起到抑制腫瘤發生的作用。但部分研究發現,在一些腫瘤組織中JMJD3、UTX和EZH2表達均有增高的現象,出現同一種腫瘤中H3K27甲基轉移酶和去甲基化酶表達同時升高的“矛盾”現象。Xiang等[1]在前列腺癌中發現JMJD3和EZH2均高表達,其認為JMJD3和EZH2可能通過“代償”機制調節H3K27的甲基化水平,即當甲基轉移酶表達水平過度時,去甲基化酶就通過“代償”調節H3K27甲基化水平,兩者表達失調從而引起腫瘤的發生。在小鼠神經干細胞中,JMJD3可直接和p53和ARF外顯子相結合,但H3K27me3表達水平不變,這提示JMJD3并未通過其對H3K27me3的去甲基化酶作用來調節p53和ARF的表達[66]。因此說明JMJD3可能存在去甲基化酶作用以外的其他功能,參與更加廣泛的調節網絡。
5 JMJD3研究前景
研究表明,H3K27去甲基化酶JMJD3,在細胞分化、衰老、胚胎發育及腫瘤發生、發展等生理活動中有著重要的作用。但是,關于JMJD3在參與各種生理活動的作用和調節機理尚不太清楚,如JMJD3在哪些生理活動中通過其非組蛋白去甲基化酶活性或作為轉錄因子去調節,其是否還存在其他作用。在腫瘤發生過程中,研究JMJD3在哪些腫瘤中發揮了抑癌作用,在哪些腫瘤中發揮了原癌基因作用,探索其調節的靶基因及它們在腫瘤發生中的作用,為進一步研究針對癌癥治療的組蛋白去甲基化酶抑制劑或激活劑奠定理論基礎,為腫瘤發生機制的闡明、預防、診斷和治療發揮重大的推動作用。
[1]Xiang Y, Zhu Z, Han G, et al. JMJD3 is a histone H3K27 demethylase[J]. Cell Res, 2007, 17(10):850-857.
[2] Li Q, Wang HY, Chepelev I, et al. Stage-dependent and locusspecific role of histone demethylase Jumonji D3(JMJD3)in the embryonic stages of lung development[J]. PLoS One, 2014, 10(7):e1004524.
[3]Zhao L, Zhang Y, Gao Y, et al. JMJD3 promotes SAHF formation in senescent WI38 cells by triggering an interplay between demethylation and phosphorylation of RB protein[J]. Cell Death Differ, 2015, 22(10):1630-1640.
[4]Burchfield JS, Li Q, Wang HY, Wang RF. JMJD3 as an epigenetic regulator in development and disease[J]. Int J Biochem Cell Biol, 2015, 67:148-157.
[5]Shi Y, Lan F, et al. Histone demethylation mediated by the nuclear amine oxidase homolog LSD1[J]. Cell, 2004, 119(7):941-953.
[6]Peters AH, KubicekS, Mechtler K, et al. Partitioning and plasticity of repressive histone methylation states in mammalian chromatin[J]. Molecular Cell, 2003, 12:1577-1589.
[7]Barski A, Cuddapah S, Cui K, et al. High-resolution profiling of histone methylations in the human genome[J]. Cell, 2007, 129:823-837.
[8]Klose RJ, Kallin EM, Zhang Y. JmjC-domain-containing proteins and histone demethylation[J]. Nat Rev Genet, 2006, 7(9):715-727.
[9]Ke XS, Qu Y, Rostad K, et al. Genome-wide profiling of histone h3 lysine 4 and lysine 27 trimethylation reveals an epigenetic signature in prostate carcinogenesis[J]. PLoS One, 2009, 4(3):e4687.
[10]Swigut T, Wysocka J. H3K27 demethylases, at long last[J]. Cell, 2007, 131(1):29-32.
[11]Zhang F, Xu L, Xu L, et al. Histone demethylase JMJD3 is required for osteoblast differentiation in mice[J]. Sci Rep, 2015, 5:13418.
[12]Iida A, Iwagawa T, Kuribayashi H, et al. Histone demethylase Jmjd3is required for the development of subsets of retinal bipolar cells[J]. Proc Natl Acad Sci USA, 2014, 111:3751-3756.
[13]Zhao W, Li Q, Ayers S, et al. Jmjd3 inhibits reprogramming by up regulating expression of INK4a/Arf and targeting PHF20 for ubiquitination[J]. Cell, 2013, 152(5):1073-1050.
[14]Tanaka Y, Yano H, Ogasawara S, et al. Mild glucose starvation induces KDM2A-mediated H3K36me2 demethylation through AMPK to reduce rRNA transcription and cell proliferation[J]. Mol Cell Biol, 2015, 35(24):4170-4184.
[15]Janzer A, Stamm K, Becker A, et al. The H3K4me3 histone demethylase fbxl10 is a regulator of chemokine expression, cellular morphology, and the metabolome of fibroblasts[J]. Journal of Biological Chemistry, 2012, 287(37):30984-3092.
[16]Herzog M, Josseaux E, et al. The histone demethylase Kdm3a is essential to progression through differentiation[J]. Nucleic Acids Res, 2012, 40(15):7219-7232.
[17]Ling Y, Fan Z, Bo Y, et al. Histone Demethylases KDM4B and KDM6B Promotes Osteogenic Differentiation of HumanMSCs[J]. Cell Stem Cell, 2012, 11(1):50.
[18]Su Z, Wang F, Lee JH, et al. Reader domain specificity and lysine demethylase-4 family function[J]. Nature Communications, 2016, 7:13387.
[19] Pack LR, Yamamoto KR, Fujimori DG. Opposing Chromatin Signals Direct and Regulate the Demethylase Activity of KDM4C[J]. J Biol Chem, 2016, 291(12):6060-6070.
[20] Kupershmit I, Khouryhaddad H, Awwad S W, et al. KDM4C(GASC1)lysine demethylase is associated with mitotic chromatin and regulates chromosome segregation during mitosis. [J]. Nucleic Acids Research, 2014, 42(10):6168-6182.
[21]Zoabi M, Nadar-Ponniah PT, Khoury-Haddad H, et al. RNA-dependent chromatin localization of KDM4D lysine demethylase promotes H3K9me3 demethylation[J]. Nucleic Acids Research, 2014, 42(21):13026.
[22]Wang C, Wang J, et al. KDM5A controls bone morphogenic protein 2-induced osteogenic differentiation of bone mesenchymal stem cells during osteoporosis[J]. Cell Death Dis, 2016, 7(8):e2335.
[23]Wang D, Han S, Peng R, et al. Depletion of histone demethylase KDM5B inhibits cell proliferation of hepatocellular carcinoma by regulation of cell cycle checkpoint proteins p15 and p27. [J]. J Exp Clini Cancer Res, 2016, 35(1):1-13.
[24]Jiang W, Wang J, Zhang Y. Histone H3K27me3 demethylases KDM6A and KDM6B modulate definitive endoderm differentiation from human ESCs by regulating WNT signaling pathway[J]. Cell Research, 2013, 23(1):122-130.
[25]Pan MR, Hsu MC, Chen LT, et al. G9a orchestrates PCL3 and KDM7A to promote histone H3K27 methylation[J]. Scientific Reports, 2015, 5:18709.
[26]Feng W, Yonezawa M, Ye J, et al. PHF8 activates transcription of rRNA genes through H3K4me3 binding and H3K9me1/2 demethylation[J]. Nat Struct Mol Biol, 2010, 17:445-450.
[27]Qi HH, Sarkissian M, Hu GQ, et al. Histone H4K20/H3K9 demethylase PHF8 regulates zebrafish brain and craniofacial development[J]. Nature, 2010, 466:503-507.
[28]Chen B, Yu M, et al. Mdig de-represses H19 large intergenic noncoding RNA(lincRNA)by down-regulating H3K9me3 and heterochromatin[J]. Oncotarget, 2013, 4(9):1427.
[29] Lee KH, Ju UI, Song JY, et al. The histone demethylase PHF2 promotes fat cell differentiation as an epigenetic activator of both C/EBPα and C/EBPδ. [J]. Mol Cells, 2014, 37(10):734.
[30]Chen Q, Sinha K, Deng JM, et al. Mesenchymal deletion of histone demethylase NO66 in mice promotes bone formation[J]. J Bone Miner Res, 2015, 30(9):1608-1617.
[31]Burgold T, Spreafico F, De Santa F, et al. The histone H3 lysine 27-specific demethylase JMJD3 is required for neural commitment[J]. PLoS One, 2008, 3(8):e3034.
[32]GaoY, Hyttel P, Hall VJ. Regulation of H3K27me3 and H3K4me3 during early porcine embryonic development[J]. Mol Reprod Dev, 2010, 77(6):540- 549.
[33]Canovas S, Cibelli JB, Ross PJ. Jumonji domain-containing protein 3 regulates histone3 lysine 27 methylation during bovine preimplantation development[J]. Proc Natl Acad Sci USA, 2012, 109(7):2400-2405.
[34]Kartikasari AE, Zhou JX, Kanji MS, et al. The histone demethylase Jmjd3 sequentially associates with the transcription factors Tbx3 and Eomes to drive endoderm differentiation[J]. Embo J, 2013, 32(10):1393-1408.
[35]Dahle, Kumar A, Kuehn MR. Nodal signaling recruits the histone demethylase Jmjd3 to counteract polycomb-mediated repression at target genes[J]. Sci Signal, 2010, 3(127):ra48.
[36]Satoh T, Takeuchi O, Vandenbon A, et al. The Jmjd3-Irf4 axisregulates M2 macrophage polarization and host responses against helminthinfection[J]. Nat Immun, 2010, 11:936-944.
[37]Morales Torres C, Laugesen A, Helin K. Utx is required for proper induction of ectoderm andmesoderm during differentiation of embryonic stem cells[J]. PLoS One, 2013;8:e60020.
[38]Ohtani K, Zhao C, Dobreva G, et al. Jmjd3 controls mesodermal andcardiovascular differentiation of embryonic stem cells[J]. Circ Res, 2013, 113:856-862.
[39]Zhang F, Xu L, Xu L, et al. JMJD3 promotes chondrocyte proliferation and hypertrophy during endochondral bone formation in mice[J]. J Mol Cell Biol, 2015, 7(1):23-34.
[40]Gomez-Sanchez JA, Gomis-Coloma C, Morenilla-Palao C, et al. Epigenetic induction of the Ink4a/Arf locus prevents Schwann cell overproliferation during nerveregeneration and after tumorigenic challenge[J]. Brain:J Neurol, 2013;136:2262-2278.
[41]Huszar JM, Payne CJ. MIR146A inhibits JMJD3 expression and osteogenic differentiation in human mesenchymal stem cells[J].FEBS Lett, 2014, 588(9):1850-1856.
[42]Xu J, Yu B, Hong C, Wang CY. KDM6B epigenetically regulates odontogenic differentiation of dentalmesenchymal stem cells[J]. Int J Oral Sci, 2013, 5:200-205.
[43]張妍. JMJD3調控彌漫性大B細胞淋巴瘤進展的作用機制研究[D]. 天津:南開大學, 2014.
[44]Liu Z, Cao W, Xu L, et al. The histone H3 lysine-27 demethylase Jmjd3 plays a critical role in specific regulation of Th17 cell differentiation[J]. J Mol Cell Biol, 2015, 7(6):505-516.
[45]De Santa F, Totaro MG, et al. The histone H3 lysine-27 demethylase Jmjd3 links inflammation to inhibition of polycomb-mediated gene silencing[J]. Cell, 2007, 130(6):1083-1094.
[46]Dai JP, Lu JY, Zhang Y, et al. Jmjd3 activates Mash1 gene in RA induced neuronal differentiation of P19 cell[J]. J Cell Biochem, 2010, 110:1457-1463.
[47]Akizu N, Estaras C, Guerrero L, et al. H3K27me3 regulates BMP activity indeveloping spinal cord[J]. Development(Cambridge, England), 2010, 137:2915-2925.
[48]Fonseca MB, Nunes AF, Morgado AL, et al. TAp63γ demethylation regulates protein stability and cellular distribution during neural stem cell differentiation[J]. PLoS One, 2012, 7(12):e52417.
[49]Sen GL, Webster DE, Barragan DI, et al. Control of differentiationin a self-renewing mammaliantissue by the histonedemethylase JMJD3[J]. Genes Dev, 2008, 22(14):1865-1870.
[50]Jung JW, et al. Histone deacetylase controls adult stem cell aging by balancing the expression of polycomb genes and jumonji domain containing 3[J]. Cell Mol Life Sci, 2010, 67(7):1165-1176.
[51]Agger K, Cloos PA, Rudkjaer L, et al. The H3K27me3 demethylase JMJD3 contributes to the activation of the INK4A-ARF locus in response to oncogene- and stress-induced senescence[J]. Genes & Development, 2009, 23(10):1171-1176.
[52]Barradas M, Anderton E, Acosta JC, et al. Histone demethylase JMJD3 contributes to epigenetic control of INK4a/ARF by oncogenic RAS[J]. Genes Dev, 2009, 23(10):1177-1182.
[53]Agherbi H, Gaussmann-Wenger A, et al. Polycomb mediated epigenetic silencing and replication timing at the INK4a/ARF locus during senescence[J]. PLoS One, 2009, 4(5):e5622.
[54]Chandra T, Kirschner K, Thuret JY, et al. Independence of repressive histone marks and chromatin compaction during senescent heterochromatic layer formation[J]. Mol Cell, 2012, 47(2):203-214.
[55]Di Micco R, Sulli G, Dobreva M, et al. Interplay between oncogeneinduced DNA damage response and heterochromatin in senescence and cancer[J]. Nat Cell Boil, 2011, 13(3):292-302.
[56]Wang Z, Liu Y, Takahashi M, et al. N terminus of ASPP2 binds to Ras and enhances Ras/Raf/MEK/ERK activation to promote oncogene-induced senescence[J]. Proc Natl Acad Sci USA, 2013, 110(1):312-317.
[57]Campisi J, d’AddadiFagagna F. Cellular senescence:when bad things happen to good cells[J]. Nat Rev Mol Cell Biol, 2007, 8(9):729-740.
[58]Kim WY, Sharpless NE. The regulation of INK4/ARF in cancer and aging[J]. Cell, 2006, 127(2):265-275.
[59]Yang Q, Tian Y, Ostler KR, et al. Epigenetic alterations differ in phenotypically distinct human neuroblastoma cell lines[J]. BMC Cancer, 2010, 10:286.
[60]He LR, Liu MZ, et al. Prognostic impact of H3K27me3 expressiononlocoregional progression after chemoradiotherapy in esophageal squamous cellcarcinoma[J]. BMC Cancer, 2009, 9:461.
[61] Lu TY, Kao CF, Lin CT, et al. DNA methylation and histone modificationregulate silencing of OPG during tumor progression[J]. J Cell Biochem, 2009, 108(1):315-325.
[62]楊琳. 真核表達載體過表達 JMJD3 基因對急性白血病HL-60細胞株影響的實驗研究[D]. 福州:福建醫科大學, 2014.
[63]Shen Y, Guo X, Wang Y, et al. Expression and significance of histone H3K27 demethylases in renal cell carcinoma[J]. BMC Cancer, 2012, 12:470.
[64]Anderton JA, Bose S, et al. The H3K27me3 demethylase, KDM6B, is induced by Epstein-Barr virus and over-expressed in Hodgkin’s Lymphoma[J]. Oncogene, 2011, 30(17):2037-2043.
[65]Svotelis A, Bianco S, Madore J, et al. H3K27 demethylation by JMJD3 at a poised enhancer of anti-apoptotic gene BCL2 determines ER alpha ligand dependency[J]. Embo J, 2011, 30(19):3947-3961.
[66]Sola S, Xavier JM, Santos DM, et al. p53 interaction with JMJD3 results in its nuclear distribution during mouse neural stem cell differentiation[J]. PLoS One, 2011, 6(3):el8421.
(責任編輯 狄艷紅)
Research Progress on Histone Demethylase JMJD3
HU Shan1,2HAN Cong1,2HU Jian-hong2ZHU Hai-jing1
(1. College of Life Sciences,Yulin University,Yulin 719000;2. College of Animal Science and Technology,Northwest A&F University,Yangling 712100)
Histone methylation state is dynamically regulated by different groups of histone methyltransferases and demethylases. H3K27me2/3 is controlled by the polycomb group proteins(such as methyltransferase EZH2),and its demethylation can activate gene expression. At present,two H3K27me3 demethylation enzymes,JMJD3 and UTX,have been identified. Moreover,a large number of studies have found that JMJD3 may promote cell differentiation and aging,and involve in the regulation of the occurrence and development of tumor. Here we summarize the roles and regulation mechanisms of JMJD3 in embryonic development as well as the occurrence and development of tumor,and the broad prospects in tumor diagnosis and treatment,for laying a theoretical basis for the future research work.
JMJD3;H3K27me3;embryonic development;cell aging;tumorigenesis
10.13560/j.cnki.biotech.bull.1985.2017-0148
2017-03-01
陜西省科技統籌創新工程計劃項目(2014KTDZ02-01),陜西省科技統籌創新工程計劃項目(2015KTTSNY04-03),榆林學院高層次人才科研啟動基金(16GK06)
胡姍,女,碩士研究生,研究方向:動物生殖干細胞;E-mail:1243860951@qq.com
朱海鯨,男,博士,講師,研究方向:家畜繁殖與生殖干細胞;E-mail:haijing12585@163.com

