異丙醇鈦控制水解的小角X射線散射
杜倩倩,谷景華,默廣,魏彥茹,殷文杰,李甲
?
異丙醇鈦控制水解的小角X射線散射
杜倩倩1,谷景華1,默廣2,魏彥茹2,殷文杰1,李甲1
(1北京航空航天大學材料科學與工程學院,北京 100191;2中國科學院高能物理研究所,北京 100039)
由金屬醇鹽水解制備溶膠的方法已廣泛應用于溶膠-凝膠法制備納米孔無機膜,但對金屬醇鹽水解機理的認識十分有限。通過控制異丙醇鈦[Ti(-OC3H7)4]在異丙醇(-C3H7OH)中水解制備TiO2溶膠,利用小角X射線散射(SAXS)方法研究了由不同H2O/Ti(-OC3H7)4的反應混合物[Ti(-OC3H7)4:H2O:-C3H7OH=1::30(摩爾比)]形成TiO2溶膠的過程,探討了控制Ti(-OC3H7)4水解的過程中膠粒形成與長大的規律。研究結果表明,所合成的TiO2溶膠的膠粒粒徑小于10 nm,膠粒的形成和長大與H2O/Ti(-OC3H7)4摩爾比密切相關。H2O/Ti(-OC3H7)4(摩爾比)≥2.0時,隨著H2O/Ti(-OC3H7)4增加,溶膠的穩定性下降。
異丙醇鈦水解;SAXS;TiO2溶膠;粒度分布;穩定性;膠粒形狀
引 言
多孔無機膜與有機膜相比,具有良好的力學性能、化學穩定性、熱穩定性和抗生物侵蝕性,適用于食品、化工、制藥、廢水處理等條件嚴苛的分離過程中[1]。除分子篩膜之外,多孔無機膜以氧化物膜為主,其中介孔膜(孔徑為2~50 nm)和微孔膜(孔徑<2 nm)的常用制備方法是溶膠-凝膠(sol-gel)法,如SiO2[2]、Al2O3[3]、TiO2[4]、ZrO2[5]及其復合膜[6-8]的制備。制備介孔膜和微孔膜所用的溶膠-凝膠技術路線不同,一種是制備粒子型溶膠,以金屬醇鹽或無機鹽為反應物,使之完全水解形成沉淀后,再將沉淀物分散成溶膠,用來制備介孔膜[9];另一種是制備聚合型溶膠,以金屬醇鹽為反應物,控制其水解程度,使水解產物縮合成較小的膠粒(或聚合物)形成溶膠,用來制備微孔膜[10]。溶膠中膠粒(或無機聚合物)的大小是影響無機膜孔徑的重要因素之一[11-12],因此,制備孔徑為微孔或較小介孔的氧化物膜需要控制溶膠中膠粒(或無機聚合物)的大小。
TiO2微孔膜的孔結構在水環境下比SiO2微孔膜穩定而具有更廣闊的應用前景。目前,對于控制金屬醇鹽水解的研究主要集中于反應溫度、螯合劑等因素[10,13-14]對溶膠粒度的影響,缺少針對膠粒形成與長大的溶膠形成過程的研究。過去對控制非金屬醇鹽四乙氧基硅(TEOS)水解程度制備聚合型SiO2溶膠的報道較多,但金屬鈦醇鹽的水解速度比非金屬硅的醇鹽快得多[15],控制水解的條件也有很大差別,因此有必要研究鈦醇鹽的水解縮合過程,探究TiO2溶膠的形成和失去穩定性的微觀過程。表征溶膠膠粒的大小常用動態光散射法(DLS)、透射電鏡法(TEM)和小角X射線散射法(SAXS)。DLS法利用懸浮在液體中的散射體在做布朗運動時散射光強的相關函數隨時間變化計算散射體粒徑分布,要求樣品的散射計數達到一定值才能保證分析的可靠性,且對< 3 nm的粒度分布分析結果受大顆粒干擾很大[16]。TEM只能表征固體樣品,視場中粒子數有限,粒子統計性較差[17],不能對膠體樣品進行實時檢測。小角X射線散射(SAXS)法利用物質內部電子密度的不均勻性使入射X射線在小角度范圍產生散射的數據獲得樣品在納米尺度范圍內(1~100 nm)的幾何結構信息[18]。對于固液分散體系,如溶膠、懸濁液、聚合物溶液等,通過對SAXS散射曲線的分析,可以得到分散相的回轉半徑g、形狀、粒度分布、分形維數、聚合物分子量等信息,進而推斷體系中發生的變化,另外,利用SAXS還可以非破壞性地對樣品進行實時測試,因此,SAXS已成為研究溶膠形成過程的有效方法[19]。
本文以異丙醇鈦[Ti(-OC3H7)4]為原料,通過改變加水比例控制Ti(-OC3H7)4水解,利用SAXS法研究不同H2O/Ti(-OC3H7)4(摩爾比)的初始反應混合物形成TiO2溶膠的過程,獲得金屬鈦的醇鹽在控制水解條件下形成溶膠的規律,并探討膠體失去穩定性的原因。
1 實驗材料和方法
1.1 材料
將適量Ti(-OC3H7)4(97%,Alfa)與異丙醇(-C3H7OH,99.5%,Alfa)混合制成溶液A,將適量去離子水與異丙醇混合制成溶液B,將溶液B逐滴加入溶液A中之后開始計時(設為反應時間= 0),并將反應混合物置于60℃水浴中加熱攪拌,在不同反應時間取樣進行SAXS實驗。初始反應混合物中,Ti(-OC3H7)4:H2O:-C3H7OH = 1::30(摩爾比),其中分別為2.0、2.2和2.3。
1.2 SAXS實驗
SAXS實驗在北京同步輻射裝置(BSRF)1W2A光束線上的SAXS實驗站完成[20],貯存環的電子能量為2.5 GeV,平均束流強度為200 mA,入射X射線波長0.154 nm,樣品到探測器距離為1599 mm。采用Mar CCD探測器記錄溶膠樣品(反應混合物)散射強度、空白樣品(溶劑異丙醇)散射強度,用軟件Fit 2D[21]獲得散射強度-位置關系數據,利用S.exe軟件進行散射強度的空白扣除、吸收校正和回轉半徑的計算[20,22-23]。
溶膠中膠粒的散射光強
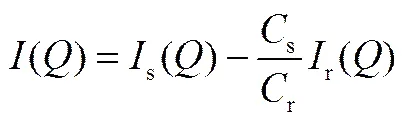
在SAXS曲線的Guinier區[24]
(2)
回轉半徑g反映散射體的大小,但回轉半徑與散射體大小的關系因散射體形狀而異,對于球形粒子,回轉半徑g和幾何半徑的對應關系為[24],同系列樣品中組成和形狀均相同的散射體可直接用回轉半徑來比較大小。由式(2)可知,在Guinier區,單分散的散射體系的ln()-2曲線(Guinier曲線)在低角區呈線性,其斜率的絕對值正比于2g。
多分散稀疏粒子體系在低角區的ln()-2曲線已不再是直線,而是下凸的曲線。利用Guinier曲線解析粒度寸分布的方法有很多,主要有Shull-Roess法、對數正態分布理論、逐級切線法[24]和Monte Carlo法(簡稱McSAS法)[25-26]。Zhao等[27]分別使用逐級切線法與McSAS法對陳化的鋁硅酸鹽溶膠的SAXS數據進行處理,得出兩種方法計算的膠體粒徑分布基本一致,說明采用逐級切線法得到的結果對于組成和電子結構相同的粒子構成的多分散體系能夠滿足要求。本文采用的S.exe軟件處理數據的理論依據為逐級切線法。
逐級切線法將粒度分成幾個級別,多分散的散射體系可由Guinier曲線計算散射體回轉半徑的分布,總散射強度[24]
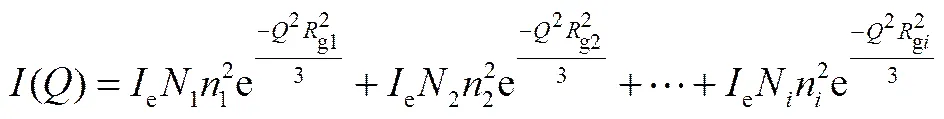
做ln()-2曲線,在高2值區(散射角大)近似直線部分作切線,交于縱坐標k,然后將曲線與切線上相同值所對應的強度值相減,得到另一條曲線;這樣連續分級作下去,直至所得曲線近似于直線。根據切線斜率,可以分別求出每個粒度級別的粒子回轉半徑gi,通過切線的截距k與各粒度級別粒子相對體積分數W之間的對應關系
k=CWR3gi(4)
求出各級粒子的體積分數W,其中為常數[24]。
2 實驗結果與討論
異丙醇鈦通過水解縮合反應生成納米尺度的TiO2膠粒(或無機聚合物),其電子密度與反應混合物溶液不同,使X射線發生小角度散射。通過對SAXS數據進行分析,可得到Ti(-OC3H7)4在控制水解過程中膠粒形成與長大的規律。
化學熱力學上,使Ti(-OC3H7)4全部轉化為TiO2只需要H2O/Ti(-OC3H7)4=2.0(摩爾比),考慮到反應動力學因素的影響,還需要考察H2O的比例適當過量的情況,因此,在本研究中選擇H2O/Ti(-OC3H7)4≥2.0(摩爾比)。下文中摩爾比H2O/Ti(-OC3H7)4簡寫為H2O/Ti。
2.1 H2O/Ti=2.0時形成的TiO2溶膠
圖1為H2O/Ti=2.0的初始反應混合物經過不同反應時間(0~180 min)形成的TiO2溶膠中膠粒的SAXS曲線和Guinier曲線。在圖1(a)中可以看到,在反應初期(0~30 min),隨著反應時間延長散射強度明顯增強;反應30 min以后,隨著反應時間延長,膠粒的散射強度只是略增大。
圖1(a)所示的強度曲線[lg()-lg曲線]中沒有斜率≤-1的線性段,可確定TiO2溶膠中膠粒不具有分形結構[28-29]。根據圖1(b)所示Guinier曲線計算膠粒的回轉半徑,假設膠粒為球狀計算膠粒直徑,平均回轉半徑以體積分數為權重進行計算,經不同反應時間形成的TiO2溶膠的膠粒回轉半徑和膠粒直徑的分布數據列于表1。反應時間0~180 min,膠粒的回轉半徑g< 2 nm,膠體不是單分散體系,小膠粒g= 0.5~0.6 nm(粒徑1.4~1.5 nm),大膠粒g= 1.8~1.9 nm(粒徑4.8~4.9 nm),其中小膠粒占97% (體積)以上。
在計時開始=0時,檢測到1 nm的膠粒,表明在制備反應混合物的過程中,Ti(-OC3H7)4有少量水解。在反應初期,=0~30 min,小膠粒和大膠粒僅略有增大,可認為散射強度迅速增大主要來源于膠粒數目的顯著增加。反應30 min以后,膠粒大小基本不變,散射強度緩慢增大反映出膠粒數目稍有增加。受H2O/Ti=2.0的限制,經過一段時間的反應消耗,H2O的濃度變得很低,水解反應非常緩慢,縮合反應也很慢,膠粒大小基本不變且溶膠中粒徑1~2 nm的膠粒占97%(體積)以上。這表明Ti(-OC3H7)4水解程度有限,縮合反應只能在較少的部位進行,能夠發生縮合的反應物和反應位置的數量限制了膠粒的生長,反應混合物中只形成很少量直徑4~5 nm的膠粒。
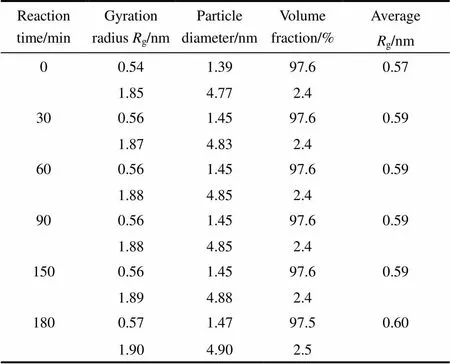
表1 初始反應混合物中H2O/Ti=2.0時TiO2溶膠的粒徑分布隨反應時間的變化
2.2 H2O/Ti=2.2時形成的TiO2溶膠
圖2是H2O/Ti=2.2的初始反應混合物經過不同反應時間(0~180 min)形成的TiO2溶膠中膠粒的SAXS曲線和Guinier曲線。在圖2(a)中可以看到,在反應初期(0~20 min),散射強度隨反應時間顯著增強;反應20 min后,散射強度仍隨反應時間增大,但增速變緩。
對圖2(a)進行分析可確定TiO2膠粒不具有分形結構。根據圖2(b)所示Guinier曲線計算膠粒的回轉半徑,假設膠粒為球狀計算膠粒直徑,以體積分數為權重計算平均回轉半徑,經不同反應時間形成的TiO2溶膠的膠粒回轉半徑和膠粒直徑的分布數據列于表2。=0時,檢測到回轉半徑g~0.8 nm(粒徑~ 2 nm)的膠粒,表明Ti(-OC3H7)4有少量水解。反應10 min以后,膠體不再是單分散體系,反應時間0~180 min,小膠粒g= 0.8~1.0 nm(粒徑2.0~2.5 nm),大膠粒g= 2.7~3.1 nm(粒徑7~8 nm),其中小膠粒占95% (體積)以上;隨著反應時間延長,小膠粒和大膠粒均增大,且粒徑7~8 nm的大膠粒所占的比例增加。
在初始反應混合物H2O/Ti=2.2的體系中,由于H2O/Ti增大,Ti(-OC3H7)4的水解程度增大,可發生縮合反應的反應物及反應位置增多。在=0時形成的膠粒大小均一,粒徑約為2 nm。在反應初期(0~20 min),直徑2 nm的小膠粒有可觀測的直徑增大,直徑7 nm的大膠粒迅速形成且體積分數增加,從圖2(a)中可以看到這個階段散射光強迅速增大。根據小角散射理論,相比于小顆粒,大顆粒對散射曲線中小角區的強度有較大貢獻[見式(3),n與顆粒體積呈正比],所以,不僅是H2O的濃度較高時Ti(-OC3H7)4水解縮合形成新膠粒使得圖2(a)中散射強度增大,膠粒尺寸增大也是導致散射強度迅速增大的一個因素,散射強度的變化反映出這一階段Ti(-OC3H7)4的水解、縮合反應速率大。反應時間=20~180 min,膠粒繼續長大,并且部分2~3 nm的膠粒長大成7~8 nm的膠粒,從圖2(a)中看到散射光強增大漸緩,可認為散射光強增大主要來源于膠粒長大,表明在這個階段水解反應緩慢,縮合反應起主要作用。圖3是H2O/Ti=2.2的初始反應混合物(=0)、反應20 min和反應180 min形成的TiO2溶膠的粒度分布條形圖,顯示了膠粒長大的現象和大小膠粒體積百分比的改變,但不能給出膠粒的絕對數量。
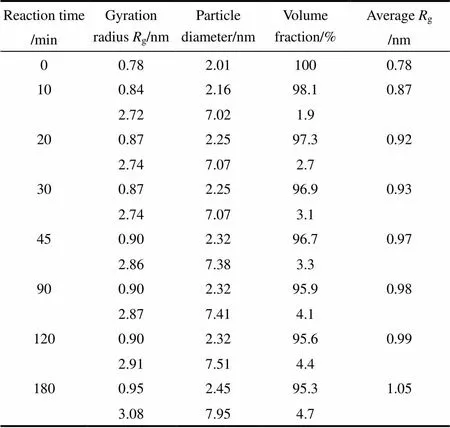
表2 初始反應混合物中H2O/Ti=2.2時TiO2溶膠的粒徑分布隨反應時間的變化
2.3 H2O/Ti=2.3時形成的TiO2溶膠
圖4是H2O/Ti=2.3的初始反應混合物經過不同反應時間(0~40 min)形成的TiO2溶膠中膠粒的SAXS曲線和Guinier曲線。在圖4(a)中可以看到,在反應初期(0~20 min),散射強度隨反應時間顯著增強;反應20 min后,散射強度仍隨反應時間增大,但增速變緩。
對圖4(a)進行分析可確定TiO2溶膠中膠粒不具有分形結構,根據圖4(b)所示Guinier曲線計算膠粒的回轉半徑,假設膠粒為球狀計算膠粒直徑,以體積分數為權重計算平均回轉半徑,經不同反應時間形成的TiO2溶膠的膠粒回轉半徑和膠粒直徑的分布數據列于表3。=0時,檢測到回轉半徑g約為0.9 nm(粒徑約為2.3 nm)的膠粒,表明Ti(-OC3H7)4有少量水解。反應10 min以后,膠體不再是單分散體系,反應時間0~40 min,小膠粒g= 0.9~1.1 nm(粒徑2.3~2.7 nm),大膠粒g= 2.8~3.3 nm(粒徑7~9 nm),其中小膠粒占93%(體積)以上;隨著反應時間延長,小膠粒和大膠粒均增大,并且一部分2~3 nm的膠粒迅速長成7~9 nm的膠粒。
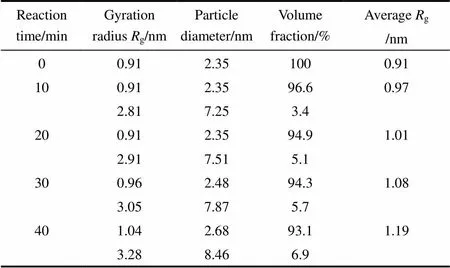
表3 初始反應混合物中H2O/Ti=2.3時TiO2溶膠的粒徑分布隨反應時間的變化
初始反應混合物H2O/Ti=2.3的體系中,在反應初期(0~20 min),直徑7~8 nm的大膠粒迅速形成且體積分數增加較快,從圖4(a)中可以看到散射光強迅速增大,反映出這一階段Ti(-OC3H7)4的水解、縮合反應速率很大,更多膠粒形成和膠粒長大是導致散射強度迅速增大的原因。反應時間=20~40 min,膠粒繼續長大,并且部分2~3 nm的膠粒長大成7~9 nm的膠粒,圖4(a)顯示散射光強隨反應時間延長增速變慢,但依然有十分明顯的增大,反映出因Ti(-OC3H7)4水解程度較高,這階段仍有足夠多的水解產物可作為縮合反應物進行縮合反應。圖5是H2O/Ti=2.3(摩爾比)的初始反應混合物(=0)、反應20 min和反應40 min形成的TiO2溶膠的粒度分布條形圖。在圖5中可見,隨著反應時間延長,膠粒迅速長大,反應40 min時直徑超過8 nm的膠粒已近7%(體積)。實驗發現,反應50 min 之后溶膠變渾濁,有沉淀物出現。由于H2O過量,水解縮合反應不斷進行使膠粒長大,可推斷反應50 min左右,膠體中有更多直徑超過8 nm的膠粒。另外,膠粒表面存在較多有極性的羥基(—OH)基團,在范德華力作用下膠粒很容易發生團聚,進而形成較大的團聚體導致沉淀物出現。
2.4 H2O/Ti對TiO2溶膠的影響
初始反應混合物中H2O/Ti=2.0,2.2,2.3分別對應Ti(-OC3H7)4完全水解縮合形成TiO2所需H2O/Ti摩爾比的理論值、過量10%和過量15%,從2.1~2.3節所述實驗結果中可以看到,H2O/Ti對Ti(-OC3H7)4的水解縮合程度有非常大的影響。圖6是不同H2O/Ti的初始反應混合物(=0)和反應生成的TiO2溶膠(=30 min)的粒徑分布。
在制備的初始反應混合物中,=0時刻已形成少量膠粒,膠粒隨H2O/Ti摩爾比的增加而增大;由于H2O/Ti=2.0對Ti(-OC3H7)4水解程度的限制,縮合反應受到了位置限制,導致膠粒粒徑很小卻非單分散,H2O/Ti>2.0的溶膠中膠粒呈單分散[圖6(a)]。反應至30 min時,H2O/Ti=2.0的溶膠,受水解程度限制,膠粒沒有顯著的長大;H2O/Ti>2.0的溶膠中膠粒的粒徑及粒徑增大的速度均隨H2O/Ti增大[圖6(b)]。在反應開始的前30 min之內(=0~30 min,H2O/Ti=2.0)或前20 min之內(=0~20 min,H2O/Ti=2.2,2.3)散射強度迅速增大[圖1(a)、圖2(a)和圖4(a)],單位時間內散射強度增大的比例(D/)隨H2O/Ti的增加而增大,表明H2O/Ti增加使Ti(-OC3H7)4水解和縮合反應加快。反應30 min之后,水解和縮合反應速率與反應初期相比均下降,H2O/Ti=2.0的溶膠,縮合反應受Ti(-OC3H7)4水解程度的限制,反應180 min時膠粒沒有明顯長大(表1);H2O/Ti>2.0的溶膠中膠粒持續長大,粒徑>7 nm 的膠粒增多(表2和表3),膠粒長大的速度隨H2O/Ti的增加而顯著增大,表明溶膠中有足夠的H2O使水解縮合反應持續進行,溶膠中水解縮合反應是不可控的。實驗中發現,由H2O/Ti=2.0,2.2,2.3的初始反應混合物所形成的TiO2溶膠中出現沉淀的時間依次為5 d、17 h和50 min,與SAXS法得到的溶膠膠粒長大的規律相符。
2.5 TiO2溶膠中膠粒的形狀
對膠粒散射強度()進行傅里葉變換,得到相關函數()和距離分布函數()[30-31]
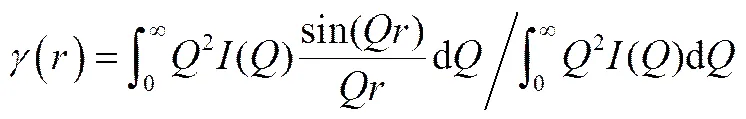
()=() (6)
圖7是不同H2O/Ti的初始反應混合物形成的TiO2溶膠中膠粒的()-曲線。() 函數的主峰近乎對稱,可認為膠粒是球狀的[30-31],這表明上文中計算膠粒大小時采用膠粒為球狀的假設是合理的。
3 結 論
以異丙醇為溶劑,異丙醇鈦[Ti(-OC3H7)4]的稀溶液為反應物,控制Ti(-OC3H7)4水解制備TiO2溶膠,膠粒的形成和長大與初始反應混合物中H2O/Ti(-OC3H7)4摩爾比密切相關。
(1)H2O/Ti(-OC3H7)4=2.0時,在異丙醇鈦與水混合后30 min之內膠粒迅速形成,1~2 nm的膠粒占97%(體積)以上,其余膠粒粒徑約5 nm;反應30 min后受水解程度的限制,膠粒長大十分緩慢。
(2)H2O/Ti(-OC3H7)4=2.2~2.3時,異丙醇鈦與水混合后20 min之內膠粒迅速形成并長大,溶膠中出現粒徑7~8 nm的膠粒;反應20 min后,水解縮合反應持續進行,粒徑>7 nm的膠粒增多。
(3)H2O/Ti(-OC3H7)4≥2.0時,反應時間相同,膠粒的大小隨H2O/Ti(-OC3H7)4的增加而增大;H2O/Ti(-OC3H7)4越高,膠粒長大越快,膠體穩定性越差。
符 號 說 明

Cr——透過空白樣品的光強對應的電離室計數 Cs——透過溶膠樣品的光強對應的電離室計數 F(r)——距離分布函數 I(0)——零角度處的散射強度 Ie——單個電子的散射強度 Ir(Q)——空白樣品(溶劑異丙醇)的散射強度 Is(Q)——溶膠樣品(反應混合物)的散射強度 Ni——各尺寸級別的粒子數目 ni——各級別單個粒子中的電子數目 Q——散射矢量的大小,,nm-1 R——散射體幾何半徑,nm Rg——散射體回轉半徑,nm r——相關距離,nm Wi——各級粒子的相對體積分數 γ(r)——相關函數 2q——散射角,(°) l——入射波波長,nm x——相關長度,nm
References
[1] ZEIDLER S, PUHLFüR? P, K?TZEL U,. Preparation and characterization of new low MWCO ceramic nanofiltration membranes for organic solvents[J]. J. Membr. Sci., 2014, 470(470): 421-430.
[2] HA T J, PARK H H, JANG H W,. Study on the thermal stability of ordered mesoporous SiO2, film for thermal insulating film[J]. Microporous Mesoporous Mater., 2012, 158(8): 123-128.
[3] SCHAEP J, VANDECASTEELE C, PEETERS B,. Characteristics and retention properties of a mesoporous γ-Al2O3membrane for nanofiltration[J]. J. Membr. Sci., 1999, 163(2): 229-237.
[4] SEKULI? J, TEN?ELSHOF J, BLANK D H A. A microporous titania membrane for nanofiltration and pervaporation[J]. Adv. Mater.2004, 16(17):1546-1550.
[5] QI H, ZHU G Z, LI L,. Fabrication of a sol-gel derived microporous zirconia membrane for nanofiltration[J]. J. Sol-Gel Sci. Technol.2012, 62(2): 208-216.
[6] TSURU T, WADA S I, IZUMI S,. Silica-zirconia membranes for nanofiltration[J]. J. Membr. Sci., 1998, 149(1): 127-135.
[7] HAO Y X, LI J S, YANG X J,. Preparation of ZrO2-Al2O3composite membranes by sol-gel process and their characterization[J]. Mater. Sci. Eng. A, 2004, 367(1/2):243-247.
[8] SPIJKSMA G I, HUISKES C, BENES N E,. Microporous zirconia-titania composite membranes derived from diethanolamine-modified precursors[J]. Adv. Mater.2010, 18(16):2165-2168.
[9] GESTEL T V, VANDECASTEELE C, BUEKENHOUDT A,. Alumina and titania multilayer membranes for nanofiltration: preparation, characterization and chemical stability[J]. J. Membr. Sci., 2002, 207(1): 73-89.
[10] GUO H L, ZHAO S F, WU X X,. Fabrication and characterization of TiO2/ZrO2ceramic membranes for nanofiltration[J]. Microporous Mesoporous Mater., 2016. DOI: 10.1016/j.micromeso.2016.03.011.
[11] ZHU G Z, JIANG Q, QI H,. Effect of sol size on nanofiltration performance of a sol-gel derived microporous zirconia membrane[J]. Chin. J. Chem. Eng., 2015, 23(1): 31-41.
[12] PUTHAI W, KANEZASHI M, NAGASAWA H,. Effect of firing temperature on the water permeability of SiO2-ZrO2membranes for nanofiltration[J]. J. Membr. Sci., 2016, 497: 348-356.
[13] 申興叢, 徐杰, 張睿, 等. 納米TiO2的溶膠-凝膠法制備及其表征[J]. 浙江理工大學學報, 2012, 29(2): 249-253.SHEN X C, XU J, ZHANG R,. Preparation of nano-TiO2sol-gel method and its characterization[J]. J. Zhejiang Sci-Tech Univ., 2012, 29(2): 249-253.
[14] FUKUMOTO T, YOSHIOKA T, NAGASAWA H,. Development and gas permeation properties of microporous amorphous TiO2-ZrO2-organic composite membranes using chelating ligands[J]. J. Membr. Sci., 2014, 461(461): 96-105.
[15] GESTEL T V,SEBOLD D, HAULER F,. Potentialities of microporous membranes for H2/CO2separation in future fossil fuel power plants: evaluation of SiO2, ZrO2, Y2O3-ZrO2and TiO2-ZrO2sol-gel membranes[J]. J. Membr. Sci., 2010, 359: 64-79.
[16] SCHWAMBERGER A, ROO B D, JACOB D,. Combining SAXS and DLS for simultaneous measurements and time-resolved monitoring of nanoparticle synthesis[J]. Nucl. Instrum. Methods B, 2015, 343: 116-122.
[17] ZHOU H, WILKES G L. Comparison of lamellar thickness and its distribution determined from d.s.c. SAXS, TEM and AFM for high-density polyethylene films having a stacked lamellar morphology[J]. Polymer, 1997, 38(23): 5735-5747.
[18] 徐耀, 吳東, 孫予罕, 等. 小角X射線散射法研究氧化硅溶膠的制備環境依賴性[J]. 物理學報, 2005, 54(6): 2814-2820.XU Y, WU D, SUN Y H,. Dependence of silica sol properties on synthesis situation studied by SAXS[J]. Acta Phys. Sin., 2005, 54(6): 2814-2820.
[19] 朱育平. 小角X射線散射——理論、測試、計算及應用[M]. 北京: 化學工業出版社, 2008: 2-4. ZHU Y P. Small Angle X-ray Scattering—Theory, Test, Calculation and Application[M]. Beijing: Chemical Industry Press, 2008: 2-4.
[20] LI Z H, WU Z H, MO G,. A small-angle X-ray scattering station at beijing synchrotron radiation facility[J]. Instrum. Sci. & Technol., 2014, 42(2): 128-141.
[21] HAMMERSLEY A P. FIT2D: a multi-purpose data reduction, analysis and visualization program[J].J. Appl. Crystallogr., 2016, 49(2): 646-652.
[22] 王維, 陳興, 蔡泉, 等. 小角X射線散射(SAXS)數據分析程序SAXS1.0[J]. 核技術, 2007, 30(7): 571-575. WANG W, CHEN X, CAI Q,. SAXS1.0—a program for small-angle X-ray scattering data analysis[J]. Nucl. Sci. Tech., 2007, 30(7): 571-575.
[23] LI Z H. A program for SAXS data processing and analysis[J]. Chin. Phys. C, 2013, 37(10): 110-115.
[24] 孟昭富. 小角X射線散射理論及應用[M]. 長春: 吉林科學出版社, 1996: 4-28. MENG Z F. Theory and Application of Small Angle X-Ray Scattering[M].Changchun: Jilin Science and Technical Press, 1996: 4-28.
[25] PAUW B R, PEDERSEN J S, TARDIF S,. Improvements and considerations for size distribution retrieval from small-angle scattering data by Monte Carlo methods[J].J. Appl. Crystallogr., 2012, 46(2): 365-371.
[26] BRESSLER I, PAUW B R, THüNEMANN A F. McSAS: software for the retrieval of model parameter distributions from scattering patterns[J].J. Appl. Crystallogr., 2015, 48(3): 962-969.
[27] ZHAO X M, LIU R G, ZHANG H,. Structure evolution of aluminosilicate sol and its structure-directing effect on the synthesis of NaY zeolite[J].J. Appl. Crystallogr., 2017, 50: 231-239.
[28] KEEFER K D, SCHAEFER D W. Growth of fractally rough colloids[J]. Phys. Rev. Lett., 1986, 56(22): 2376-2379.
[29] EDLER K J, WHITE J W. Preparation dependent stability of pure silica MCM-41[J]. J. Mater. Chem., 1999, 9(10): 2611-2615.
[30] XU Y N, KOGA Y, STRAUSZ O P. Characterization of athabasca asphaltenes by small-angle X-ray scattering[J]. Fuel, 1995, 74(7): 960-964.
[31] GLATTER O, KRATKY O. Small Angle X-Ray Scattering[M]. New York: Academic Press, 1982: 167-179.
Controlled hydrolysis of titanium isopropoxide by small angle X-ray scattering
DU Qianqian1,GU Jinghua1,MO Guang2,WEI Yanru2,YIN Wenjie1,LI Jia1
(1School of Materials Science and Engineering,Beihang University,Beijing100191, China;2Institute of High Energy Physics, Chinese Academy of Sciences,Beijing100039, China)
Metal oxide sols can be prepared from metal alkoxides by hydrolyzation, which has been widely used in synthesis of nano-porous ceramic membranes by sol-gel method. However, the knowledge on hydrolysis mechanism of metal alkoxides is very limited. In this paper, TiO2sols were prepared by controlled hydrolyzation of titanium isopropoxide [Ti(-OC3H7)4] in isopropanol (-C3H7OH). The formation of TiO2sols from the initial reactant mixtures with different molar ratios of H2O/Ti(-OC3H7)4[Ti(-OC3H7)4:H2O:-C3H7OH = 1::30] was charterized by small angle X-ray scattering (SAXS). The mechanism of formation and growth of colloidal particles is discussed. TiO2sol with a particle size less than 10 nm can be obtained. The formation and growth of colloidal particles are remarkably influenced by the molar ratio of H2O/Ti(-OC3H7)4. When the molar ratio of H2O/Ti(-OC3H7)4≥2.0, the stability of TiO2sol decreases with the molar ratio of H2O/Ti(-OC3H7)4increasing.
hydrolysis of titanium isopropoxide; SAXS; TiO2sol; particle size distribution; stability; shape of colloidal particle
10.11949/j.issn.0438-1157.20170263
O 648.1
A
0438—1157(2017)09—3607—09
2017-03-19收到初稿,2017-05-19收到修改稿。
谷景華。
杜倩倩(1990—),女,碩士研究生。
國家自然科學基金項目(51178017)。
2017-03-19.
GU Jinghua, associate professor,gujh@buaa.edu.cn
supported by the National Natural Science Foundation of China (51178017).

