硼氫化鈉醇解制氫用泡沫鎳載鈷磷納米花合金催化劑的研究
夏亦良,王亞男,王芳輝
(1.江西省新余市第四中學,江西 新余 338000; 2.北京化工大學理學院有機化學系,北京 100029)
硼氫化鈉醇解制氫用泡沫鎳載鈷磷納米花合金催化劑的研究
夏亦良1,王亞男2,王芳輝2
(1.江西省新余市第四中學,江西 新余 338000; 2.北京化工大學理學院有機化學系,北京 100029)
使用化學鍍法制備了Co-P/Ni foam催化劑,詳細研究了催化劑制備條件對其表面形貌和催化性能的影響。優化制備條件得到納米花型形貌的Co-P/Ni foam催化劑,通過對其結構和性能進行表征,該納米花型形貌的Co-P/Ni foam催化劑表現出優秀的催化硼氫化鈉甲醇解制氫的活性,室溫下達到3.52 L/min/g的最大制氫速率。
納米花;鈷磷合金催化劑;泡沫鎳;催化活性;硼氫化鈉醇
環境問題的惡化和化石能源的枯竭促使人們渴望尋找和使用潔凈、可再生的能源。從長遠的角度來看,氫能是一種清潔能源,而燃料電池實現了氫能與電能之間的轉化[1-2],產生的電能既可以用于固定設備也可以用于移動設備中,從而取代內燃機中對化石能源的直接燃燒利用[3-4]。
氫元素是地球上豐度最高的元素,但其中僅有不到1%的氫元素是以氫氣分子(H2)形式存在的,這極大限制了對氫能的利用。因此,氫氣首先要從富含氫元素的材料中制備出來,隨即經過存儲以及運輸的過程,最后應用于終端耗氫設備。氫的儲存方法主要包括物理儲氫和化學儲氫,在化學儲氫方法中,氫通過化學鍵作用和絡合作用的形式存在于化學儲氫物質中,通過化學反應途徑(通常是熱分解反應和催化分解反應)將氫元素以氫氣的形式釋放出來。化學儲氫物質以其存儲形式分為固態化學儲氫物質和液態化學儲氫物質。固態化學儲氫物質中,硼氫化鈉(NaBH4)作為含氫量較高的化合物受到廣泛關注。1954年,Schlesinger等人[5]首次報道室溫下1 mol NaBH4與水反應緩慢釋放出4 mol H2,但硼氫化鈉水解制氫仍然存在很多問題:a.副產物NaBO2微溶于水,沉積在催化劑表面,易覆蓋住催化劑的活性位點從而抑制其催化效率[6]。b.水的冰點為0℃,故硼氫化鈉水解反應在0℃以下的環境無法進行,這限制了其在車載式燃料電池領域的應用[7]。直到1961年,Davis等人[8]提出并證明了硼氫化鈉與甲醇反應釋放氫氣的事實。硼氫化鈉甲醇解反應是自發的,在不添加任何催化劑的情況下,硼氫化鈉的自發醇解在室溫下高于自發水解的動力學反應常數[9]。另一方面,硼氫化鈉醇解反應的副產物NaB(OCH3)4具有可溶性,避免了副產物對催化劑活性的抑制,從而表現出優于水解的應用潛力。除此之外,作為反應溶劑和反應物,甲醇的凝固點為-97.8℃,這樣的一個優點促使硼氫化鈉—甲醇制氫系統在寒冷地域成為車載式燃料電池氫源的候選項。
使用合適的催化劑可以提高硼氫化鈉甲醇解釋氫的效率,發展硼氫化鈉—甲醇制氫系統的核心問題在于開發高效且穩定的催化劑。目前開發的催化劑中,釕等貴金屬催化劑表現出優秀的催化活性。由于貴金屬在自然界中的低豐度和高成本的弊端,非貴金屬催化劑被認為是貴金屬催化劑的代替。Sahiner課題組在非金屬催化劑方面做出了巨大的貢獻,包括HNTs-NH2·HCl作為一種天然的制氫催化劑[10],聚咪唑離子液體微凝膠用于硼氫化鈉醇解制氫[11],新型聚合物微凝膠p(TAEA-co-GDE)[12]制氫催化劑,處理后的SiO2可以用于硼氫化鈉醇解制氫[13],Cell-EPC-DETA-HCl[14]制氫催化劑以及P/boehmite催化劑等[15]。
近年來的研究發現,非貴金屬Co與非金屬(如P或B)結合可以大大提高鈷的催化活性,因此,更多的研究者將目光投入到Co基催化劑的制備與研究中。與Co-B催化劑相比,制備Co-P催化劑所需的含磷原材料通常會更為廉價,因此,開發高活性的硼氫化鈉醇解Co-P催化劑具有重要的研究意義和實用價值[16]。迄今為止,已有大量粉末狀的負載型Co-P催化劑被制備出來。然而,粉末狀催化劑具有難以分離、易聚集等缺點,過去的幾年里,為了解決粉末狀催化劑的弊端,將大量的工作精力投入到發展塊狀負載型催化劑。
眾所周知,催化劑的活性與其形態結構密切相關,一些各向異性的納米催化劑由于存在更多的邊緣、拐角和面,從而可以提供更多的催化活性位點,這將有利于提供更高的催化性能[17]。
本文設計并制備出了泡沫鎳負載的Co-P合金催化劑,塊狀載體泡沫鎳的選擇是為了提高催化劑的實用性能。另一方面,實驗通過優化制備條件,得到不同形貌的催化劑,探索出影響催化劑形貌的主要原因。制備出的Co-P納米結構旨在提供更多的催化活性位點,從而提高其在催化硼氫化鈉甲醇解制氫方面的性能。
1 實驗部分
1.1 泡沫鎳載鈷磷合金(Co-P/Ni foam)催化劑的制備
1.1.1 泡沫鎳預處理
A.清洗。將泡沫鎳裁剪成的小塊,置于無水乙醇中超聲洗滌,除去表面污漬后在濃度為10 wt%的稀硝酸中超聲洗滌,除去泡沫鎳表面油漬,大量水沖洗后自然晾干。
B.敏化。將清洗過的泡沫鎳置于敏化液中攪拌,敏化液的組成是:0.1 mol/L SnCl2+ 2.5 mol/L HCl。
C.活化。將敏化后的泡沫鎳直接置活化液中繼續攪拌。攪拌結束后用大量去離子水沖洗泡沫鎳,最后使用無水乙醇沖洗,自然晾干,裝袋備用。活化液的組成是:0.0014 mol/L PdCl2+ 0.25 mol/L HCl。
1.1.2 Co-P/Ni foam催化劑的制備
配制鍍液:取一定量前驅體氯化鈷、還原劑次亞磷酸氫鈉和穩定劑甘氨酸溶于去離子水中,形成穩定溶液,取一塊處理過的泡沫鎳于上述鍍液中,室溫攪拌下加入NaOH水溶液(2 M),調節pH值,待pH保持不變,90℃油浴反應一定時間,反應過程中可以觀察到有大量氣體產生。待反應結束后,冷卻至室溫,取出鎳塊,用大量的去離子水沖洗,最后用無水乙醇沖洗,置于表面皿上待其自然晾干。
1.1.3 Co-P/Ni foam催化劑制備條件優化
對上述制備方法進行條件優化,控制單一變量,分別對前驅體溶液濃度、還原劑濃度、反應pH和反應時間這四組條件進行優化。具體實驗參數,如表1所示。
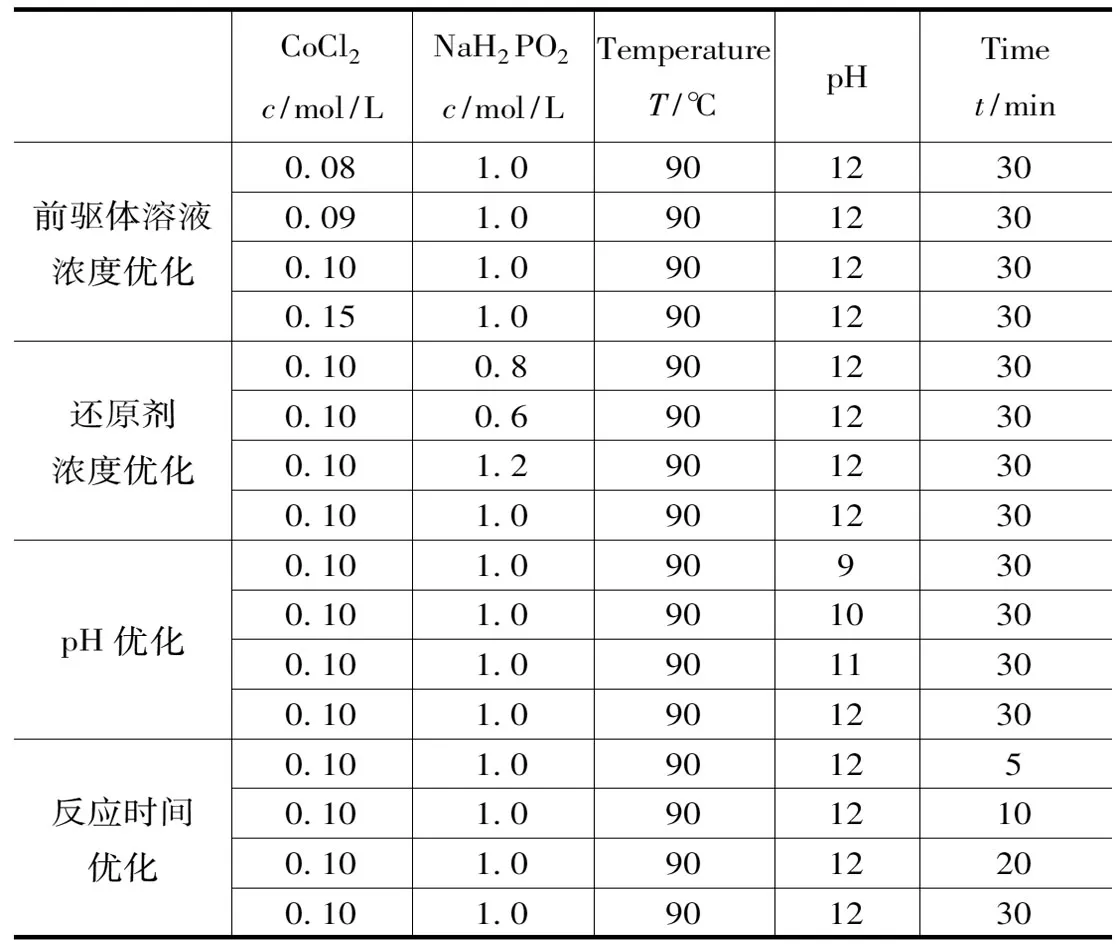
表1 Co-P/Ni foam催化劑制備條件優化的實驗參數Tab.1 Co-P/Ni foam catalyst preparation conditions optimized experimental parameters
1.2 泡沫鎳載鈷磷合金(Co-P/Ni foam)催化劑的性能測試
將制備的催化劑投入到硼氫化鈉的甲醇體系中,測定制備出的氫氣產生速率,制氫速率越高,說明催化劑的性能越好。具體的實驗步驟如下:
在一只干燥的三孔瓶中先加入部分甲醇,加入總甲醇量1 wt%的氫氧化鈉固態顆粒,等其溶解后加入總甲醇量10 wt% 硼氫化鈉。氫氧化鈉在該體系中的作用是穩定劑,目的是抑制硼氫化鈉與甲醇在無催化劑作用下的反應。隨后取20 mg的Ru-Co/C催化劑將其分散于剩余的甲醇中,將分散好的催化劑甲醇混合液通過注射器注射于硼氫化鈉甲醇體系中,此時在催化劑的催化作用下發生釋氫反應。用于反應的三孔瓶,其中一個孔插入溫度計,檢測反應溫度,另一個孔用于注射催化劑,最后一個孔連接一根導氣管通向與計算機相連接的氣體流量計,直接讀取氫氣流速,并記錄于計算機上。測定氫氣流速使用的是Sevenstar公司的CS200C氣體流量計。
2 結果與討論
2.1 制備條件對催化劑形貌以及催化活性的影響
制備條件對催化劑的形貌具有一定的影響,而催化劑的形貌是影響催化劑活性的主要因素之一。在制備條件中,反應pH、前驅體濃度和還原劑濃度對催化劑的形貌影響最大。
2.1.1 pH對催化劑形貌及催化活性的影響
控制其他反應條件不變,分別在pH為9、10、11和12的條件下制備Co-P/Ni foam催化劑,并對制備出的4種催化劑進行了性能測試,結果如圖1所示。從圖1中可以觀察到,pH為11時制備出的Co-P/Ni foam具有最佳的催化硼氫化鈉甲醇解制氫的活性。
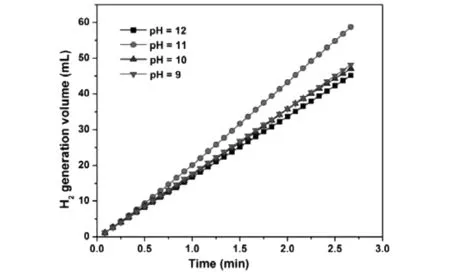
圖1 不同pH下制備的Co-P/Ni foam的催化制氫性能對比Fig.1 Comparison of catalytic hydrogen production of Co-P/Ni foam prepared at different pH
對這四種催化劑進行了SEM的形貌表征,如圖2所示。從圖2中可以看出,pH對催化劑形貌的影響非常明顯,pH為11時,可以觀察到Co-P鍍層的表面具有納米顆粒的形貌,測量納米顆粒的平均粒徑為20 nm。由此可知,具有較小粒徑的Co-P納米顆粒的催化劑具有更高的催化劑比表面積,從而可以提供更多的活性位點,表現出更高的催化活性。
2.1.2 前驅體濃度對催化劑形貌及催化活性的影響
分別在CoCl2濃度為0.08 mol/L、0.09 mol/L、0.10 mol/L和0.15 mol/L的條件下制備Co-P/Ni foam催化劑,將制備出的催化劑進行性能測試,結果如圖3所示。從圖3中可以看出,前驅體濃度對催化劑的性能具有很大的影響,當CoCl2濃度為0.08 mol/L、0.09 mol/L和0.15 mol/L時催化劑的制氫速率較低,當其濃度為0.10 mol/L時,催化劑制氫速率顯著增大。

圖2 不同pH下制備的Co-P/Ni foam催化劑的SEM形貌表征Fig.2 SEM characterization of Co-P/Ni foam catalyst prepared at different pH
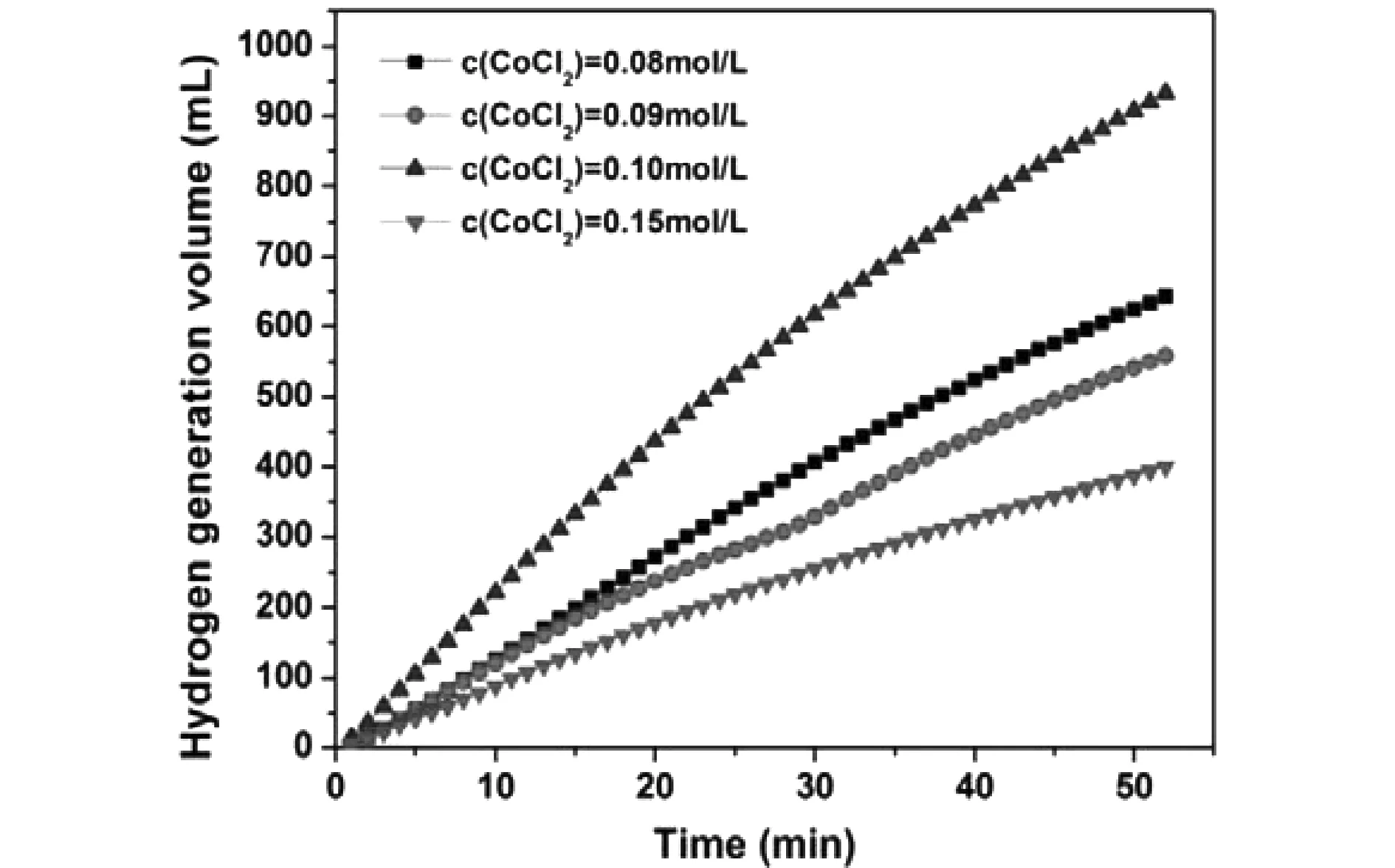
圖3 不同氯化鈷濃度下制備的Co-P/Ni foam催化劑的制氫活性對比Fig.3 Comparison of hydrogen production activity of Co-P/Ni foam catalyst prepared at different concentrations of cobalt chloride
為了分析前驅體濃度對催化劑形貌的影響,將不同前驅體濃度下制備的催化劑進行SEM的形貌表征,結果如圖4所示。從表征結構可以看出,CoCl2濃度對催化劑的形貌具有一定的影響。當CoCl2濃度為0.08 mol/L和0.09 mol/L時,Co-P的平均粒徑分別為848.6 nm和782 nm;當CoCl2濃度增至0.10 mol/L,催化劑的表面形貌發生變化,為納米花和納米線的結構,Co-P的粒徑明顯減小,其平均粒徑為383.4 nm;當CoCl2濃度繼續增加至0.15 mol/L時,催化劑的納米花結構消失,合金的粒徑明顯增大。由此可知,在不同的前驅體濃度條件下制備的催化劑具有不同的表面形貌,當前驅體濃度為0.1 mol/L時,合金的粒徑最小,這導致催化劑的比表面積大大增加,從而提高了催化劑的活性位點的數量,表現為催化性能的顯著提高。

圖4 不同還原劑濃度下制備的Co-P/Ni foam催化劑的SEM形貌表征Fig.4 SEM characterization of Co-P/Ni foam catalyst prepared at different concentration of reducing agent
2.1.3 還原劑濃度對催化劑形貌及催化活性的影響
還原劑濃度是對催化劑表面形貌影響較大的另一因素,控制其他反應條件不變,分別在還原劑濃度為0.6 mol/L、0.8 mol/L、1.0 mol/L和1.2 mol/L的條件下制備Co-P/Ni foam催化劑,并對所制備出的4種催化劑進行制氫活性測試,測試結果如圖5所示。從圖5中可以看出,當還原劑濃度為1.2 mol/L時,制備的Co-P/Ni foam催化劑的催化硼氫化鈉醇解制氫的效果最好,平均制氫速率為20.57 mL/min/g。
另一方面,對4種催化劑進行SEM形貌表征,表征結果如圖6所示。從形貌的表征可以看出,還原劑濃度對催化劑的形貌具有一定的影響,隨著還原劑濃度的增大,催化劑表面逐漸形成納米花的結構,當還原劑濃度為1.2 mol/L時,已經形成完整的納米花型結構。在納米花的周圍是納米線結構,這樣特殊的、具有更多邊緣和拐角的形貌可能對催化劑的活性產生更大的影響。
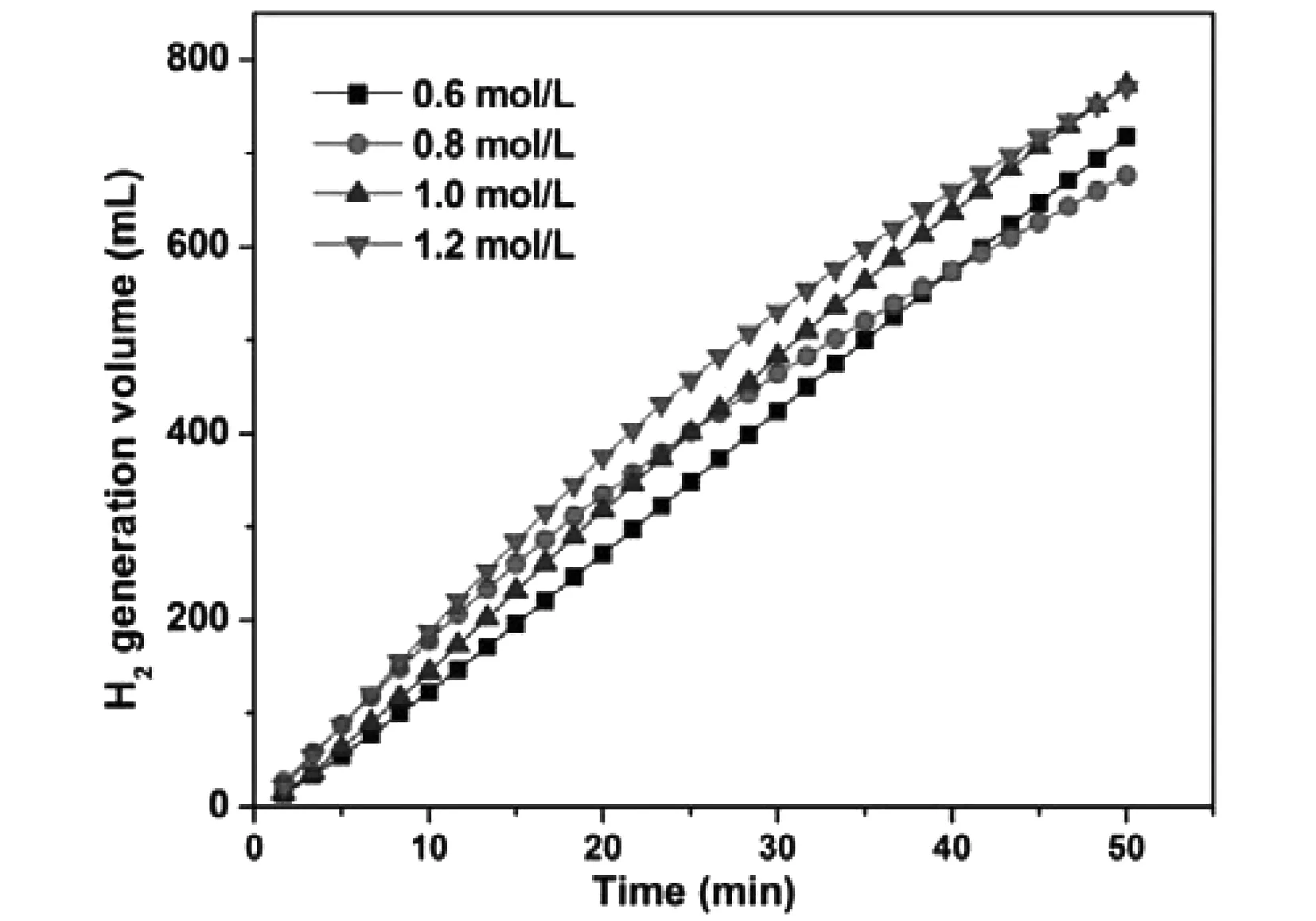
圖5 不同還原劑濃度下制備的Co-P/Ni foam催化劑制氫活性對比Fig.5 Comparison of hydrogen production activity of Co-P/Ni foam catalyst prepared at different concentration of reducing agent
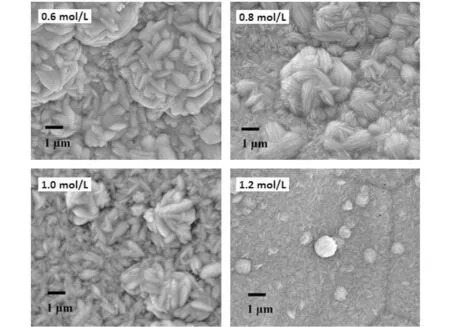
圖6 不同還原劑濃度下制備的Co-P/Ni foam催化劑的SEM形貌表征Fig.6 SEM topography of Co-P/Ni foam catalyst prepared at different concentration of reducing agent
2.1.4 反應時間對催化劑活性的影響
反應時間對催化劑活性的影響,如圖7所示。分別控制制備時長為5 min、10 min、20 min和30 min,對不同時間下制備的催化劑進行性能測試。從圖7中可以看出,化學鍍5 min和10 min制備的催化劑具有相近的催化活性,當化學鍍時間增加到20 min后,該條件下制備的催化劑催化制氫速率具有顯著的提高,而當化學鍍時間繼續增加至30 min,催化劑的活性呈現降低的趨勢。由此可見,化學鍍時間對催化劑的性能具有重要影響,結合催化劑的SEM形貌表征,如圖8所示,分析性能提高的原因。5 min的化學鍍時間下,Co-P鍍層不能完全覆蓋住泡沫鎳載體;當化學鍍時間為10 min時,僅形成了Co-P鍍層,而尚未形成納米花型的結構;直到化學鍍時間增加到20 min,所制備的Co-P鍍層充分覆蓋住泡沫鎳載體,并且形成納米花結構特征,此時催化劑表面的活性位點的數量大大增加,表現為催化制氫速率的提高;當化學鍍時間進一步增加至30 min,只是增加了鍍層的厚度,提高了催化劑的質量,但催化劑的活性位點的數量并沒有增加,故表現出催化性能的降低。
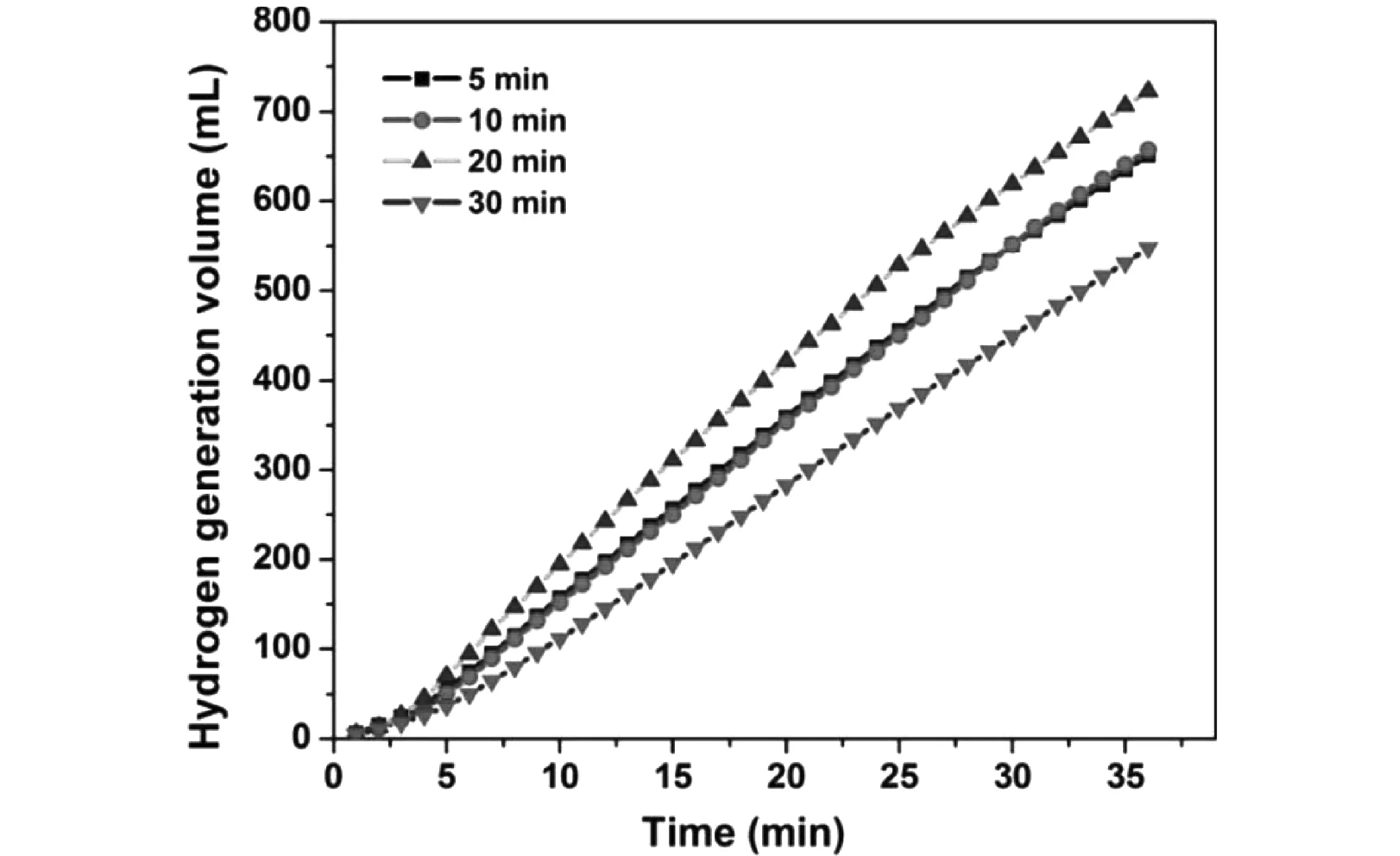
圖7 不同化學鍍時長下制備的Co-P/Ni foam催化劑的制氫活性對比Fig.7 Comparison of hydrogen production activity of Co-P/Ni foam catalyst prepared at different chemical plating times
總結以上反應條件對Co-P/Ni foam催化劑的形貌及催化活性的影響,得出最佳的催化劑制備條件,將其列于表2。在該條件下制備的Co-P/Ni foam催化劑催化制氫的最高速率達到3.52 mL/min/g。

圖8 不同化學鍍時間下制備的Co-P/Ni foam催化劑的SEM形貌表征Fig.8 SEM topography of Co-P/Ni foam catalyst prepared under different electroless plating times

反應條件最佳值前驅體濃度c/mol/L0.1還原劑濃度c/mol/L1.2pH11反應時間t/min20
2.2 泡沫鎳載鈷磷合金(Co-P/Ni foam)催化劑的結構表征與分析
2.2.1 Co-P/Ni foam 催化劑的SEM分析
對最優制備條件下制備的催化劑進行SEM結構表征,與泡沫鎳載體進行對比,如圖9所示,其中(a)為Ni foam的SEM表征圖,(b)、(c)和(d)為Co-P/Ni foam的SEM表征圖。從圖9(b)中可以明顯看到Co-P鍍層充分覆蓋在泡沫鎳骨架上。圖9(c)展現了催化劑表面的納米花和納米線相間的結構。將掃描電鏡的倍數繼續放大,觀察到獨立的納米花花瓣上為單分散的納米顆粒,納米顆粒的粒徑約為19.8 nm,如圖9(d)所示。這一獨特的表面形貌可以解釋該催化劑具有最佳催化活性的這一現象:這種納米花型的形貌使得催化劑比表面積大大增加,同時增加了活性位點的數量,從而提高了催化劑的活性。
2.2.2 Co-P/Ni foam 催化劑的XRD分析
對最優制備條件下制備的催化劑以及泡沫鎳載體分別進行XRD結構表征,結果如圖10所示。觀察圖10中載體泡沫鎳的XRD衍射圖,在2θ = 44.8°,52.0°處出現鎳 (111),(200) 晶面的特征衍射峰。Co-P/Ni foam催化劑的XRD中的鎳的特征衍射峰發生正移且峰強度明顯減弱,這說明鎳的晶格中進入了其他原子,使得鎳的晶面間距變大。在2θ =46°出現Co-P物相的特征衍射峰,該峰比較弱,說明Co-P為無定形態,XRD表征結果證明化學鍍的方法成功將Co-P鍍于泡沫鎳表面。

圖9 Ni foam和Co-P/Ni foam催化劑的SEM形貌表征Fig.9 SEM micrographs of Ni foam and Co-P/Ni foam catalysts
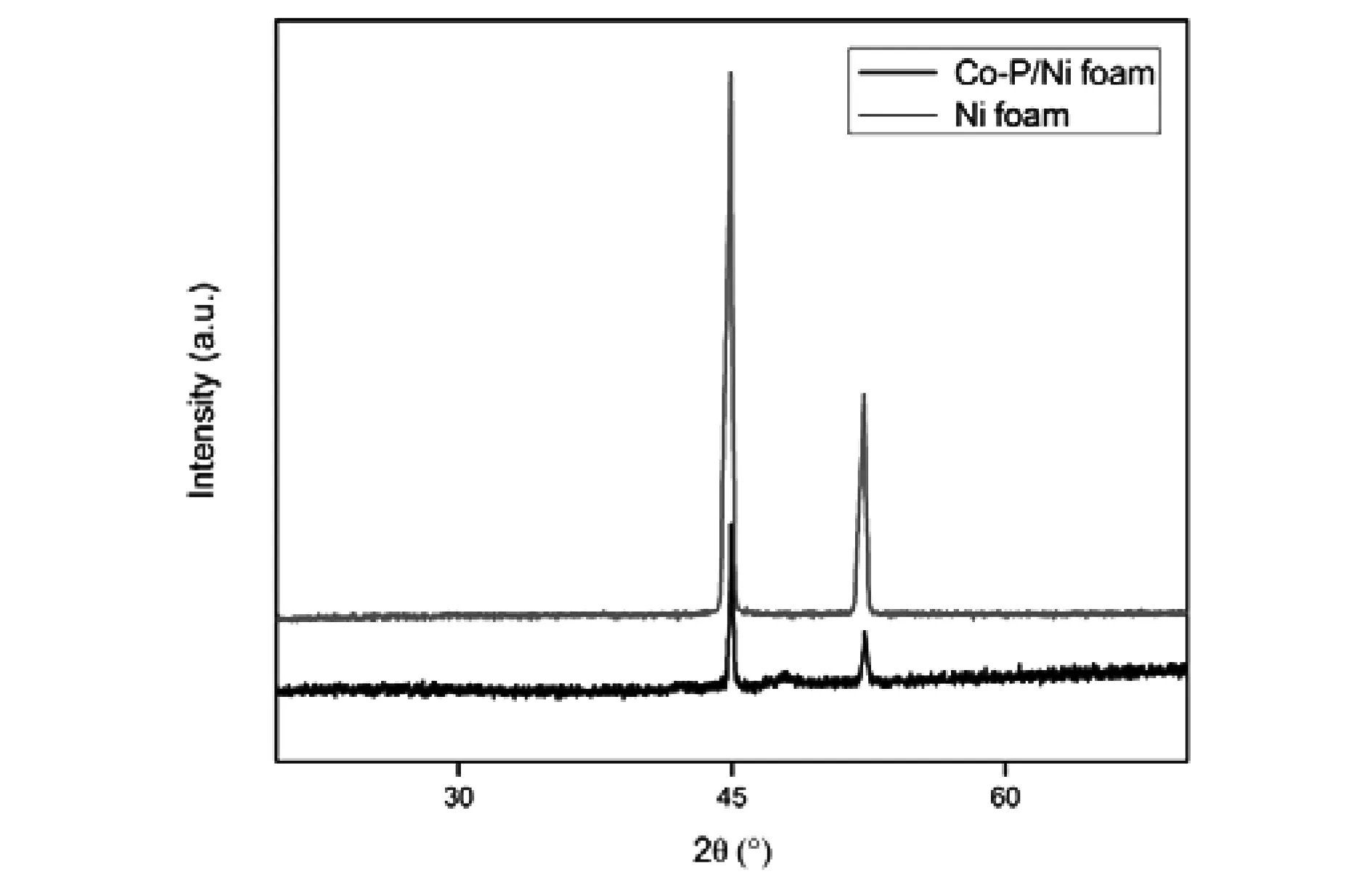
圖10 Co-P/Ni foam催化劑和Ni foam載體的XRD譜圖Fig.10 XRD patterns of Co-P/Ni foam catalyst and Ni foam carrier
2.2.3 Co-P/Ni foam 催化劑的EDX分析
最優條件制備得到的Co-P/Ni foam催化劑進行能譜表征,確定表面組成成分。如圖11所示,譜圖中出現Co和P的峰,證明催化劑由Co和P兩種元素組成,在能譜中沒有觀察到Ni的峰,這說明Co和P緊密地覆蓋在鎳骨架上,表面沒有暴露的Ni。在Co-P/Ni foam上分別取兩個區域進行能譜測試,定量分析的結果如表3所示,得到兩個區域Co和P兩種元素的原子質量比基本相等,這說明催化劑的組成很均勻。
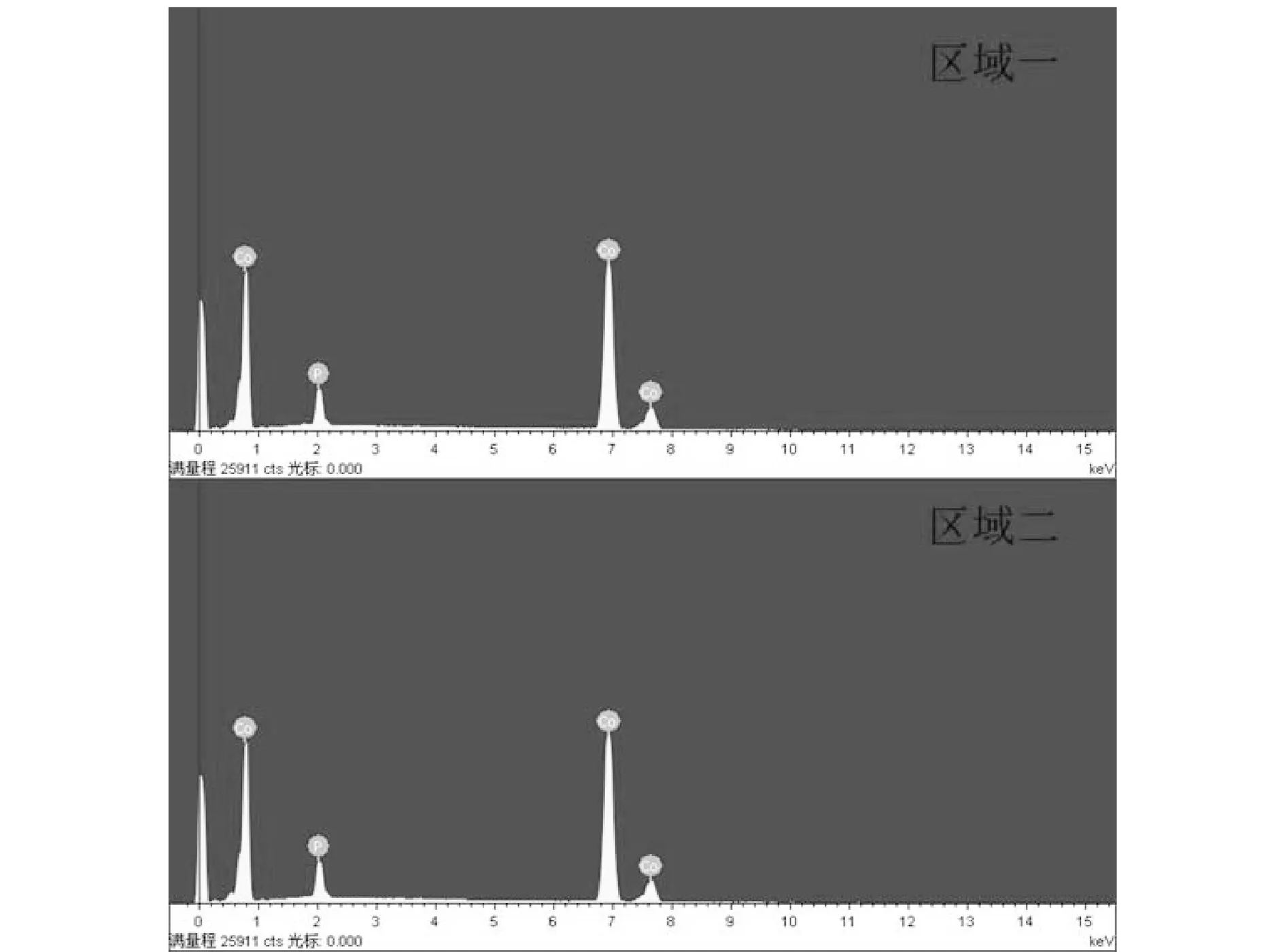
圖11 Co-P/Ni foam催化劑EDX的定性分析結果Fig.11 Qualitative analysis results of Co-P/Ni foam catalyst EDX

元素區域一/atom%區域二/atom%Co88.4988.38P11.5111.62Co/Pratio7.6887.606
3 結論
以泡沫鎳為載體,通過化學鍍法制備了泡沫鎳載鈷磷合金催化劑(Co-P/Ni foam),詳細研究了制備條件(前驅體濃度、還原劑濃度、pH和反應時間)對催化劑形貌和性能的影響。在前驅體濃度為0.1 mol/L、還原劑濃度為1.2 mol/L、pH為11、反應時間為20 min和50℃的條件下制備的Co-P/Ni foam催化劑具有納米花型結構,在納米花的表面具有高分散的納米顆粒,納米顆粒的平均粒徑為19.8 nm,這種特殊的催化劑形貌導致催化劑的性能大大增加,最大制氫速率達到3.52 L/min/g。
[2] McDowall W,Eames M. Forecasts,scenarios,visions,backcasts and roadmaps to the hydrogen economy: A review of the hydrogen futures literature[J].Energy Policy,2006,(34): 1236-1250.
[3] Kahraman E,OzcanlSC,Ozerdem B. An experimental study on performance and emission characteristics of a hydrogen fuelled spark ignition engine[J].Int. J. Hydrogen Energy,2007,(32): 2066-2072.
[4] Ciancia A,Pede G, Brighigna M. Compressed hydrogen fuelled vehicles: reasons of a choice and developments in ENEA[J].Int. J. Hydrogen Energy,1996,(21): 397-406.
[5] Schlesinger HI,Brown HC,Hoekstra HR,et al. Reactions of diborane with alkali metal hydrides and their addition compounds. New syntheses of borohydrides. Sodium and potassium borohydrides[J]. J. Am. Chem. Soc., 1953,(75): 199-204.
[6] Lo CF,Karan K,Davis BR. Kinetic studies of reaction between sodium borohydride and methanol,water, and their mixtures[J].Ind. Eng. Chem. Res.,2007,(46): 5478-5484.
[7] Hannauer J,Demirci UB,Pastor G,et al. Hydrogen release through catalyzed methanolysis of solid sodium borohydride[J].Energy Environ. Sci.,2010,(03): 1796-1803.
[8] Davis RE,Bromels E,Kibby CL. Boron hydrides. III. Hydrolysis of sodium borohydride in aqueous solution[J]. J. Am. Chem. Soc.,1962,(84):885-892.
[9] Lo CF,Karan K,Davis BR. Kinetic assessment of catalysts for the methanolysis of sodium borohydride for hydrogen generation[J].Ind. Eng. Chem. Res.,2009,(48): 5177-5184.
[10] Sahiner N,Sengel S B. Environmentally benign halloysite clay nanotubes as alternative catalyst to metal nanoparticles in H2 production from methanolysis of sodium borohydride[J]. Fuel Process. Technol.,2017,(158): 1-8.
[11] Sahiner N,Yasar AO. Imidazolium based polymeric ionic liquid microgels as an alternative catalyst to metal catalysts for H2 generation from methanolysis of NaBH4[J]. Fuel Process. Technol.,2016,(152): 316-324.
[12] Sahiner N,Sengel SB. Quaternized polymeric microgels as metal free catalyst for H2 production from the methanolysis of sodium borohydride[J].J. Power Sources,2016,(336): 27-34.
[13] Sahiner N,Yasar AO. A new application for colloidal silica particles: natural,environmentally friendly, low-cost,and reusable catalyst material for H2 production from NaBH4 methanolysis[J].Ind. Eng. Chem. Res.,2016,(55): 11245-11252.
[14] Sahiner N,Demirci S. Natural microgranular cellulose as alternative catalyst to metal nanoparticles for H2 production from NaBH4 methanolysis[J].Appl. Catal. B: Environ.,2017,(202): 199-206.
[15] Xu D,Zhang Y,Cheng F,et al. Enhanced hydrogen generation by methanolysis of sodium borohydride in the presence of phosphorus modified boehmite[J].Fuel,2014,(134): 257-262.
[16] Wang L,Li Z,Liu X,et al. Hydrogen generation from alkaline NaBH4 solution using electroless-deposited Co-W-P supported on γ-Al2O3[J].Int. J. Hydrogen Energy,2015,(40): 7965-7973.
[17] Wang Y,Qi K,Wu S,et al. Preparation,characterization and catalytic sodium borohydride hydrolysis of nanostructured cobalt-phosphorous catalysts[J]. J. Power Sources,2015,(284): 130-137.
Studyonthecobaltphosphorusnanofloweralloycatalystssupportedbyfoamnickelforhydrogenationofsodiumborohydride
XIA Yi-liang1, WANG Ya-nan2, WANG Fang-hui2
(1.Xinyu No.4 Middle School of Jiangxi Province, Xinyu 338000, China;2.Department of Organic Chemistry, School of Science, Beijing University of Chemical Technology, Beijing 100029, China)
Ni foam supported Co-P alloy catalysts were synthesized by electroless plating method. Effects of preparation conditions on morphology and performance of the catalysts were studied in detail. And the optimum conditions for the catalyst were studied. Co-P catalysts composed of nano flowers are successfully obtained under optimized conditions. The as-prepared Co-P/Ni foam catalyst with hierarchical flower-like shape shows significantly enhanced catalytic activity during methanolysis of NaBH4, affording hydrogen release rate of 3.52 L·min-1·g-1at 25℃.
Nano flowers; Co-P alloy catalysts; Ni foam; Catalytic activity; Sodium borohydride
O643.36
A
1674-8646(2017)18-0008-06
2017-07-20
國家自然科學基金“硼氫化鈉醇解可控制氫催化劑的制備及構效關系研究”(21476020)
夏亦良(2000-),男,江西省新余市第四中學學生,曾獲2016年新余市優秀團員,生物全國奧賽江西賽區二等獎。
王芳輝(1977-),男,博士,副教授。

