重金屬脅迫對羅非魚血細胞DNA損傷的影響
張來軍,李曉梅,陳永敢,陳 攀,杭瑜瑜,公維潔
(海南熱帶海洋學院 生命科學與生態學院,海南 三亞 572022)
重金屬脅迫對羅非魚血細胞DNA損傷的影響
張來軍,李曉梅,陳永敢,陳 攀,杭瑜瑜,公維潔
(海南熱帶海洋學院 生命科學與生態學院,海南 三亞 572022)
為研究重金屬對魚類的毒性效應,將羅非魚血細胞分別暴露于低、中、高三種不同濃度的四種重金屬溶液Cr(VI)、Pb、Cu、Hg中2 h,采用單細胞凝膠電泳實驗(彗星電泳)技術檢測血細胞的DNA損傷程度,對照組不加任何重金屬,檢測指標包括尾部DNA含量、尾長、尾矩、Olive尾矩.結果顯示,魚血細胞對四種重金屬脅迫均極為敏感,隨重金屬脅迫濃度的升高,DNA損傷程度增加.因此,羅非魚可作為評價重金屬污染遺傳毒性損傷的敏感性生物標記物.
單細胞凝膠電泳;魚血細胞;重金屬污染;DNA損傷
0 引言
重金屬污染,是指由重金屬或其化合物造成的環境污染.隨著城市現代化和工業化的加速發展,導致重金屬污染物通過河流、排泄口、家庭污水管、大氣遷移和沿海傾倒的廢物進入海洋.由于重金屬具有不易移動、難溶解,以及富集性的特性,很難在環境中降解,進入生物體后也難以被排出,從而造成生物體慢性中毒,以致水體中痕量重金屬通過食物鏈的各個環節對生態系統造成危害并最終危及人類的健康.為了能準確、及時、全面地反映海洋環境質量現狀及發展趨勢,需要隨時進行環境檢測[1].
近年來,單細胞凝膠電泳(single cell gel eletrophoresis,SCGE),或彗星電泳(Comet assay)技術常被用于水環境污染遺傳毒理學檢測[2-4].這一技術最早用于動物細胞 DNA 損傷檢測,具有簡便、快速、靈敏等特點,現在已廣泛應用于各種真核生物不同類型的細胞試驗.外界環境中的理化因素會對細胞DNA造成損傷,進而可能引起基因突變或癌變,所以判斷細胞DNA是否損傷是環境監測中重要的一環.在1999年舉行的國際基因毒性檢驗程序專題學術討論會中,單細胞凝膠電泳(pH>13)被定為確定某物質是否具有基因毒性的最佳方法[5].
羅非魚生長于16~38℃的水域,為廣鹽性魚類,海淡水中均可生存,耐低氧.本研究以羅非魚為實驗材料,采用單細胞凝膠電泳技術,檢測四種重金屬Cr6+、Pb2+、Cu2+、Hg2+脅迫對羅非魚外周血細胞DNA 的損傷,為重金屬脅迫的血液毒理學以及評價重金屬對海洋環境中生物的影響提供參考資料.
1 材料與方法
1.1主要試劑與儀器
正常熔點瓊脂糖(NMA, 西班牙),低熔點瓊脂糖(LMA),Triton X-100,肌氨酸鈉, DMSO,上述試劑均為Amresco分裝產品.重鉻酸鉀、硫酸銅、醋酸鉛和氯化汞均為國產分析純.倒置熒光顯微鏡(德國Leica 公司DMI 3000),電泳儀(Tanon EPS 300),電泳槽(北京六一,DYCP-33A).
1.2實驗動物
羅非魚購自海南省三亞市荔枝溝農貿市場,為海水養殖魚,體長不超過15 cm.試驗前用曝氣自來水加天然海水,配制成鹽度為17‰~20‰的實驗用水,馴養1 周,每天換水1次,試驗時挑選健康正常個體進行處理.
1.3試驗方法
用肝素處理的注射器鰓動脈無菌取血,血液用PBS緩沖液稀釋到105~106cell/mL,等體積分到不同的離心管中.Cr6+、Pb2+、Cu2+、Hg2+離子脅迫濃度分別按《漁業水質標準》(GB 11607)最高限量值的100倍、500倍和1000倍設置成低濃度組、中濃度組和高濃度組三個脅迫濃度組,具體脅迫濃度如表1至表4中所示.空白對照組不加任何重金屬離子,25 ℃脅迫2 h.脅迫結束后,血細胞以1000 r/m離心收集,再用PBS緩沖液沖洗1次,離心,重新加入PBS,調整細胞密度,觀察細胞活力,準備電泳.
1.4單細胞凝膠電泳
按Zhang[6]等改良方法進行單細胞凝膠電泳.將潔凈的載玻片在0.6%的常熔點瓊脂糖中浸沒后取出,置37 ℃烘箱烘烤過夜以備電泳;將血細胞懸液和1%低熔點瓊脂糖等體積混合均勻,鋪在預處理后的載玻片上,4 ℃固化5 min,將載玻片放入新鮮配制的裂解液(2.5 mol·L-1NaCl,0.1 mol·L-1EDTA,0.01 mol·L-1Tris,1%肌氨酸鈉,pH 10,1% Triton X-100,10% DMSO)中,裂解1 h;蒸餾水沖洗后,再放入電泳緩沖液(0.3 mol·L-1NaOH,1mmol·L-1EDTA,pH>13)中,變性解旋20 min;電泳20 min(26 V,300 mA);400 mmol·L-1Tris緩沖液(pH 7.5)中和3次;從裂解到中和的所有過程需在4 ℃下進行.將載玻片置于冰冷的無水乙醇中,脫水10 min,室溫晾干, EB(20 μg· mL-1)染色,鏡檢,照相.也可不經過脫水過程,直接染色觀察.
1.5彗星圖像分析和數據的統計分析
每個處理隨機取約50個細胞圖像,用CASP軟件進行分析,可得到諸多反應DNA損傷程度的參數,本文選擇尾部DNA含量(TDNA%)、尾長(TailLength,TL)、尾矩(TailMomen,TM)和Olive尾矩(Olive TailMoment,OTM)四種參數作為衡量細胞DNA損傷程度的評價指標.
用SPSS13.0 對數據進行單因素方差分析(ANOVA),比較各濃度組之間及其與對照組之間各組數據差異的顯著性,實驗重復3次.
2 結果與分析
2.1重金屬Cu2+脅迫對羅非魚血細胞DNA損傷的形態觀察
圖1為Cu2+脅迫對羅非魚血細胞影響的幾種典型彗星圖像.其中圖 1A是空白對照組,其血細胞核大小均勻,呈圓形熒光團,彗星頭部DNA集中,亮度強,無拖尾或輕微拖尾現象;DNA 受損的血細胞由于其DNA鏈斷裂,電泳時斷片向陽極移動,產生彗星樣拖尾,且隨著Cu2+濃度的提高,DNA鏈斷裂程度由輕到重,彗尾逐漸變長,并在一定程度下熒光強度增加;彗星頭部逐漸變小,熒光強度逐漸變弱(圖 1B、C、D).
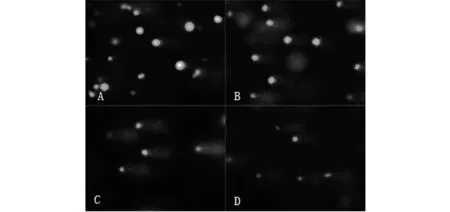
注:A:空白對照組;B:1 mg·L-1 ;C:10 mg·L-1;D:15 mg·L-1圖1 不同濃度Cu2+引起羅非魚血細胞 DNA 受損典型彗星電泳圖像(×200)
2.2四種重金屬對羅非魚血細胞DNA損傷的影響彗星電泳結果
經彗星圖像分析軟件CASP軟件處理彗星圖像后,得到的 TDNA%、TL、TM、OTM四個參數數值經SPSS統計處理后,用Mean±SD表示.四種重金屬離子Cr6+、Pb2+、Cu2+、Hg2+對魚血細胞DNA損傷的分析結果以下列各表所示.
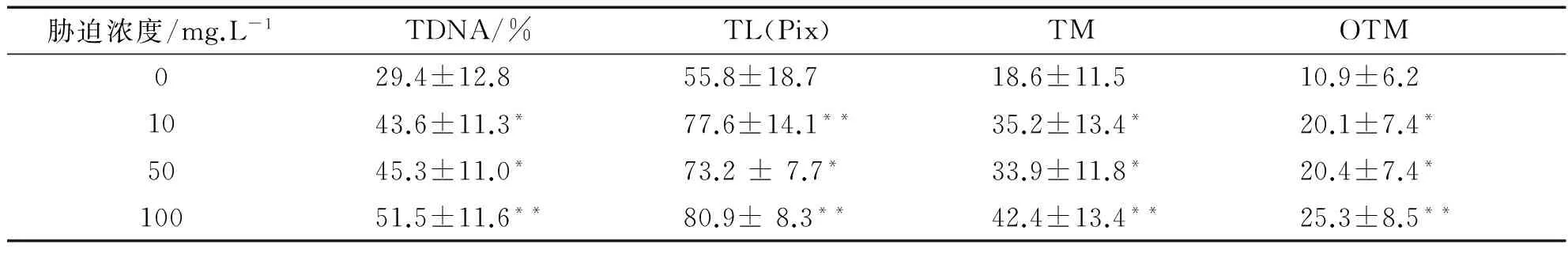
表1 不同劑量Cr6+對羅非魚血細胞DNA損傷的彗星電泳結果
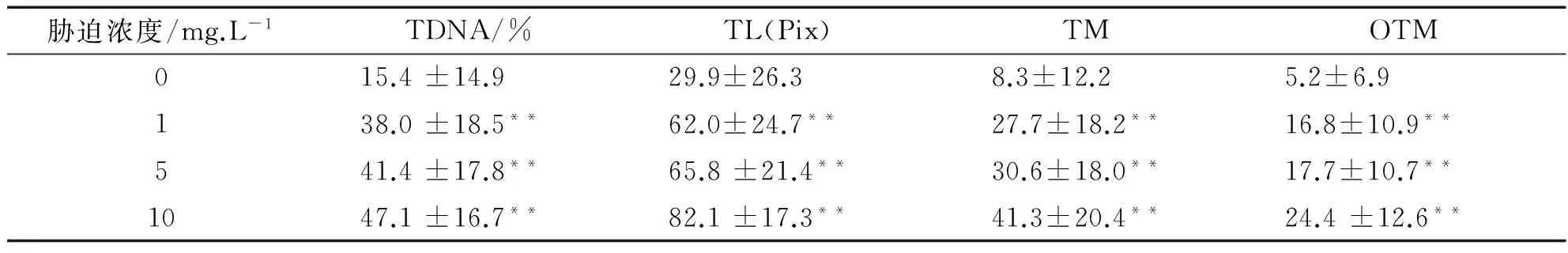
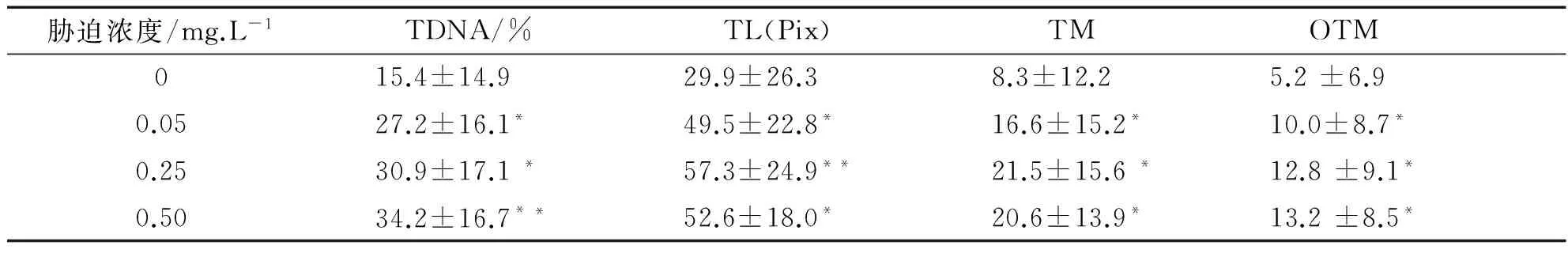
注:與對照組比較“*”表示差異顯著(P<0.05),“**”表示差異極顯著(0.05 由表1數據可知,低、中和高3個Cr6+濃度組的4項指標值顯著高于對照組(P<0.05),其中高濃度組與對照組之間的差異達到極顯著水平(P<0.01),且與低濃度組和中濃度組之間也具有差異(P<0.05).但是低濃度組與中濃度組之間比較差異不顯著(P>0.05).因此隨Cr6+脅迫濃度的提高,TDNA%、TL、TM和OTM的值也隨之增加,魚血細胞DNA損傷越嚴重.Cr6+脅迫濃度與DNA損傷程度二者間存在著明顯的劑量-效應關系.四種參數中,TDNA%、TM和OTM最能夠體現出劑量-效應關系. 表2 不同劑量Pb2+對羅非魚血細胞DNA損傷的彗星電泳結果 注:“*”表示與對照組比較差異顯著(P<0.05) 由表2可知,隨Pb2+脅迫濃度的增加,TDNA%、TL、TM和OTM的值也隨之增加.高濃度組的四項指標分別顯著高于對照組和低濃度組(P<0.05),中濃度組的TDNA%和OTM與對照組比較也具有顯著差異(P<0.05),而低濃度組除OTM高于對照組(P<0.05)外,其他指標與對照組比較沒有差異(P>0.05).Pb2+脅迫濃度與DNA損傷程度二者間也存在著明顯的劑量-效應關系. 表3 不同劑量Cu2+對羅非魚血細胞DNA損傷的彗星電泳結果 注:與對照組比較“*”表示差異顯著(P<0.05),“**”表示差異極顯著(0.05 由表3可知,隨Cu2+脅迫濃度增加,四項指標TDNA%、TL、TM和OTM的值也明顯增加.低、中和高三個濃度組的4項指標與對照組各值比較均有極顯著差異(P<0.01);且高濃度組的4項指標還顯著高于中、低兩個濃度組(P<0.05)(數據未顯示).在實驗所設濃度范圍內,隨Cu2+脅迫的濃度增加,魚血細胞DNA損傷加重,Cu2+濃度與DNA損傷程度之間存在顯著的劑量-效應關系. 表4 不同劑量Hg2+對羅非魚血細胞DNA損傷的彗星電泳結果 注:與對照組比較“*”表示差異顯著(P<0.05),“**”表示差異極顯著(0.05 由表4可知,隨Hg2+脅迫濃度的升高,TDNA%、TL、TM和OTM的值隨之增加.高、中和低3個濃度組的4項指標均顯著高于對照組(P< 0.05),其中高濃度組的TDNA%值顯著大于中、低2個濃度組(P<0.05).在實驗所設濃度范圍內,隨脅迫的Hg2+濃度增加,魚血細胞DNA損傷加重,二者間存在明顯的劑量-效應關系. 因此,魚血細胞對四種重金屬污染極為敏感,隨重金屬脅迫濃度升高血細胞DNA損傷嚴重.四種參數TDNA%、TL、TM、OTM中,TDNA%和OTM最能體現出重金屬脅迫濃度與DNA損傷程度之間的劑量-效應關系. 重金屬污染與其他污染相比,具有范圍廣、長期持久和不可逆等特點,可以長期留在水體和土壤中,再通過富集作用大量積累在植物體內,或通過食物鏈進入到動物體內.實驗室條件下,海水中的鎘能迅速而大量的蓄積于波紋巴菲蛤的內臟團、腮和肌肉組織中[7],而近江牡蠣的體內也具有蓄積大量鉛的能力[8].進入動物體內的重金屬影響生長發育,破壞正常的細胞活動,嚴重時引起死亡.重金屬脅迫對動物DNA的影響表現為引起堿基損傷、DNA鏈斷裂、鏈內或鏈間交聯等,從而影響DNA的完整性,產生遺傳毒性,因此檢測動物細胞DNA損傷是評價環境污染物遺傳毒性的一個重要參數.而單細胞凝膠電泳是迄今檢測DNA損傷非常靈敏的方法;魚類是首批與彗星電泳密切結合用于水環境毒理學領域研究的動物模型.Pandrangi等在1995最先將兩種淡水魚美洲洄魚(Ameiurusnebulosus)和鯉魚(Cyprinuscarpio)作為實驗材料檢測湖底沉積物中有毒廢料的毒性效果[9].但是迄今為止海洋環境中應用于彗星電泳的魚種類極為有限,僅有十多種.最常用的是鰈形目魚類[10-11],細鱗鯻(Theraponjarbua)[12-13],雜斑盔魚(Corisjulis)[14-15],以及海鱸魚[16-17],分別用于檢測重金屬[13,17]、有機物[10-11]、農藥[12]等污染物對魚類的影響;我國僅有大彈涂魚一種被用于彗星電泳研究,檢測鎘、鉛、鉻等重金屬對其外周血細胞DNA損傷的影響[18-20].我國用于海洋污染監測的物種,包括魚類,大多數未實驗動物化和實現市場化供應,因此開展海洋污染物生物監測迫切需要建立標準化的實驗動物. 羅非魚作為彗星電泳的實驗材料曾用于軟骨藻酸(Domoic acid, DA)和苯并(a) 芘的毒性檢測[21-22].本實驗用四種重金屬Cr6+、Pb2+、Cu2+、Hg2+脅迫羅非魚血細胞,彗星電泳檢測DNA損傷程度,發現四種重金屬均引起了羅非魚血細胞DNA損傷,且損傷的程度隨重金屬脅迫的濃度升高而加劇.說明羅非魚對環境污染物,包括重金屬污染較為敏感,可以將這種魚類作為指示生物用于水環境污染生物檢測研究. [1]閻鐵,呂海晶.海洋環境污染生物監測規劃的制定[J].海洋環境科學,1987,3(6):55-59. [2]SRUT M,TRAVEN L,STAMBUK A,et al.Genotoxicity of marine sediments in the fish hepatoma cell line PLHC-1 as assessed by the Comet assay [J].Toxicology in Vitro,2011,25(1):308-314. [3]SULLIVAN C,MITCHELMORE C L,HALE R C,et al.Induction of CYP1A and DNA damage in the fathead minnow (Pimephalespromelas) following exposure to biosolids [J].Science of the Total Environment,2007,384(1-3):221-228. [4]GUILHERME S,GAIVAO I,SANTOS M A,et al.European eel (Anguillaanguilla) genotoxic and pro-oxidant responses following short-term exposure to Roundup-a glyphosate-based herbicide [J].Mutagenesis,2010,25(5):523-530. [5]TICE R R,AGURELL E,ANDERSON D,et al.Single cell gel/ comet assay:guidelines for in vitro and in vivo genetic toxicology testing [J].Environmental and Molecular Mutagenesis,2000,35(3):206-221. [6]ZHANG L J,JIA JF,HAO J G,et al.A modified protocol for the comet assay allowing the processing of multiple samples [J].Mutation Research,2011,721(2):153-156. [7]于淑池,符修正,王昌昊,等.鎘對波紋巴非哈(Paphiaundulata)的急性毒性及組織蓄積性研究[J].瓊州學院學報,2016,23(2):35-39. [8]李曉梅,郭體環,張來軍.鉛對近江牡蝠的急性毒性研究[J].瓊州學院學報,2015,22(5):77-80. [9]PANDRANGI R,PETRAS M,RALPH S,et al.Alkaline single cell gel (comet) assay and genotoxicity monitoring using bullheads and carp[J].Environmental and Molecular Mutagenesis,1995,26(4),345-356. [10]LE D,LACOSTE M,AKCHA F,DEVIER M H,et al.Comparative study of different exposure routes on the biotransformation and genotoxicity of PAHs in the flatfish species,Scophthalmus maximus [J].Environmental Science and Pollution Research International,2013,20(2):690-707. [11]WESSEL N,MENARD D,PICHAVANT-RAFINI K,et al.Genotoxic and enzymatic effects of fluoranthene in microsomes and freshly isolated hepatocytes from sole (Solea solea)[J].Aquatic Toxicology,2012,108(1):33-41. [12]DEVI V J,NAGARANI N,BABU M Y,et al.Genotoxic effects of profenofos on the marine fish,Therapon jarbua[J].Toxicology Mechanisms and Methods,2012,22(2):111-117. [13]NAGARANI N,DEVI V J,KUMARAGURU A K.Identification of DNA damage in marine fish Therapon jarbua by comet assay technique[J].Journal of Environmental Biology,2012:33(4):699-703. [14]TOMASELLO B,COPT C,PUVIRENTI V,et al.Biochemical and bioaccumulation approaches for investigating marine pollution using Mediterranean rainbow wrasse,Coris julis (Linneaus 1798)[J].Ecotoxicology and Environmental Safety,2012,86(4):168-175. [15]FASULO S,MARINO S,MAUCERI A,et al.A multibiomarker approach in Coris julis living in a natural environment [J].Ecotoxicology and Environmental Safety,2010,73(7):1565-1573. [16]SRUT M,STAMBUK A,PAVLICA M,et al.Cage exposure of European sea bas (Dicentrarchus labrax) for in situ assessment of pollution-related genotoxicity [J].Arh Hig Rada Toksikol,2010,61(1):29-36. [17]LABIENIEC M,MILOWSKA K,BALCERCZYK A,et al.Interactions of free copper (II) ions alone or in complex with iron (III) ions with erythrocytes of marine fish Dicentrarchus labrax[J].Cell Biology International,2009,33(9):941-948. [18]陳寅兒,徐鎮.SCGE技術檢測鎘對大彈涂魚外周血細胞DNA損傷[J].基因組學與應用生物學,2010,29(2):369-374. [19]梁亞芳,苗亮,李明云,等.鉛、鉻脅迫對大彈涂魚血細胞遺傳損傷的彗星實驗檢測[J].生物學雜志,2014,31(6):35-38. [20]金春華,李明云,劉偉成,等.鎘脅迫對大彈涂魚(Boleophthalmuspectinirostris)血細胞遺傳損傷的研究[J].海洋與湖沼,2010,41(1):80-84. [21]CAVA T,KNEN S.In vivo genotoxicity testing of the amnesic shellfish poison (domoic acid) in piscine erythrocytes using the micronucleus test and the comet assay [J].Aquatic Toxicology,2008,90(2):154-159. [22]宋超,范立民,孟順龍,等.苯并(a)芘對羅非魚(GIFTOreochromisniloticus) 肝細胞DNA損傷的影響[J].生態環境學報,2013,22(9):1583-1587. DNADamageinHemocytesofTilapia(Oreochromisniloticus)InducedbyHeavyMetalswithSCGETechnique ZHANG Lai-jun, LI Xiao-mei, CHEN Yong-gan, CHEN Pan, HANG Yu-yu, GONG Wei-jie (School of Life Sciences and Ecology, Hainan Tropical Ocean University, Sanya Hainan 572022, China) To investigate the toxic effects of heavy metal on marine fish, hemocytes ofOreochromisniloticuswere respectively exposed to four kinds solution— Cr(VI), Pb, Cu and Hg, each with three concentrations.Then the DNA damage to hemolymph cells was detected by single cell gel electrophoresis(comet assay) after two hours, whereas the control group did not add any heavy metal.The detection indexes include tail DNA content, tail length, tail moment and Olive tail moment.Results showed that blood cells were highly sensitive to the four kinds of heavy metal.Furthermore, with the increase of the concentration of heavy metal, the degree of DNA damage increased.Therefore,Oreochromisniloticuscan be a sensitive biological marker to evaluate the genetic toxicity effects of heavy metals. single cell gel electrophoresis;Oreochromisniloticushemocytes; heavy metal; genetic damage 格式:張來軍,李曉梅,陳永敢,等.重金屬脅迫對羅非魚血細胞DNA損傷的影響[J].海南熱帶海洋學院學報,2017,24(5):31-35. 2017-06-11 國家自然科學基金(31260139);海南省自然科學基金(313050) 張來軍(1968-),女,甘肅慶陽人,海南熱帶海洋學院生命科學與生態學院副教授,博士,研究方向為細胞生物學. Q75;X55 A 2096-3122(2017) 05-0031-05 10.13307/j.issn.2096-3122.2017.05.06 (編校李由明)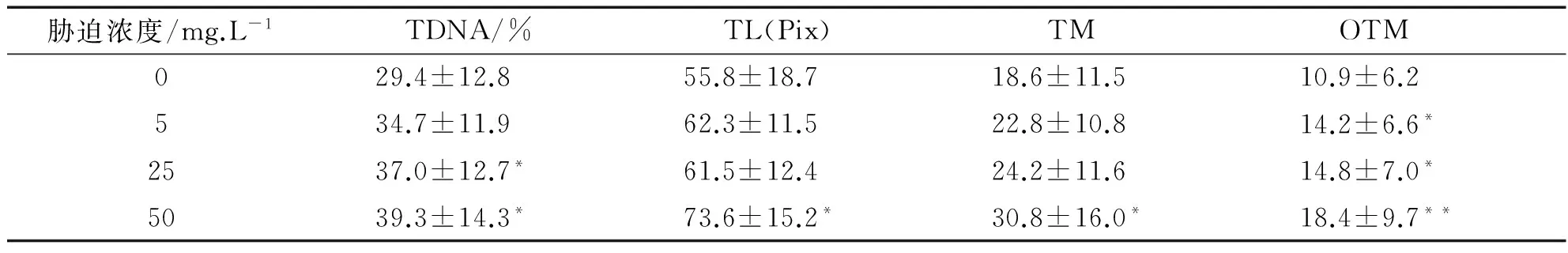
3 討論

