神經酰胺代謝途徑對皮膚屏障功能影響研究進展
劉 媛 解宇環 何 丹 林 青 孫曉菲
·綜述·
云南省科學技術廳應用基礎研究計劃項目(編號:2013FB056)
2016年云南省科學技術廳-云南中醫學院應用基礎研究聯合專項資金項目[編號:2017FF116(-027)]
2016年云南省教育廳科學研究基金項目(編號:2016YJS071)
云南中醫學院,云南昆明,650500
孫曉菲,E-mail: xiaofeisun@163.com
神經酰胺代謝途徑對皮膚屏障功能影響研究進展
劉 媛 解宇環 何 丹 林 青 孫曉菲
神經酰胺是角質層脂質的主要成分,是反映皮膚屏障功能的關鍵性物質,其含量的變化會使細胞間脂質結構發生變化,導致皮膚屏障功能障礙,而引發相關皮膚病。本文對神經酰胺的合成、分解、對皮膚屏障功能的影響及相關皮膚病進行綜述。
神經酰胺; 皮膚屏障; 代謝途徑; 酶
1 神經酰胺概述
1.1 神經酰胺簡介 神經酰胺類化合物(Ceramide,Cer)是由鞘氨醇類(Sphingosine)和長鏈脂肪酸通過酰胺鍵結合而成的一類化合物。神經酰胺是鞘脂類化合物中最重要的一種,是鞘脂類代謝的中心分子[1]。神經酰胺由板層小體(lamellar body)合成及分泌,具有防止水分丟失,維持皮膚屏障的功能[2]。神經酰胺與膽固醇及游離脂肪酸一起構成復層板層膜填充于角質細胞間,約占40%~55%。
1.2 人體皮膚中的神經酰胺 人體皮膚中含有大量的神經酰胺。在表皮上層神經酰胺主要分布于板層小體,轉運高爾基體,角質細胞間隙和角質化包膜[3]。目前人體皮膚角質層(stratum corneum, SC)中已發現至少9種神經酰胺[4](圖1),根據鞘氨脂堿基基團(鞘氨醇、植物鞘氨醇和6-羥基鞘氨醇)和碳氫化合物鏈長的不同分為[5]:a.含鞘氨醇基團者 Cer1(CER-EOS)、Cer2(CER-NS)、Cer5(CER-AS),b. 含植物鞘氨醇者Cer3(CER-NP)、Cer7(CER-AP)、Cer9(CER-EOP),c.含6-羥基鞘氨醇者 Cer4(CER-EOH)、Cer6(CER-NH)、Cer8(CER-AH)。由于角質層中神經酰胺的多樣性使其在角質層結構及凝聚中具有獨特的性能,由此形成角質層的皮膚屏障功能。皮膚屏障功能障礙患者皮損中的神經酰胺組成與正常皮膚中不同,前者神經酰胺的總含量明顯減少,其中以Cer1、Cer3減少最為顯著,相反膽固醇含量明顯增加,神經酰胺與膽固醇的比例發生變化可能是引起皮膚生理功能異常的原因[6]。干燥皮損中,經表皮失水率(transepidermal water loss, TEWL)與Cer3顯著相關。神經酰胺鏈長度對皮膚屏障功能的影響至關重要,通常皮損中短鏈神經酰胺水平顯著升高。因此短鏈神經酰胺會使皮膚屏障功能障礙增強,而長鏈神經酰胺則會使皮膚屏障功能障礙減弱[7]。臨床上常應用Cer1、Cer2、Cer3治療皮膚屏障障礙相關皮膚病,如特異性皮炎等,神經酰胺可通過增加皮膚的水合度,降低經表皮失水率來修復受損的皮膚屏障功能[8,9]。故神經酰胺的質的變化會導致脂質結構的改變,從而影響皮膚屏障功能,進而引發相關皮膚病。
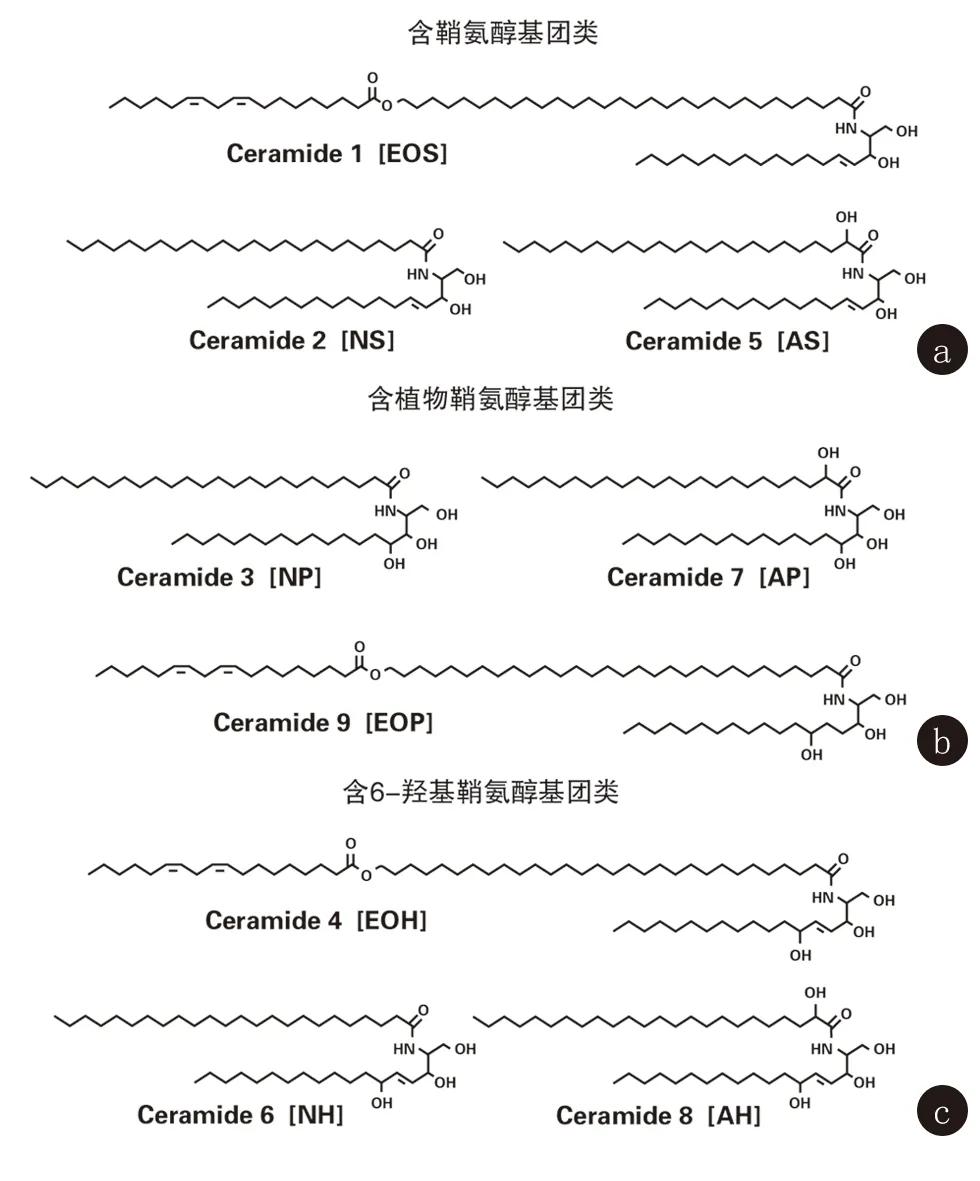
圖中根據鞘氨脂堿基基團(鞘氨醇、植物鞘氨醇和6-羥基鞘氨醇)和碳氫化合物鏈長的不同將皮膚中神經酰胺分為3類,即含鞘氨醇基團類a、含植物鞘氨醇類b、含6-羥基鞘氨醇類c
圖1 人角質層神經酰胺結構
2 神經酰胺的代謝途徑
目前已知部分皮膚病如特異性皮炎、銀屑病等的發生與皮膚角質層中神經酰胺的含量變化密切相關[10]。目前研究表明,神經酰胺含量是通過復雜的代謝途徑進行調控,主要由其合成酶及分解酶來控制的,這些酶對不同的細胞刺激起反應。
2.1 神經酰胺的合成代謝途徑 神經酰胺的合成代謝途徑主要包括三條(圖2):a. 從頭合成途徑(de novo pathway)[11,12]。神經酰胺的從頭合成途徑在內質網(endoplasmic reticulum)上進行[13](圖3)。首先,絲氨酸(serine)和棕櫚酰輔酶A(palmitoyl-CoA)在絲氨酸棕櫚酰轉移酶(serine palmitoyl transferase,SPT)催化下縮合生成3-酮基二羥鞘氨醇(3-ketosphinganine,3-KDS),這是神經酰胺合成的限速步驟。KDS生成二氫鞘氨醇,并經過N端酰化形成二氫神經酰胺,二氫神經酰胺在二氫神經酰胺去飽和酶(dihydroceramide desaturase,DES)的作用下最終生成神經酰胺。 b.水解途徑。鞘磷脂酶(sphingomyelinase, SMase)的水解途徑是 SMase水解鞘磷脂(sphingomyelin, SM),生成神經酰胺和磷脂酰膽堿(phosphatidyl choline,PC)[14]。c.水解酶水解鞘糖脂途徑[15]。各種鞘糖脂先經溶酶體中的葡糖腦苷酯酶和糖苷酶水解為葡糖神經酰胺(glucosylceramide,GlcCer),進而轉變為神經酰胺。
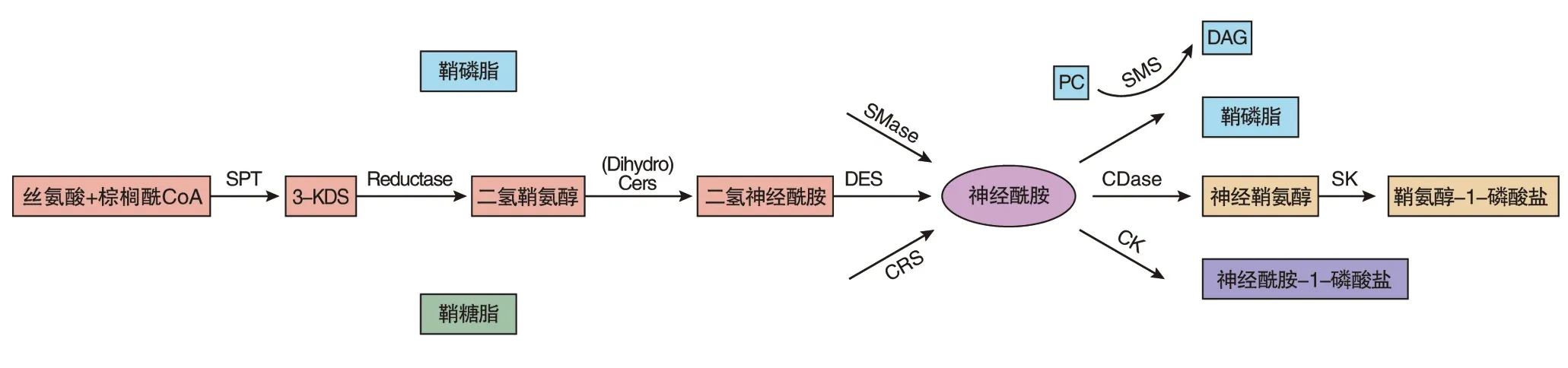
注:神經酰胺可以通過三條主要途徑進行合成,分別是:從頭合成途徑(粉紅色部分)、鞘磷脂酶水解途徑(藍色部分)和水解酶水解鞘糖脂途徑(綠色部分)。反之,神經酰胺也可以被神經酰胺激酶磷酸化生成神經酰胺-1-磷酸鹽(C1P),或是作為鞘磷脂(SM)合成的底物。此外,神經酰胺還可經神經酰胺酶(CDase)作用生成神經鞘氨醇,進一步經神經鞘氨醇激酶(SK)作用生成鞘氨醇-1-磷酸鹽(S1P)
圖2 神經酰胺代謝途徑
2.2 神經酰胺的分解代謝途徑 神經酰胺的分解代謝途徑主要包括三條(圖2):①神經酰胺被鞘磷脂合成酶(sphingomyelin synthase, SMS)催化生成鞘磷脂(SM)和二酯酰甘油(diacylglycerol, DAG),清除神經酰胺。從頭合成途徑生成的神經酰胺將被神經酰胺轉運蛋白(CERT)從內質網轉運到高爾基體(Golgi)[16],高爾基體是SM合成場所。②神經酰胺經內質網中的中性神經酰胺酶(ceramidase, CDase)、質膜上的堿性神經酰胺酶及溶酶體中的酸性神經酰胺酶作用生成神經鞘氨醇(sphingosine),進一步經神經鞘氨醇激酶(sphingosine kinase, SK)作用生成具有前生長因子活性的鞘氨醇-1-磷酸鹽(Sphingosine-1-phosphate, S1P)[17]。③神經酰胺在質膜上被神經酰胺激酶(ceramide kinase, CK)磷酸化生成神經酰胺-1-磷酸鹽(Ceramide-1-phosphate, C1P)[18]。
3 神經酰胺與皮膚屏障功能
皮膚角質層的脂質結構主要成分是神經酰胺類,它具有鎖水、抑制炎癥反應、促進皮膚屏障功能修復的作用,在皮膚屏障功能的調控中起主導作用。研究表明[19,20]特異性皮炎患者角質層中的神經酰胺含量明顯下降,皮膚屏障功能減弱。因此,神經酰胺是反映皮膚屏障功能的關鍵性物質之一,當表皮受損時將迅速啟動皮膚屏障功能的恢復過程,神經酰胺合成增加。
課題組采用膠帶法復制小鼠皮膚屏障障礙模型,使小鼠皮膚屏障功能受損,導致其皮膚TEWL值上升,表皮神經酰胺含量下降。給予健脾方藥參苓白術散和六君子湯13天后,以皮膚組織病理學改變、TEWL值、神經酰胺含量為指標評價健脾方藥參苓白術散和六君子湯對模型小鼠皮膚屏障功能的修復作用。實驗結果發現小鼠皮膚TEWL值較模型組顯著下降,神經酰胺含量明顯增加,小鼠皮膚屏障功能得以修復。研究表明健脾方藥參苓白術散和六君子湯能改善皮膚屏障功能,其機制與角質層中神經酰胺含量的增加有關。
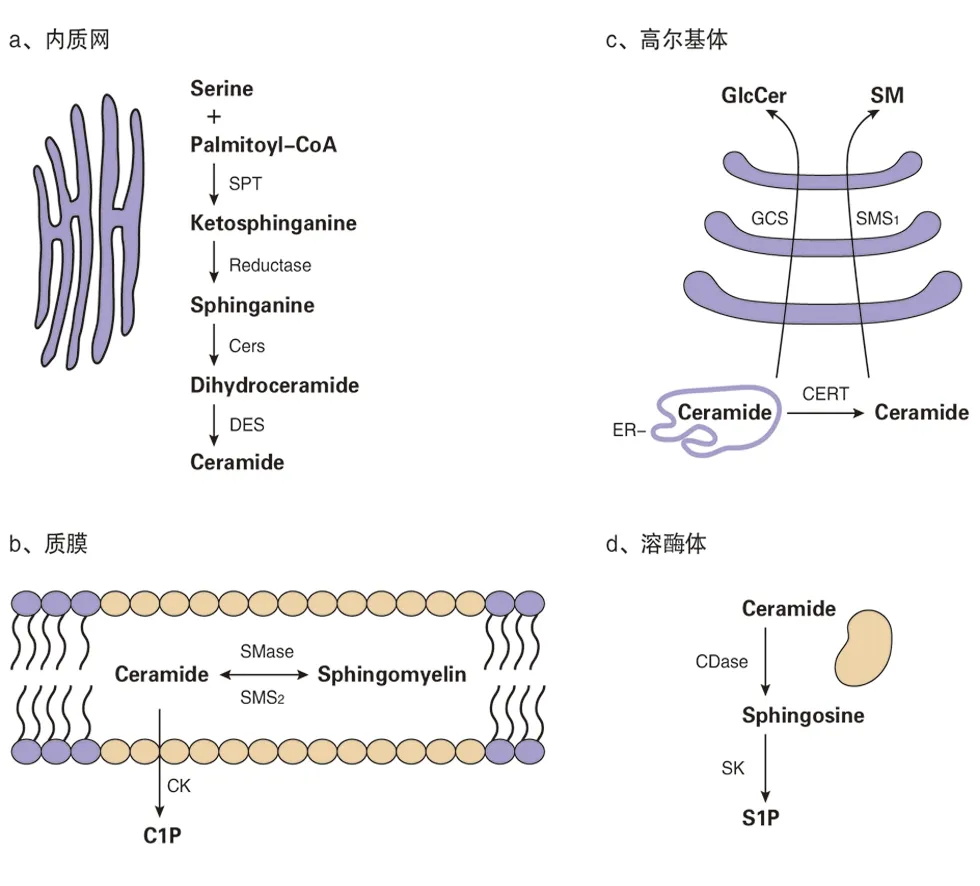
神經酰胺的從頭合成途徑在內質網上進行,隨后通過CERT轉運到高爾基體。在高爾基體中,神經酰胺作為鞘糖脂和鞘磷脂合成的前體。鞘磷脂被輸送到質膜,被水解生成神經酰胺。在溶酶體中,神經酰胺可以被水解生成神經鞘氨醇,然后再在內質網中被利用。神經酰胺也可以轉換成C1P或S1P
圖3 神經酰胺代謝場所
目前,神經酰胺作為皮膚屏障修復劑越來越多應用于護膚品中,可外源性的提供神經酰胺以維持皮膚神經酰胺水平。添加神經酰胺的護膚品具有很強的締合水分子的能力,它通過在角質層中形成網狀結構來維持皮膚的水分,提升皮膚的電導率,具有強大的鎖水能力[21]。同時神經酰胺能增加角質層的厚度,提高皮膚持水能力,減少皺紋,增強皮膚彈性,延緩皮膚衰老[22]。此外,含有神經酰胺的護膚品還能適當降低炎癥反應的發生[23],重建受損的皮膚屏障功能,可輔助用于皮膚屏障功能障礙相關病的治療。
3.1 神經酰胺合成代謝途徑與皮膚屏障功能 角質層中神經酰胺的含量影響著皮膚屏障的功能,而神經酰胺代謝相關酶的活性可調節神經酰胺在細胞內的含量。神經酰胺合成代謝途徑所涉及的主要酶包括:絲氨酸棕櫚酰轉移酶(SPT)、神經酰胺合成酶(CerS)、鞘磷脂酶(SMase)。Man等[24]通過膠帶剝離法建立皮膚機械屏障破壞模型,之后給實驗組小鼠一定量中藥提取物,與對照組相比實驗組皮膚屏障功能顯著提高,其機制與提高SPT表達從而增加其角質層神經酰胺含量有關。 Ishikawa等[25]研究結果表明桉樹提取物可以增加角質層中神經酰胺的含量,從而改善角質層功能。其中神經酰胺含量增加的原因是由于桉樹提取物誘導神經酰胺代謝中的一些酶如 SPT表達增加。Nakajima等[26]研究證明 SPT基因被敲除的新生小鼠全身出現皮膚干燥現象,與正常小鼠相比皮膚保水功能明顯受損,表皮神經酰胺含量有明顯的降低。 Duan等[27]通過缺鎂飲食誘導特異性皮炎模型及膠帶剝離法建立皮膚屏障破壞模型,然后給予鞘磷脂飲食飼養2周,實驗結果表明膳食鞘磷脂能上調表皮CerS2、CerS3、CerS4的表達,從而使神經酰胺含量提高,修復皮膚屏障功能。Jennemann[28]等研究結果已經證明CerS3對神經酰胺的合成及皮膚屏障功能起到關鍵作用。Mizutani[29]等發現CerS3在分化的角質形成細胞中表達增加,推測CerS3可能導致表皮屏障的形成。Marsella[30]等發現在特異性皮炎和老年皮膚病等皮膚屏障缺陷疾病中酸性SMase和中性SMase的活性明顯降低,從而導致角質層中神經酰胺含量降低。Itaya[31]等應用鞘磷脂脂質體培養皮膚細胞模型,研究發現 SMase表達增加,繼而神經酰胺含量增加。因此,特異性皮炎、銀屑病等皮膚屏障功能障礙的皮膚病中神經酰胺合成酶SPT、CerS、SMase的活性明顯降低,當給予外源性干預后,相關合成酶的表達明顯提高,同時神經酰胺含量也有所增加,皮膚屏障功能得以修復。
3.2 神經酰胺分解代謝途徑與皮膚屏障功能 神經酰胺分解代謝途徑所涉及的主要酶包括:鞘磷脂合成酶(SMS)、神經酰胺酶(CDase)、神經鞘氨醇激酶 (SK)、神經酰胺激酶(CK)等。Duan等[27]通過缺鎂飲食誘導特異性皮炎模型及膠帶剝離法建立皮膚屏障破壞模型,然后給予鞘磷脂飲食飼養2周,實驗結果表明膳食鞘磷脂能下調SK2及CK的表達,恢復皮膚屏障功能。CDase對神經酰胺代謝具有雙向調節功能[32]:在pH約4.5時,可以水解神經酰胺成為神經鞘氨醇,進一步生成 S1P;當pH約5.5時,則可以反向催化神經酰胺的合成。特異性皮炎患者CDase的活性改變[33],可能會使表皮中神經酰胺的含量減少,延緩受損皮膚屏障的修復。Moon[34]等實驗結果表明銀屑病患者皮膚中使神經酰胺分解的酶CDase表達上升。因此,皮膚屏障功能障礙相關皮膚病中神經酰胺分解酶活性明顯增加,神經酰胺含量下降,皮膚屏障功能受到損傷。
綜上所述,皮膚中神經酰胺含量主要由其代謝過程中的相關酶進行調控,相關酶活性的變化可導致神經酰胺含量的變化,進而影響皮膚屏障功能,故神經酰胺代謝途徑對皮膚屏障功能產生十分重要的影響。
4 神經酰胺與皮膚障礙性皮膚病
4.1 特異性皮炎 特異性皮炎患者角質形成細胞的增殖能力降低,神經酰胺的含量減少,其中Cer1、Cer3明顯降低,而膽固醇含量明顯升高,神經酰胺與膽固醇比例的改變可能是導致患者皮膚生理功能異常的原因。皮損區神經酰胺合成減少,游離脂肪酸總量無明顯變化,但游離長鏈脂肪酸明顯減少。這些結果提示,特異性皮炎患者皮膚屏障功能異常可能與神經酰胺和長鏈脂肪酸的減少有關[35]。
研究表明特異性皮炎患者神經酰胺含量的變化可能是由于神經酰胺合成代謝途徑中的鞘磷脂酶水解途徑改變所致。有報道顯示[12]特異性皮炎患者的皮損和非皮損區酸性SMase和中性SMase的活性均降低。此外,特異性皮炎患者皮損處神經酰胺缺乏的另一機制可能是神經酰胺酶活性的改變。研究表明特異性皮炎患者皮膚中CDase的活性升高,患者皮膚神經酰胺的缺乏可能與CDase的活性有關。這些研究提示,特異性皮炎患者神經酰胺代謝異常引起神經酰胺含量降低,是導致特異性皮炎患者皮膚屏障功能障礙的病因。
4.2 銀屑病 銀屑病皮損中經表皮失水率顯著增加,大約可增加1~20倍,皮損中神經酰胺組成的改變可能與其經表皮失水率增加有關,特別是Cer1的減少。銀屑病患者皮膚中神經酰胺總量與正常人皮膚含量相近,但銀屑病皮損中含植物鞘氨醇的神經酰胺比例明顯減少,而含神經鞘氨醇的神經酰胺明顯增加。此外,銀屑病皮損中游離脂肪酸的相對含量顯著低于正常皮膚。
研究表明銀屑病皮損區神經酰胺含量的改變可能由神經酰胺合成代謝途徑中的從頭合成途徑及神經酰胺分解代謝途徑進行調控。Moon[34]等實驗研究表明銀屑病患者皮膚中CerS表達下降,而CDase表達上升,從而導致皮膚中神經酰胺含量的減少。于是我們推測調節神經酰胺代謝過程中相關的酶可能成為治療銀屑病的新途徑之一。
5 小結與展望
皮膚完整是機體的天然屏障,具有抵御外界物理、化學損傷及生物抗原等物質侵入的功能,并且能適應外界溫度變化的影響。特異性皮炎、銀屑病、魚鱗病等與遺傳、環境相關的皮膚疾病仍是臨床治療的難題,嚴重影響著患者的生活質量。傳統治療主要應用抗組胺藥及糖皮質激素藥等。其中抗組胺藥能緩解皮膚急性期的病變,但對緩解期皮膚屏障功能的修復療效不佳,無法解決停藥后復發的問題;糖皮質激素藥可減輕局部炎癥,緩解瘙癢癥狀,但長期使用會引起皮膚萎縮,色素沉著、毛細血管擴張等不良反應,且久用可產生治療抵抗和成癮,停藥后易引起皮損復發。故目前用于治療皮膚屏障功能障礙相關皮膚病的方法尚不理想。
皮膚屏障功能障礙是特異性皮炎、銀屑病、魚鱗病等皮膚病的共同發病機制。皮膚屏障損傷的修復已經成為治療該類疾病最重要的環節,隨著皮膚屏障功能的深入研究,表明皮膚屏障功能與神經酰胺的含量有密切的關系。神經酰胺對皮膚的生物功能有重要的調節作用,調控皮膚神經酰胺含量及角質層神經酰胺代謝過程中相關的酶可能成為未來治療皮膚屏障障礙相關皮膚病的有效方法。
[1] Ponnusamy S, Meyers-Needham M, Senkal CE, et al. Sphingolipids and cancer: ceramide and sphingosine-1-phosphate in the regulation of cell death and drug resistance[J]. Future Oncol,2010,6(10):1603-1624.
[2] Boer M, Duchnik E, Maleszka R, et al. Structural and biophysical characteristics of human skin in maintaining proper epidermal barrier function[J]. Postepy Dermatol Alergol,2016,33(1):1-5.
[3] Gabriele V, Stephan P, Lore B, et al. Localization of ceramide and glucosylceramide in human epidermis by immunogold electron microscopy[J]. Invest Dermatol,2001,117(5):1126-1136.
[4] Joo KM, Hwang JH, Bae S, et al. Relationship of ceramide-, and free fatty acid-cholesterol ratios in the stratum corneum with skin barrier function of normal, atopic dermatitis lesional and non-lesional skins[J]. J Dermatol Sci,2015,77(1):71-81.
[5] Smeden JV, Bouwstra JA. Stratum corneum lipids: their role for the skin barrier function in healthy subjects and atopic dermatitis patients[J]. Curr Probl Dermatol,2016,49:8-26.
[6] Jungersted JM, Hogh JK, Hellgren LI, et al. Hand eczema and stratum corneum ceramides[J]. Clin Exp Dermatol,2015,40(3):243-246.
[7] Janssens M, van Smeden J, Gooris GS, et al. Increase in short-chain ceramides correlates with an altered lipid organization and decreased barrier function in atopic eczema patients[J]. J Lipid Res,2012,53:2755-2766.
[8] Murakami S, Shimamoto T, Nagano H, et al. Producing human ceramide-NS by metabolic engineering using yeast Saccharomyces cerevisiae[J]. Sci Rep,2015,5:16319.
[9] Meckfessel MH, Brandt S. The structure, function, and importance of ceramides in skin and their use as therapeutic agents in skin-care products[J]. J Am Acad Dermatol,2014,71(1):177-184.
[10] Zhang Q, Flach CR, Mendelsohn R, et al. Topically applied ceramide accumulates in skin glyphs[J]. Clin Cosmet Investig Dermatol,2015,8:329-337.
[11] Sahle FF, Gebre-Mariam T, Dobner B, et al. Skin diseases associated with the depletion of stratum corneum lipids and stratum corneum lipid substitution therapy[J]. Skin Pharmacol Physiol,2015,28(1):42-55.
[12] Borodzicz S, Rudnicka L, Mirowska-Guzel D, et al. The role of epidermal sphingolipids in dermatologic diseases[J]. Lipids Health Dis,2016,15(1):13-21.
[13] Yamaji T, Hanada K. Sphingolipid metabolism and interorganellar transport: localization of sphingolipid enzymes and lipid transfer proteins[J]. Traffic,2015,16(2):101-122.
[14] Cingolani F, Futerman AH, Casas J. Ceramide synthases in biomedical research[J]. Chem Phys Lipids,2016,197:25-37.
[15] Wennekes T, van den Berg RJ, Boot RG, et al. Glycosphingolipids--nature, function, and pharmacological modulation[J]. Angew Chem Int Ed Engl,2009,48(47):8848-8869.
[16] Santos C, Rogriguez F, Garcia V, et al. Identification of novel CERT ligands as potential ceramide trafficking inhibitors[J]. Chembiochem,2014,15(17):2522-2528.
[17] Borodzicz S, Czarzasta K, Kuch M, et al. Sphingolipids in cardiovascular diseases and metabolic disorders[J]. Lipids Health Dis,2015,16(14):55.
[18] Kolter T. A view on sphingolipids and disease[J]. Chem Phys Lipids,2011,164(6):590-606.
[19] Sugiura A, Nomura T, Mizuno A, et al. Reevaluation of the nonlesional dry skin in atopic dermatitis by acute barrier disruption: an abnormal permeability barrier homeostasis with defective processing to generate ceramide[J]. Arch Dermatol Res,2014,306(5):427-440.
[20] Shaw TE, Currie GP, Koudelka CW, et al. Eczema prevalence in the United States: data from the 2003 National Survey of Children's Health[J]. J Invest Dermatol,2011,131:67-73.
[21] 魏靜,張偉敏,鐘耕,等.神經酞胺對皮膚生理作用及其在化妝品中應用[J].糧食與油脂,2007,1:21-24.
[22] 翁曉芳,高紅軍,林統文,等.皮膚屏障功能研究及其在化妝品中的應用[J].廣東化工,2015,42(4): 61-63.
[23] 蔄茂強,劉俐,呂成志.角質層的含水量及其對皮膚生物功能的影響[J].臨床皮膚科雜志,2008,37(12):816-818.
[24] Man M, Hupe M, Mackenzie D, et al. A topical Chinese herbal mixture improves epidermal permeability barrier function in normal murine skin[J]. Exp Dermatol,2011,20(3):285-288.
[25] Ishikawa J, Shimotoyodome Y, Chen S, et al. Eucalyptus increases ceramide levels in keratinocytes and improves stratum corneum function[J]. Int J Cosmet Sci,2012,34(1):17-22.
[26] Nakajima K, Terao M, Takaishi M, et al. Barrier abnormality due to ceramide deficiency leads to psoriasiform inflammation in a mouse model[J]. J Invest Dermatol,2013,133(11):2555-2565.
[27] Duan J, Sugawara T, Hirose M, et al. Dietary sphingolipids improve skin barrier functions via the upregulation of ceramide synthases in the epidermis[J]. Exp Dermatol,2012,21(6):448-452.
[28] Jennemann R, Rabionet M, Gorgas K, et al. Loss of ceramide synthase 3 causes lethal skin barrier disruption[J]. Hum Mol Genet,2012,21(3):586-608.
[29] Mizutani Y, Kihara A, Chiba H, et al. 2-Hydroxy-ceramide synthesis by ceramide synthase family: enzymatic basis for the preference of FA chain length[J]. J Lipid Res,2008,49:2356-2364.
[30] Marsella R, Olivry T, Carlotti DN. Current evidence of skin barrier dysfunction in human and canine atopic dermatitis[J]. Vet Dermatol,2011,22(3):239-248.
[31] Itaya Y, Tokudome Y. Upregulation of gene expression levels of ceramide metabolic enzymes after application of sphingomyelin-based liposomes to a three-dimensional cultured human epidermis model[J]. Biochem Biophys Res Commun,2016,473(1):114-131.
[32] Okino N, He X, Gatt S, et al. The reverse activity of human acid ceramidase[J]. J Biol Chem,2003,278(32):29948-29953.
[33] Kita K, Sueyoshi N, Okino N, et al. Activation of bacterial ceramidase by anionic glycerophospholipids: possible involvement in ceramide hydrolysis on atopic skin by Pseudomonas ceramidase[J]. Biochem J,2002,362(3):619-626.
[34] Moon SH, Kim JY, Song EH, et al. Altered levels of sphingosine and sphinganine in psoriatic epidermis[J]. Ann Dermatol,2013,25(3):321-326.
[35] Choi MJ, Maibach HI. Role of ceramides in barrier function of healthy and diseased skin[J]. Am J Clin Dermatol,2005,6(4):215-223.
Updateoftheeffectofceramidemetabolismpathwayonskinbarrierfunction
LIUYuan,HEDan,XIEYuhuan,LINQing,SUNXiaofei.
YunnanUniversityofTraditionalChineseMedicine,Kunming650500,China
SUNXiaofei,E-mail:xiaofeisun@163.com
Ceramide is a major ingredient of the lipid in stratum corneum, the key material, which reflects skin barrier function. The change of content of ceramide can lead to the structure damage of the lipid in stratum corneum, which leads to the skin barrier function damage and skin diseases. The composition, catabolism and the effects on skin barrier function of ceramide is reviewed in this article.
ceramide; skin barrier; metabolic pathway; enzyme
(收稿:2016-10-13 修回:2016-12-04)

