原花青素類成分在防治2型糖尿病作用機制方面的研究進展
王雪萍 李醫明 王釗 賈琦 陳凱先

[摘要]糖尿病是一種以升高血糖為主要特點的慢性疾病,長期高血糖會引發多種并發癥。原花青素是一類廣泛存在于植物中的多酚化合物,在降血糖、改善胰島素抵抗、保護胰島β細胞方面具有良好的作用,對于2型糖尿病的預防及治療顯示出較好的效果。該文對原花青素類成分調控2型糖尿病在促進葡萄糖吸收、保護胰島β細胞、改善腸道微環境、調節糖尿病并發癥等方面的研究進展進行綜述,為該類成分進一步研究提供參考。
[關鍵詞]原花青素; 2型糖尿病; 作用機制
[Abstract]Diabetes mellitus, a chronic disease, is characterized by high blood glucose that could induce various complications Procyanidin, a kind of polyphenol compounds existing in many plants, have shown to be effective in preventing and treating type 2 diabetes mellitus as they may lower blood glucose, moderate insulin resistance and protect islet β cells This review focused on the research advances on the preventive and therapeutic application of procyanidin in promoting glucose absorption, protecting islet β cells, modulating intestinal microbiota and regulating diabetic complications of type 2 diabetes mellitus, which should provide useful reference for subsequent studies.
[Key words]procyanidin; type 2 diabetes mellitus; mechanism
糖尿病是一種因胰島素分泌不足和/或胰島素作用障礙所致的以高血糖為主要特征的代謝紊亂綜合征,長期慢性高血糖導致多種組織損害、器官功能障礙,使患者生活質量降低、壽命縮短、病死率增高。根據發病機制的不同,糖尿病分為以胰島素分泌不足為主的1型糖尿病及以胰島素抵抗為主要特征的2型糖尿病,其中糖尿病患者以2型為主,占比超過90%[1]。目前臨床上治療2型糖尿病的藥物,存在低血糖反應、變態反應、消化道不適等一系列的不良反應[2],研發安全有效的降糖藥物是當前藥物研發的重要任務,而天然藥物是新藥發現與研究的重要來源。
原花青素是一類以黃烷3醇為單體的聚合多酚類物質,常根據參與聚合的單體數目進行分類 (原花青素分類見表1及圖1),其廣泛存在于各種植物的核、皮或種子中,如葡萄籽、藍莓、肉桂、桑椹、野蘋果等植物中均含有較為豐富的原花青素類成分[3]。研究表明原花青素具有降血糖、降血脂、抗氧化、抗炎等藥理活性,其降血糖的效果越來越受到人們的關注。雖然已有文獻對原花青素降糖降脂作用進行了綜述[45],但未見原花青素降糖機制方面的系統綜述。本文對原花青素改善2型糖尿的作用機制進行較為系統的綜述,為后續深入研究原花青素用于2型糖尿病的防治提供參考。
1促進外周細胞葡萄糖吸收
高血糖是糖尿病的一個典型特點,機體細胞對于葡萄糖的吸收利用主要存在于肝臟、肌肉、脂肪等外周組織中,促進外周細胞葡萄糖的吸收是降低血糖的一個重要途徑。藥理實驗表明,原花青素可以促進葡萄糖的吸收,其作用機制包括以下幾點。
11促進細胞膜外葡萄糖轉運葡萄糖吸收入血后,依賴葡萄糖轉運體(GLUTs)進入細胞。葡萄糖轉運體包括13個亞型,GLUT2主要在腎小管細胞、肝臟細胞及胰島β細胞中表達,GLUT4主要表達于胰島素敏感的骨骼肌、脂肪細胞和心肌中。AMPK,Akt磷酸化促進葡萄糖轉運體由胞質轉移到胞膜,從而促進葡萄糖吸收。在胰島素敏感的外周組織中,原花青素增加糖轉運水平。在高脂誘導的肥胖型糖尿病小鼠中,可可酒原花青素提取物提高骨骼肌、棕色脂肪組織及白色脂肪組織中GLUT4表達和AMPKα磷酸化[6]。在KKAy糖尿病小鼠中,黑豆皮原花青素提取物提高肝臟及骨骼肌AMPK活性[7]。STZ誘導的糖尿病模型小鼠中,檳榔果中原花青素提取物增加肝臟AMPK活性[8]。在過表達人胰島素受體的中國倉鼠卵巢細胞(CHOIR)中,葡萄籽原花青素提取物(GSPE)增加了Akt磷酸化水平[9];在3T3L1脂肪細胞中,海岸松樹皮原花青素提取物提高Akt磷酸化水平[10]。此外,可可類黃酮表兒茶素通過增加HepG2細胞胰島素受體(IR)、胰島素受體底物1(IRS1)、胰島素受體底物2(IRS2)磷酸化水平,激活PI3K/Akt,AMPK信號通路,增加GLUT2轉運水平。但是部分研究顯示,原花青素降低葡萄糖轉運體mRNA的表達。在胰島素誘導的胰島素抵抗的3T3L1脂肪細胞中,GSPE下調Pparg2,GLUT4 及IRS1 mRNA水平,但不影響其促進葡萄糖吸收作用[11]。這提示原花青素可以通過改善胰島素信號通路或激活AMPK,Akt引起GLUT4或/和GLUT2轉移到細胞膜,調節葡萄糖吸收[12]。
12促進糖原合成及糖酵解,抑制糖異生過程糖原合成是血糖代謝的一個重要途徑,肝臟和骨骼肌是合成糖原的主要場所,對調節血糖代謝有著至關重要的作用。糖原是葡萄糖在體內儲存的主要形式,胰島素可調節其合成與分解。有報道指出,胰島素抵抗患者體內的糖原含量會顯著降低[13]。PI3K/Akt信號通路是調節糖原合成的一個重要通路[14]。可可豆原花青素能夠非胰島素依賴性的刺激人原代骨骼肌細胞糖原合成、葡萄糖吸收;這種作用在低聚原花青素和多聚原花青素中都有體現,而且多聚原花青素效果更加顯著[15]。在3T3L1脂肪細胞中,GSPE具有一定促進糖原合成的能力[16]。endprint
糖酵解途徑是體內葡萄糖代謝最主要的途徑之一,也是糖、脂肪和氨基酸代謝相聯系的途徑。肝臟糖異生紊亂導致肝糖輸出增多是機體肝臟胰島素抵抗發生的重要誘因[17]。在STZ誘導的糖尿病小鼠中,蓮蓬低聚原花青素提高肝臟丙酮酸激酶(PK)、磷酸果糖激酶(PFK) mRNA的表達促進糖酵解過程[18]。蘋果原花青素給予ob/ob小鼠8周,在丙酮酸耐受實驗中,15,30 min蘋果原花青素給藥組顯著降低血糖,抑制糖異生[19]。此外,GSPE促進糖原合成作用弱于胰島素,但將葡萄糖合成脂質方面強于胰島素,大多數葡萄糖直接合成甘油,但并不影響甘油三酯的總量[16]。
13調節與葡萄糖代謝相關酶的活性原花青素調節與葡萄糖輸入或輸出相關酶的活性。原花青素能夠提高葡萄糖激酶、己糖激酶、糖原合成酶活性,降低葡萄糖6磷酸酶(G6Pase)、磷酸烯醇丙酮酸羧激酶(PEPCK)、果糖1,6二磷酸酶活性,減少葡萄糖生成[2023]。
原花青素下調與糖酵解通路相關的酶。糖酵解過程的關鍵酶葡萄糖激酶(GK),PK,PFK的活性直接影響著糖酵解過程[2425]。GSPE 25 mg·kg-1給藥45 d,在大鼠胰島上檢測葡萄糖激酶基因表達水平顯著降低[26]。另外,原花青素對丙酮酸激酶同工酶M1/M2(PKM2)、甘油醛3磷酸脫氫酶、ATP5B均有調節作用[27]。原花青素通過下調胰腺組織中與糖酵解通路相關酶的mRNA的表達或影響酶的活性降低葡萄糖的含量,從而改善2型糖尿病。
2保護胰島β細胞
在2型糖尿病中,機體處于胰島素抵抗狀態,為了維持正常血糖水平,機體自我調節機制使胰島β細胞分泌更多的胰島素,加重胰島β細胞功能受損狀態,從而產生高胰島素血癥。研究表明,原花青素對胰島素分泌和產生具有一定作用,也可影響β細胞的凋亡和增殖。
21調節胰島素的合成和分泌正常情況下,葡萄糖的轉運和利用主要在胰島素等激素的刺激下,通過胰島素轉導途徑,引起一系列激酶的激活、葡萄糖轉運體易位等,最終促進靶組織吸收葡萄糖。胰島素信號轉導途徑任一環節異常都會導致胰島素抵抗。原花青素能增強機體對胰島素的敏感性,調節胰島素合成和分泌。在db/db糖尿病小鼠中,200 mg·kg-1柴桂原花青素提取物給藥4周,小鼠血清及胰腺中胰島素含量增加,葡萄糖耐受及胰島素敏感性增加[28]。棕櫚酸誘導的胰島β細胞損傷模型中,原花青素三聚體提高葡萄糖刺激的胰島素分泌水平[2930]。蛋白組學研究顯示,原花青素通過調節羧肽酶蛋白(將前胰島素轉化為胰島素)水平從而控制胰島素合成[26]。但是,部分研究結果顯示,高脂飲食誘導的糖尿病鼠中,給予GSPE,胰島素基因表達有降低的趨勢[27,31]。此外,原花青素促進胰島β細胞增殖,其原因可能與胰島素含量較高有關[25]。INS1E(β細胞系)經GSPE處理后,在高糖刺激下,GSPE增加β細胞對葡萄糖的吸收;改善葡萄糖誘導線粒體超極化的損傷、三磷酸腺苷合成的降低、改變細胞膜電位;改變GLUT2、葡萄糖激酶、UCP2基因表達及肝臟胰島素降解酶的表達,進而改變胰島素的降解;即原花青素在病理條件下通過調節胰島素合成、分泌和降解來改變β細胞作用[32]。
原花青素調節胰島素的分泌另外一個機制與miRNA改變相關。健康大鼠GSPE 25 mg·kg-1給藥45 d,miR1249,miR483及miR30c1*下調,miR3544上調[33]。這些miRNA控制與胰島素分泌過程相關的離子轉運、刺激條件下激素和有機物質應答相關基因的表達,進而影響胰島素的分泌[4]。
22改善胰島β細胞功能及緩解炎癥狀態葡萄籽原花青素提取物能夠降低高血糖、提高β細胞功能、保護胰島β細胞[34]。其機制可能為:①通過調節β細胞的增殖[26]和凋亡[35]來調節細胞的功能。在人胰腺癌MIA PaCa2細胞中,給予10~100 mg·L-1的GSPE長期孵育,給藥組減少胰島β細胞增殖,增加β細胞凋亡,其原因可能是下調抗凋亡蛋白Bcl2和線粒體膜去極化[31]。在高脂誘導的2型糖尿病晚期鼠模型中,500 mg·kg-1給予GSPE 16周,β細胞功能及胰島素表達增加,其原因是改善內質網應激和減少胰島β細胞凋亡[36]。②INS1E細胞經油酸誘導3 d,GSPE處理后,上調CPT1a(增加β氧化),下調與脂質合成相關基因(FASn,SREBF1),減少β細胞中脂質堆積[31]。③改善炎癥狀態。Yin等[37]研究葡萄籽原花青素B2對db/db鼠胰腺的作用,發現與炎癥相關的MFGE8,IL1β及NLRP3水平降低,且得出MFGE8可能是原花青素B2緩解db/db鼠胰腺炎癥狀態,從而發揮保護db/db鼠胰島細胞作用的一個重要靶點的結論。
3改善腸道微環境
目前研究已揭示了腸道菌群與宿主代謝之間的復雜聯系,腸道菌群可以通過影響葡萄糖和脂質代謝發揮對能量平衡的調節[38]。原花青素可以通過調節腸道菌群平衡及腸道微環境維持機體穩態。
31調節腸道菌群平衡研究表明,原花青素增加腸道中有益菌含量及種類,降低有害菌含量,優化腸道菌群多樣性及優勢性。宋雪琳等[39]發現GSPE能夠有效降低營養肥胖型大鼠腸道菌群中厚壁菌門Firmicutes的量,增加擬桿菌門Bacteroidetes的量,降低F/B比值,改善肥胖模型大鼠腸道菌群結構。RTPCR定量研究也發現,GSPE可以促進有益的擬桿菌增殖,抑制有害的柔嫩梭菌增殖,對優勢菌群具有顯著的調節作用。傅穎等[40]給予高脂飼料喂養的SD大鼠不同劑量原花青素,發現各劑量組腸道優勢菌群多樣性明顯增加,隨著原花青素的干預劑量加大,中、高劑量組腸道菌群多樣性明顯減少,腸道優勢菌群結構明顯恢復。另外,原花青素能促進人類糞便培養液中雙歧桿菌等益生菌的生長,增加短鏈脂肪酸的含量,抑制大腸桿菌、鼠李糖乳桿菌、鼠傷感沙門氏菌等有害菌的生長,減少厚壁菌門和擬桿菌門的比例[4143];酚類物質可通過破壞特定菌細胞膜的正常功能、改變微生物代謝酶構成和活性等途徑來影響腸道菌群結構,但尚不清楚引起這些變化的由于酚類物質本身還是酚類物質的代謝產物[44]。endprint
32改善腸壁通透性及腸道蛋白功能慢性炎癥和氧化應激反應都可能引起胰島β細胞的凋亡,而胰島素抵抗將最終引起2型糖尿病的發生[45]。研究顯示,由高脂膳食誘導的大鼠2型糖尿病,其腸道中的細菌可蔓延到能引起炎癥反應的腸壁周圍的脂肪組織和血液中,提升細菌對于黏膜的黏附作用,從而導致炎癥的發生[46]。原花青素對腸道環境的改善具有積極作用。在高脂飼料喂養Wistar大鼠建立的營養肥胖模型中,肖俊松等[47]發現GSPE可以顯著恢復腸壁通透性。高脂膳食可誘導腸壁通透性異常升高,而腸壁通透性增加導致腸道內大量有毒物質經過靜脈進入肝臟進而導致肝臟解毒負擔,GSPE可減輕肝臟負擔。
二肽基肽酶4 (DPP4)為一種糖膜蛋白,能使胰高血糖素樣肽(GLP1)和抑胃肽(GIP) 快速降解,DPP4通過影響這2種肽類激素促進胰島β細胞分泌胰島素的功能,進而影響2型糖尿病患者血糖水平。原花青素可通過抑制腸道中DPP4的活性及/或基因的表達,來調節血糖水平。Gonzálezabuín等[48]發現GSPE長期處理人源Caco2細胞,DPP4的活性及基因的表達降低;在健康大鼠中,GSPE 25 mg·kg-1給藥45 d,其腸道中DPP4的活性及基因表達相對未給予GSPE大鼠明顯降低;飲食誘導的肥胖型大鼠中,經GSPE干預DPP4基因表達下調;可可黃酮通過抑制小腸上皮細胞中α淀粉酶、α葡萄糖苷酶、DPP4活性,抑制SGLT1及GLUT2糖轉運體向胞漿轉運,提高GLP1分泌影響碳水化合物的吸收[49]。
4調節與糖尿病相關的并發癥
慢性高血糖可能會引起糖尿病腎病、糖尿病微血管病變等多種并發癥的發生。目前研究結果表明糖尿病并發癥發生與氧化應激、多元醇通路、蛋白質非酶糖激化、蛋白激酶C等相關[50]。在這些通路中可能存在控制糖尿病并發癥發生的潛在靶點,以發病機制為靶點的治療可能會給控制糖尿病慢性并發癥發生及發展帶來新的希望。
41調節血脂在脂肪組織、肝臟、肌肉組織中脂質過度積累將會導致肥胖,而肥胖也是引起2型糖尿病、心血管疾病等的一個危險因素。由高脂飲食誘導的糖尿病大鼠模型中,短期GSPE處理降低血清中甘油三酯、低密度脂蛋白含量,降低肝臟中SREBP1,MTP,DGAT2的表達[51]。
原花青素調節脂質的機制可能是:①降低肝臟PPARα、脂肪組織PPARγ水平,使ACO,CPT1,ABCA1等上調,提高脂肪酸氧化和降低膽固醇的形成;使FAS,SREBP1/2,DGAT2等下調,降低脂質合成和TAG儲存[5255]。GSPE干預db/db鼠8周,可降低血尿素氮、血肌酐、尿白蛋白的水平,抑制腎小管上皮細胞內脂滴形成及脂肪酸合成,促進脂肪酸β氧化[56]。GSPE處理3T3L1脂肪細胞,調節PPARγ及miR4835p,抑制脂質生成[57]。②降低激素敏感性脂肪酶(HSL)等酶活性,減少脂解[5859]。在3T3L1細胞中,GSPE在其誘導分化的第4天,可明顯降低HSL的mRNA表達[59]。但是,也有研究顯示不同的結果。高脂誘導的倉鼠經GSPE處理,與合成代謝相關基因(ACC1,GPAT)、分解代謝相關基因(PPARα,ATGL,HSL)的mRNA水平提高,其糖脂/脂肪酸循環受到影響[60]。
42改善氧化應激及炎癥狀態肥胖條件下,脂肪酸和葡萄糖代謝增加將導致線粒體氧化應激,同時激活部分炎癥信號通路[6162]。在胰島素抵抗的動物模型上,原花青素降低與產生毒性物質相關酶的活性,如Cu,ZnSOD,谷胱甘肽過氧化物酶(GPx),過氧化氫酶 [6364];降低NFκB,COX2,CRP,IL6,TNFα等細胞因子在肝臟、脂肪及肌肉組織中基因表達[6568],促進脂肪組織脂聯素含量的增加,緩解炎癥狀態[69]。糖尿病小鼠胰島β細胞上顯示出相似作用[70]。研究人員通過研究黑豆皮花青素對2型糖尿病大鼠氧化應激信號傳導通路DAGPKC的影響,發現黑豆皮花青素可明顯降低糖尿病大鼠血糖,對糖基化終產物(AGEs)的形成具有明顯的抑制作用,腎小球PKC活性和腎小球總DAG的含量比糖尿病模型組明顯下降,改善2型糖尿病大鼠的抗氧化能力[71] 。肖俊松等[47]發現GSPE可顯著降低高脂誘導的肥胖大鼠血清中丙二醛水平,升高超氧化物歧化酶和過氧化氫酶水平,改善肥胖大鼠氧化應激狀態;降低白介素1的水平,改善炎癥狀態。
5結語和展望
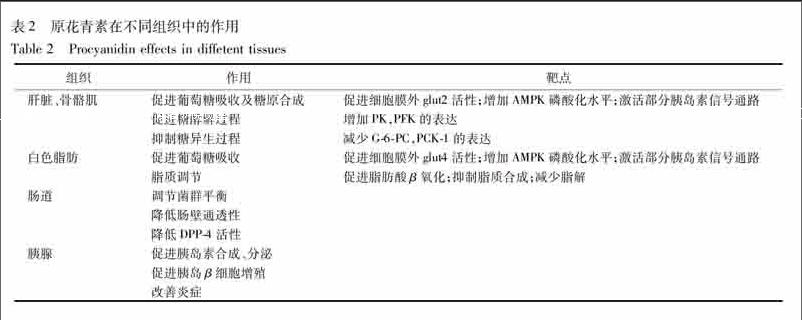
2型糖尿病是一種長期慢性疾病,病理過程涉及多個器官病變。研究發現原花青素具有多組分、多靶點、多功能作用,其在不同組織中的作用概括見表2。原花青素類成分可能通過促進葡萄糖吸收,減輕高糖毒性;抑制脂質分解,減輕脂毒性;調節胰島素的合成和分泌;調節β細胞的增殖和凋亡等方面調控糖尿病。因此,原花青素類成分對2型糖尿病的防治具有較大優勢。
美國食品和藥品監督管理局(FDA)批準的第一個植物藥——綠茶中的提取物Veregen,此植物藥的主要成分為表沒食子兒茶素沒食子酸酯(EGCG)及其他兒茶素衍生物。原花青素類成分與EGCG在結構上有諸多相似之處,且毒副作用較小,這提示原花青素類成分在保健品及藥品方面具有潛在的價值。但是,目前原花青素類成分的研究仍存在一些問題,如:①原花青素具有多個酚羥基,導致其不穩定,容易被氧化成其他成分;②目前對于單體原花青素發揮降糖活性的機制研究尚不徹底;③如何改善原花青素多聚體生物利用度低的問題尚不明確。因此,原花青素類成分對于改善2型糖尿病的研究還有很長的一段路要走。
[參考文獻]
[1]American Diabetes Association Diagnosis and classification of diabetes mellitus [J]. Diabetes Care, 2013, 36(Suppl 1):S67.
[2]王艷梅,王根杰,張樹林,等. 臨床常用降糖藥物的不良反應及防治策略[J]. 中國醫院藥學雜志, 2015, 35(24):2233.endprint
[3]張小軍,夏春鏜,吳建銘原花青素的資源研究[J]. 中藥材, 2009, 32(7):1154.
[4]Gonzalezabuin N, Pinent M, Casanovamarti A, et al Procyanidins and their healthy protective effects against type 2 diabetes [J]. Curr Med Chem, 2015, 22(1):39.
[5]Bladé C, Arola L, Salvadó M J Hypolipidemic effects of proanthocyanidins and their underlying biochemical and molecular mechanisms[J]. Mol Nutr Food Res, 2010,54: 37.
[6]Yamashita Y, Okabe M, Natsume M, et al Prevention mechanisms of glucose intolerance and obesity by cacao liquor procyanidin extract in highfat dietfed C57BL/6 mice[J]. Arch Biochem Biophys, 2012, 527(2):95.
[7]Kurimoto Y, Shibayama Y, Inoue S, et al Black soybean seed coat extract ameliorates hyperglycemia and insulin sensitivity via the activation of AMPactivated protein kinase in diabetic mice [J]. J Agric Food Chem, 2013, 61(23):5558.
[8]Huang P L, Chi C W, Liu T Y Areca nut procyanidins ameliorate streptozocininduced hyperglycemia by regulating gluconeogenesis [J]. Food Chem Toxicol, 2013, 55(3):137.
[9]Montagut G, Onnockx S, Vaqué M, et al Oligomers of grapeseed procyanidin extract activate the insulin receptor and key targets of the insulin signaling pathway differently from insulin[J]. J Nutr Biochem, 2010, 21(6):476.
[10]Lee H H, Kim K J, Lee O H, et al Effect of pycnogenol on glucose transport in mature 3T3L1 adipocytes [J]. Phytother Res, 2010, 24(8):1242.
[11]Montagut G, Bladé C, Blay M, et al Effects of a grapeseed procyanidin extract (GSPE) on insulin resistance [J]. J Nutr Biochem, 2010, 21(10):961.
[12]Corderoherrera I, Martín M á, Goya L, et al Cocoa flavonoids attenuate high glucoseinduced insulin signalling blockade and modulate glucose uptake and production in human HepG2 cells [J]. Food Chem Toxicol, 2014, 64(2):10.
[13]Krssak M, Brehm A, Bernroider E, et al Alterations in postprandial hepatic glycogen metabolism in type 2 diabetes [J]. Diabetes, 2004, 53(12):3048.
[14]Youl C J, Jongsun P Contribution of natural inhibitors to the understanding of the PI3K/PDK1/PKB pathway in the insulinmediated intracellular signaling cascade [J]. Int J Mol Sci, 2008, 9(11):2217.
[15]Bowser S M, Moore W T, Mcmillan R P, et al Highmolecularweight cocoa procyanidins possess enhanced insulinenhancing and insulin mimetic activities in human primary skeletal muscle cells compared to smaller procyanidins [J]. J Nutr Biochem, 2017, 39:48.
[16]Pinent M, Bladé M C, Salvadó M J, et al Metabolic fate of glucose on 3T3L1 adipocytes treated with grape seedderived procyanidin extract (GSPE) Comparison with the effects of insulin[J]. J Agric Food Chem, 2005, 53(15):5932.endprint
[17]黃衛東,劉毅,辛超,等. Irisin對2型糖尿病小鼠血糖的影響及機制[J]. 心臟雜志, 2014(4):408.
[18]Li X, Sui Y, Wu Q, et al Attenuated mTOR signaling and enhanced glucose homeostasis by dietary supplementation with lotus seedpod oligomeric procyanidins in streptozotocin (STZ)induced diabetic mice[J]. J Agric Food Chem, 2017,65(19):3801.
[19]Ogura K, Ogura M, Shoji T, et al Oral administration of apple procyanidins ameliorates insulin resistance via suppression of proinflammatory cytokines expression in liver of diabetic ob/ob mice[J]. J Agric Food Chem, 2016, 64(46):8857.
[20]Zhang H J, Ji B P, Chen G, et al A combination of grape seedderived procyanidins and gypenosides alleviates insulin resistance in mice and HepG2 cells [J]. J Food Sci, 2009, 74(1):H1.
[21]Sundaram R, Naresh R, Shanthi P, et al Modulatory effect of green tea extract on hepatic key enzymes of glucose metabolism in streptozotocin and high fat diet induced diabetic rats [J]. Phytomedicine, 2013, 20(7):577.
[22]FernandezLarrea J, Montagut G, Bladé M C, et al GSPE has the same effects as insulin on the mRNA levels of the main genes of glucose disposal in the liver of STZdiabetic animals [J]. Diab Vasc Dis Res, 2007(1): S186.
[23]Gandhi G R, Ignacimuthu S, Paulraj M G Solanum torvum Swartz fruit containing phenolic compounds shows antidiabetic and antioxidant effects in streptozotocin induced diabetic rats [J]. Food Chem Toxicol, 2011, 49(11):2725.
[24]Lenzen S A fresh view of glycolysis and glucokinase regulation: history and current status [J]. J Biol Chem, 2014, 289(18):12189.
[25]Arden C, Petrie J L, Tudhope S J, et al Elevated glucose represses liver glucokinase and induces its regulatory protein to safeguard hepatic phosphate homeostasis [J]. Diabetes, 2011, 60(12):3110.
[26]CastellAuví A, Cedó L, Pallarès V, et al Procyanidins modify insulinemia by affecting insulin production and degradation [J]. J Nutr Biochem, 2012, 23(12):1565.
[27]Cedó L, CastellAuví A, Pallarès V, et al Pancreatic islet proteome profile in Zucker fatty rats chronically treated with a grape seed procyanidin extract [J]. Food Chem, 2012, 135(3):1948.
[28]Chen L, Sun P, Wang T, et alDiverse mechanisms of antidiabetic effects of the different procyanidin oligomer types of two different cinnamon species on db/db mice [J]. J Agric Food Chem, 2012, 60(36):9144.
[29]Sun P, Wang T, Chen L, et al Trimer procyanidin oligomers contribute to the protective effects of cinnamon extracts on pancreatic βcells in vitro [J]. Acta Pharm Sin, 2016, 37(8):1083.endprint
[30]Wang T, Sun P, Chen L, et al Cinnamtannin D1 protects pancreatic βcells from palmitic acidinduced apoptosis by attenuating oxidative stress [J]. J Agric Food Chem, 2014, 62(22):5038.
[31]Castellauví A, Cedó L, Pallarès V, et al Grape seed procyanidins improve βcell functionality under lipotoxic conditions due to their lipidlowering effect [J]. J Nutr Biochem, 2013, 24(6):948.
[32]Hutton J C Insulin secretory granule biogenesis and the proinsulinprocessing endopeptidases [J]. Diabetologia, 1994, 37(2):S48.
[33]CastellAuví A, Cedó L, Movassat J, et al Procyanidins modulate microRNA expression in pancreatic islets [J]. J Nutr Biochem, 2013, 61(2):355.
[34]Zunino S Type 2 diabetes and glycemic response to grapes or grape products [J]. J Nutr, 2009, 139(9):1794S.
[35]Mantena S K, Baliga M S, Katiyar S K Grape seed proanthocyanidins induce apoptosis and inhibit metastasis of highly metastatic breast carcinoma cells [J]. Carcinogenesis, 2006, 27(8):1682.
[36]Ding Y, Zhang Z, Dai X, et al Grape seed proanthocyanidins ameliorate pancreatic betacell dysfunction and death in lowdose streptozotocinand highcarbohydrate/highfat dietinduced diabetic rats partially by regulating endoplasmic reticulum stress [J]. Nutr Metab, 2013, 10(1):51.
[37]Yin W, Li B, Li X, et al Antiinflammatory effects of grape seed procyanidin B2 on a diabetic pancreas [J]. Food Funct, 2015, 6(9):3065.
[38]Ley R E, Peterson D A, Gordon A J I Ecological and evolutionary forces shaping microbial diversity in the human intestine [J]. Cell, 2006, 124(4):837.
[39]宋雪琳,李雅梅,肖俊松,等. 葡萄籽原花青素對營養肥胖模型大鼠腸道菌群的影響[J]. 食品科學技術學報, 2015, 33(5):39.
[40]傅穎,梅松,劉冬英,等. 原花青素經腸道微生態途徑對脂質代謝的調節[J]. 中國生物制品學雜志, 2013, 26(2):225.
[41]Parkar S G, Trower T M, Stevenson D E Fecal microbial metabolism of polyphenols and its effects on human gut microbiota [J]. Anaerobe, 2013, 23:12.
[42]Lee H C, Jenner A M, Low C S, et al Effect of tea phenolics and their aromatic fecal bacterial metabolites on intestinal microbiota [J]. Res Microbiol, 2006, 157(9):876.
[43]Parkar S G, Stevenson D E, Skinner M A The potential influence of fruit polyphenols on colonic microflora and human gut health [J]. Int J Food Microbiol, 2008, 124(3):295.
[44]龔凌霄,曹文燕,王靜,等. 全谷物調節代謝性疾病機制研究的新視角——腸道微生物[J]. 食品工業科技, 2017, 38(2):364.
[45]Donath M Y, Bnischnetzler M, Ellingsgaard H, et al Islet inflammation impairs the pancreatic betacell in type 2 diabetes [J]. Physiology, 2009, 24(6):325.endprint
[46]Amar J, Serino M, Lange C, et al Involvement of tissue bacteria in the onset of diabetes in humans: evidence for a concept [J]. Diabetologia, 2011, 54(12):3055.
[47]肖俊松,王瑩,宋雪琳,等. 原花青素對營養肥胖模型大鼠氧化應激的影響[J]. 食品科學, 2014, 35(3):183.
[48]Gonzálezabuín N, Martínezmicaelo N, Blay M, et al Grape seedderived procyanidins decrease dipeptidylpeptidase 4 activity and expression [J]. J Agric Food Chem, 2012, 60(36):9055.
[49]Strat K M, Smithson A T, Tessem J S, et al Mechanisms by which cocoa flavanols improve metabolic syndrome and related disorders [J]. J Nutr Biochem, 2016, 35:1.
[50]鄭玲,劉秋爽,金晶,等. 糖尿病并發癥治療靶點的研究進展[J]. 海峽藥學, 2014, 26(1):13.
[51]Quesada H, Bas J M D, Pajuelo D, et al Grape seed proanthocyanidins correct dyslipidemia associated with a highfat diet in rats and repress genes controlling lipogenesis and VLDL assembling in liver [J]. Int J Obes, 2009, 33(9):1007.
[52]Serra A Procyanidins target mesenteric adipose tissue in Wistar lean rats and subcutaneous adipose tissue in Zucker obese rat [J].Food Chem, 2013, 141(1):160.
[53]Lee Y A, Cho E J, Yokozawa T Effects of proanthocyanidin preparations on hyperlipidemia and other biomarkers in mouse model of type 2 diabetes [J]. J Agric Food Chem, 2008, 56(17):7781.
[54]Shimada T, Tokuhara D, Tsubata M, et al Flavangenol (pine bark extract) and its major component procyanidin B1 enhance fatty acid oxidation in fatloaded models [J]. Eur J Pharmacol, 2012, 677(677):147.
[55]Baselgaescudero L, Bladé C, Ribaslatre A, et al Grape seed proanthocyanidins repress the hepatic lipid regulators miR33 and miR122 in rats [J]. Mol Nutr Food Res, 2012, 56(11):1636.
[56]杜春陽,姚芳,任韞卓,等. 葡萄籽原花青素對db/db小鼠腎組織脂質沉積的影響[J]. 中國細胞生物學學報, 2017, 39(3):288.
[57]Zhang J, Huang Y Z, Shao H Y, et al Grape seed procyanidin B2 inhibits adipogenesis of 3T3L1 cells by targeting peroxisome proliferatoractivated receptorγ with miR4835p involved mechanism [J]. Biomed Pharmacother, 2017, 86:292.
[58]Caimari A, Bas J M D, Crescenti A, et al Low doses of grape seed procyanidins reduce adiposity and improve the plasma lipid profile in hamsters [J]. Int J Obes, 2013, 37(4):576.
[59]Pinent M, Bladé M C, Salvadó M J, et al Grapeseed derived procyanidins interfere with adipogenesis of 3T3L1 cells at the onset of differentiation [J]. Int J Obes, 2005, 29(8):934.
[60]Caimari A, Crescenti A, Puiggròs F, et al The intake of a highfat diet and grape seed procyanidins induces gene expression changes in peripheral blood mononuclear cells of hamsters: capturing alterations in lipid and cholesterol metabolisms [J]. Genes Nutr, 2015, 10(1):438.endprint
[61]Kolb H, MandrupPoulsen T An immune origin of type 2 diabetes[J]. Diabetologia, 2005, 48(6):1038.
[62]Houstis N, Rosen E D, Lander E S Reactive oxygen species have a causal role in multiple forms of insulin resistance [J]. Nature, 2006, 440(7086):944.
[63]Pajuelo D, Fernándeziglesias A, Díaz S, et al Improvement of mitochondrial function in muscle of genetically obese rats after chronic supplementation with proanthocyanidins [J]. J Agric Food Chem, 2011, 59(15):8491.
[64]Castrillejo V M, Romero M M, Esteve M, et al Antioxidant effects of a grapeseed procyanidin extract and oleoylestrone in obese Zucker rats [J]. Nutrition, 2011, 27(11/12):1172.
[65]Yokozawa T, Kim H J, Cho E J Gravinol ameliorates highfructoseinduced metabolic syndrome through regulation of lipid metabolism and proinflammatory state in rats [J]. J Agric Food Chem, 2008, 56(13):5026.
[66]Terra X, Montagut G, Bustos M, et al Grapeseed procyanidins prevent lowgrade inflammation by modulating cytokine expression in rats fed a highfat diet [J]. J Nutr Biochem, 2009, 20(3):210.
[67]Kanamoto Y, Yamashita Y, Nanba F, et al A black soybean seed coat extract prevents obesity and glucose intolerance by upregulating uncoupling proteins and downregulating inflammatory cytokines in highfat dietfed mice [J]. J Agric Food Chem, 2011, 59(16):8985.
[68]Chacón M R, CeperueloMallafré V, MaymóMasip E, et al Grapeseed procyanidins modulate inflammation on human differentiated adipocytes in vitro [J]. Cytokine, 2009, 47(2):137.
[69]Terra X, Pallarés V, Ardèvol A, et al Modulatory effect of grapeseed procyanidins on local and systemic inflammation in dietinduced obesity rats [J]. J Nutr Biochem, 2011, 22(4):380.
[70]Li R, Liang T, Xu L, et al Protective effect of cinnamon polyphenols against STZdiabetic mice fed highsugar, highfat diet and its underlying mechanism [J]. Food Chem Toxicol, 2013, 51(1):419.
[71]趙艷威,孫靜,李玲,等. 黑豆皮花青素對2型糖尿病大鼠氧化應激信號傳導通路DAGPKC的影響[J]. 中藥藥理與臨床, 2012(6):27
[責任編輯張寧寧]endprint

