透明質酸、TGF-β1對下頜骨髁突軟骨增殖分化的影響
藺棟鵬 呂瑾茹 趙天一 王永功 彭利偉 馬秦
透明質酸、TGF-β1對下頜骨髁突軟骨增殖分化的影響
藺棟鵬 呂瑾茹 趙天一 王永功 彭利偉 馬秦
目的研究透明質酸(HA)、TGF-β1因子對下頜骨髁突軟骨增殖分化的影響。方法取新生小鼠的下頜骨髁突軟骨體外進行組織培養,按培養液內添加因子不同分為對照組、HA(0.5 mg/ml)、TGF-β1(5 ng/ml)組,于培養1、2、4、6、8 周后進行形態學觀察、軟骨面積測量、茜素紅染色以及堿性磷酸酶染色研究。結果對照組中髁突軟骨在培養4 周后軟骨內開始出現高密度光阻射區,茜素紅染色、堿性磷酸酶染色提示軟骨基質出現了鈣化、軟骨內成骨的過程;HA組中髁突軟骨內未出現高密度光阻射區,而髁突軟骨面積卻顯著增大(P<0.05);TGF-β1組中髁突軟骨在培養2 周后提前出現了高密度光阻射區,然軟骨面積無顯著改變(P>0.05)。結論在體外培養下,HA可以促進髁突軟骨的增殖,對軟骨細胞的肥大分化有一定的抑制作用,TGF- β1 在早期可顯著促進髁突軟骨細胞的肥大分化。
下頜骨髁突軟骨; 組織培養; 體外; 透明質酸; TGF- β1; 增殖分化
顳下頜關節骨關節炎(TMJ OA)是發生于成人顳頜關節區的骨關節炎,其顯著特征是髁突軟骨基質進行性降解,并引起一系列臨床癥狀,給患者的生活質量造成很大的影響。研究顯示[1],OA的病理改變類似于軟骨內成骨過程中軟骨細胞的肥大分化過程。透明質酸(HA)是一種高分子量的粘多糖,構成了關節軟骨與滑液的主要成分,關節腔內注射HA不僅被廣泛應用于治療OA引起的疼痛[2],而且還能夠延緩OA的進程[3]。轉化生長因子(TGF-β)在軟骨細胞的增殖分化中起重要作用,TGF-β1屬于TGF-β超家族中的一個亞型,實驗證明TGF-β1不僅可以抑制軟骨細胞的肥大分化,而且能維持未分化的軟骨細胞表型[4]。本人在前期實驗已成功建立了髁突軟骨在體外培養下軟骨細胞發生肥大分化,自發基質鈣化的模型。本次研究使用前期的實驗模型,探討HA、TGF-β1對髁突軟骨細胞增殖分化的影響,為臨床上研究髁突軟骨細胞增殖分化異常導致的疾病提供一定的依據。
1 材料與方法
1.1 材料
1.1.1 實驗動物 選用新生3 d的昆明小鼠子鼠,平均體重為2.1 g,由第四軍醫大學動物實驗中心提供,實驗由大學倫理委員會批準實施。
1.1.2 主要試劑 IMDM培養液(Hyclone,美國),100 μg/ml青鏈霉素(Solarbio,北京), β-甘油磷酸鹽、蘇木精伊紅染液、0.05%茜素紅染色液、0.01% light green solution(Sigma,美國),4%多聚甲醛固定液、堿性磷酸酶染色液試劑盒(Leagene,北京),PBS(實驗室提供),梯度酒精等。
1.1.3 主要設備 超凈工作臺、生物組織包埋機、展烤片機(愛華,天津),石蠟切片機(Leica,德國),電熱恒溫干燥箱(東星,上海),培養箱,體視顯微鏡、倒置顯微鏡 (Olypus,日本),12孔板,顯微外科手術器械等。
1.2 方法
1.2.1 分組取材 采用新生3 d的昆明小鼠子鼠30 只,在超凈工作臺內,斷頸處死后得到60 支髁突組織,按培養液內添加因子不同分為3 組(對照組、TGF-β1組,HA組),每個實驗組按照不同時間點(1、2、4、6、8 周)進行實驗研究。其中,髁突組織被切長度約2 mm,要求包含全部髁突軟骨和部分骨組織。
1.2.2 體外組織培養 將取好的軟骨組織先用無菌PBS液沖洗10 min后,再用配置好的IMDM培養液(含100 μg/ml青鏈霉素,β-甘油磷酸鹽5 mmol/L)沖洗2 次,每次5 min。隨后將髁突軟骨組織放入12 孔板內,每孔含IMDM培養液1 ml。最后將培養板放入37 ℃,含CO2濃度為5%的恒溫箱內,培養液每周更換3 次。其中HA組中培養液采用的濃度是0.5 mg/ml[5],TGF-β1組中培養液采用的濃度是5 ng/ml[6]。
1.2.3 形態學觀察與軟骨面積測量 分別于5 個時間點(1、2、4、6、8 周)對軟骨組織進行形態學觀察與軟骨面積測量,具體方法:采用倒置顯微鏡觀察,每次使用相同的倍數(×40)、標尺及其它光學參數,保持軟骨組織在同一水平面,拍攝照片后將其導入Cellsens 1.7顯微圖像軟件,在軟件中利用多邊形測量工具測量軟骨的面積 (S,μm2),每個時間點測量6 張圖片,每張圖片測量5 次,并記錄數值。軟骨面積具體測量見圖 1。
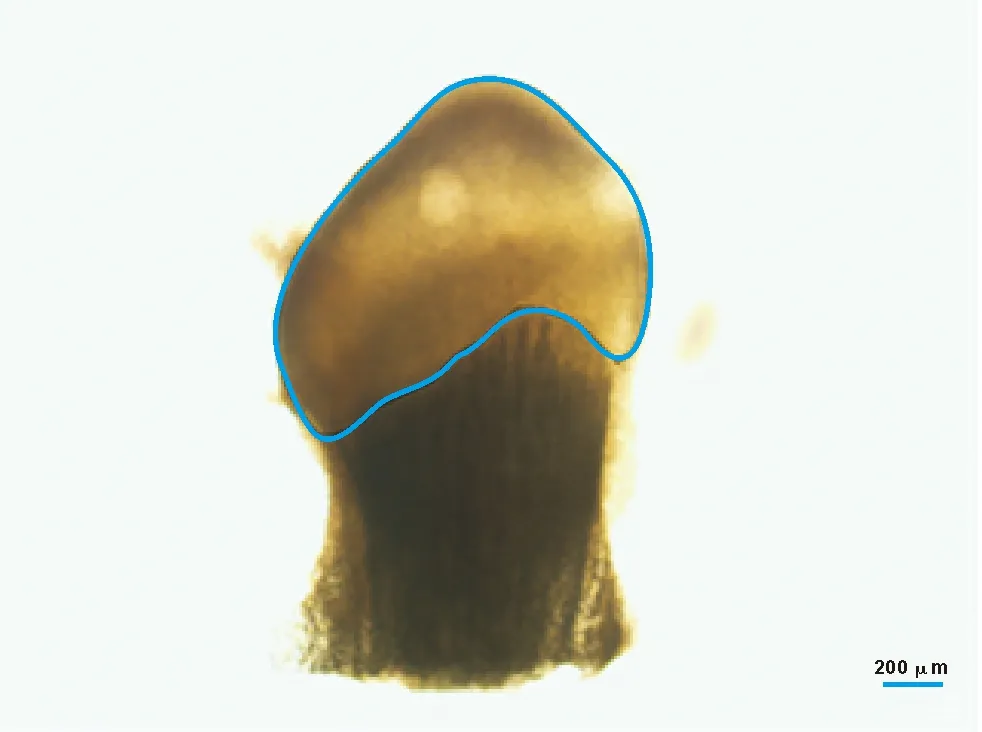
圖 1 髁突軟骨面積測量
1.2.4 茜素紅染色 石蠟切片常規脫蠟、水化、漂洗后,切片入0.05%茜素紅染液30 min,漂洗2 min后,再入0.01%Light green solution 5 min,最后脫水、二甲苯透明、中性樹膠封片、干燥。
1.2.5 堿性磷酸酶染色 石蠟切片常規脫蠟、水化、漂洗后,切片入ALP孵育液,37 ℃孵育2~12 h。蒸餾水漂洗5 min后,切片入硝酸鈷溶液,37 ℃孵育5 min。蒸餾水漂洗5 min后,切片入ALP硫化工作液,37 ℃孵育2 min。最后蒸餾水漂洗,蘇木精復染細胞核1 min,二甲苯脫水,透明,中性樹膠封片、干燥。
1.3 統計學分析
本實驗軟骨面積測量數據比較采用單因素方差分析。統計學顯著差異為P<0.05。
2 結 果
2.1 形態學觀察與軟骨面積測量
通過倒置顯微鏡觀察,可以看到各培養組在體外培養下,軟骨組織沒有發生崩解壞死現象。空白培養組中髁突軟骨在培養4 周后,髁突軟骨后緣與骨交界處出現了高密度光阻射區,培養6 周結束,高密度光阻射區延伸至對側軟骨,培養8 周后高密度光阻射區幾乎占據整個軟骨區域(圖 2)。TGF-β1 組在培養2 周后,高密度光阻射區提前發生,培養4 周后,軟骨內高密度光阻射區延伸至對側軟骨,培養6 周、8 周結束,高密度光阻射區同樣幾乎占據整個軟骨區。HA組髁突軟骨自培養初至培養8 周結束,軟骨內均未觀察到高密度光阻射區。隨著培養時間推進,HA組中髁突軟骨面積呈上升趨勢;而對照組與TGF-β1組,髁突軟骨面積無明顯變化。HA對髁突軟骨的增殖具有顯著促進作用(P<0.05),而 TGF-β1對于髁突軟骨的增殖無顯著作用(P>0.05)(圖 3)。
圖 2 形態學觀察結果(×40)
Fig 2 Morphological observation(×40)
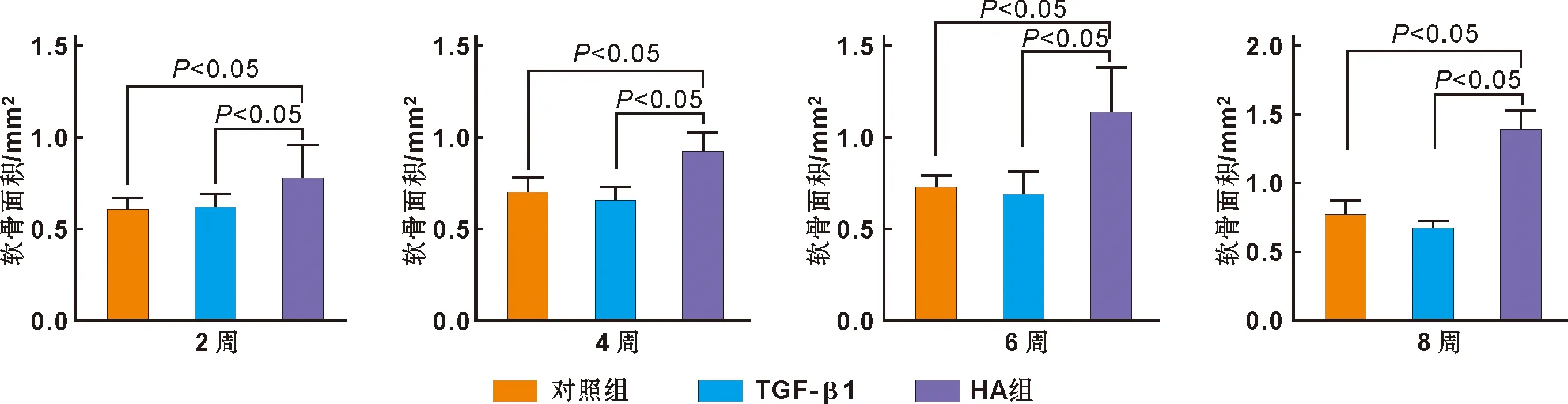
圖 3 髁突軟骨面積直方圖
2.2 茜素紅染色
對照組中髁突軟骨在培養4周后胞外基質(ECM)發生了鈣化,而TGF-β1組中髁突軟骨培養2 周后,ECM鈣化提前發生,培養4 周后,ECM鈣化幾乎占據了大部分軟骨層。而HA組中髁突軟骨內尚未發現ECM鈣化(圖 4)。
2.3 堿性磷酸酶染色
對照組與TGF-β1組中髁突軟骨培養4周后,堿性磷酸酶活性不僅表達于鈣化軟骨層及骨組織,而且表達于發生肥大分化的軟骨細胞及胞外基質。培養8 周結束,堿性磷酸酶表達更為明顯。堿性磷酸酶活性的增強提示軟骨細胞發生的肥大分化,其實質是正在經歷軟骨內成骨的一個過程。而HA組中髁突軟骨除肥大層及骨組織表達陽性外,其余軟骨層未見明顯表達(圖 5)。
3 討 論
3.1 骨關節炎與軟骨細胞肥大分化
髁突軟骨屬于繼發性軟骨,其生長特性與長骨生長板軟骨不同,主要由纖維軟骨構成,易受到局部因素的影響[7]。本實驗中髁突軟骨在體外培養條件下,發生的軟骨細胞肥大分化,自發基質鈣化的現象,主要由髁突軟骨的生長特性決定的。髁突軟骨細胞的肥大分化過程主要存在于軟骨內成骨(EO)的過程中,髁突軟骨增殖層中含有未分化的間充質細胞,該細胞具有多向分化的潛能,在基因的調控下細胞開始聚集增殖分化為軟骨細胞,隨后軟骨細胞停止增殖發生肥大化[8],最終肥大分化的細胞被成骨細胞所代替,并表達自身特有的標記物ALP、X型膠原。骨關節炎是一種以ECM降解為特征的退行性疾病,正常的關節軟骨細胞在生理環境下,通過適度的代謝活性,以維持ECM的組成。而在病理環境下,一些關節軟骨細胞失去了分化表型,軟骨細胞進入了一個類似于EO的增殖過程和肥大分化過程[9],并伴隨著肥大分化階段顯著的標記物表達,如ALP[10],X型膠原等。因此本實驗在體外培養下髁突軟骨細胞發生肥大分化,基質鈣化的模型可以作為體外骨關節炎模型來研究。
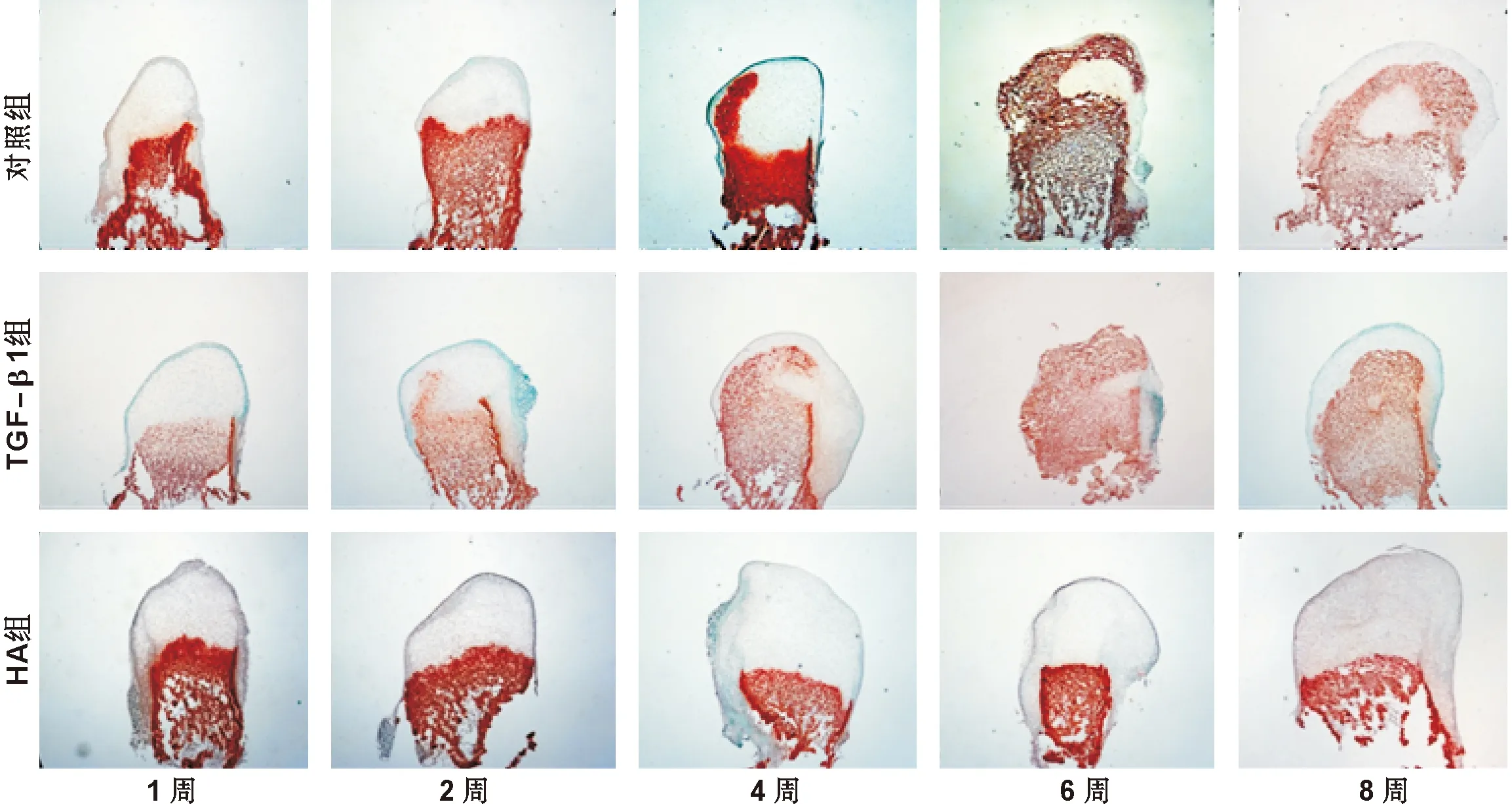
圖 4 茜素紅染色(×40)
Fig 4 Alizarin red staining(×40)
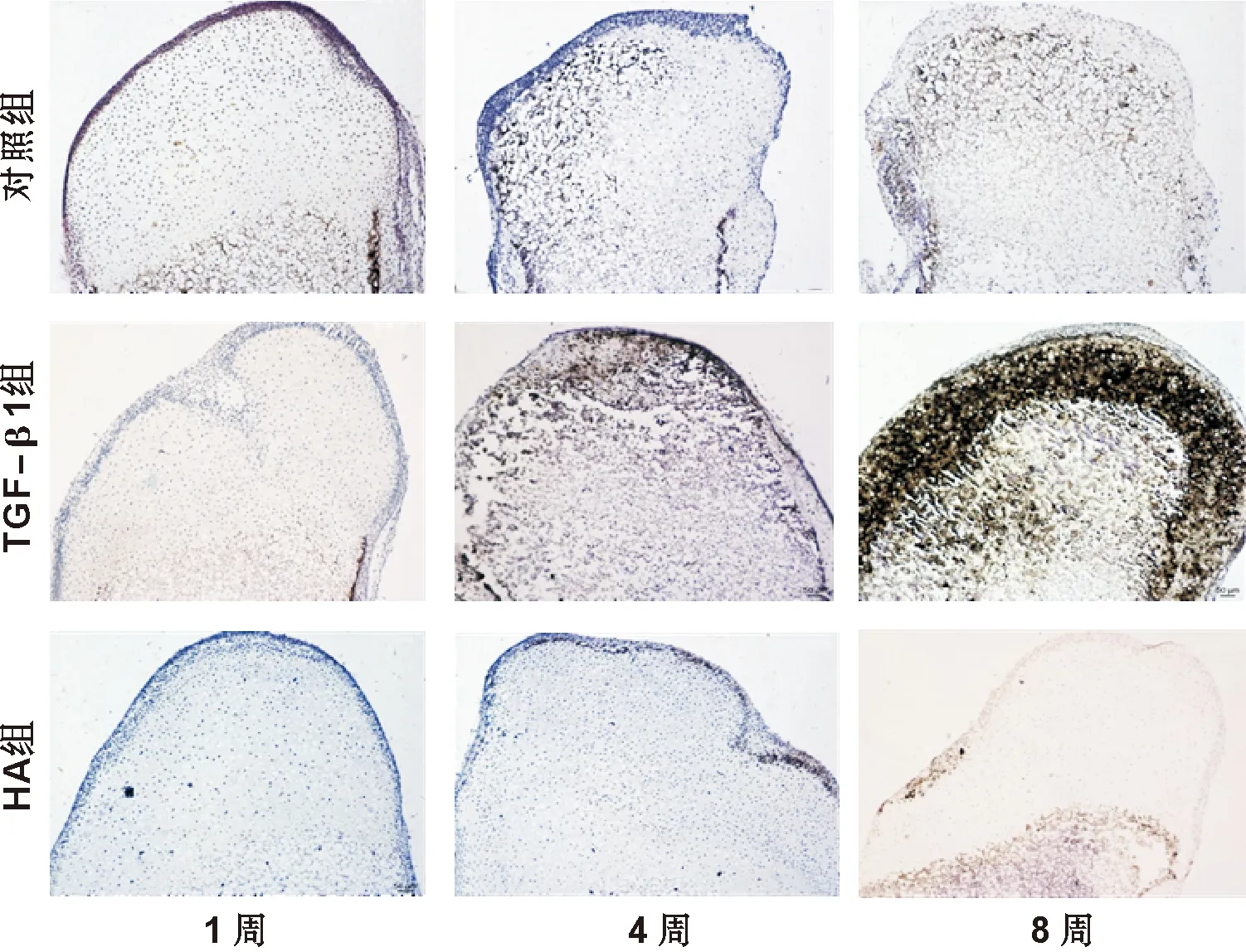
圖 5 堿性磷酸酶染色(×100)
Fig 5 Alkaline phosphatase staining(×100)
3.2 TGF-β1早期促進髁突軟骨細胞肥大分化
本實驗添加TGF-β1的培養組中,早期培養2 周后髁突軟骨細胞開始發生肥大分化,形態學觀察看到了明顯的高密度光阻射區,茜素紅染色證實ECM發生了鈣化,堿性磷酸酶染色表明軟骨細胞正經歷著軟骨內成骨的過程,然而軟骨面積與對照組相比無明顯差異。這表明TGF-β1早期促進了髁突軟骨細胞的肥大分化,但對軟骨細胞的增殖并無顯著影響。Delatte[11]在體外培養髁突軟骨發現,培養液內添加TGF-β1可以顯著增加髁突軟骨中GAG、膠原的含量,但TGF-β1對髁突軟骨細胞的增殖并無明顯影響。這與本實驗結論有相似之處。Livne[12]在體外組織培養中研究發現TGF-β1能夠明顯促進TMJ OA鼠的下頜骨髁突軟骨細胞的基質合成,還可誘導增強堿性磷酸酶的代謝活性。本實驗中TGF-β1組髁突軟骨培養2 周后,ALP的活性增強與其結論一致。另外,TGF-β1對于髁突軟骨細胞增殖分化的影響,除受自身生物學特性影響外,還可能與TGF-β1的濃度、培養時間、培養環境等因素有關。
3.3 HA抑制髁突軟骨細胞肥大分化,促進軟骨增殖
HA由B型滑膜細胞分泌,具有潤滑、營養和保護關節軟骨結構的功能。本實驗添加HA的培養組中,形態學觀察髁突軟骨內始終未出現高密度光阻射區,茜素紅染色也未發現ECM鈣化現象,堿性磷酸酶染色表達陰性證實了髁突軟骨細胞并未發生肥大分化。而髁突軟骨面積直方圖明顯看到HA對髁突軟骨的增殖作用顯著。因此可以認為,在體外環境下,HA 對于髁突軟骨細胞的肥大分化存在一定的抑制作用,但能顯著地促進了軟骨的增殖。HA目前被越來越多運用于臨床治療OA引起的關節疼痛,實驗研究表明HA能夠延緩OA的進程。趙天一[13]利用本實驗的研究模型證實了HA可以抑制下頜骨髁突軟骨鈣化,并對其發生的可能機制進行了闡述;這與本實驗研究發現一致。Christopher[14]在研究關節軟骨細胞的特性實驗中發現,培養系統中加入HA后,對于軟骨細胞基質的產生和軟骨細胞的增殖活性有明顯的促進作用。而外源性的HA治療OA的生理效應很大程度還取決于HA的分子質量,高分子質量的HA 關節腔內注射較低分子質量HA對于OA引起的疼痛更為有效[15]。本實驗中HA抑制了軟骨細胞的肥大分化,從臨床角度看在一定程度上緩解了OA的病理過程,但對其確切的機制還需進一步研究。
綜上所述,本實驗在前期實驗的基礎上,進一步探討了TGF-β1、HA對于髁突軟骨增殖分化的影響。TGF-β1早期對軟骨細胞肥大分化的促進作用,HA促進髁突軟骨增殖,抑制軟骨細胞肥大分化的結果將對后期更深入的研究與其相關的臨床疾病提供了可靠的依據。
[1] Dreier R. Hypertrophic differentiation of chondrocytes in osteoarthritis: The developmental aspect of degenerative joint disorders[J]. Arthritis Res Ther, 2010, 12(5): 216.
[2] Recommendations for the medical management of osteoarthritis of the hip and knee: 2000 update. American College of Rheumatology Subcommittee on Osteoarthritis Guidelines[J]. Arthritis Rheum, 2000, 43(9): 1905-1915.
[3] Zhu T, Park HC, Son KM, et al. Effects of dimethyloxalylglycine on wound healing of palatal mucosa in a rat model[J]. BMC Oral Health, 2015, 15: 60.
[4] Yang X, Chen L, Xu X, et al. TGF-beta/Smad3 signals repress chondrocyte hypertrophic differentiation and are required for maintaining articular cartilage[J]. J Cell Biol, 2001, 153(1): 35-46.
[5] Brun P, Panfilo S, Daga Gordini D, et al. The effect of hyaluronan on CD44-mediated survival of normal and hydroxyl radical-damaged chondrocytes[J]. Osteoarthritis Cartilage, 2003, 11(3): 208-216.
[6] 寧旭, 尹培榮, 尚顯文. TGF-β1與IGF-Ⅰ對體外培養兔軟骨細胞增殖的影響[J]. 貴陽醫學院學報, 2005, 30(1): 26-29.
[7] 李松. 下頜髁狀突軟骨與生長板軟骨生長發育的比較研究[J]. 昆明醫科大學學報, 2014, 35(2): 1-4.
[8] Kronenberg HM. Developmental regulation of the growth plate[J]. Nature, 2003, 423(6937): 332-336.
[9] Tallheden T, Bengtsson C, Brantsing C, et al. Proliferation and differentiation potential of chondrocytes from osteoarthritic patients[J]. Arthritis Res Ther, 2005, 7(3): R560-R568.
[10]Pfander D, Swoboda B, Kirsch T. Expression of early and late differentiation markers (proliferating cell nuclear antigen, syndecan-3, annexin VI, and alkaline phosphatase) by human osteoarthritic chondrocytes[J]. Am J Pathol, 2001, 159(5): 1777-1783.
[11]Delatte ML, Von den Hoff JW, Nottet SJ, et al. Growth regulation of the rat mandibular condyle and femoral head by transforming growth factor-beta1, fibroblast growth factor-2 and insulin-like growth factor-I[J]. Eur J Orthod, 2005, 27(1): 17-26.
[12]Livne E, Laufer D, Blumenfeld I. Osteoarthritis in the temporo-mandibular joint (TMJ) of aged mice and the in vitro effect of TGF-beta 1 on cell proliferation, matrix synthesis, and alkaline phosphatase activity[J]. Microsc Res Tech, 1997, 37(4): 314-323.
[13]趙天一, 藺棟鵬, 田海鎖, 等. 透明質酸抑制下頜骨髁突軟骨鈣化的實驗研究[J]. 實用口腔醫學雜志, 2016, 32(2): 167-172.
[14]Little CJ, Kulyk WM, Chen X. The effect of chondroitin sulphate and hyaluronic acid on chondrocytes cultured within a fibrin-alginate hydrogel[J]. J Funct Biomater, 2014, 5(3): 197-210.
[15]Shetty V, Mohan A. A prospective, randomized, double-blind, placebo-controlled clinical trial comparing the efficacy of systemic enzyme therapy for edema control in orthognathic surgery using ultrasound scan to measure facial swelling[J]. J Oral Maxillofac Surg, 2013, 71(7): 1261-1267.
TheeffectsofhyaluronicacidandTGF-β1onthegrowthofmandibularcondylarcartilageandthehyperthophicdifferentiationofthecondylarchondrocyts
LINDongpeng1,LVJinru2,ZHAOTianyi3,WANGYonggong1,PENGLiwei1,MAQin4.
1. 450000Zhengzhou,DepartmentofStomatology,HenanProcincialPeople'sHospital,China; 2.DepartmentofStomatology,ZhengzhouPeople'sHospital; 3.DepartmentofStomatology,SuzhouDentalHospital,China; 4.StateKeyLaboratoryofMilitaryStomatology&NationalClinicalResearchCenterforOralDiseases&ShaanxiClinicalResearchCenterforOralDiseases,DepartmentofOralandMaxillofacialSurgery,SchoolofStomatology,TheFourthMilitaryMedicalUniversity,Xi'an
Objective: To study the effects of hyaluronic acid(HA) and TGF-β1 on the growth of mandibular condylar cartilage and the hyperthophic differentiation of the condylar chondrocyts.Methods60 condyle samples from newborn mice wereinvitrocultured and treated with HA(0.5 mg/ml), TGF- beta 1(5 ng/ml) and without additional agent(the control) respectively. The Morphological observation,Alizarin Red Staining, Alkaline phosphatase staining and condylar cartilage surface area measurement were conducted after 1, 2, 4, 6 and 8 weeks of culture respectively.ResultsHigh-density photoresist area was observed in the condylar cartilage of the control group after 4 weeks of culture. Alizarin Red Staining and Alkaline phosphatase staining showed condylar cartilage matrix production and calcification.The HA group showed no high-density photoresist area at all time points, however, the cartilage area was significantly increased(P<0.05); the TGF-beta 1 group showed high-density photoresist area after 2 weeks of culture. but the cartilage area were not significantly changed(P>0.05).ConclusionHA can promote the growth of condylar cartilageinvitro, but have an inhibitory effect on chondrocyte differentiation. TGF-β1 plays a role in mandibular condylar chondrocyte hypertrophic differentiation in the early days ofinvitroculture.
Mandibularcondylarcartilage;Tissueculture;Invitro;Hyaluronicacid(HA);TGF-β1;Hyperplasia
十二五軍隊重點課題(編號: BWS11J046)
450000 鄭州, 河南省人民醫院口腔頜面外科(藺棟鵬 彭利偉 王永功); 鄭州人民醫院口腔科(呂瑾茹); 蘇州口腔醫院(趙天一); 軍事口腔醫學國家重點實驗室, 口腔疾病國家臨床醫學研究中心, 陜西省口腔疾病臨床醫學研究中心, 第四軍醫大學口腔醫院頜面外科(馬秦)
馬秦 E-mail: qinma@fmmu.edu.cn
R782.6
A
10.3969/j.issn.1001-3733.2017.05.003
(收稿: 2017-03-28 修回: 2017-03-30)

