缺血性腦卒中患者外周血血管內皮祖細胞水平變化及意義
李友梅,馮曉麗,陳淑華,馬艷婷,陳紅艷
(上海市楊浦區中心醫院,上海200090)
缺血性腦卒中患者外周血血管內皮祖細胞水平變化及意義
李友梅,馮曉麗,陳淑華,馬艷婷,陳紅艷
(上海市楊浦區中心醫院,上海200090)
目的探討缺血性腦卒中患者外周血血管內皮祖細胞(EPCs)水平的變化及意義。方法選擇缺血性腦卒中患者63例作為健康觀察組、體檢健康者20例作為健康對照組。分別于患者發病第1、7、14、21天用流式細胞術檢測外周血EPCs比例,用酶聯免疫吸附法檢測血清血管內皮生長因子(VEGF)、基質細胞衍生因子1(SDF-1)水平。結果發病第1、7、14天,觀察組外周血EPCs比例較健康對照組高(P均<0.05),發病第21天兩組外周血EPCs比例比較差異無統計學意義(P>0.05)。發病第1、7、14天,觀察組血清VEGF、SDF-1水平與對照組比較差異有統計學意義(P均<0.05),發病第21天兩組血清VEGF、SDF-1水平比較差異無統計學意義(P均>0.05)。結論缺血性腦卒中患者發病第1天外周血EPGs數量減少,隨后逐漸增多,至第21天恢復正常;EPGs數量變化可反映缺血性腦卒中患者病情發展。
缺血性腦卒中;血管內皮祖細胞;旁分泌功能
動脈粥樣硬化和血栓形成是缺血性腦卒中的主要病因[1]。缺血性腦卒中可引起栓塞部位末梢的腦血管內皮因缺氧發生壞死和脫落。近年研究顯示,存在于體循環中的血管內皮祖細胞(EPCs)可以分化為內皮細胞,修復受損傷的腦血管內皮[2]。在健康人外周血中EPCs數量很少并在小范圍內波動,當血管內皮完整性遭到破壞時,EPCs的數量會發生改變。當缺血缺氧引起腦血管內皮受損后,骨髓中的EPCs動員并釋放到外周血中。目前對缺血性腦卒中患者外周血EPCs數量變化報道不一[3~5]。本研究對缺血性腦卒中患者在發病后不同時間EPCs數量的變化進行觀察,并探討其臨床意義。
1 資料與方法
1.1 臨床資料 選擇2016年7月~2017年4月本院收治的缺血性腦卒中患者63例(觀察組),均符合腦梗死的診斷標準[6],經頭顱CT或MRI檢查確診。其中男41例、女22例,年齡(61.4±3.5)歲,發病至入院時間<24 h。入選標準:入院前均有不同程度的偏癱和意識障礙等神經系統受損癥狀,排除入院后行溶栓治療的患者。患者入院后給予阿托伐他汀、拜阿司匹林、血栓通進行治療;治療后參照《腦卒中患者臨床神經功能缺損程度評分標準》,神經功能缺損評分減少18%~45%者納入研究。同期選擇體檢健康者20例作為健康對照組,男13例、女7例,年齡(58.8±4.1)歲,無高血壓、糖尿病、心肌梗死和冠心病等病史。本研究經本院倫理委員會批準,患者知情同意。
1.2 外周血EPCs檢測 采用流式細胞術。分別于患者發病第1、7、14、21天取末梢血10 mL,加入等體積的Percoll分離液(購于美國GE公司),放入50 mL離心管,1 500 r/min離心20 min,吸取液面交界處的有核細胞,并將細胞轉移至15 mL離心管中,使用PBS稀釋后1 500 r/min離心5 min,棄上清液,再加入PBS 10 mL重復離心清洗1次。重懸細胞制備單細胞懸液并調整細胞為1×106個/mL,取細胞懸液200 μL,分別加入EPCs因子CD34-PE、VEGRF-2-APC流式抗體(購于美國BD公司)各5 μL,避光室溫孵育20 min后于流式細胞儀(美國BD公司)上檢測CD34和VEGRF-2的表達。采用Cell Quest軟件分析結果,計算CD34、VEGRF-2表達均為陽性的細胞(EPCs)占有核細胞的比例。
1.3 血清血管內皮生長因子(VEGF)、基質細胞衍生因子1(SDF-1)檢測 采用酶聯免疫吸附法。分別于患者發病第1、7、14、21天取末梢血1 mL,放入1.5 mL離心管中,3 000 r/min離心10 min。抽取血清5 μL加入495 μL的樣品稀釋液中,標準品取500 μL(不需要使用稀釋液)。取出反應板,在每一孔中加入稀釋后的血清10 μL,設置5個復孔,對照組中加入標準品原液10 μL,設置5個復孔。加樣結束后,每孔分別加入VEGF、SDF-1抗體100 μL,室溫下混勻,置于30 ℃的干燥箱內靜置30 min。取出后棄上清液,加入辣根過氧化物酶100 μL,避光保存10 min,加入終止液并用FACSCalibur 550酶標儀(美國Bio-Rad公司)測波長450 nm處檢查各孔的光密度值,通過實驗的標準品計算樣本濃度。
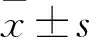
2 結果
2.1 兩組外周血EPCs水平比較 發病第1、7、14天觀察組外周血EPCs比例較健康對照組高(P均<0.05),發病第21天兩組外周血EPCs比例比較差異無統計學意義(P>0.05)。見表1。

表1 兩組外周血EPCs比例比較
2.2 兩組血清VEGF、SDF-1水平比較 發病第1、7、14天觀察組血清VEGF、SDF-1水平與對照組比較差異有統計學意義(P均<0.05),發病第21天兩組血清VEGF、SDF-1水平比較差異無統計學意義(P均>0.05)。見表2。

表2 兩組血清VEGF、SDF-1水平比較
注:與對照組同時點比較,*P<0.05。
3 討論
EPCs是一種具備分化潛能的前體細胞,在一定條件下可以分化為血管內皮細胞。在生理狀態下,EPCs存在于末梢血循環中的量很少,其主要參與維持更新或修補受損傷的血管內皮細胞,使機體內的血管生成維持在一定的動態平衡[7]。但在病理狀態下,EPCs可從骨髓動員到外周血中,歸巢至損傷的組織,參與血管的形成,并可分化為成熟的血管內皮細胞,參與缺血組織的修復[8]。多種心血管疾病(冠心病、急性心肌梗死、高血壓、高膽固醇血癥、缺血性腦卒中等)患者EPCs在外周血中的數量均發生變化[9]。研究顯示,缺血性腦卒中患者體內EPCs數量減少,且可將EPCs作為評價心血管風險的標志物之一[10];同時也有研究報道,缺血性腦卒中患者體內EPCs的數量增多,并認為EPCs數量與缺血性腦卒中患者的預后相關[11,12]。本研究中缺血性腦卒中患者發病第1天血清EPCs數量減少,但隨著病情轉歸EPCs數量逐漸升高并在發病第21天恢復正常。
EPCs還可通過旁分泌作用釋放各種細胞因子,包括VEGF、堿性成纖維細胞生長因子、粒細胞-巨噬細胞集落刺激因子、SDF-1和基質金屬蛋白酶9等。以上細胞因子對促進EPCs的骨髓動員起重要作用[13],可動員EPCs從骨髓進入外周血,還可以促進EPCs增殖、分化、趨化和歸巢。VEGF是目前已知的誘導EPCs向成熟的血管內皮細胞分化的最重要的細胞因子,促進EPCs的骨髓動員、成熟,在EPCs增殖、分化、趨化和歸巢中起至關重要的作用;SDF-1是一種趨化因子,對EPCs的趨化作用是其他細胞因子的10倍。血液中SDF-1水平升高有利于EPCs歸巢,誘發EPCs與受損內皮黏附和血小板聚集,并抑制EPCs凋亡,在診斷和治療心肌缺血性疾病中有重要意義。因此,本研究選取VEGF、SDF-1兩種因子進行分析。結果顯示缺血性腦卒中發生的第1天,患者血清VEGF、SDF-1水平降低。由于EPCs可直接分泌VEGF和SDF-1,因此EPCs數量減少后血清VEGF、SDF-1水平下降。隨著缺血性腦卒中患者病情康復,血清VEGF、SDF-1水平逐漸升高,到發病第21天恢復正常。
本研究未將藥物治療作為影響因素加以考慮。EPCs增殖主要受內皮損傷和腫瘤因素的影響,當機體內發生外源性的內皮損傷和血管生長旺盛需要有內皮細胞補充時,機體可通過骨髓動員的方式將EPCs動員到外周血中,而且數量極少。藥物對EPCs骨髓動員效果較差,目前用以治療缺血性腦卒中的藥物無動員EPCs的相關報道。
綜上所述,通過對發病不同時期缺血性腦卒中患者內體的EPCs水平的觀察,發現EPCs在發病初期出現明顯下降,此后EPCs比例隨患者康復逐漸升高并最終恢復正常。與此同時,VEGF和SDF-1在缺血性腦卒中患者體內的變化也證實了其變化趨勢與EPCs變化相同。可見,EPCs水平變化可反映缺血性腦卒中患者病情的變化。
[1] 張小雪,張京芬.國內急性期缺血性腦卒中的溶栓治療現狀分析[J].中華老年心腦血管病雜志,2015,17(2):222-224.
[2] 彭飛飛,黃巖.丁苯酞對急性缺血性腦卒中患者外周血EPCs的影響[J].實用藥物與臨床,2016,19(3):311-313.
[3] 任長虹,高明清,李寧,等.腦卒中生物標志物研究的重要性及研究現狀[J].軍事醫學,2012,36(2):150-153.
[4] 岳丹丹,吳丹紅.內皮祖細胞在缺血性腦卒中診治中的研究進展[J].醫學研究雜志,2015,44(11):173-175.
[5] 李歡歡,何旭,劉亢丁.內皮祖細胞與缺血性腦卒中[J].中國組織工程研究,2010,14(19):3569-3572.
[6] 許予明,譚頌,劉鳴,等.腦血管疾病診斷與治療臨床指南[J].內科急危重癥雜志, 2005,11(5):243-245.
[7] Dragoni S, Guerra G, Fiorio PA, et al. A functional transient receptor potential vanilloid 4 (TRPV4) channel is expressed in human endothelial progenitor cells[J]. J Cell Physiol, 2015,230(1):95-104.
[8] Wang H, Cai KY, Li W, et al. Sphingosine-1-phosphate induces the migration and angiogenesis of EPCs through the Akt signaling pathway via sphingosine-1-phosphate receptor 3/platelet-derived growth factor receptor-β[J]. Cell Mol Biollett, 2015,20(4):597-611.
[9] 徐家行,殷桂林.內皮祖細胞治療缺血性疾病的臨床應用進展[J].山東醫藥,2010,50(18):111-112.
[10] 朱江,劉煜敏.內皮祖細胞與缺血性腦血管病研究進展[J].中華老年醫學雜志,2010,29(5):436-438.
[11] 張道培,閆福嶺,朱奕昕,等.急性重癥腦卒中患者單核細胞免疫抑制與炎性標志物的相關性[J].中華神經醫學雜志,2008,7(10):1067-1070.
[12] 李剛,韓雄,徐軍,等.急性腦卒中的血液生化標志物診斷研究進展[J].中華醫學雜志,2013,93(7):554-557.
[13] Szmitko PE, Fedak PW, Weisel RD, et al. Endothelial progenitor cells: new hope for a broken heart[J]. Circulation, 2003,107(24):3093.
10.3969/j.issn.1002-266X.2017.37.023
R743.33
B
1002-266X(2017)37-0068-03
上海市楊浦區衛生與計劃生育委員會課題(201308)。
2017-05-31)

