中藥對神經干細胞增殖分化信號通路的綜合調控作用分析
汪宏錦 李晶晶 柯慧 徐曉玉
[摘要]尋找促進神經干細胞增殖與分化的有效方法是加速神經干細胞臨床應用的途徑之一。該文分析了近十年來中外文獻關于調控神經干細胞增殖分化的中藥及其作用靶點與信號通路的報道,發現中藥對神經干細胞增殖分化信號通路具有綜合調控作用。第一,中藥能通過Notch,PI3K/Akt,Wnt/βcatenin,GFs等信號通路影響神經干細胞的增殖與分化。①黃芪、淫羊藿、龜甲、遠志能通過調節Notch信號通路中的關鍵蛋白或基因Notch1,NICD和Hes的表達起調控作用;②人參、銀杏葉、丹參能通過介導PI3K/Akt信號通路發揮調控作用,但對該通路中上下游靶標的具體作用機制尚無研究;③姜黃、蛇床子可以上調Wnt/βcatenin信號通路中的關鍵靶蛋白Wnt3a及βcatenin的水平從而介導Wnt/βcatenin信號通路起調控作用;④三七、川芎可以通過促進分泌性生長因子EGF,bFGF等的表達發揮作用。 第二,一些中藥能通過多種途徑誘導神經干細胞的增殖或分化:黃芪中的黃芪甲苷可以通過Notch信號通路調控神經干細胞的增殖或分化,但黃芪多糖含藥血清又可以通過調節VEGF含量,活化PI3K/Akt信號通路發揮作用;淫羊藿中的淫羊藿苷和淫羊藿黃酮類可以分別介導Notch或GFs信號通路來控制神經干細胞的命運轉化;人參皂苷Rg1可以通過Notch和PI3K/Akt信號通路發揮調控作用;銀杏內酯B可通過激活PI3K/Akt信號通路、上調HIF1α表達來有效調節神經干細胞凋亡相關基因和促進細胞增殖與分化,進而起到神經保護作用,而銀杏葉提取物也能通過上調多種細胞因子的釋放促進神經干細胞的增殖與分化;姜黃素可以通過Wnt/βcatenin與Notch信號通路來調控神經干細胞的增殖與分化。第三,信號通路的串話(crosstalk)是一些中藥發揮促NSCs增殖與分化的重要途徑。Notch與GFs信號通路、GFs與PI3K/Akt信號通路、Notch與Wnt/βcatenin信號通路等在調控神經干細胞的過程中相互協調,相互制約,在中藥促進神經干細胞增殖或分化中發揮著關鍵的作用。中藥對調控神經干細胞增殖分化信號通路的串話研究有待進一步加深,闡明其多靶點和多途徑的作用機制與綜合調控作用。
[關鍵詞]神經干細胞; 增殖; 分化; 中藥; 信號通路; 串話
[Abstract]Since the discovery of neural stem cells(NSCs) in embryonic and adult mammalian central nervous systems, new approaches for proliferation and differentiation of NSCs have been put forward One of the approaches to promote the clinical application of NSCs is to search effective methods to regulate the proliferation and differentiation This problem is urgently to be solved in the medical field Previous studies have shown that traditional Chinese medicine could promote the proliferation and differentiation of NSCs by regulating the relevant signaling pathway in vivo and in vitro Domestic and foreign literatures for regulating the proliferation and differentiation of neural stem cells in recent 10 years and the reports for their target and signaling pathways were analyzed in this paper Traditional Chinese medicine could regulate the proliferation and differentiation of NSCs through signaling pathways of Notch, PI3K/Akt, Wnt/βcatenin and GFs However, studies about NSCs and traditional Chinese medicine should be further deepened; the mechanism of multiple targets and the comprehensive regulation function of traditional Chinese medicine should be clarified.
[Key words]neural stem cell; proliferation; differentiation; traditional Chinese medicine; signaling pathways; crosstalk
神經干細胞(neural stem cells,NSCs)是存在于哺乳動物中樞神經系統內具有自我更新能力和多向分化潛能的細胞群,主要分布于大腦室管膜下區(subventricular zone,SVZ)和海馬齒狀回的顆粒下層(subgranular zone,SGZ)[14]。在大腦發育過程中,NSCs可以分化為神經元和膠質細胞,構建大腦結構與功能單元;在大腦發育成熟后,NSCs依然具有有限的再生能力,為大腦損傷修復提供可能。當腦部病變或受損后,內源性的NSCs就會被“招募”到缺損部位進而參與神經再生和神經修復[5]。但是機體內NSCs數目本身較少,僅由外界損傷刺激所引起的機體自身的反饋仍不足以達到神經自我修復與功能重建的目的[67]。目前,NSCs移植已經成為神經系統疾病及損傷一項新的治療策略,相關疾病的治療如腦卒中、阿爾茲海默病、帕金森病、肌萎縮側索硬化等已進入臨床試驗階段[811]。但是NSCs移植存在存活率不高、定向分化困難、易成瘤、難以穿透疤痕組織等問題[12]。如何通過調控內源性NSCs的增殖并分化為特定神經細胞來補充缺失的細胞是成體神經再生研究的熱點問題。闡明NSCs增殖分化的機制,尋找調控NSCs增殖與分化的靶標,開發促進NSCs增殖分化的創新藥物對于攻克難以治愈的神經系統損傷及退行性病變有重要意義[13]。研究發現,諸多經典信號通路如Notch信號通路、PI3K/Akt信號通路、Wnt/βcatenin信號通路、GFs信號通路等在調控NSCs的過程中相互協調,相互制約,發揮著關鍵的作用。endprint
中藥具有多組分、多靶點、多效果的特點和優勢。中藥可以通過激活機體內源性干細胞、誘導移植的外源性干細胞,或調整干細胞生存的微環境來改善并促進神經再生。并且中藥是通過有效成分組成的復雜物質體系和病理條件下藥物作用靶點組成的復雜生物體系的有機結合達到對機體的綜合調控作用,中藥的多成分決定著其對NSCs的調控具有多靶點、多效果的優勢,利用此優勢對于神經系統疾病的研究或治療具有重大的應用價值。近年研究發現中藥能通過Notch,PI3K/Akt,Wnt/βcatenin,GFs等信號通路等影響NSCs的增殖與分化。并且許多中藥如黃芪、淫羊藿、銀杏葉等能通過其中一種或多種途徑誘導NSCs的增殖或分化。信號通路之間的“串話”是一些中藥發揮促進NSCs增殖與分化的重要途徑。本文立足于中醫藥的整體觀念,對近十年來研究中藥調控NSCs增殖分化的作用及機制進行總結,為臨床應用中藥誘導NSCs的增殖與分化治療神經系統疾病或損傷提供參考。
1NSCs增殖分化信號通路及其具有調控作用的中藥
11調控Notch信號通路促NSCs增殖分化的中藥
Notch信號通路最早于突變果蠅的發育研究中發現,是一個高度保守的控制細胞命運的重要調控通路。Notch信號通路的激活能實現相鄰細胞之間的相互協調作用從而啟動細胞的增殖、分化或凋亡程序,調節細胞、組織、器官的分化和發育[14]。經典的Notch通路主要由Notch受體、Notch配體、轉錄因子、靶分子以及一些調節分子組成[15]。
Notch信號通路是NSCs增殖與分化的網絡系統中的一個關鍵調控環節,可以和Wnt/βcatenin,GFs等其他多種信號通路共同調控NSCs的增殖與分化。早期研究認為[1618],Notch信號通路屬于干細胞分化的抑制性通路,可抑制NSCs向神經元和膠質細胞分化,由此間接維持干細胞的多能性和自我更新能力。Notch信號通路的阻斷可以削弱NSCs的自我更新能力,而持續性的激活其受體Notch1又可以增強NSCs的增殖。而目前有研究顯示[19],Notch通路在NSCs分化的不同階段發揮不同的調控作用。在分化早期,Notch通路可以通過抑制NSCs向神經元和膠質細胞分化、增強細胞信號連接等方式獨立調控細胞周期進程來維持NSCs的自我更新能力。而在分化晚期,通過Notch通路可以將中間祖細胞選擇性的分化為神經元或者星型膠質細胞,而向少突膠質細胞分化的比例較少。
當Notch受體被鄰近細胞分泌的跨膜配體如Delta,Serrate或Lag2激活后,胞內區(Notch intracellular domain,NICD)被γ分泌酶切開并轉移到核內,引起多種靶基因如Hes(hariy enhancer of split,Hes)的表達,從而產生抑制NSCs分化的作用[20]。Haupt S等[21]將重組NICD轉錄到NSCs中,可以轉基因實現激活Notch通路,使細胞處于增殖狀態。Hes為Notch通路的下游靶基因,屬于bHLH基因家族,包括Hes1和Hes5[2223]。活化的Notch信號通路可以增加Hesl和Hes5的表達,上調細胞周期蛋白從而進一步促進干細胞的增殖[2425]。因此,Hes可以維持NSCs的自我更新和抑制其分化,對神經細胞的發生和構筑正常神經功能具有重要意義[26]。
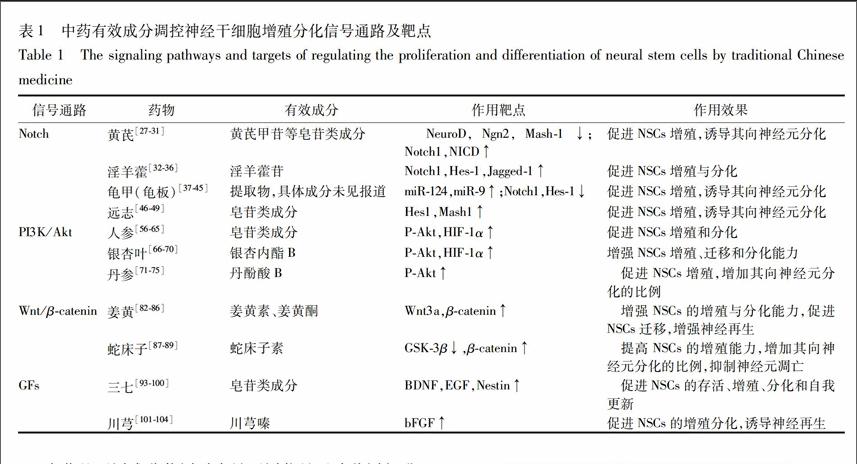
111黃芪豆科植物蒙古黃芪Astragalus membranaceus(Fisch)Bgevarmongholicus(Bge)Hsiao或膜莢黃芪A. membranaceus(Fisch)Bge的干燥根。研究發現[2728],黃芪注射液可以上調腦缺血模型大鼠腦內巢蛋白(Nestin)及其與膠質纖維酸性蛋白(GFAP)或微管相關蛋白2(MAP2)共同表達的陽性細胞數,說明黃芪注射液可以促進NSCs增殖,并能夠誘導其向神經元及膠質細胞分化。在其機制研究方面,曹寶萍等[29]發現黃芪注射液在誘導NSCs分化的過程中,可能啟動了bHLH轉錄因子家族,促使相關基因NeuroD,Ngn2和Mash1的下調,從而使NSCs向神經元方向分化;Haiyan H等[30]研究證明黃芪甲苷Ⅳ能上調體外培養的大鼠海馬區NSCs的Notch1和NICD,誘導外源性NSCs的增殖與分化,并且將其移植到阿爾茲海默模型大鼠海馬區后可以顯著改善模型大鼠的學習和記憶能力。柴麗娟等[31]發現黃芪甲苷能明顯提高體外NSCs增殖率、神經球的形成率,其誘導增殖與細胞周期蛋白D1,Hes1,Hes5的基因表達增加有關。由上可知,黃芪中的皂苷類成分可以通過Notch信號通路調控NSCs的增殖或分化。
112淫羊藿小檗科植物淫羊藿Epimedium brevicornu Maxim.、箭葉淫羊藿E. sagittatum(Siebet Zucc)Maxim.、柔毛淫羊藿E pubescens Maxim或朝鮮淫羊藿E koreanum Nakai的干燥葉。許多研究表明淫羊藿苷可以調控NSCs的增殖與分化。付小龍等[32]發現淫羊藿苷可以促進大鼠海馬區NSCs內Brdu陽性的表達,明顯提高NSCs細胞周期蛋白Cyclin D1及p21 mRNA的表達,促進NSCs的增殖。楊潘[33]也證實了淫羊藿苷可以促進人胚胎NSCs增殖,并誘導其分化。Yang P等[34]研究發現淫羊藿苷可以通過促進NSCs的增殖和分化發揮其神經保護的作用。Wu B等[35]利用Morris水迷宮證明了淫羊藿苷能激活衰老模型大鼠腦內靜止的NSCs,促進其增殖與分化,進而延緩衰老大鼠認知能力的減退。關于其機制研究方面,俞悅[36]通過建立胎鼠腦NSCs培養體系發現淫羊藿苷能上調Notch1,Hes1和Jagged1的表達,通過介導Notch信號通路促進NSCs的增殖。
113龜甲(龜板)龜科動物烏龜Chinemys reevesii(Gray)的背甲及腹甲。陳東風等[37]觀察龜板水煎液對局灶性腦缺血模型大鼠NSCs的影響時發現龜板水煎液可以增強腦缺血后Nestin表達、降低神經功能評分,提示龜板可減輕神經損傷癥狀,促進局灶性腦缺血后NSCs的增殖。李伊為等[38]研究表明龜板水煎液可使Allen脊髓損傷模型大鼠脊髓中Nestin持續高表達至術后第28天,而模型組僅持續高表達至術后21 d;且增加的Nestin陽性細胞數量與神經功能的改善程度平行,提示龜板可促進脊髓損傷后NSCs的增殖并減輕神經損傷癥狀。李彩霞等[39]發現龜板提取物能誘導miR124和miR9的表達,顯著下調Notch1信號分子和下游的靶基因Hes1的表達,促進NSCs向神經元分化。microRNA在NSCs的增殖分化過程中起著重要的調控作用[40]。Giraldez A J等[41]通過斷裂斑馬魚Dicer酶基因來抑制miRNA生成,并最終導致神經管發育缺陷,率先證實了miRNA在NSCs增殖分化過程中的關鍵調控作用。有研究表明[4243],miR124可通過靶向調控Jagged1Notch信號途徑,抑制NSCs的增殖,促進其向神經元的分化。相反地,在體外抑制miR124的表達可以促進NSCs的增殖,抑制其向神經元分化[44]。Landgraf P等[45]研究發現,miR9是除了miR124之外另一個被證實在NSCs向神經元細胞分化過程中發揮著重要調控作用的microRNA。基于以上研究,推測龜板提取物可以通過誘導miR124和miR9的表達來介導Notch信號通路調控NSCs的增殖與分化。endprint
114遠志遠志科植物遠志Polygala tenuifolia Willd或卵葉遠志P. sibirica L的干燥根。遠志中的皂苷類成分具有調控NSCs增殖或分化的作用。陳玉靜等[46]發現在遠志皂苷元的干預下,Nestin陽性細胞數較對照組減少,神經元特異性烯醇化酶(NSE)和膠質纖維酸性蛋白(GFAP)陽性細胞數較對照組增加,說明遠志皂苷元能促進新生大鼠海馬區NSCs的分化。黃昕艷等[47]也發現遠志總皂苷對海馬NSCs向神經元分化有一定的促進作用。經遠志總皂苷誘導24 h后,可見細胞球周邊有分化出的神經元樣細胞。誘導3 d后,神經球周邊神經元樣的分化細胞增多,相鄰細胞球之間形成神經網絡連接。說明在NSCs分化早期,遠志總皂苷可能促使其神經纖維生成、生長,并在神經纖維相互之間的連接起到一定作用。在其調控機制方面,朱曉峰等[48]發現遠志總皂苷能夠促進體外培養的海馬NSCs向神經元及膽堿能神經元定向分化,并上調NSCs中Mashl的表達。而師昉等[49]也證實了遠志皂苷元可顯著促進NSCs增殖,同時上調Hes1和Mash1基因表達,促進NSCs分化,提高其向神經元分化的比例。由此可見,遠志可以通過Notch信號通路調控NSCs的增殖與分化過程。
12調控PI3K/Akt信號通路促NSCs增殖分化的中藥
PI3K/Akt信號通路廣泛存在于細胞中,也是細胞內一條經典的信號轉導通路,是膜受體信號向細胞內轉導的重要途徑,其參與細胞激活、葡萄糖轉運、蛋白質合成等調控環節,在細胞增殖、代謝、凋亡等過程中發揮著關鍵作用。
PI3K/Akt (磷酯酰肌醇3激酶/蛋白激酶B)信號通路主要由磷脂酰肌醇PI3K和其下游分子蛋白激酶B Akt所組成。PI3K具有磷脂酰肌醇激酶的活性,可被多種細胞因子和理化因素激活。PI3K激活的結果是在質膜上產生第二信使PIP3,PIP3與細胞內的信號蛋白Akt結合,通過誘導磷酸化反應導致Akt的活化。Akt是PI3K下游具有絲氨酸/蘇氨酸(Serine/Threonine)活性的激酶,也在多種類型細胞的生存及增殖過程中起到關鍵的調控作用。Akt完全活化后由能引起下游磷酸化級聯反應和調節Bad,GSK3和p27Kip1等細胞命運調控相關靶蛋白的表達,進而影響細胞的增殖、分化、凋亡以及遷移等[50]。研究顯示,該通路在調控胚胎干細胞的自我更新和維持其多向分化潛能方面發揮著關鍵的作用[51]。而對于NSCs而言,通過介導此信號通路也可以促進體外或體內NSCs的增殖與分化[5254],維持細胞活性;并且在病理條件下如通過氧糖剝奪所模擬的體外腦缺血模型中也發現PI3K/Akt信號通路能夠在低氧干預下有效促進NSCs的增殖過程[55]。
121人參五加科植物人參Panax ginseng C A Mey的干燥根和根莖。人參皂苷是人參中的重要活性成分之一,具有良好的腦保護作用。Lin T等[56]發現人參皂苷能提高體內外的大鼠海馬區NSCs Brdu陽性細胞數,說明人參皂苷可以誘導NSCs增殖,促進海馬區的神經再生。Wang B等[57]在研究人參皂苷對鉛損傷大鼠神經再生功能的影響中發現人參皂苷預處理后可以下調小膠質細胞標記物Iba1的免疫反應性,削弱鉛誘導的炎癥因子IL1β,IL6和TNFα上調,阻止鉛所導致的室管膜下區和顆粒下層的Brdu與DCX陽性細胞數下降,說明人參皂苷可能通過抑制小膠質細胞活性、對抗炎癥反應、維持NSCs增殖能力而促進腦部神經再生和自我修復,發揮其神經保護作用。Li Y等[58]將人參皂苷Rg1誘導的NSCs移植到缺血缺氧損傷大鼠模型,證明人參皂苷Rg1可以促進模型大鼠部分功能的恢復。Wang L等[59]也發現經BDNF與人參皂苷(Rg1和Rb1)聯合誘導的人NSCs在分化過程中具有更好的存活能力,更多的神經突觸生長、發育及細胞連接形成。李英博等[60]將采用經過人參皂苷Rg1誘導的NSCs移植到模型大鼠側腦室治療缺血缺氧腦損傷,發現模型大鼠的學習記憶能力有了明顯的提高,能夠較快的尋找到隱藏的平臺,而且在空間探索時也顯示了一定的目的性,提示經Rg1誘導后的NSCs在缺血性腦損傷中對學習、記憶等復雜神經功能的恢復起到了很好的作用。而關于人參皂苷調控NSCs的機制,李英博等[61]在后續的研究中采用基因芯片技術對基因芯片海量數據進行Pathway數據演算,得出在人參皂苷Rg1誘導NSCs增殖過程中,PI3KAkt信號傳導通路具有重要作用。鄭玉芹等[62]發現人參皂苷Rb1組的NSCs增殖率及磷酸化Akt蛋白水平均較對照組高,且這種作用可以被PI3K/Akt抑制劑LY294002逆轉。此結果不但說明人參皂苷Rb1在一定濃度范圍內可以促進體外培養NSCs的增殖,而且也發現了PI3K/Akt信號通路在人參皂苷Rb1促進NSCs增殖作用中發揮重要作用。在中風等腦損傷情況下,人參皂苷能夠作用于NSCs巢內的星形膠質細胞,使星形膠質細胞HIF1α表達上調,促進下游VEGF的分泌增加,通過旁分泌的形式作用于NSCs并促進NSCs增殖和分化,從而達到修復腦損傷的目的[63]。HIF1α是組織缺氧時細胞的低氧應答反應過程中的關鍵因子。輕度缺氧時,HIF1α介導的多種基因表達上調,誘導NSCs的生長、增殖并向神經元分化,從而補充損失的神經元[64]。并且有研究證實,缺氧以及非缺氧性刺激都可通過PI3K依賴性或相關的途徑誘導HIF1α的表達和活性[65]。綜上推測人參皂苷可以通過PI3K/Akt途徑影響HIF1α的表達來調控NSCs的增殖與分化。
122銀杏葉銀杏科植物銀杏Ginkgo biloba L的干燥葉。銀杏內酯B是銀杏葉提取物中的主要藥效成分,具有神經保護作用。劉靜[66]研究發現銀杏內酯B能誘導NSCs 向神經元和星形膠質細胞的分化,促進細胞突起的生長。Wang C等[67]采用銀杏葉提取物干預體外小鼠耳蝸NSCs,發現銀杏葉提取物可以顯著提升NSCs的增殖與分化能力,并且由此分化形成的神經元具有更加復雜的突觸生長和神經網絡的形成。Wang J等[68]也發現銀杏葉提取物EGb761可以提高血管性癡呆模型大鼠NSCs的增殖、遷移和分化能力。并且經過誘導分化產生的新生神經細胞可以通過與周圍細胞建立突觸連接、融入神經網絡而增強突觸可塑性,促進大腦損傷組織的恢復,提高血管性癡呆大鼠的學習和記憶能力。在銀杏內酯B調控NSCs的機制方面,劉娜等[6970]研究發現經銀杏內酯B處理后的NSCs的HIF1α,pAkt表達均較對照組明顯增高,該作用可被PI3K/Akt特異性抑制劑Wortmannin所抑制,且PI3K/Akt信號通路激活能促進HIF1α的表達,該研究很好地說明了銀杏內酯B可能通過激活PI3K/Akt信號通路、上調HIF1α表達來對NSCs起保護作用。endprint
123丹參唇形科植物丹參Salvia miltiorrhiza Bge的干燥根和根莖,其中所含的丹酚酸B是治療腦部損傷或神經退行性疾病的主要藥效成分。Guo G等[71]研究發現丹酚酸B可以促進體外培養的胎鼠皮層NSCs的神經突生長及其向神經元分化,為損傷神經組織結構和功能的恢復提供了潛在的可能。而Zhang N等[72]進一步研究發現丹酚酸B不但可以促進NSCs的增殖,增加其向神經元分化的比例,還可以誘導腦源性神經營養因子BDNF的產生,減少乳糖漏出率,抑制細胞凋亡,從而減輕由H2O2所導致的氧化應激損傷,發揮其神經保護作用。山愛景[73]、郭國慶等[74]也同樣證實丹酚酸B可顯著減少NSCs G0/G1期的百分比并增加G2/S期細胞百分比,延長NSCs對數生長期的時間,促進NSCs分化并使其分化的神經元纖維增多、增長。Zhuang P等[75]也發現丹酚酸B可以維持腦缺血模型大鼠腦內NSCs的增殖能力,并促進其神經功能的恢復,提高其術后的學習和記憶能力。而關于丹酚酸B調控NSCs的作用機制,Zhuang P進一步研究發現PI3K/Akt信號通路的阻斷劑Ly294002會抑制丹酚酸B所誘導的NSCs增殖;并且在丹酚酸B的干預下,NSCs中Akt的磷酸化會增加,而這種作用也會被Ly294002所抑制。此結果說明了丹酚酸B可以通過介導PI3K/Akt信號通路來維持NSCs的自我更新能力并促進其增殖。
13調控Wnt/βcatenin信號通路促NSCs增殖分化的中藥
Wnt信號轉導通路是一個非常廣泛的調控無數生命活動的信號通路,在中樞神經系統發育及成體神經再生過程中控制著細胞的生長及分化[76]。Wnt信號傳導途徑是因啟動蛋白為Wnt而得名,Wnt蛋白是一個富含半胱氨酸殘基的分泌信號糖蛋白大家族,是一類調控細胞生長發育的重要分泌性生長因子[77]。Wnt/βcatenin信號通路首先被發現在胚胎NSCs發育中起關鍵調控作用[78],此后許多研究也表明Wnt信號能夠顯著促進成體NSCs向神經元分化。Wnt蛋白通過自分泌或旁分泌作用與位于細胞膜上的受體相結合,激活細胞內信號通路,調節靶基因的表達,在成體神經發育與再生中起到非常重要的調節作用[79]。而βcatenin是該通路的關鍵信號分子,其轉錄活性對于該通路的激活至關重要[80]。Wnt/βcatenin通路的活化能減輕腦缺血后的腦損傷,顯著地促進成體海馬區NSCs的增殖與分化,提高其向神經元細胞分化的比例[81]。
131姜黃姜科植物姜黃Curcuma longa L.的干燥根莖。姜黃素與姜黃酮都是從姜黃中提取的生物活性物質,也是姜黃發揮抗炎、抗氧化、抗癌、神經保護等藥理作用的活性成分。Dong S等[82]發現姜黃素可以顯著的促進衰老模型大鼠海馬齒狀回的神經再生,從而改善癥狀并提高其認知能力。Hucklenbroich J等[83]研究表明,姜黃酮在體內外均能提高NSCs的增殖與分化能力,促進NSCs在室管膜下區與海馬的遷移,增強神經再生。向鑫等[84]研究發現姜黃素可誘導脊髓損傷后被激活的內源性NSCs更多地分化為神經元,減輕膠質瘢痕,從而促進大鼠后肢功能的恢復。并且姜黃素處理組中Wnt3a,βcatenin的表達與單純損傷組趨勢相似,但各時間點的表達量均顯著高于單純損傷組。故認為Wnt/βcatenin信號通路參與了損傷后內源性NSCs的增殖過程;而應用姜黃素干預脊髓損傷后發現Wnt3a及βcatenin的表達量進一步上調,同時內源性NSCs向神經元分化,證明姜黃素正是通過激活Wnt/βcatenin信號通路促進脊髓損傷后被激活的內源性NSCs更多地向神經元方向分化,從而改善大鼠脊髓損傷的預后。陳飛等[85]觀察姜黃素對體外NSCs增殖分化的影響時發現姜黃素組Wnt3a,βcatenin表達量較其他各組明顯升高,經Wnt通路特異性阻斷劑IWR1處理后其表達水平明顯降低;RTPCR結果顯示姜黃素組Wnt3a及βcatenin基因表達水平明顯上調,而IWR1組Wnt3a及βcatenin基因表達水平明顯下降,總體變化趨勢與Western blot結果一致。此研究初步證明姜黃素在誘導NSCs增殖分化過程中與經典的Wnt/βcatenin 信號通路密切相關。Chen F等[86]同樣發現姜黃素可以提高Wnt3a和βcatenin的表達,并且這種作用也能被IWR1所抑制,證明姜黃素發揮神經保護作用的機制之一就是激活Wnt/βcatenin通路。
132蛇床子傘形科植物蛇床Cnidium monnieri (L)Cuss的干燥成熟果實。蛇床子素是從蛇床子中提取的一種香豆素類藥效成分,對神經系統、心血管系統、免疫系統等都有藥理作用。Gao Z等[87]研究發現蛇床子素可以通過抗炎作用改善體內移植NSCs的生存環境,誘導NSCs向神經元和少突膠質細胞分化,抑制星形膠質細胞增生,從而增強中樞神經系統內源性神經營養因子對髓鞘和軸突損傷的修復。姚瓔珈等[88]在研究蛇床子素對叔丁基過氧化氫所誘導的NSCs衰老損傷時發現,蛇床子素可以明顯提高NSCs存活率,提高其向星形膠質細胞和神經元分化能力,降低與衰老相關的βgal陽性率,表明蛇床子素可改善衰老NSCs的增殖和分化能力,對NSCs具有延緩衰老的作用。而在其進一步機制研究中發現[89],蛇床子素不僅可以提高NSCs的增殖能力,增加其向神經元分化的比例,而且還可以抑制神經元凋亡;RTPCR和Western blot的結果均顯示蛇床子素可抑制 GSK3β基因及蛋白的表達,促進βcatenin基因及蛋白的表達。由此說明蛇床子素促進NSCs增殖分化可能與通過激活Wnt/βcatenin信號通路有關。
14調控GFs信號通路促NSCs增殖分化的中藥
細胞生長因子(growth factors,GFs)是一類能在細胞間傳遞信息、刺激細胞生長活性的蛋白質或小分子多肽。影響NSCs增殖分化的細胞生長因子有很多,主要包括表皮生長因子(epidermal growth factor,EGF)、成纖維細胞生長因子(fibroblast growth factor,FGF)、腦源性神經營養因子(BDNF)、白血病抑制因子(LIF)、白細胞介素(IL)、血小板源生長因子(PDGF)等。其中,GFs家族的EGF與FGF在調控NSCs增殖中起著至關重要的作用,可以共同調節胚胎發育晚期NSCs對向膠質細胞分化的反應性[90]。研究證實,激活GFs可以提高NSCs的活性,促進NSCs的增殖與遷移[91]。但是對FGF應答的細胞在胚胎發育早期就已經存在,維持中樞神經系統的正常功能并延緩細胞老化,并能使較多的神經元在病理狀態下得以生存;促進腦損傷后的早期修復而對EGF應答的NSCs在發育晚期特定的時間和空間才出現;而在分別阻斷EGF與FGF信號通路后也發現這2個信號通路可以分別獨立的調控NSCs的增殖與分化[92]。endprint
141三七五加科植物三七P. notoginseng (Burk) FH Chen的干燥根和根莖。三七中的皂苷類成分在神經系統疾病方面具有廣泛的藥理活性。張建平等[93]觀察不同劑量的三七總皂苷對大鼠NSCs的影響,發現三七總皂苷能夠調節體外培養的大鼠海馬NSCs的增殖和分化水平,在合適的劑量下顯著提高了神經元的分化比例。雷勛明等[94]也發現三七總皂苷能誘導缺氧缺血性腦損傷新生鼠內源性NSCs增殖、分化,提示其具有促進神經發生的作用。姜曉鋒等[95]觀察到三七三醇皂苷可以發揮類缺血耐受作用,促進急性腦缺血模型大鼠腦內源性NSCs增殖,進而改善大鼠腦梗死后的神經功能缺損癥狀。Ke C等[96]研究發現三七皂苷可以提高NSCs移植到帕金森模型大鼠體內分化形成的多巴胺能神經元的存活能力和治療效果。Si Y C等[97]發現三七皂苷可以提高體外NSCs在氧糖剝奪后的增殖與分化能力,促進胚胎大鼠海馬區NSCs的自我更新與分化,提示三七皂苷具有增強神經形成及再生的功效。關于其作用機制,Si Y等[98]研究證明了通過自分泌與旁分泌通路釋放的神經營養因子能促進大鼠胚胎NSCs的存活能力、自我更新、增殖與分化。而鐘森等[99]觀察三七總皂苷對腦缺血再灌注大鼠NSCs相關調節因子的影響時發現缺血再灌注各時間點三七總皂苷組Bcl2,Nestin,BDNF,EGF的表達與模型組比較顯著增加,說明三七總皂苷能上調相關細胞因子BDNF,EGF,Nestin的表達而促進NSCs增殖。程龍[100]也發現三七總皂苷可能通過促進體外胎鼠皮層NSCs或前體細胞bFGF,BDNF自身合成增加來促進NSCs的存活、增殖、分化和自我更新。通過以上研究結果可以說明GFs信號通路是三七誘導NSCs增殖與分化的一條重要途徑之一。
142川芎傘形科植物川芎Ligusticum chuanxiong Hort的干燥根莖。祁文等[101102]研究發現川芎嗪能夠促進脊髓損傷后損傷區域GFAP的表達,對脊髓損傷后內源性NSCs增殖分化有促進作用;并且川芎嗪能明顯減輕脊髓損傷后水腫、炎性細胞浸潤及出血程度,保護神經細胞,促進脊髓組織修復。Tian Y等[103]也證實了川芎嗪可以促進體外低氧刺激條件下大鼠NSCs分化為神經元并誘導神經再生,起到神經保護的作用。另有研究發現[104],川芎嗪能上調重型腦損傷后損傷區腦組織bFGF的表達,保護神經元尼氏體,恢復神經功能。故基于以上推測,川芎嗪可能可以通過GFs信號通路來調控NSCs的增殖分化,發揮其神經保護作用。
綜上,中藥有效成分調控神經干細胞增殖分化信號通路及靶點總結見表1。
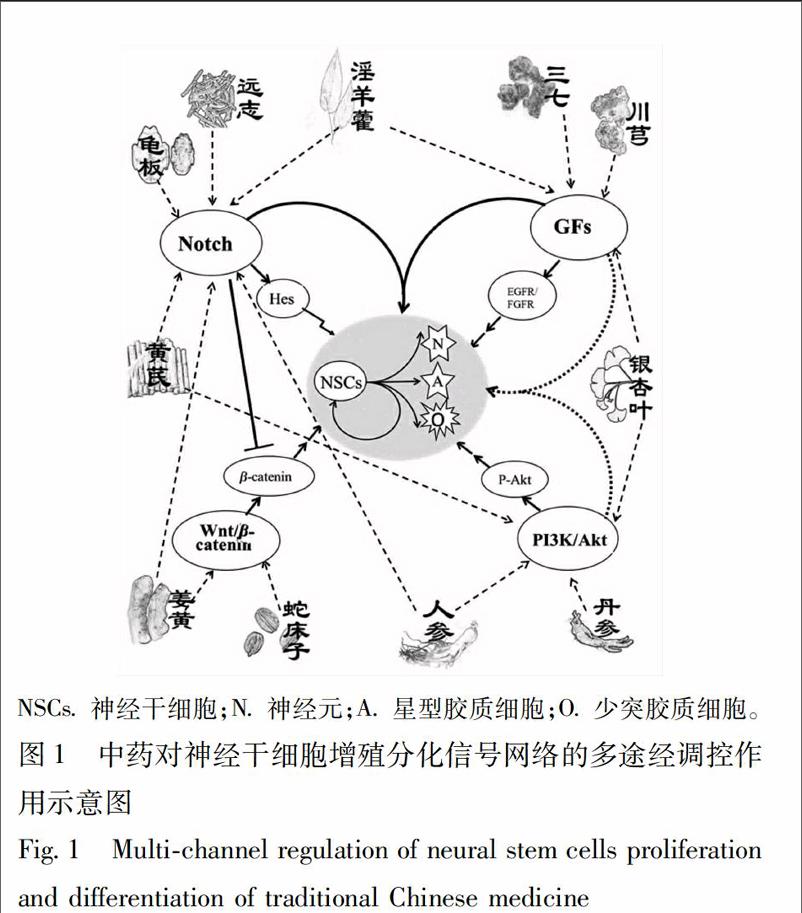
2中藥的不同成分能同時介導不同信號通路共同促進NSCs的增殖或分化
多成分、多靶點、多功效是中藥的獨特優勢。中藥在對NSCs發揮調控作用時,由于其成分的復雜性,多種有效成分往往能通過多種途徑發揮多重功效,多個信號通路協調運作,共同調控NSCs的增殖與分化,進而影響神經再生,發揮其神經保護作用。已有研究發現,黃芪、淫羊藿、人參、銀杏葉、姜黃等中藥中的多種成分就能通過不同信號通路共同促進NSCs的增殖或分化,見圖1。
黃芪中的黃芪甲苷可以通過Notch信號通路調控NSCs的增殖或分化[2931],但黃芪多糖含藥血清又可以通過調節VEGF含量,活化PI3K/Akt信號通路,促進Akt磷酸化,調節下游靶基因,促進NSCs增殖;并且能通過VEGF影響鈣離子通道,提高突觸p38表達,促進NSCs向神經元分化[105]。
淫羊藿中的淫羊藿苷能通過介導Notch信號通路激活衰老模型大鼠腦內靜默的NSCs,促進其增殖與分化[36]。而Yao R等[106]研究發現淫羊藿的另外一類活性成分淫羊藿黃酮類能通過影響GFs的表達從而促進NSCs的Tuj1,NF200,GFAP表達上調,Brdu陽性細胞數增加,誘導體外NSCs增殖和分化。
人參皂苷Rg1,Rb1可以介導PI3K/Akt信號通路促進體外培養的NSCs的增殖[6162]。但基因芯片篩選技術也發現[61],Hes1可以維持NSCs的自我更新,對產生神經細胞的合適數量和構建正常神經功能具有重要意義。而人參皂苷 Rg1之所以能發揮較好的促進NSCs增殖的效果,也與其能激活Notch信號通路,顯著上調Hes1基因表達水平相關。
銀杏內酯B能夠增強皮層NSCs活性,減少細胞凋亡,促進細胞增殖、分化,通過激活PI3K/Akt信號通路、上調HIF1α表達來有效調節NSCs凋亡相關基因和促進細胞增殖與分化,進而起到神經保護作用[6970]。而近年研究也發現,銀杏葉提取物與堿性成纖維生長因子bFGF等聯合能更好的發揮對腦神經細胞的保護作用。因此,推測銀杏葉提取物中的某種成分可能也能通過多種細胞因子促進NSCs的增殖與分化,其進一步的機制還有待于研究[107]。
姜黃素可以通過Wnt/βcatenin調控NSCs的增殖分化[8486]。但也有研究發現,姜黃素處理組的缺血再灌注大鼠梗死側室管膜下區BrdU及BrdU/DCX標記的NSC較模型組顯著增多,同時其較模型組更廣泛地分布在往病灶遷移的路徑上;反映Notch通路活性的胞內段NICD生成也增多。說明姜黃素能促進缺血再灌注大鼠室管膜下區NSCs增殖和遷移,其機制可能是通過激活Notch信號通路產生的[108]。
3信號通路間相互串話,共同調控NSCs的增殖與分化
在NSCs的增殖分化過程中存在著Notch,PI3K/Akt,Wnt/βcatenin,GFs等多個信號通路共同發揮調控作用。各因素在調控NSCs的過程中并不是相互獨立的,而是彼此存在交叉,相互作用,共同構成一個復雜的生物分子網絡系統。在這個網絡系統中,Notch與其他信號通路關系密切。Notch經典信號轉導通路在細胞、組織和器官的發育中發揮著重要作用,調控著組織類型及其形態的發生。細胞的增殖、分化和存活等復雜程序的正常運行正是基于正確的Notch信號轉導。Notch,PI3K/Akt,Wnt/βcatenin,GFs信號通路等以Notch信號通路為核心,以信號通路之間的“串話”實現多途徑、多過程的調控NSCs的增殖與分化[1920],見圖1。endprint
31Notch與GFs信號通路的關聯
Notch信號通路與GFs信號通路交互協作,在許多方面共同控制著NSCs的增殖與分化。在室管膜下區,Notch信號通路維持著NSCs的干性及自我更新能力,而GFs信號通路則影響著NSCs的增殖與遷移[109110]。Aguirre等[111]發現當GFs信號通路中的EGFR信號過度表達時,能促進Numb,E3泛素連接酶和Notch受體的反應,增大其泛素化,進而降低NICD水平,與Notch通路共同維持著NSCs與神經祖細胞之間的平衡。但是也有研究發現,Notch信號通路還可以和CFs信號共同維持NSCs自我更新活性,顯著增加神經球的形成頻率[19]。然而,在不存在細胞生長因子的情況下,Notch通路也可以單獨促進NSCs的自我更新。Notch通路對NSCs這種非生長因子依賴性的活化包括細胞周期和細胞間相互聯系的調節,即通過抑制NSCs向神經元和膠質細胞分化、增強細胞信號連接、不依賴外源性或內源性的生長因子獨立調控細胞周期進程來促進NSCs的自我更新。在NSCs的分化階段,Notch在與神經營養因子和生長因子的協同下又可以促進NSCs向神經元與星型膠質細胞方向分化。
32GFs與PI3K/Akt信號通路的關聯
在NSCs的增殖分化過程中,Notch與PI3K/Akt信號通路能否相互影響目前并無研究報道。但是有研究發現,PI3K/Akt和GFs信號通路都可以調控NSCs的增殖或遷移[111112],故推測二者在此過程中存在某種關聯。Zhang Q等[113]發現BDNF與EGF聯用時可以增加NSCs的增殖率和遷移率,提高Akt的磷酸化水平;而在使用PI3K/Akt的信號通路特異性阻滯劑LY294002后,EGF所誘導的NSCs的增殖和遷移作用消失,說明BDNF可以通過PI3K/Akt信號通路來促進EGF誘導的NSCs增殖或遷移。Ojeda L等[114]研究發現介導PI3K/Akt信號通路可以下調運動神經元的標志蛋白MAP2的水平,抑制NSCs分化為運動神經元;并且在阻斷PI3K/Akt通路后可以增加移植到成年大鼠脊髓中的NSCs分化為運動神經元的比例。而FGF2和EGF可以通過微調PI3K/Akt信號通路來影響體外或移植到大鼠脊髓中的NSCs增殖或分化,促進運動神經元的產生。上述研究說明GFs信號通路與PI3K/Akt信號通路可以協調發揮作用,控制NSCs的命運轉化,但具體的調控過程與作用機制有待進一步研究。
33Notch與Wnt/βcatenin信號通路的關聯
Notch與Wnt/βcatenin信號通路在調控NSCs增殖分化過程中關系復雜,既相互制約又相互促進。研究顯示,Notch與Wnt/βcatenin信號通路可以發揮協同作用維持Miller細胞的干性,維持中樞神經系統中干細胞與祖細胞的平衡[115]。Notch信號通路還可以通過負性調節活性βcatenin蛋白水平的修飾方式,降低βcatenin積累而抑制Wnt通路,從而有助于調控干細胞和祖細胞中的Wnt/βcatenin蛋白信號,以緩和擴張細胞的增殖狀態,影響細胞的調控過程,繼而維持干細胞與祖細胞數量與功能的平衡。內吞接頭蛋白Numb是此負性調節過程中的關鍵蛋白,當敲除Numb及Numbl時,Notch信號將無法抑制βcatenin蛋白的轉錄活性[116],也就無法維持NSCs神經祖細胞池的動態平衡。
4小結
41中藥促進NSCs增殖分化的綜合調控作用為神經系統疾病治療提供了新方向
目前,對于阿爾茲海默病、帕金森癥、腦缺血等一些嚴重危害著人類健康的神經系統退行性疾病或損傷,在臨床上并無理想的治療手段。通過外界干預促使機體神經系統的修復與再生是攻克這類臨床醫學難題的新興方向。細胞療法特別是干細胞療法是神經系統疾病研究的新興領域,其臨床應用為諸多神經系統疾病或損傷提供了一個創新性的解決辦法。基于干細胞的治療方法有2種思路[13]。第一種是通過外界藥物干預,促使內源性(如大腦、血液或骨髓)的干細胞遷移到受損部分,進而增殖分化為特定的功能細胞來補充缺失的細胞以達到治療的目的。第二種方法是將體外誘導的外源性干細胞移植到機體特定的部位(如腦內移植)或全身(如靜脈或動脈灌注),激發機體自身各種因子的釋放,促進結構再生與功能恢復。
對于調控內源性或外源性的NSCs在機體內更好的發揮效用,治療發病機制復雜,臨床難以治愈的神經系統疾病,中藥具有整體調節和綜合治療的優勢。中藥的多成分特性必然決定著其對NSCs增殖或分化的調控是多途徑的,也可能具有單一成分難以達到的效果。NSCs的增殖分化是一個復雜的信號通路網絡系統綜合調控的過程,各信號通路間彼此交叉,互相關聯。立足于中藥整體思想,探討中藥的多靶點、多通路、多層次的分子生物學機制,構建調控NSCs增殖分化的生物分子網絡系統,深入分析各信號因素間的網絡關系,將使中藥在神經系統疾病或損傷方面的治療中發揮巨大的潛能。
42中藥對NSCs增殖分化信號通路網絡的綜合調控作用有待深入研究
因中藥普遍具有多有效成分的特點,故許多研究顯示同種中藥如黃芪、淫羊藿、姜黃等能通過不同的信號通路發揮對NSCs增殖分化的調控作用,且這種作用是多途徑、多層次的。同種中藥的不同成分在調控NSCs的增殖分化過程中能同時通過不同的信號通路發揮作用,而不同的信號通路之間在NSCs增殖分化的不同階段也會相互協調或相互抑制。所以在同一條件下,探索中藥如何通過多條信號通路間的相互作用來完成對NSCs增殖分化的調控,其對信號通路網絡的綜合調控作用是如何體現的,也就具有重要的研究意義。但目前的研究局限于傳統思路,僅僅依賴于常規分子生物學技術對單一信號通路中的幾個關鍵基因或蛋白的檢測,往往不能形成系統性認識,難以全面詮釋中藥作用的多靶點、多通路、多層次的綜合作用機制[117]。并且目前的研究沒有將中藥中復雜的有效成分與作用效果的“譜效關系”有機結合,不易明確成分靶點效果的對應關系,導致研究的深度不足和對中醫藥整體觀念的欠缺。加強對于蛋白組學和基因芯片等高通量篩選技術的應用,利用中藥小分子探針快速有效地分析信號通路串聯網絡,加深中藥調控NSCs信號通路之間“串話”的研究深度,有助于厘清中藥對NSCs全方位的綜合調控作用,闡明中藥誘導神經干細胞增殖分化,促進神經再生的多靶點和多途徑的作用機制,發掘中藥應用于神經干細胞治療神經系統疾病及損傷的潛在價值,加快中藥通過調控NSCs在神經系統疾病或損傷上的臨床應用。endprint
[參考文獻]
[1]Conti L, Cattaneo E Neural stem cell systems:physiological players or in vitro entities?[J]. Nat Rev Neurosci, 2010, 11(3):176
[2]Louis S A, Mak C K H, Reynolds B A Methods to culture, differentiate, and characterize neural stem cells from the adult and embryonic mouse central nervous system[M]// Cheryl D H, Cindy L M. Basic Cell Culture Protocols. Clifton:Humana Press, 2013:479.
[3]Bond A M, Ming G L, Song H Adult mammalian neural stem cells and neurogenesis:five decades later[J]. Cell Stem Cell, 2015, 17(4):385.
[4]Kornblum H I Introduction to neural stem cells[J]. Stroke, 2007, 38(2):810.
[5]Barbosa J S, Sanchezgonzalez R, Di G R, et al. Neurodevelopment Live imaging of adult neural stem cell behavior in the intact and injured zebrafish brain[J]. Science, 2015, 348(6236):789
[6]Arvidsson A, Collin T, Kirik D, et al. Neuronal replacement from endogenous precursors in the adult brain after stroke[J]. Nat Med, 2002, 8(9):963.
[7]Chen Y, Sun F Y Agerelated decrease of striatal neurogenesis is associated with apoptosis of neural precursors and newborn neurons in rat brain after ischemia[J]. Brain Res, 2007, 1166(1):9
[8]Hicks C, Stevanato L, Stroemer R P, et al. In vivo and in vitro characterization of the angiogenic effect of CTX0E03 human neural stem cells[J]. Cell Transplant, 2013, 22(9):1541.
[9]Mack G S Reneuron and stem cells get green light for neural stem cell trials[J]. Nat Biotechnol,2011, 29(2):95.
[10]Trounson A, Thakar R G, Lomax G, et al. Clinical trials for stem cell therapies[J]. BMC Med, 2011, 9(1):52.
[11]Jin K, Xie L, Mao X O, et al. Effect of human neural precursor cell transplantation on endogenous neurogenesis after focal cerebral ischemia in the rat[J]. Brain Res, 2011, 1374(1374):56.
[12]莊述娟, 陳小玉,劉慶山神經干細胞增殖的分子機制及中藥干預研究進展[J]. 中國實驗方劑學雜志, 2013, 19(3):341
[13]MartínezMorales P L, Revilla A, Ocaa I, et al. Progress in stem cell therapy for major human neurological disorders[J]. Stem Cell Rev Rep, 2013, 9(5):685.
[14] Artavanistsakonas S, Rand M D, Lake R J, et al. Notchsignalling:cell fate control and signal integration in development[J]. Science, 1999, 284(5415):770.
[15]Yoon K, Gaiano N Notch signaling in the mammalian central nervous system:insights from mouse mutants[J]. Nat Neurosci, 2005, 8(6):709.
[16]Chambers C B, Peng Y, Nguyen H, et al. Spatiotemporal selectivity of response to Notch1 signals in mammalian forebrain precursors[J]. Development, 2001, 128(5):689.endprint
[17]Ge W, Martinowich K, Wu X, et al. Notch signaling promotes astrogliogenesis via direct CSLmediated glial gene activation[J]. J Neurosci Res, 2002, 69(6):848.
[18]Grandbarbe L, Bouissac J, Rand M, et al. DeltaNotch signaling controls the generation of neurons/glia from neural stem cells in a stepwise process[J]. Development, 2003, 130(7):1391.
[19]Nagao M, Sugimori M, Nakafuku M Cross talk between Notch and growth factor/cytokine signaling pathways in neural stem cells[J]. Mol Cell Biol, 2007, 27(11):3982.
[20]Sivakumar K C, Dhanesh S B, Shobana S, et al. A systems biology approach to model neural stem cell regulation by notch, shh, wnt, and EGF signaling pathways[J]. OMICS, 2011, 15(10):729
[21]Haupt S, Borghese L, Brustle O, et al. Nongenetic modulation of Notch activity by artificial delivery of Notch intracellular domain into neural stem cells[J]. Stem Cell Rev Rep, 2012, 8(3):672
[22]Alexson T, Hitoshi S, Coles B L, et al. Notch signaling is required to maintain all neural stem cell populationsirrespective of spatial or temporal Niche[J]. Dev Neuroscie, 2006,28(1/2):34
[23]Woo S M, Kim J, Han H W, et al. Notch signaling is required for maintaining stemcell features of neuroprogenitor cells derived from human embryonic stem cells[J]. BMC Neurosci, 2009, 10(1):97.
[24]Yamamoto S, Nagao M M, Kosako H, et al. Transcription factor expression and Notchdependent regulation of neural progenitors in the adult rat spinal cord[J]. J Neurosci, 2002, 21(24):9814.
[25]Dequéant M L, Pourquié O Segmental patterning of the vertebrate embryonic axis[J]. Nat Rev Genet, 2008, 9(5):370.
[26]Tan S L, Ohtsuka T, Aitor González, et al. MicroRNA9 regulates neural stem cell differentiation by controlling Hes1 expression dynamics in the developing brain[J]. Genes Cells, 2012, 17(12):952.
[27]張力,羅秀成,楊石照,等增強大鼠神經干細胞生物活性的黃芪注射液[J]. 中國組織工程研究, 2013, 17(27):5057.
[28]韋云飛,趙偉佳,郝永楠,等黃芪注射液對缺血后腦組織神經干細胞增殖和分化的影響[J]. 臨床神經病學雜志, 2012, 25(3):192.
[29]曹寶萍黃芪在神經干細胞體外分化過程中作用的研究[D]. 西安:陜西師范大學, 2009.
[30]Haiyan H, Rensong Y, Guoqin J, et al. Effect of astragaloside IV on neural stem cell transplantation in Alzheimer's disease rat models[J]. Evid Based Complement Alternat Med, 2016, 2016(6):1
[31]柴麗娟,鐘佩茹,周志煥,等黃芪甲苷對體外神經干細胞增殖作用影響的研究[J]. 中國藥理學通報, 2010, 26(5):670.
[32]付小龍淫羊藿苷對大鼠海馬神經干細胞增殖的影響[D]. 遵義:遵義醫學院, 2015.
[33]楊潘淫羊藿苷對人胚胎神經干細胞增殖的影響及其機制研究[D]. 北京:首都醫科大學, 2009.
[34]Yang P, Guan Y Q, Li Y L, et al. Icariin promotes cell proliferation and regulates gene expression in human neural stem cells in vitro[J]. Mol Med Rep, 2016, 14(2):1316.endprint
[35] Wu B, Chen Y, Huang J, et al. Icariin improves cognitive deficits and activates quiescent neural stem cells in aging rats[J]. J Ethnopharmacol, 2012, 142(3):746.
[36]俞悅 從Caveolin1/Notch信號通路探補腎中藥單體促神經干細胞增殖的作用機制[D]. 長沙:湖南中醫藥大學, 2013
[37]陳東風,杜少輝,李伊為,等龜板對局灶性腦缺血后神經干細胞的作用[J]. 廣州中醫藥大學學報, 2001, 18(4):328.
[38]李伊為,崔曉軍,陳東風,等龜板對脊髓損傷大鼠神經干細胞的作用[J]. 神經解剖學雜志, 2003, 19(3):321.
[39]李彩霞,周健洪,陳東風,等龜板提取物誘導神經干細胞向神經元分化過程中相關microRNA表達變化[J]. 廣州中醫藥大學學報, 2015(3):481.
[40]Lagosquintana M, Rauhut R, Lendeckel W, et al. Identification of novel genes coding for small expressed RNAs[J]. Science, 2001, 294(5543):853.
[41]Giraldez A J, Schier A F MicroRNAs regulate brain morphogenesis in zebrafish[J]. Science, 2005, 308(5723):833.
[42]Maiorano N A, Mallamaci A Promotion of embryonic corticocerebral neuronogenesis by miR124[J]. Neural Dev, 2009, 4(1):780
[43]Imayoshi I, Kageyama R The role of Notch signaling in adult neurogenesis[J]. Mol Neurobiol, 2011, 44(1):7.
[44]Cheng L C, Pastrana E, Tavazoie M, et al. miR124 regulates adult neurogenesis in the subventricular zone stem cell niche[J]. Nat Neurosci, 2009, 12(4):399.
[45]Landgraf P, Rusu M, Sheridan R, et al. A mammalian microRNA expression atlas based on small RNA library sequencing[J]. Cell, 2007, 129(7):1401.
[46]陳玉靜,黃小波,陳文強,等遠志皂苷元對新生大鼠海馬神經干細胞分化的影響[J]. 中國康復理論與實踐, 2014, 20(11):1028.
[47]黃昕艷,王禹,張曉梅,等遠志總皂苷對神經干細胞向神經元分化的影響[J]. 神經損傷與功能重建, 2011, 6(2):90.
[48]朱曉峰,戚旬中,時晶,等遠志總皂苷對海馬神經干細胞定向分化的作用及對Mash1表達的影響[J]. 中華神經醫學雜志, 2009, 8(12):1193.
[49]師昉,梁志剛,郭紫瑄,等遠志皂苷元促進人神經干細胞體外增生和分化的研究[J]. 首都醫科大學學報, 2013, 34(4):559
[50] Shioda N, Han F, Fukunaga K Role of Akt and ERK signaling in the neurogenesis following brain ischemia[J]. Int Rev Neurobiol, 2009, 85:375.
[51]Hishida T, Nakachi Y, Mizuno Y, et al. Functional compensation between Myc and PI3K signaling supports selfrenewal of embryonic stem cells[J]. Stem Cells, 2015, 33(3):713.
[52]Zhang X, Zhang L, Cheng X, et al. IGF1 promotes Brn4 expression and neuronal differentiation of neural stem cells via the PI3K/Akt pathway[J]. PLoS ONE, 2014, 9(12):e113801.
[53]Belle J L, Orozco N, Paucar A A, et al. Proliferative neural stem cells have high endogenous ROS levels that regulate selfrenewal and neurogenesis in a PI3K/Aktdependant manner[J]. Cell Stem Cell, 2011, 8(1):59.
[54] Lee J E, Lim M S, Park J H, et al. S6K promotes dopaminergic neuronal differentiation through PI3K/Akt/mTORdependent signaling pathways in human neural stem cells[J]. Mol Neurobiol, 2016, 53(6):3771.endprint
[55]崔曉萍,陳建梅,穆軍山,等 PI3KAKT通路對腦缺血損傷神經干細胞的增殖作用[J]. 中國康復醫學雜志, 2016, 31(2):154
[56]Lin T, Liu Y, Shi M, et al. Promotive effect of ginsenoside Rd on proliferation of neural stem cells in vivo and in vitro[J]. J Ethnopharmacol, 2012, 142(3):754.
[57]Wang B, Feng G, Tang C, et al. Ginsenoside Rd maintains adult neural stem cell proliferation during leadimpaired neurogenesis[J]. Neurol Sci, 2013, 34(7):1181.
[58]Li Y, Wang Y, Tang J, et al. Neuroprotective effects of ginsenoside Rg1induced neural stem cell transplantation on hypoxicischemic encephalopathy[J]. Neural Reg Res, 2015, 10(5):753
[59] Wang L, Kisaalita W S Administration of BDNF/ginsenosides combination enhanced synaptic development in human neural stem cells[J]. J Neurosci Methods, 2011, 194(2):274.
[60]李英博,涂柳,陳笛,等人參皂苷Rg1處理的人神經干細胞對缺氧缺血腦損傷的功能恢復研究[J]. 中國中藥雜志, 2012, 37(4):509.
[61]李英博,趙香琴,姜英虹,等基因芯片技術篩選人參皂苷Rg1促進人神經干細胞增殖的分子靶點研究[J]. 中國中藥雜志, 2013, 38(16):2701.
[62]鄭玉芹,姜正林,徐美玉人參皂苷Rb1對體外培養胎鼠神經干細胞增殖及分化的影響[J]. 神經解剖學雜志, 2014, 30(3):273.
[63]萬鳳,司銀楚,牛欣人參皂苷作用于星形膠質細胞對中風后神經干細胞增殖和分化的影響[C]. 廣州:全國中醫藥博士生學術論壇,2016.
[64]Feliciano D M, Zhang S, Quon J, et al. Hypoxiainducible factor 1a is a Tsc1regulated survival factor in newborn neurons in tuberous sclerosis complex[J]. Human Mol Genet, 2013, 22(9):1725
[65]Ye Z, Guo Q, Xia P, et al. Sevoflurane postconditioning involves an upregulation of HIF1α and HO1 expression via, PI3K/Akt pathway in a rat model of focal cerebral ischemia[J]. Brain Res, 2012, 1463:63.
[66]劉靜銀杏內酯B及黃芪皂甙促進小鼠神經干細胞分化的實驗研究[D]. 重慶:第三軍醫大學, 2009.
[67]Wang C, Han Z Ginkgo biloba extract enhances differentiation and performance of neural stem cells in mouse cochlea[J]. Cell Mol Neurobiol, 2015, 35(6):1.
[68]Wang J, Chen W, Wang Y A Ginkgo biloba extract promotes proliferation of endogenous neural stem cells in vascular dementia rats[J]. Neural Reg Res, 2013, 8(18):1655.
[69]劉娜,袁寶強,孫康欽,等銀杏內酯B對體外培養神經干細胞內HIF1α及PI3K/Akt信號通路的影響[J]. 中風與神經疾病, 2014, 31(6):525.
[70]劉娜,孫康欽,白蓮琴,等銀杏內酯B對損傷神經干細胞內HIF1α及PI3K/Akt信號通路的影響[J]. 中華臨床醫師雜志:電子版, 2014(11):2059.
[71]Guo G, Li B, Wang Y, et al. Effects of salvianolic acid B on proliferation, neurite outgrowth and differentiation of neural stem cells derived from the cerebral cortex of embryonic mice[J]. Science China Life Sci, 2010, 53(6):653.
[72]Zhang N, Kang T, Yang X, et al. Effects of salvianolic acid B on survival, selfrenewal and neuronal differentiation of bone marrow derived neural stem cells[J]. Eur J Pharm, 2012, 697(1/3):32.endprint
[73]山愛景丹酚酸B對小鼠胚胎腦神經干細胞增殖和分化的誘導[D]. 廣州:暨南大學, 2006.
[74]郭國慶,李斌,王圓圓,等丹酚酸B促進胎鼠大腦皮質神經干細胞增殖、突起生長和分化[J]. 中國科學:生命科學, 2009(8):793.
[75]Zhuang P, Zhang Y, Cui G, et al. Direct stimulation of adult neural stem/progenitor cells in vitro and neurogenesis in vivo by salvianolic acid B[J]. PLoS ONE, 2012, 7(4):e35636.
[76]Hans Clevers, Roel Nusse Wnt/βCatenin signaling and disease [J]. Cell, 2012, 149(6):1192.
[77] Ye F, Chen Y, Hoang T, et al. HDAC1 and HDAC2 regulate oligodendrocyte differentiation by disrupting βCateninTCF interaction[J]. Nat Neurosci, 2009, 12(7):829.
[78]Kléber M, Sommer L Wnt signaling and the regulation of stem cell function[J]. Curr Opin Cell Biol, 2004, 16(6):681.
[79]Lie D C, Colamarino S A, Song H J, et al. Wnt signalling regulates adult hippocampal neurogenesis[J]. Nature, 2005, 437(7063):1370.
[80]Wisniewska M B, Nagalski A, Dabrowski M, et al. Novel βcatenin target genes identified in thalamic neurons encode modulators of neuronal excitability[J]. BMC Genomics, 2012, 13(1):635.
[81]Davidson K C, Adams A M, Goodson J M, et al. Wnt/βcatenin signaling promotes differentiation, not selfrenewal, of human embryonic stem cells and is repressed by Oct4[J]. Proc Natl Acad Sci USA, 2012, 109(12):4485.
[82]Dong S, Zeng Q, Mitchell E S, et al. Curcumin enhances neurogenesis and cognition in aged rats:implications for transcriptional interactions related to growth and synaptic plasticity[J]. PLoS ONE, 2011, 7(2):e31211.
[83]Hucklenbroich J Aromaticturmerone induces neural stem cell proliferation in vitro and in vivo[J]. Stem Cell Res Ther, 2014, 5(4):1.
[84]向鑫,袁繼超,陳飛,等姜黃素誘導內源性神經干細胞促進大鼠脊髓損傷后功能修復[J]. 第三軍醫大學學報, 2014, 36(9):883.
[85]陳飛,王皓香,向鑫,等姜黃素對神經干細胞Wnt/βcatenin信號通路表達影響的離體研究[J]. 第三軍醫大學學報, 2014, 36(8):764.
[86]Chen F, Wang H, Xiang X, et al. Curcumin increased the differentiation rate of neurons in neural stem cells via Wnt signaling in vitro study[J]. J Surg Res, 2014, 192(2):298.
[87]Gao Z, Wen Q, Xia Y, et al. Osthole augments therapeutic efficiency of neural stem cellsbased therapy in experimental autoimmune encephalomyelitis[J]. J Pharmacol Sci, 2014, 124(1):54
[88]姚瓔珈,孔亮,教亞男,等蛇床子素延緩叔丁基過氧化氫誘導的神經干細胞衰老[J]. 中國藥理學與毒理學雜志, 2015, 29(4):565
[89]姚瓔珈,孔亮,教亞男,等蛇床子素通過Wnt/βcatenin信號通路促進轉染APP基因的神經干細胞分化為更多神經元且減少神經元凋亡[J]. 中國藥理學通報, 2015(11):1516.
[90]Reynolds B A, Weiss S Clonal and population analyses demonstrate that an EGFresponsive mammalian embryonic CNS precursor is a stem cell[J]. Dev Biol, 1996, 175(1):1.endprint
[91]Ayusosacido A, Moliterno J A, Kratovac S, et al. Activated EGFR signaling increases proliferation, survival, and migration and blocks neuronal differentiation in postnatal neural stem cells[J]. J NeuroOncol, 2010, 97(3):323.
[92]Tropepe V, Sibilia M, Ciruna B G, et al. Distinct neural stem cells proliferate in response to EGF and FGF in the developing mouse telencephalon[J]. Dev Biol, 1999, 208(1):166.
[93]張建平,司銀楚,朱培純三七總皂苷對體外培養的大鼠海馬神經干細胞增殖分化的作用[J]. 解剖學報, 2010, 41(3):362.
[94]雷勛明,陳全景,張曉芬,等三七總皂甙對缺氧缺血性腦損傷新生鼠內源性神經干細胞增殖分化的影響[J]. 中國婦幼保健, 2013, 28(4):684.
[95]姜曉鋒,張杰文,羅祖明三七三醇皂苷與腦缺血耐受對腦自體神經干細胞增殖的作用[J]. 中國組織工程研究, 2014, 18(37):6014.
[96]Ke C, Chen B, Yang C, et al. Panax notoginseng saponins influence on transplantation of neural stem cellderived dopaminergic neurons in a rat model of Parkinson′s disease[J]. Neural Regen Res, 2008, 3(7):714.
[97] Si Y C, Zhang J P, Xie C E, et al. Effects of Panax notoginseng saponins on proliferation and differentiation of rat hippocampal neural stem cells[J]. Am J Chin Med, 2011, 39(5):999.
[98]Si Y, Zhu J, Huang X, et al. Effects of Panax notoginseng, saponins on proliferation and differentiation of rat embryonic cortical neural stem cells[J]. J Chin Med Assoc, 2016, 79(5):256.
[99]鐘森,陳文超,徐永強,等三七總皂苷對腦缺血再灌注損傷大鼠神經干細胞相關調節因子及腦細胞凋亡的影響[J]. 中國中醫急癥, 2010, 19(2):279.
[100]程龍三七總皂甙對去皮層血管成年大鼠前腦神經干細胞及神經營養因子作用的實驗研究[D]. 北京:北京中醫藥大學, 2003.
[101]祁文 Ihh/Glil通路對大鼠急性脊髓損傷后內源性神經干細胞增殖分化的調控及川芎嗪干預作用研究[D]. 長沙:湖南中醫藥大學, 2013.
[102]祁文,熊鷹,韓杰,等川芎嗪對大鼠脊髓損傷后內源性神經干細胞增殖分化過程中GFAP表達的影響[J]. 大眾科技, 2017, 19(1):53.
[103]Tian Y, Liu Y, Chen X, et al. Tetramethylpyrazine promotes proliferation and differentiation of neural stem cells from rat brain in hypoxic condition via mitogenactivated protein kinases pathway in vitro[J]. Neurosci Lett, 2010, 474(1):26.
[104]馬潞,劉文科,張躍康,等川芎嗪對重型腦損傷組織BDNF、bFGF表達的影響及對神經元的保護作用[J]. 四川大學學報:醫學版, 2008, 39(2):207.
[105]查倩,江瓊,伍亞民,等黃芪多糖含藥血清對神經干細胞增殖和分化的影響[J]. 中藥材, 2015, 38(8):1721.
[106]Yao R, Zhang L, Li X, et al. Effects of Epimedium flavonoids on proliferation and differentiation of neural stem cells in vitro[J]. Neurol Res, 2010, 32(7):736.
[107]高洪泉,王英,張愛清銀杏葉提取物對體外培養大鼠皮層神經干細胞缺糖缺氧/復糖復氧損傷的保護作用[J]. 神經解剖學雜志, 2013, 29(5):491.
[108]程建華,劉雙,韓釗,等 姜黃素通過調控Notch通路促進大鼠腦缺血后神經干細胞增殖和遷移[J]. 中國病理生理雜志, 2013, 29(5):878.
[109]Hitoshi S, Alexson T, Tropepe V, et al. Notch pathway molecules are essential for the maintenance, but not the generation, of mammalian neural stem cells[J]. Genes Dev, 2002, 16(7):846.endprint
[110]Alexson T O, Hitoshi S, Coles B L, et al. Notch signaling is required to maintain all neural stem cell populationsirrespective of spatial or temporal Niche[J]. Dev Neurosci, 2006, 28(1/2):34.
[111]Aguirre A, Rubio M E, Gallo V Notch and EGFR pathway interaction regulates neural stem cell number and selfrenewal[J]. Nature, 2010, 467(7313):323.
[112]Wu Y, Peng H, Cui M, et al. CXCL12 increases human neural progenitor cell proliferation Tthrough Akt1/FOXO3a signaling pathway[J]. J Neurochem, 2009, 109(4):1157.
[113]Zhang Q, Liu G, Wu Y, et al. BDNF promotes EGFinduced proliferation and migration of human fetal neural stem/progenitor cells via the PI3K/Akt pathway[J]. Molecules, 2011, 16(12):10146.
[114]Ojeda L, Gao J, Hooten K G, et al. Critical role of PI3K/Akt/GSK3β in motoneuron specification from human neural stem cells in response to FGF2 and EGF[J]. PLoS ONE, 2011, 6(8):e23414.
[115]Das A, Mallya K, Zhao X, et al. Neural stem cell properties of Miller glia in the mammalian retina:regulation by Notch and Wnt signaling[J]. Dev Biol, 2006, 299(1):283.
[116]Kwon C, Cheng P, King I N, et al. Notch posttranslationally regulates βcatenin protein in stem and progenitor cells[J]. Nat Cell Biol, 2011, 13(10):1244.
[117]陳娉婷,周小青,周德生,等中藥對神經干細胞增殖分化相關信號通路調控的研究進展[J]. 中藥新藥與臨床藥理, 2015(6):859
[責任編輯張寧寧]endprint

