無機相變材料CaCl2·6H2O的過冷特性
何媚質,楊魯偉,張振濤
(1中國科學院理化技術研究所,北京 100190;2中國科學院大學,北京 100049;3熱力過程節能技術北京市重點實驗室,北京 100190)
無機相變材料CaCl2·6H2O的過冷特性
何媚質1,2,楊魯偉1,3,張振濤1,3
(1中國科學院理化技術研究所,北京 100190;2中國科學院大學,北京 100049;3熱力過程節能技術北京市重點實驗室,北京 100190)
CaCl2·6H2O作為一種常見的常溫無機水合鹽相變材料,由于成本低、易獲取、蓄熱強而受到廣泛的關注。按無水CaCl2與H2O的質量比為1.027:1制備了CaCl2·6H2O,經X射線衍射(XRD)表征其晶體結構;通過添加成核劑SrCl2·6H2O和Ba(OH)2對CaCl2·6H2O改性,發現兩者的聯合作用可抑制過冷,10次熔化-冷卻循環平均過冷度1.07℃。采用差示掃描量熱儀(DSC)測定CaCl2·6H2O添加成核劑前后相變潛熱,發現潛熱由223.54 J·g-1降至160.41 J·g-1;為了擴大CaCl2·6H2O相變溫度的范圍,通過添加質量分數分別為5%、10%、15%、20%和25%的MgCl2·6H2O,發現相變溫度隨MgCl2·6H2O質量分數的升高呈線性降低,但不宜超過20%;選取CaCl2·6H2O-20%MgCl2·6H2O二元共晶鹽相變儲熱體系為改性目標,通過添加1% SrCl2·6H2O和0.5% CMC,過冷度降至0.57℃,相變潛熱為 141.09 J·g-1,低于單獨組成鹽 CaCl2·6H2O 的潛熱 223.54 J·g-1和 MgCl2·6H2O 的潛熱 163.35 J·g-1。研究表明,CaCl2·6H2O作為無機相變材料具有顯著的應用價值。
CaCl2·6H2O;相變;制備;過冷;成核;潛熱;MgCl2·6H2O;二元共晶鹽
引 言
熱能儲存體系為當今世界的能源問題提供了行之有效的解決辦法,相變材料作為潛熱儲存媒介用于熱能儲存體系[1]。由于潛熱儲存量大,相變材料不僅能滿足能量需求,還能根據需求隨時隨地釋放能量[2]。目前潛熱儲存技術廣泛應用于各個領域,包括太陽能利用[3-6]、住宅建筑物[7-9]、溫室[10]、空調系統[11-12]、制冷[13]、電子業[14]、紡織業[15-16]等。
相變材料(phase change materials, PCMs)根據物質的屬性可以分為有機相變材料、無機相變材料或共晶體相變材料[17]。對于無機相變材料,常見的為無機水合鹽,無機水合鹽不僅蓄熱能力強、近似等溫相變,且不可燃,因此相比于易燃的有機相變材料,在熱能儲存應用中具有更強的適用性和安全性[18]。
CaCl2·6H2O 作為常見的無機水合鹽相變材料之一,其理論熔點為29.92℃,由于成本低、易獲取、蓄熱強而受到研究者們的青睞,然而過冷和相分離是限制無機水合鹽相變材料廣泛應用的兩大因素[19]。早期,Lane[20]就報道了SrCl2·6H2O能作為CaCl2·6H2O 相變體系的有效成核劑而抑制過冷;Bilen等[21]在CaCl2·6H2O相變體系中添加3%(質量)KNO3作成核劑,發現相變性能有明顯提高;Li等[22]制備了 CaCl2·6H2O/SrCl2·6H2O/EGO 復合相變儲熱體系,通過添加1.0%(質量) EGO,可將過冷度降至1℃以下,且材料具有良好的循環穩定性;Tyaji等[23]研究了pH對CaCl2·6H2O過冷的影響,發現通過調節體系的pH可以降低甚至消除過冷;Tyaji等[24]為了測試CaCl2·6H2O作為相變材料的熱循環穩定性,進行了1000次連續熔化-冷卻實驗后,發現其相變溫度和熔化潛熱變化范圍小,有希望在建筑儲能體系中發揮作用。
雖然相變材料 CaCl2·6H2O 抑制過冷的研究日益成熟,但有關成核劑聯合作用抑制過冷的報道卻相對較少,本研究選取報道較多的SrCl2·6H2O為成核劑之一,聯合加入Ba(OH)2,對CaCl2·6H2O相變材料進行改性,通過熔化-冷卻循環實驗,觀察結晶過程,記錄步冷曲線,分析過冷度變化,而成核劑的加入會因為影響相變材料有效成分而降低相變潛熱值,因此采用差示掃描量熱儀測定添加成核劑前后CaCl2·6H2O的DSC曲線,分析相變潛熱變化。
CaCl2·6H2O的理論熔點為 29.92℃,為了擴大其在室溫范圍內的應用空間,根據文獻[18],CaCl2·6H2O和MgCl2·6H2O形成的二元共晶鹽相變儲熱體系能實現相變溫度的調節。本研究具體分析了MgCl2·6H2O質量分數對相變溫度的影響,并對CaCl2·6H2O-20% MgCl2·6H2O 二元共晶鹽相變材料進行了改性研究,分析了二元共晶鹽相變潛熱相比于單獨組成鹽相變潛熱的變化。
1 實驗材料和方法
1.1 材料
無水CaCl2(AR,國藥集團化學試劑有限公司,中國)、MgCl2·6H2O(AR,國藥集團化學試劑有限公司,中國)、SrCl2·6H2O(AR,國藥集團化學試劑有限公司,中國)、Ba(OH)2(AR,天津市致遠化學試劑有限公司,中國)、硼砂 Na2B4O7·10H2O(AR,國藥集團化學試劑有限公司,中國)、去離子水、羧甲基纖維素鈉CMC(CP,800~1200 mPa·s,上海源葉生物科技有限公司,中國)。
1.2 儀器
X射線衍射儀(D8 focus,Bruker公司,德國)、差示掃描量熱儀(DSC1,Mettler Toledo公司,瑞士)、恒溫冷卻槽(CC-K6 with Pilot ONE,Huber 公司,德國)、電子天平(FA2104N,上海菁海儀器有限公司,中國)、夾套結晶器、研缽、量筒、燒杯、藥勺、玻璃棒。
1.3 制備與分析
1.3.1 CaCl2·6H2O 的制備與表征 用研缽將無水CaCl2研磨成粉末,按無水CaCl2與H2O的質量比為 1.027:1進行取樣,將去離子水倒入燒杯中,分量加入無水CaCl2并攪拌,溶解過程放熱,根據表1所示無水CaCl2的溶解度,放熱有助于無水CaCl2的溶解,溶解完全后,取少量樣品待測XRD,當熔體在室溫下降至35℃后,轉移至20℃冷浴下冷卻,觀察結晶過程,記錄步冷曲線。

表1 無水CaCl2溶解度Table 1 Solubility of anhydrous calcium chloride
1.3.2 CaCl2·6H2O的改性 將研磨的無水CaCl2與H2O按質量比1.027:1進行取樣,將去離子水倒入燒杯中,分量加入無水CaCl2并攪拌至溶解完全后,取少量樣品待測XRD和DSC,加入稱取的成核劑1.5%(質量) SrCl2·6H2O 和 1.5%(質量) Ba(OH)2并攪拌后,取少量樣品待測DSC。當熔體在室溫下降至35℃后,轉移至20℃冷浴下冷卻,觀察結晶過程,記錄步冷曲線,熔化-冷卻過程循環10次后,取少量樣品待測XRD。冷卻實驗裝置如圖1所示。

圖1 冷卻實驗裝置Fig.1 Setup of cooling experiment
1.3.3 CaCl2·6H2O-MgCl2·6H2O 二元共晶鹽相變儲熱體系制備與改性 將研磨的無水CaCl2與H2O按質量比1.027:1進行取樣,MgCl2·6H2O按質量分數分別為5%、10%、15%、20%和25%取樣,將稱取的 MgCl2·6H2O 溶于去離子水中,分量加入無水CaCl2并攪拌至溶解完全,熔體在室溫下降至35℃后,轉移至18℃冷浴下冷卻,觀察結晶過程,記錄步冷曲線。
將CaCl2·6H2O-20% MgCl2·6H2O相變儲熱體系分別加入1%(質量)硼砂和1%(質量) SrCl2·6H2O改性,觀察結晶過程,記錄步冷曲線。改變 1%SrCl2·6H2O 添加順序,先于 MgCl2·6H2O 加入去離子水中,觀察結晶過程,記錄步冷曲線。同時加入1%(質量) SrCl2·6H2O 和 0.5%(質量) CMC 改性,觀察結晶過程,記錄步冷曲線。
分 別 取 樣 MgCl2·6H2O 和 CaCl2·6H2O-20%MgCl2·6H2O-1% SrCl2·6H2O-0.5% CMC,測定 DSC曲線,分析二元共晶鹽相變潛熱相比于單獨組成鹽相變潛熱的變化。
2 實驗結果與討論
2.1 CaCl2·6H2O 的表征
通過X射線衍射儀對制備的CaCl2·6H2O晶體結構進行表征,XRD譜圖見圖2。從圖2中可以發現樣品的特征峰位與標準譜圖特征峰位一致,表明制備的樣品為CaCl2·6H2O。由于本研究采用質量配比法制備CaCl2·6H2O,相比于重結晶法,將降低此次研究的成本,因為通過重結晶法制備CaCl2·6H2O,總有一部分無水 CaCl2溶解在母液中而造成浪費,如果是質量配比法,則無水CaCl2和水都能轉化為CaCl2·6H2O。可能由于無水CaCl2能完全溶于去離子水中,初次熔化-冷卻過程無相分離,而多次循環實驗相分離問題有待進一步研究。CaCl2·6H2O步冷曲線如圖3所示,可發現冷卻過程過冷現象嚴重,沒有發生相變,主要由于溶液澄清,無有效晶核產生。
2.2 成核劑對CaCl2·6H2O過冷的影響

圖2 制備的CaCl2·6H2O XRD譜圖Fig.2 XRD patterns of CaCl2·6H2O prepared

圖3 CaCl2·6H2O步冷曲線Fig.3 Cooling curve of CaCl2·6H2O prepared
由于CaCl2·6H2O本身成核性能較差,如果發生均相成核,過冷度很大,這使得CaCl2·6H2O相變材料的潛熱不能得到有效及時的釋放。根據文獻[25],非均相成核方法眾多,包括冷指法、添加成核劑法、超聲波成核法、彈性勢能法和攪拌法等。這些方法都是為了降低相變材料的過冷度,使潛熱得到有效及時的釋放,延長相變材料使用周期。本研究采取添加成核劑法,選取 SrCl2·6H2O和Ba(OH)2作為防過冷劑,為提高數據信服度,熔化-冷卻過程循環10次。
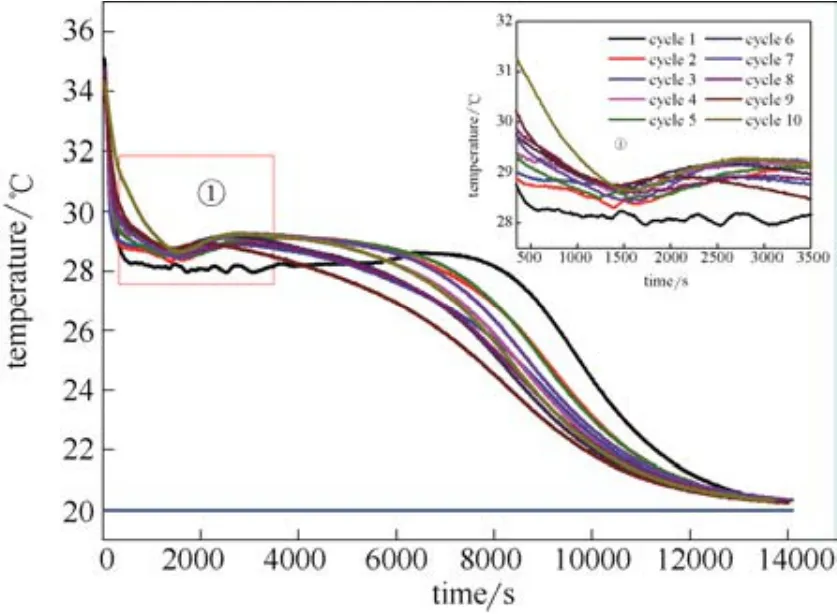
圖4 加入成核劑的CaCl2·6H2O循環10次步冷曲線Fig.4 Cooling curves of CaCl2·6H2O prepared with nucleating agents for 10 cycles

圖5 加入成核劑的CaCl2·6H2O循環10次相變溫度變化Fig.5 Variations of phase change temperature of CaCl2·6H2O prepared with nucleating agents for 10 cycles

表2 加入成核劑的CaCl2·6H2O循環10次冷卻相變特性Table 2 Cooling phase change characteristics of CaCl2·6H2O prepared with nucleating agents for 10 cycles
初始溫度、冷浴溫度、終了溫度、冷浴時間、理論熔點、相變溫度、過冷度如表2所示,循環10次步冷曲線如圖4所示,相變溫度變化如圖5所示。從表2可以看出10次循環實驗條件一致,初始溫度保持在35.00℃,冷浴溫度保持在20.00℃,終了溫度范圍為 20.25~20.84℃,冷浴時間范圍為 207~236 min,相變溫度范圍為28.26~29.05℃,接近理論熔點29.92℃,過冷度范圍為0.87~1.66℃,平均過冷度為 1.07℃,說明成核劑 SrCl2·6H2O 和Ba(OH)2聯合作用能有效地抑制過冷,使相變材料CaCl2·6H2O有效及時地釋放潛熱。根據文獻[25],在結晶過程中,必須形成晶核并且不斷生長,過程才能繼續。均相成核指的是在沒有外部固態表面的幫助下,晶核的形成分散在整個液體表面,且以過冷度作為結晶驅動力,因此過冷度必須大。非均相成核是指在外部固體,例如在其他物質的晶粒、雜質顆粒,或者是在容器和換熱器的凸點等的表面形成晶核,非均相成核要求的過冷度非常小。本研究選擇非均相成核中的添加成核劑法解決過冷問題,成核劑 SrCl2·6H2O 和 Ba(OH)2之間不發生化學反應,屬于物理協同作用,防過冷效果是可以疊加的。從圖4可以看出循環10次的步冷曲線具有重疊性,說明實驗具有復現性,數據具有信服度,10條重疊的步冷曲線在29℃附近有一拐點,在1500 s附近有一小凹槽,通過觀察冷卻結晶實驗現象,熔體在拐點處已發生液-固相變,從容器壁面能看到明顯的白色結晶體,小凹槽說明熔體先小幅降溫后再升溫,小幅降溫跟熔體溫度與冷浴溫度溫差較大有關,而隨著相變的進行,熱量的釋放,熔體溫度逐漸升高至29℃附近,所以認為相變溫度在29℃左右,有待增加熔化-冷卻循環實驗次數以進一步確認此變化趨勢。從圖5可以直觀地看出循環10次相變溫度變化波動小,通過計算,相變溫度的平均值為 28.85℃,標準差為0.22℃。
循環前和循環后樣品XRD譜圖如圖6所示,從圖6中可以發現循環前和循環后樣品的特征峰位與標準譜圖特征峰位一致,表明相變材料CaCl2·6H2O的晶體結構沒有發生變化,具有良好的熱循環穩定性。

圖6 CaCl2·6H2O循環前后XRD譜圖比較Fig.6 Comparison of XRD patterns of CaCl2·6H2O before and after cycling
相變材料CaCl2·6H2O添加成核劑前后DSC熔化曲線如圖7所示,以圖中曲線與水平基線所包含的面積積分得到熔化過程相變潛熱分別為 223.54 J·g-1和 160.41 J·g-1,說明成核劑的添加確實會降低相變材料相變潛熱,但潛熱值仍然較大,具有實際應用價值。

圖7 CaCl2·6H2O添加成核劑前后DSC熔化曲線Fig.7 DSC melting curves of CaCl2·6H2O before and after adding nucleating agents
2.3 不同配比 CaCl2·6H2O-MgCl2·6H2O 二元共晶鹽相變儲熱體系
2.3.1 不同質量分數MgCl2·6H2O對CaCl2·6H2O相變溫度的影響 純 CaCl2·6H2O 相變材料理論熔點為29.92℃,通過2.2節可知CaCl2·6H2O循環10次相變溫度平均值為 28.85℃,為了擴大 CaCl2·6H2O相變溫度范圍,以適應不同應用需求,在CaCl2·6H2O中添加質量分數分別為5%、10%、15%、20%和25%的MgCl2·6H2O,制備二元共晶鹽相變儲熱體系。

圖8 CaCl2·6H2O-(5%、10%、15%、20%、25%)MgCl2·6H2O 步冷曲線Fig.8 Cooling curves of CaCl2·6H2O-(5%, 10%, 15%, 20%,25%) MgCl2·6H2O

表3 CaCl2·6H2O-(5%、10%、15%、20%、25%) MgCl2·6H2O冷卻相變特性Table 3 Cooling phase change characteristics of CaCl2·6H2O-(5%, 10%, 15%, 20%, 25%) MgCl2·6H2O

圖9 MgCl2·6H2O質量分數對CaCl2·6H2O相變溫度的影響Fig.9 Influence of mass fraction of MgCl2·6H2O on phase change temperature of CaCl2·6H2O
初始溫度、冷浴溫度、終了溫度、冷浴時間、相變溫度、過冷度如表3所示,步冷曲線如圖8所示,MgCl2·6H2O質量分數對CaCl2·6H2O相變溫度的影響如圖9所示。從表3可以看出5次實驗條件一致,初始溫度保持在35.00℃,冷浴溫度保持在18.00℃,終了溫度范圍為18.47~19.54℃,冷浴時間范圍為165~225 min,相變溫度范圍為23.20~27.41℃,表明隨MgCl2·6H2O質量分數增加,相變溫度呈下降趨勢,即MgCl2·6H2O的添加能有效地調節CaCl2·6H2O的相變溫度,過冷度范圍為1.20~7.68℃。從圖8可以直觀地看出相變溫度隨MgCl2·6H2O 質量分數增加逐漸降低,但過冷現象明顯,應采取相應措施降低過冷度。從圖9可以看出,添加0%、5%、10%、15%、20% MgCl2·6H2O樣品的相變溫度與MgCl2·6H2O質量分數之間具有一定的線性關系,而添加20% MgCl2·6H2O樣品和25% MgCl2·6H2O樣品的相變溫度接近,從添加25%MgCl2·6H2O 樣品的結晶實驗中也發現,過量的MgCl2·6H2O沉降至容器底部,說明MgCl2·6H2O的添加量應控制在20%以下為佳。取添加0%、5%、10%、15%、20% MgCl2·6H2O樣品的相變溫度與對應的MgCl2·6H2O質量分數作圖,如圖10所示,擬合曲線為

相關系數R2為0.9953,接近1,表明實驗數據和擬合曲線具有很好的相關性。

圖10 CaCl2·6H2O-(0%、5%、10%、15%、20%) MgCl2·6H2O相變溫度與MgCl2·6H2O質量分數的關系Fig.10 Relationship between phase change temperature of CaCl2·6H2O-(0%, 5%, 10%, 15%, 20%) MgCl2·6H2O and mass fraction of MgCl2·6H2O
2.3.2 不同成核劑對 CaCl2·6H2O-20% MgCl2·6H2O過冷的影響 取CaCl2·6H2O-20% MgCl2·6H2O為改性樣品,通過分別添加成核劑硼砂和SrCl2·6H2O比較成核性能,添加 1%硼砂的記為樣品 1,添加1%SrCl2·6H2O的記為樣品2。從表4可以看出添加1%硼砂的 CaCl2·6H2O-20% MgCl2·6H2O 過冷度為3.40℃,而添加 1% SrCl2·6H2O 的 CaCl2·6H2O-20%MgCl2·6H2O 過冷度為 0.91℃,說明在此實驗條件下 SrCl2·6H2O 的成核性能優于硼砂。根據文獻[26-27],如果相變材料與成核劑之間的晶格參數之差小于15%,此成核劑為有效成核劑的可能性大。從結構上看,SrCl2·6H2O帶有6個結晶水,而硼砂帶有10個結晶水,且CaCl2·6H2O、SrCl2·6H2O 和MgCl2·6H2O都屬于六水合氯化鹽,元素Ca、Sr和Mg屬于同主族元素,所以SrCl2·6H2O在結構上更接近 CaCl2·6H2O 和 MgCl2·6H2O,因此能成為CaCl2·6H2O-20% MgCl2·6H2O 的有效成核劑。步冷曲線的比較見圖11,初始溫度保持在35℃,冷浴溫度保持在18℃。

表4 改性的CaCl2·6H2O-20% MgCl2·6H2O冷卻相變特性Table 4 Cooling phase change characteristics of CaCl2·6H2O-20% MgCl2·6H2O modified
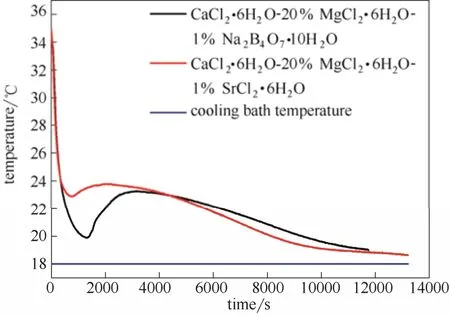
圖11 不同成核劑對CaCl2·6H2O-20% MgCl2·6H2O過冷的影響Fig.11 Influence of different nucleating agents on supercooling degree of CaCl2·6H2O-20% MgCl2·6H2O
2.3.3 成核劑 SrCl2·6H2O 添加順序對 CaCl2·6H2O-20% MgCl2·6H2O 過冷的影響 樣品 3為 1%SrCl2·6H2O先于MgCl2·6H2O添加,從表4可以看出如果1% SrCl2·6H2O先于MgCl2·6H2O添加,過冷度高達6.30℃,在進行冷卻實驗過程中,觀察到樣品溶液澄清且無明顯懸浮物。如果1% SrCl2·6H2O后于MgCl2·6H2O添加,觀察到部分SrCl2·6H2O沉降至容器底部,過冷度為 0.91℃,說明沉降的SrCl2·6H2O有助于晶核的生成,降低了過冷度。步冷曲線的比較見圖12,初始溫度保持在35℃,冷浴溫度保持在18℃。樣品3相變溫度為25.02℃,而其余3樣品相變溫度在23.5℃左右,這可能與其過冷度大造成相變材料放熱不穩定有關。

圖12 SrCl2·6H2O 添加順序對 CaCl2·6H2O-20% MgCl2·6H2O過冷的影響Fig.12 Influence of adding order of SrCl2·6H2O on supercooling degree of CaCl2·6H2O-20% MgCl2·6H2O
2.3.4 成核劑 SrCl2·6H2O 和增稠劑 CMC 共存對CaCl2·6H2O-20% MgCl2·6H2O過冷的影響 由2.3.3節可知,起到防過冷作用的成核劑SrCl2·6H2O大部分是沉降在容器底部的,說明SrCl2·6H2O在樣品溶液中的分散性不佳,主要是由于SrCl2·6H2O受到重力作用而容易發生聚沉,為了提高SrCl2·6H2O的懸浮穩定性,根據文獻[28-30],可以通過添加適量增稠劑羧甲基纖維素鈉CMC以增加溶液的黏度而使SrCl2·6H2O懸浮于溶液內部,促進晶核的生成,從而加快相變材料的結晶放熱,樣品4為同時添加1%SrCl2·6H2O和0.5% CMC,從表4可以看出如果同時添加1% SrCl2·6H2O 和 0.5% CMC,CaCl2·6H2O-20% MgCl2·6H2O 過冷度降至 0.57℃,而不加增稠劑CMC過冷度為0.91℃,說明成核劑SrCl2·6H2O 和增稠劑 CMC的共存能改善CaCl2·6H2O-20% MgCl2·6H2O 的成核性能,進一步降低過冷度。在進行冷卻實驗過程中也發現容器底部沉降物明顯減少。步冷曲線的比較見圖13,初始溫度保持在35℃,冷浴溫度保持在18℃。
2.3.5 二元共晶鹽相變潛熱與單獨組成鹽相變潛熱的比較 CaCl2·6H2O、MgCl2·6H2O、CaCl2·6H2O-20% MgCl2·6H2O-1% SrCl2·6H2O-0.5% CMC 的DSC熔化曲線如圖14所示,以圖中曲線與水平基線所包含的面積積分得到熔化過程相變潛熱分別為223.54、163.35和141.09 J·g-1,說明二元共晶鹽相變潛熱低于單獨組成鹽CaCl2·6H2O和MgCl2·6H2O相變潛熱,但仍然較大,具有實際應用價值。
3 結 論
(1)將研磨的無水 CaCl2與 H2O按質量比1.027:1進行配制,經過XRD表征晶體結構,可得到CaCl2·6H2O,相比于重結晶法,質量配比法制備相變材料CaCl2·6H2O更加經濟。

圖13 增稠劑 CMC 對 CaCl2·6H2O-20% MgCl2·6H2O-1% SrCl2·6H2O過冷的影響Fig.13 Influence of thickener CMC on degree of supercooling of CaCl2·6H2O-20% MgCl2·6H2O-1% SrCl2·6H2O

圖14 CaCl2·6H2O、MgCl2·6H2O 和 CaCl2·6H2O-20% MgCl2·6H2O-1% SrCl2·6H2O-0.5% CMC DSC 熔化曲線Fig. 14 DSC melting curves of CaCl2·6H2O, MgCl2·6H2O and CaCl2·6H2O-20% MgCl2·6H2O-1% SrCl2·6H2O-0.5% CMC
(2)觀察 CaCl2·6H2O 初次結晶過程,無相分離,根據CaCl2·6H2O步冷曲線,冷卻過程沒有發生相變,這將影響潛熱的及時釋放,為解決過冷現象,選取SrCl2·6H2O和Ba(OH)2作為成核劑進行改性,經過10次熔化-冷卻循環實驗,證明SrCl2·6H2O和Ba(OH)2的聯合作用可抑制過冷,平均過冷度為1.07℃,測定CaCl2·6H2O添加成核劑前后DSC熔化曲線,相變潛熱由 223.54 J·g-1降至 160.41 J·g-1,仍然具有實際應用價值。
(3)純CaCl2·6H2O相變材料理論熔點為29.92℃,為了擴大CaCl2·6H2O相變溫度范圍,以適應不同應用需求,分別加入不同質量分數 MgCl2·6H2O形成二元共晶鹽相變儲熱體系,根據步冷曲線,相變溫度隨 MgCl2·6H2O 質量分數的升高呈線性降低,但MgCl2·6H2O不宜超過20%,且存在過冷。
(4)取 CaCl2·6H2O-20% MgCl2·6H2O 為改性目標,發現SrCl2·6H2O成核性能優于硼砂,成核劑均勻懸浮于液體中有助于促進成核,通過添加增稠劑CMC能明顯改善成核劑的懸浮穩定性,進一步降低過冷度,促進相變材料有效及時放熱,分別測定CaCl2·6H2O、MgCl2·6H2O 和兩者二元共晶鹽 DSC熔化曲線,發現二元共晶鹽相變潛熱低于單獨組成鹽相變潛熱,但仍然達到141.09 J·g-1,不影響實際應用。
研究表明,無機水合鹽 CaCl2·6H2O 作為相變材料通過改性處理可以達到實際應用的要求。
[1] FANG G Y, CHEN Z, LI H. Synthesis and properties of microencapsulated paraffin composites with SiO2shell as thermal energy storage materials[J]. Chem. Eng. J., 2010, 163: 154-159.
[2] ?AHAN N, PAKSOY H. Determining influences of SiO2encapsulation on thermal energy storage properties of different phase change materials[J]. Sol. Energy Mater. Sol. Cells, 2017, 159: 1-7.
[3] MAZMAN M, CABEZA L F, MEHLING H,et al. Utilization of phase change materials in solar domestic hot water systems[J]. Renew.Energy, 2009, 34: 1639-1643.
[4] XU B, LI P W, CHAN C. Application of phase change materials for thermal energy storage in concentrated solar thermal power plants: a review to recent developments[J]. Appl. Energy, 2015,160: 286-307.
[5] WANG T, MANTHA D, REDDY R G. Novel low melting point quaternary eutectic system for solar thermal energy storage[J]. Appl.Energy, 2013, 102: 1422-1429.
[6] KENISARIN M, MAHKAMOV K. Solar energy storage using phase change materials[J]. Renew. Sustain. Energy Rev., 2007, 11:1913-1965.
[7] SOARES N, COSTA J J, GASPAR A R,et al. Review of passive PCM latent heat thermal energy storage systems towards buildings’energy efficiency[J]. Energy Build., 2013, 59: 82-103.
[8] KENISARIN M, MAHKAMOV K. Passive thermal control in residential buildings using phase change materials[J]. Renew. Sustain.Energy Rev., 2016, 55: 371-398.
[9] TYAGI V V, PANDEY A K, BUDDHI D,et al. Thermal performance assessment of encapsulated PCM based thermal management system to reduce peak energy demand in buildings[J]. Energy Build, 2016,117: 44-52.
[10] BENLI H, DURMUS A. Performance analysis of a latent heat storage system with phase change material for new designed solar collectors in greenhouse heating[J]. Sol. Energy, 2009, 83: 2109-2119.
[11] WANG X L, DENNIS M. An experimental study on the formation behavior of single and binary hydrates of TBAB, TBAF and TBPB for cold storage air conditioning applications[J]. Chem. Eng. Sci.,2015, 137: 938-946.
[12] AL-ABIDI A A, MAT S B, SOPIAN K,et al. Review of thermal energy storage for air conditioning systems[J]. Renew. Sustain.Energy Rev., 2012, 16: 5802-5819.
[13] GIL A, ORO E, MIRO L,et al. Experimental analysis of hydroquinone used as phase change material (PCM) to be applied in solar cooling refrigeration[J]. Int. J. Refrig., 2014, 39: 95-103.
[14] TAN F L, TSO C P. Cooling of mobile electronic devices using phase change materials[J]. Appl. Therm. Eng., 2004, 24: 159-169.
[15] ALAY S, GODE F, ALKAN C. Synthesis and thermal properties of poly(n-butylacrylate)/n-hexadecane microcapsules using different cross-linkers and their application to textile fabrics[J]. J. Appl. Polym.Sci., 2011, 120(5): 2821-2829.
[16] SARIER N, ONDER E. Organic phase change materials and their textile applications: an overview[J]. Thermochimica Acta, 2012, 540:7-60.
[17] ?AHAN N, FOIS M, PAKSOY H. The effects of various carbon derivative additives on the thermal properties of paraffin as a phase change material[J]. Int. J. Energy Res., 2016, 40: 198-206.
[18] LI G, ZHANG B B, LI X,et al. The preparation, characterization and modification of a new phase change material:CaCl2·6H2O-MgCl2·6H2O eutectic hydrate salt[J]. Sol. Energy Mater.Sol. Cells, 2014, 126: 51-55.
[19] DUAN Z J, ZHANG H Z, SUN L X,et al. CaCl2·6H2O/expanded graphite composite as form-stable phase change materials for thermal energy storage[J]. J. Therm. Anal. Calorim., 2014, 115: 111-117.
[20] LANE G A. Adding strontium chloride or calcium hydroxide to calcium chloride hexahydrate heat storage material[J]. Sol. Energy,1981, 1: 73-75.
[21] BILEN K, TAKGIL F, KAYGUSUZ K. Thermal energy storage behavior of CaCl2·6H2O during melting and solidification[J]. Energy Sources, Part A, 2008, 30: 775-787.
[22] LI X, ZHOU Y, NIAN H G,et al. Phase change behavior of latent heat storage media based on calcium chloride hexahydrate composites containing strontium chloride hexahydrate and oxidation expandable graphite[J]. Appl. Therm. Eng., 2016, 102: 38-44.
[23] TYAGI V V, KAUSHIK S C, PANDEY A K,et al. Experimental study of the supercooling and pH behavior of a typical phase change material for thermal energy storage[J]. Indian J. Pure Appl. Phys.,2011, 49: 117-125.
[24] TYAGI V V, BUDDHI D. Thermal cycle testing of calcium chloride hexahydrate as a possible PCM for latent heat storage[J]. Sol. Energy Mater. Sol. Cells, 2008, 92: 891-899.
[25] 張仁元. 相變材料與相變儲能技術[M]. 北京: 科學出版社, 2008.ZHANG R Y. Phase Change Materials and Phase Change Energy Storage Technology[M]. Beijing: Science Press, 2008.
[26] GUNTHER E, LI H, MEHLING H,et al. Subcooling in PCM emulsions(part 2): Interpretation in terms of nucleation theory[J].Thermochimica Acta, 2011, 522: 199-204.
[27] RHAFIKI T E, KOUSKSOU T, JAMIL A,et al. Crystallization of PCMs inside an emulsion: supercooling phenomenon[J]. Sol. Energy Mater. Sol. Cells, 2011, 95: 2588-2597.
[28] CABEZA L F, SVENSSON G, HIEBLER S,et al. Thermal performance of sodium acetate trihydrate thickened with different materials as phase change energy storage material[J]. Appl. Therm.Eng., 2003, 23: 1697-1704.
[29] HU P, LU D J, FAN X Y,et al. Phase change performance of sodium acetate trihydrate with AlN nanoparticles and CMC[J]. Sol. Energy Mater. Sol. Cells, 2011, 95: 2645-2649.
[30] SHIN H K, PARK M, KIM H Y,et al. Thermal property and latent heat energy storage behavior of sodium acetate trihydrate composites containing expanded graphite and carboxymethyl cellulose for phase change materials[J]. Appl. Therm. Eng., 2015, 75: 978-983.
date:2017-04-27.
YANG Luwei, lwyang2002@mail.ipc.ac.cn
supported by the National Natural Science Foundation of China(21606244).
Supercooling characteristics of inorganic phase change material CaCl2·6H2O
HE Meizhi1,2, YANG Luwei1,3, ZHANG Zhentao1,3
(1Technical Institute of Physics and Chemistry,Chinese Academy of Sciences,Beijing100190,China;2University of Chinese Academy of Sciences,Beijing100049,China;3Beijing Key Laboratory of Thermal Science and Technology,Beijing100190,China)
As a common room temperature inorganic hydrated salt phase change material(PCM), calcium chloride hexahydrate(CaCl2·6H2O) is being widely focused due to its low cost, easy availability and high thermal energy storage. CaCl2·6H2O was prepared in terms of mass ratio of anhydrous CaCl2and H2O as 1.027:1, whose crystal structure was characterized by X-ray diffraction(XRD). CaCl2·6H2O was modified by adding nucleating agents SrCl2·6H2O and Ba(OH)2. The results showed that the combination of SrCl2·6H2O and Ba(OH)2could suppress supercooling phenomenon. The average supercooling degree was 1.07℃ in the process of melting-cooling for 10 cycles. The phase change latent heat of CaCl2·6H2O before and after adding nucleating agents, characterized by differential scanning calorimetry(DSC), decreased from 223.54 J·g-1to 160.41 J·g-1. In order to enlarge the scope of phase change temperature of CaCl2·6H2O, 5%, 10%, 15%, 20% and 25%(mass) magnesium chloride hexahydrate(MgCl2·6H2O) was added into CaCl2·6H2O respectively, which indicated the phase change temperature of CaCl2·6H2O decreased linearly with the increase of MgCl2·6H2O content, however, not exceeding 20%(mass). The modification of CaCl2·6H2O-20% MgCl2·6H2O binary eutectic salt phase change thermal energy storage material was designed by adding 1% SrCl2·6H2O and 0.5% CMC, and the results suggested that the degree of supercooling was reduced to 0.57℃. The phase change latent heat of this material was 141.09 J·g-1, which was lower than that of CaCl2·6H2O(223.54 J·g-1) and MgCl2·6H2O(163.35 J·g-1). The above study showed that inorganic hydrated salt CaCl2·6H2O had significant application value as an inorganic PCM.
CaCl2·6H2O; phase change; preparation; supercooling; nucleation; latent heat; MgCl2·6H2O; binary eutectic salt
TK 02
A
0438—1157(2017)11—4016—09
10.11949/j.issn.0438-1157.20170490
2017-04-27收到初稿,2017-07-31收到修改稿。
聯系人:楊魯偉。
何媚質(1990—),女,博士研究生。
國家自然科學基金項目(21606244)。

