黃頂菊入侵對土壤氨氧化古菌群落多樣性的影響①
李科利,趙曉紅,2,劉紅梅,楊殿林,曲 波,2,皇甫超河*
(1 農業部環境保護科研監測所,天津 300191;2沈陽農業大學植物園藝學院,沈陽 110866)
黃頂菊入侵對土壤氨氧化古菌群落多樣性的影響①
李科利1,趙曉紅1,2,劉紅梅1,楊殿林1,曲 波1,2,皇甫超河1*
(1 農業部環境保護科研監測所,天津 300191;2沈陽農業大學植物園藝學院,沈陽 110866)
為了明確入侵植物黃頂菊對土壤氮循環關鍵過程硝化作用的影響機制,本研究通過對其入侵地和未入侵地、根圍土和根際土氨氧化古菌(ammonia-oxidizing archaea, AOA)的群落多樣性分析,探討了AOA對黃頂菊入侵的響應規律。結果表明:黃頂菊入侵增加了入侵地根圍土AOA的多樣性,AOA的Shannon指數表現為:入侵地根圍土>入侵地根際土>未入侵地土壤,且差異顯著。銨態氮含量與pH的變化都會影響土壤AOA的群落結構。系統發育樹分析表明,土壤AOA主要隸屬于氨氧化古菌的Nitrososphaera cluster。黃頂菊入侵導致的AOA的多樣性水平的提升主要是由于入侵地氨氧化菌群種類增加所致。
黃頂菊;氨氧化古菌;微生物多樣性;根際效應;入侵植物
近年來,外來入侵植物對土壤氮循環影響成為研究熱點之一[1-2]。入侵植物通常傾向于增加土壤氮素的有效性、提高土壤硝化作用速率,即入侵植物和入侵地土壤存在正反饋作用[3]。氨氧化作用(ammonia oxidation),也稱亞硝化作用,是硝化作用的第一個反應步驟,也是限速步驟,是全球氮循環的中心環節[4]。2005年美國科學家首次分離得到一株氨氧化古菌(ammonia-oxidizing archaea,AOA)[5],隨后的研究發現AOA廣泛存在于陸地和海洋生態系統,并且其數量通常遠遠高于氨氧化細菌(ammonia oxidizing bacteria,AOB)[6]。在不同的土壤環境中,如土壤類型、植被類型、土壤pH、土壤銨態氮濃度和土壤有機質含量對不同的氨氧化微生物均有特異的選擇性[7],進而對硝化作用乃至整個氮循環產生影響。AOA和AOB對不同環境因子的響應,可作為潛在環境因子變化的重要指標,對其生態特征的充分認識將為環境質量的變化提供預測、預警。一般認為,AOA較AOB更能夠適應脅迫環境,并在低氧如水稻土和低pH土壤中發揮了重要的作用[8],而AOB則在中性和堿性的旱地土壤中發揮了重要作用[9-10]。He等[11]通過對酸性土壤(pH 3.7 ~ 5.8)的施肥試驗表明,土壤總細菌的數量在長期施肥過程中沒有明顯的變化,而AOA和AOB的種群數量卻發生了顯著的改變;在只施加氮肥的土壤中AOA和AOB的數量最少,而在有機質與氮磷鉀肥混施的土壤中數量最多;而且AOA和AOB的數量、土壤硝化潛勢(PNR)和pH三者之間存在著顯著的正相關關系。不僅如此,AOB的群落結構在各施肥處理之間沒有顯著差異,而AOA的群落結構差異顯著。Di等[12]通過研究高氮草原的土壤氨氧化微生物多樣性發現,施加氮肥沒有影響AOA的豐度和活性,而AOB的豐度和活性與土壤硝化活性呈正相關關系。由此可見,AOA豐度與硝化作用速率呈顯著正相關,相比AOB在表征硝化作用響應環境變化方面似乎起著更為重要的作用[13-14]。如AOA多樣性變化對入侵種互花米草(Spartina alterniflora)響應更為強烈[15]。
外來入侵植物黃頂菊(Flaveria bidentis),菊科黃菊屬,原產于南美洲,2001年首次發現于我國天津、河北,已經蔓延到我國多個省市,對入侵地的植物多樣性和農業生產構成了巨大的威脅[16]。研究顯示,隨著黃頂菊入侵程度的增加,入侵地土壤全氮與銨態氮的含量提高[16],同時降低了土壤AOB 的多樣性,硝化潛勢和硝態氮的含量也都呈下降的趨勢[17],但AOA對黃頂菊入侵的響應尚不明確。鑒于二者生態位差異和互補性[6],本研究選取黃頂菊入侵典型生境,研究其入侵對AOA群落組成和多樣性的影響。
1 材料與方法
1.1 研究區概況
研究區位于天津市靜海縣黃頂菊入侵重發區(38°35' N, 116°42' E),海拔2.4 m,土壤為堿性潮土,處于暖溫帶大陸性季風氣候區,年均氣溫11.8℃,年均降水量582 mm,無霜期193 d。該黃頂菊入侵樣地主要的伴生植物有狗尾草(Setaira viridis)、蘆葦(Phragmites australis)、豬毛菜(Salsola collina)和黃花蒿(Artemisia annua)、鬼針草(Bidens pilosa)等。
1.2 樣地設計與土樣采集
研究區均為黃頂菊危害的典型荒地生境,形狀近方形,面積約0.16 hm2,樣地設計時保證每種類型樣地坡向、光照和土質基本一致。將研究區采樣點分為2種類型樣地。①黃頂菊未入侵樣地(CK):樣地內僅生長有本土植物;②黃頂菊入侵樣地:樣地內黃頂菊發生年限5 a以上,蓋度在60% ~ 100%。兩種類型樣地間隔2 ~ 5 m,對照小區在黃頂菊擴散的前沿(保證除植被因素外其他條件基本一致)。在每個樣地中隨機建立5個面積為5 m × 5 m的小區,每個小區為一個重復,各小區間距離大于5 m。于2012年8月12—15日采集土樣,此時黃頂菊處于初花期,生長旺盛。入侵樣地土樣又分為根際土(rhizosphere soil,RPS)和根圍土(bulk soil,BS)取樣。根際土取樣采用抖落法,將每個小區中的10個植株的根際土混合為一個土樣;根圍土利用5點采樣法,采集0 ~ 10 cm表土,組成一個混合土樣。在取樣前去除地面植物和凋落物等雜質。未入侵樣地采樣方法同入侵樣地根圍土采樣方法。土樣裝于塑料自封袋中用冰盒帶回實驗室。將每個小區采集的土樣過2 mm篩后分成3份,其中一份存置于 -20℃ 冰箱,用于分子生物學試驗;一份存置于4℃ 冰箱,測定速效氮含量;剩余一份置于室內自然風干,用于其他理化性質的測定。
1.3 測定項目與方法
1.3.1 土壤理化性質測定[18]土壤速效氮采用氯化鉀溶液浸提,靛酚藍比色法測定;全氮采用連續流動分析儀(AA3,Germany)測定;有機質采用重鉻酸鉀外加熱法測定;全鉀、速效鉀采用原子吸收分光光度計法測定;pH值采用電位法測定;土壤蛋白酶活性采用茚三酮比色法測定;脲酶活性采用靛酚藍比色法測定。
1.3.2 土壤樣品DNA的提取及PCR擴增 用試劑盒(PowerSoil? DNA Isolation Kit)提取土壤總DNA,按照說明書的最大得率法操作,提取的DNA用1% 瓊脂糖凝膠電泳檢測。采用如表1所示的特異引物擴增得到amoA基因序列片段。PCR反應條件按照94 ℃ 5 min;94 ℃ 1 min,60 ℃ 1 min,72℃1 min,45個循環;72 ℃ 5 min,得到產物為635 bp的片段。
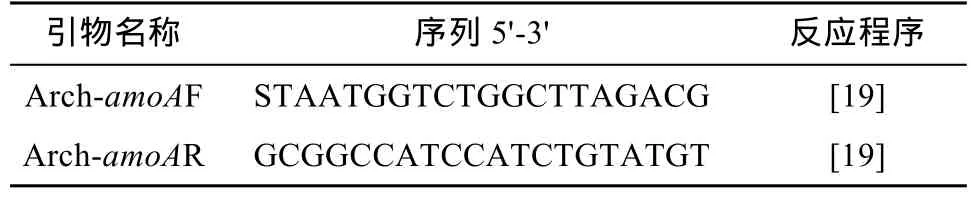
表1 氨氧化古菌PCR擴增引物及其序列
1.3.3 變性梯度凝膠電泳 對上述PCR 產物進行變性梯度凝膠電泳(DGGE)[8]。其中電泳條件為6%聚丙烯酰胺凝膠,變性梯度范圍為20% ~ 70%,所用電泳緩沖液均為1×TAE。將25 μl PCR產物和5 μl 6×loading buffer用微量進樣器加入孔中,150 V、60 ℃條件下電泳5 h。DGGE圖譜用Bio-rad成像系統進行成像。
1.3.4 DGGE條帶測序和系統發育分析 選取主要的DGGE條帶,用不帶GC夾子的Arch-amoAF和Arch-amoAR引物擴增AOA,PCR程序和體系同上。PCR擴增結果用6% 聚丙烯酰胺凝膠電泳檢測。檢測到的陽性克隆交由上海生工測序。將測序結果與NCBI數據庫中的序列進行比對分析,獲得相近典型菌株的基因序列。然后利用Mega 5.0中的鄰接法(Neighbor-Joining)構建AOA的系統發育樹。
1.4 數據處理
DGGE圖像采用Quantity one軟件進行數據化處理。采用Shannon指數(H)、均勻度指數(E)和豐富度指數(S)來評價土壤AOA的amoA基因多樣性。多樣性指數和均勻度指數的計算公式如下:

式中:H為Shannon指數,E為均勻度指數,S為DGGE膠中條帶數目,Pi為第i條帶灰度占該樣品總灰度的比率。豐富度為DGGE膠中條帶的數目。
采用Canoco 4.5軟件包對環境因子與AOA群落結構進行典范對應分析。利用Mega 5.0構建系統發育樹,古菌分類參考Wang等[8]的方法。
2 結果與分析
2.1 土壤氨氧化古菌的DGGE圖譜分析及多樣性分析
土壤AOA的DGGE電泳結果見圖1。各土樣間存在特異性條帶,如條帶l和m為土樣BS和RPS所特有,其余條帶則是3種土樣所共有的條帶,這表明不同土樣存在某些共有的AOA,而某些特異的AOA則只存在于特定土樣中。
對各土樣的AOA進行變性梯度凝膠電泳后計算得到其Shannon多樣性指數(H)(表2),H的排序為:BS > RPS > CK,且差異顯著(P<0.05),說明黃頂菊入侵對于AOA多樣性沒有明顯的根際效應。
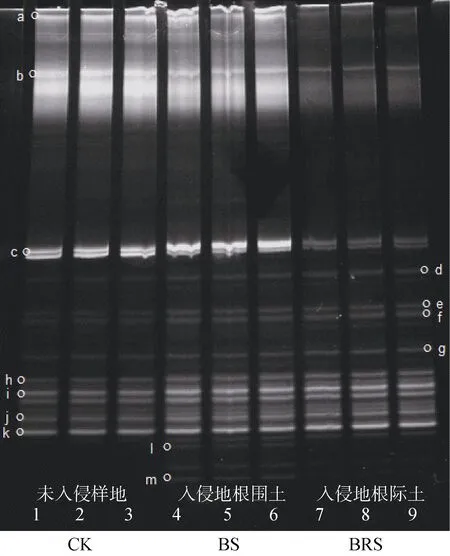
圖1 土壤AOA的DGGE電泳圖譜
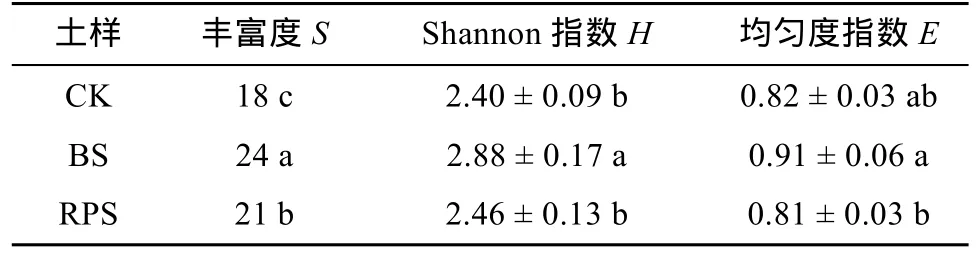
表 2 土壤AOA豐富度、Shannon指數和均勻度指數
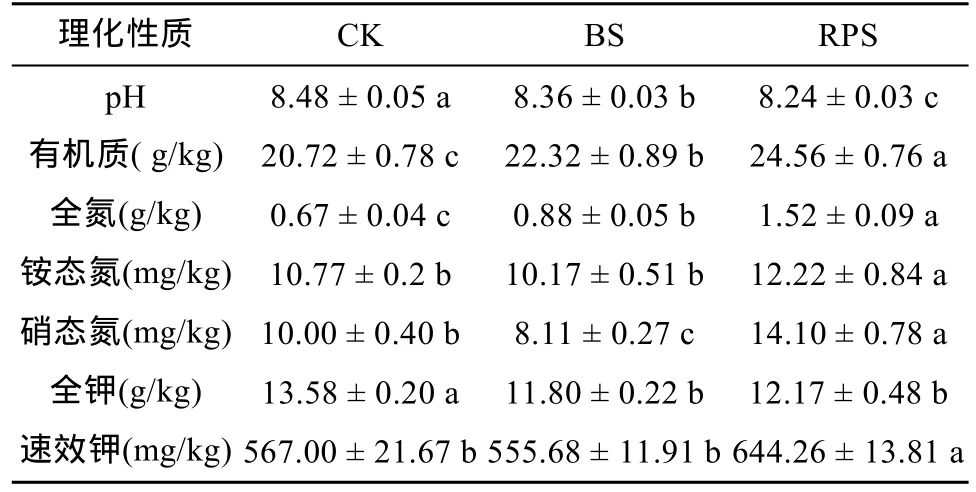
表3 黃頂菊入侵對土壤理化性質的影響[17]
2.2 土壤氨氧化古菌的測序及系統發育樹的構建
本研究共割取13條主要DGGE條帶,將測序得到的13個陽性克隆與Genbank中AOA序列進行比對,結果表明,13個條帶的序列與已知序列的相似性均較高,相似度為97% ~ 100%。利用Mega軟件對所有條帶及已知序列進行系統發育樹(圖2)的構建,分析發現測得的序列均隸屬于Nitrososphaera類群中亞類10(Nitrososphaera subcluster 10)。
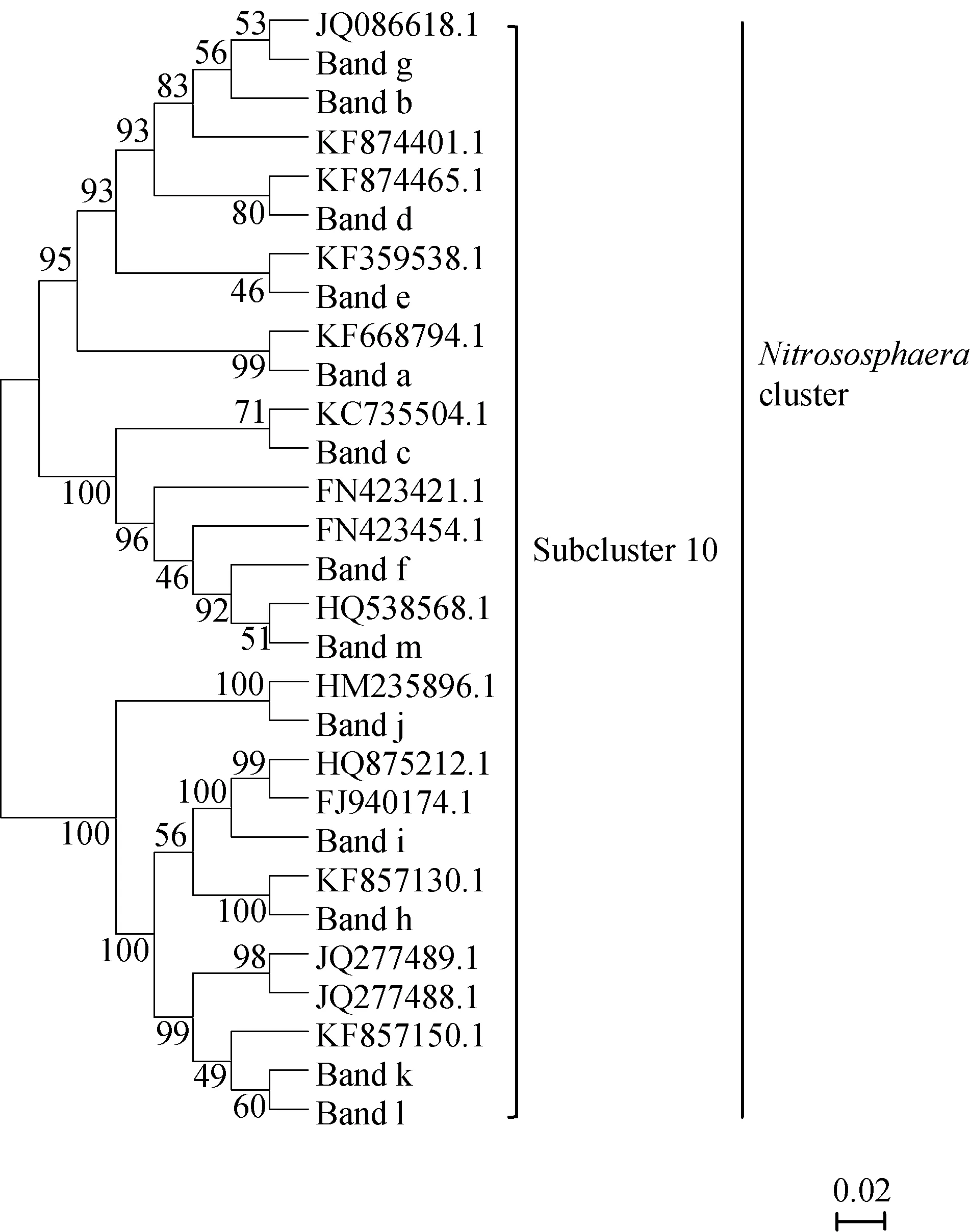
圖2 土壤AOA系統發育樹(鄰接法)
2.3 土壤氨氧化古菌的amoA基因與土壤理化因子間的典范相關分析
為進一步解釋AOA的群落結構與環境因子之間的關系,將AOA的指數H與土壤各項理化指標(表3)相結合進行典范相關分析(圖3),其中以銨態氮對其影響最大,與第1軸相關系數為0.695 1,而土壤pH與第1軸呈負相關關系,相關系數為 -0.349 2;第2軸則反映了AOA在有機質(r=0.560 2)和速效鉀(r=0.482 7)梯度上的變化。經蒙特卡洛檢驗(Monte Carlo permutation test)發現銨態氮(P=0.003)能夠解釋AOA的多樣性,具有95% 以上的置信度,說明土壤銨態氮含量是影響AOA多樣性指數H的關鍵理化因子。
3 討論
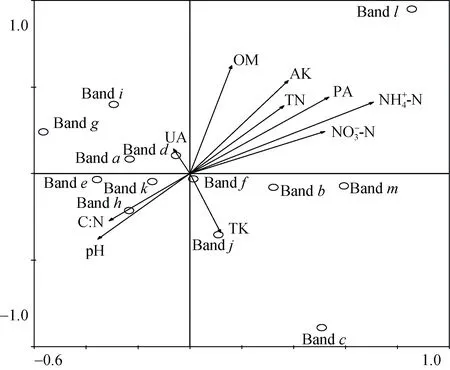
圖3 典范對應性分析
土壤多樣性是生物多樣性的基礎[20],入侵植物可以通過影響生境土壤微生物群落的結構,從而創造對自身有利的條件,進而影響入侵地生物多樣性。如入侵種加拿大一枝黃花(Solidago canadenis)能夠快速高效地獲得養分,以創造有利于其入侵的土壤環境[21]。入侵植物會改變微生物的活性、豐度、群落組成、微生物的氮循環,影響生態系統的功能,從而在抑制本土植物生長的同時促進其自身生長[22]。外來入侵植物互花米草(Spartina alterniflora)顯著提供入侵地AOA的群落多樣性,而對AOB無明顯影響[15]。趙曉紅等[17]研究發現,黃頂菊入侵降低了非根際土AOB的多樣性,但由于根際效應的存在,使得RPS的多樣性最高。土壤中PNR可以作為表征AOA豐富度重要因子[23],Zhang等[15]對互花米草的研究表明,在互花米草入侵土壤中PNR和AOA的豐富度均降低。以往的研究表明,黃頂菊入侵土壤中PNR呈下降趨勢[17],與AOB不同,在本研究中,AOA隨著黃頂菊的入侵土壤多樣性水平顯著升高,且根圍土AOA的豐富度大于根際土AOA的豐富度,因此黃頂菊入侵對AOA影響的根際效應并不明顯。
對黃頂菊入侵地影響AOB群落的多樣性影響最大的是土壤速效氮含量[16]。有研究發現酸性土壤中施用銨態氮肥可以促進AOB的豐度與多樣性,降低AOA的豐度[24]。本研究中銨態氮同樣是影響AOA多樣性指數的關鍵理化因子,二者呈顯著負相關(r=-0.566;P<0.05)。另一方面,土壤AOA、AOB多樣性水平與pH變化關系密切。Weijers等[25]對全球范圍內58種土壤樣品的分析表明,泉古菌的豐度與土壤pH具有較好的負相關。Nicol等[26]發現當土壤pH為4.9 ~ 7.5時,AOA amoA基因的拷貝數及活性均隨土壤pH的降低而升高,且隨著土壤pH的下降AOB的多樣性明顯下降。本試驗中,AOA多樣性隨土壤pH的下降呈上升趨勢,這也表明黃頂菊入侵導致的土壤pH的下降[16]可能是AOA多樣性水平升高的原因之一。
總之,通過對黃頂菊入侵地和未入侵地土壤AOB、AOA的PCR-DGGE對比分析比較,發現黃頂菊入侵影響了氨氧化微生物的群落豐富度及多樣性,其中在降低入侵地AOB多樣性水平[17]的同時增加了AOA的多樣性水平。特別是入侵地AOA/AOB高于對照樣地,且AOA的多樣性變化主要受土壤銨態氮和土壤pH的影響,這些變化可能有利于其進一步入侵。本研究提供了黃頂菊入侵和土壤生態系統功能氨氧化微生物群落構成及土壤硝化潛勢改變存在聯系的直接證據,該結論也解釋了其對銨態氮偏好利用的微生物學機制[27],而入侵地土壤理化性質的改變則可能是由于黃頂菊入侵引起了氨氧化微生物群落消長變化所致。
4 結論
1) 黃頂菊入侵通過增加入侵地氨氧化菌群種類,提升了AOA的多樣性水平。
2) 銨態氮含量與pH變化均影響土壤AOA的群落結構。
[1] Ehrenfeld J G. Effects of exotic plant invasions on soil nutrient cycling processes[J]. Ecosystems, 2003, 6(6): 503-523
[2] Windham L, Ehrenfeld J G. Net impact of a plant invasion on nitrogen cycling processes within a brackish tidal marsh[J]. Ecological Applications, 2003, 13(4): 883-897
[3] Mack M C, D’Antonio C M, Ley R E. Alteration of ecosystem nitrogen dynamics by exotic plants: a case study of C4grasses in Hawaii[J]. Ecological Applications, 2001,11(5): 1323-1335
[4] 王敬, 程誼, 蔡祖聰,等. 長期施肥對農田土壤氮素關鍵轉化過程的影響[J]. 土壤學報, 2016, 53(2): 292-304
[5] K?nneke M, Bernhard A E, Jr D L T, et al. Isolation of an autotrophic ammonia-oxidizing marine archaeon[J]. Nature,2005, 437(7058): 543-546
[6] Leininger S, Urich T, Schloter M, et al. Archaea predominate among ammonia-oxidizing prokaryotes in soils[J].Nature, 2006, 442(7104): 806-809
[7] Jordan F L, Cantera J J L, Fenn M E, et al. Autotrophic ammonia-oxidizing bacteria contribute minimally to nitrification in a nitrogen-impacted forested ecosystem[J].Applied and Environmental Microbiology, 2005, 71(1):197-206
[8] Wang B Z, Zhao J, Guo Z, et al. Differential contributions of ammonia oxidizers and nitrite oxidizers to nitrification in four paddy soils[J]. The ISME Journal, 2015, 9(5):1062-1075
[9] Jia Z J, Conrad R. Bacteria rather than Archaea dominate microbial ammonia oxidation in an agricultural soil[J].Environmental Microbiology, 2009, 11(7):1658-1671
[10] Xia W W, Zhang C X, Zeng X W, et al. Autotrophic growth of nitrifying community in an agricultural soil[J].The ISME Journal, 2011, 5(7): 1226-1236
[11] He J Z, Shen J P, Zhang LM, et al. Quantitative analyses of the abundance and composition of ammonia-oxidizing bacteria and ammonia-oxidizing archaea of a Chinese upland red soil under long-term fertilization practices[J].Environrnental Microbiology, 2007, 9(9): 2364-2374
[12] Di H J, Cameron K C, Shen J P, et al. Alysimeter study of nitrate leaching from grazed grassland as affected by a nitrification in hibitor, dicy andiamide, and relationships with ammonia oxidizing bacteria and archaea[J]. Soil Use and Management, 2009, 25: 454-461
[13] Zhang L M, Offre P R, He J Z, et al. Autotrophic ammonia oxidation by soil thaumarchaea[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(40): 17240-17245
[14] Zhalnina K, de Quadros P D, Camargo F A, et al. Drivers of archaeal ammonia-oxidizing communities in soil[J].Frontiers in Microbiology, 2012, 3: 210
[15] Zhang Q F, Peng J J, Chen Q, et al. Impacts of Spartina alterniflora invasion on abundance and composition of ammonia oxidizers in estuarine sediment[J]. Journal of Soils & Sediments, 2011, 11(6): 1020-1031
[16] 張天瑞, 皇甫超河, 白小明, 等. 黃頂菊入侵對土壤養分和酶活性的影響[J]. 生態學雜志, 2010, 29(7): 1353-1358[17] 趙曉紅, 楊殿林, 曲波, 等. 黃頂菊入侵對土壤氨氧化細菌群落結構及多樣性的影響[J]. 生態學雜志, 2014,33(6): 1492-1500
[18] 魯如坤. 土壤農業化學分析方法[M]. 北京: 中國農業科技出版社, 2000
[19] Christopher A F, Kathryn J R, J. Michael B, et al. Ubiquity and diversity of ammonia-oxidizing archaea in water columns and sediments of the ocean[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(41): 14683-14688
[20] 任圓圓, 張學雷. 土壤多樣性研究趨勢與未來挑戰[J].土壤學報, 2015, 52(1): 9-18
[21] 梁雷, 葉小齊, 吳明, 等. 加拿大一枝黃花入侵對杭州灣濕地圍墾區土壤養分及活性有機碳組分的影響[J]. 土壤, 2016, 48(4):680-685
[22] Shannon-Firestone S, Reynolds H L, Phillips R P, et al.The role of ammonium oxidizing communities in mediating effects of an invasive plant on soil nitrification[J]. Soil Biology & Biochemistry, 2015, 90: 266-274
[23] Caffrey J M, Bano N, Kalanetra K, et al. Ammonia oxidation and ammonia-oxidizing bacteria and archaea from estuaries with differing histories of hypoxia[J]. The ISME Journal, 2007, 1(7): 660-662
[24] 魏天嬌, 魏志軍, 陳鵬, 等. 氮肥形態對香蕉種植土壤中氨氧化細菌與古菌的影響[J]. 土壤, 2015, 47(4): 690-697
[25] Weijers J W H, Schouten S, Spaargaren O C, et al.Occurrence and distribution of tetraether membrane lipids in soils: Implications for the use of the TEX 86proxy and the BIT index[J]. Organic Geochemistry, 2006,37(12):1680-1693
[26] Nicol G W, Leininger S, Schleper C, et al. The influence of soil pH on the diversity, abundance and transcriptional activity of ammonia oxidizing archaea and bacteria[J].Environmental microbiology, 2008, 10(11): 2966-2978
[27] Huangfu C H, Li H Y, Chen X W, et al. Response of an invasive plant, Flaveria bidentis, to nitrogen addition: a test of form-preference uptake[J]. Biological Invasions,2016, 18(11): 3365-3380
Effects of Flaveria bidentis Invasion on Diversity of Soil Ammonia-oxidizing Archaea
LI Keli1, ZHAO Xiaohong1,2, LIU Hongmei1, YANG Dianlin1, QU Bo1,2, HUANGFU Chaohe1*
(1 Agro-Environmental Protection Institute, Ministry of Agriculture, Tianjin 300191, China;2 College of Horticulture, Shenyang Agricultural University, Shenyang 110866, China)
To understand the effects of invasive plant Flaveria bidentis on nitrification processes, the community structures of soil ammonia-oxidizing archaea (AOA) were investigated using the method of PCR-DGGE in a Flaveria bidentis invaded habitat in Jinghai County of Tianjin, China. The results showed that the diversity of AOA community tended to increase with F.bidentis invasion. The Shannon diversity indexes (H) of AOA were in an order of invaded bulk soil > invaded rhizosphere soil >non-invaded soil, with significant differences detected. Ammonium nitrogen and pH value were the key factors determining the community structure of AOA. All identified AOA belonged to Nitrososphaera cluster, the presence of specific ammonia-oxidizing archaea mainly contributed to higher diversity of AOA found in F. bidentis-invaded soil.
Flaveria bidentis; Ammonia-oxidizing archaea; Microbial diversity; Rhizosphere effect; Invasive plant
S154. 3
A
10.13758/j.cnki.tr.2017.05.029
天津市自然科學基金項目(12JCQNJC09800)和公益性行業(農業)科研專項經費項目(201103027;200803022)資助。
* 通訊作者(huangfu24@163.com)
李科利(1990—),女,河南鞏義人,碩士研究生,研究方向為入侵植物生態學。E-mail: 1763565935@qq.com

