建蘭花葉病毒和齒蘭環(huán)斑病毒聯(lián)合免疫膠體金試紙條的研制及應(yīng)用
于子翔, 李 麗, 俞祿珍, 楊翠云, 吳建祥, 黃衛(wèi)昌, 于 翠*
(1. 上海出入境檢驗檢疫局, 上海 200135; 2. 上海辰山植物園, 上海 201602; 3. 浙江大學生物技術(shù)研究所, 杭州 310058)
建蘭花葉病毒和齒蘭環(huán)斑病毒聯(lián)合免疫膠體金試紙條的研制及應(yīng)用
于子翔1, 李 麗2, 俞祿珍1, 楊翠云1, 吳建祥3, 黃衛(wèi)昌2, 于 翠1*
(1. 上海出入境檢驗檢疫局, 上海 200135; 2. 上海辰山植物園, 上海 201602; 3. 浙江大學生物技術(shù)研究所, 杭州 310058)
為了實現(xiàn)蘭花種植苗圃和口岸一線直接檢測樣品中建蘭花葉病毒Cymbidiummosaicvirus(CymMV)和齒蘭環(huán)斑病毒Odontoglossumringspotvirus(ORSV)的目的,我們研制了上述兩種病毒聯(lián)合免疫膠體金檢測試紙條。采用檸檬酸三鈉還原法制備膠體金顆粒,標記單抗C10并固定于膠金墊上;將抗體5B7和4F3分別固定于硝酸纖維素膜上作為檢測線,將羊抗鼠抗體包被固定于硝酸纖維素膜上作為質(zhì)控線,經(jīng)優(yōu)化后組裝膠體金試紙條。結(jié)果表明研制的聯(lián)合試紙條特異性強,能夠在10 min之內(nèi)同時檢出兩種病毒,操作簡便。對兩個種植苗圃的93份蘭花樣品進行實際檢測所得結(jié)果與ELISA的檢測結(jié)果符合性好(Kappa值分別為84.6%和86.7%),能滿足蘭花樣品中建蘭花葉病毒和齒蘭環(huán)斑病毒的初篩要求。
建蘭花葉病毒; 齒蘭環(huán)斑病毒; 聯(lián)合免疫膠體金試紙條
隨著人民生活水平的提高,國人對蘭花的品種和數(shù)量都有相當大的需求。然而病蟲害特別是病毒的侵染會嚴重影響蘭花的品質(zhì)。目前至少有28種病毒曾被記錄可侵染蘭科植物,其中各項特性已被清楚掌握,分類地位明確的有建蘭花葉病毒Cymbidiummosaicvirus(CymMV)、齒蘭環(huán)病毒Odontoglossumringspotvirus(ORSV)、黃瓜花葉病毒Cucumbermosaicvirus(CMV)、煙草花葉病毒Tobaccomosaicvirus(TMV)、煙草脆裂病毒Tobaccorattlevirus(TRV)、番茄環(huán)斑病毒Tomatoringspotvirus(ToRSV)、番茄斑萎病毒Tomatospottedwiltorthotospovirus(TSWV)、鳳仙花壞死斑病毒Impatiensnecroticspotorthotospovirus(INSV)、建蘭環(huán)斑病毒Cymbidiumringspotvirus(CymRSV)、菜豆黃花葉病毒Beanyellowmosaicvirus(BYMV)、蕪菁花葉病毒Turnipmosaicvirus(TuMV)、三葉草黃脈病毒Cloveryellowveinvirus(CYVV)和蘭花斑點病毒Orchidfleckdichorhavirus(OFV)等13種[1-2],而對于蘭花上最近發(fā)生的辣椒褪綠病毒Capsicum chlorosis virus (CaCV)、石斛脈壞死病毒Dendrobium vein necrosis virus (DVMV)和蝶蘭褪綠斑病毒Phalaenopsis chlorotic spot virus(PhCSV)等15種病毒的分類地位、傳播方式及侵染過程等尚不十分明確。
針對侵染蘭花的病毒檢測,酶聯(lián)免疫吸附(ELISA)和RT-PCR分子檢測應(yīng)用較為普遍[3-6]。這兩種方法特異性較強且靈敏度高,但是需要一定的試驗場所、儀器設(shè)備,不適合口岸一線及苗圃的現(xiàn)場檢測。免疫層析膠體金試紙條檢測是一種簡便、靈敏、適合現(xiàn)場快速檢測的方法,目前已有侵染葫蘆科的4種病毒的免疫膠體金試紙條研制成功[7],但均無成功應(yīng)用報告,此外還有煙草環(huán)斑病毒和番茄環(huán)斑病毒聯(lián)合免疫膠體金試紙的研制8]等。在蘭花病毒病的發(fā)生中以CymMV和ORSV最為普遍,危害也最大,而CymMV和ORSV的復合膠體金免疫層析試紙條的研究尚未見報道,因此研制這兩種主要蘭花病毒的試紙條可以快速篩查出帶病植株,將在我國蘭花的進出境口岸一線和蘭花種植苗圃中發(fā)揮重要作用。
1 材料與方法
1.1 病毒來源
建蘭花葉病毒和齒蘭環(huán)斑病毒陽性對照購自美國Agdia公司,用于試紙條的靈敏度檢測;南芥菜花葉病毒、黃瓜花葉病毒、番茄花葉病毒陽性對照購自美國Agdia公司,用于驗證試紙條檢測的特異性;辰山植物園蘭花培養(yǎng)溫室、孫橋農(nóng)業(yè)園區(qū)蘭花種植苗圃采集的樣品用于驗證試紙條檢測的準確性。
1.2 膠體金的制備、鑒定
采用常規(guī)的氯金酸-檸檬酸三鈉還原法制備膠體金。具體制備和鑒定過程參考魏梅生等的方法[8-10]。將燒制的膠體金溶液用紫外-可見光分光光度計(島津UV-2450)進行全波長掃描鑒定。
1.3 抗體配對篩選
先將所有抗體分別稀釋至2 mg/mL,然后分別標記和包被,CymMV采用4×4配對,ORSV采用6×6配對,組裝簡易試紙條進行抗體配對篩選。
1.4 免疫膠體金試紙條制備工藝優(yōu)化
著重對標記量、標記pH、復溶液配方、膠體金與抗體配比量進行優(yōu)化,具體優(yōu)化過程參照魏梅生等的文獻進行[9]。
1.4.1 免疫膠體金制備及條件優(yōu)化
取10支潔凈小試管分別加入1 mL膠體金,用0.2 mol/L K2CO3分別調(diào)節(jié)pH至5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0,加入不同濃度的待標記單抗50 μL,使其終濃度分別為5、7.5、10、12.5、15 μg/mL,混勻后室溫靜置反應(yīng)15 min,加入100 μL 10% NaCl溶液,觀察顏色變化。根據(jù)結(jié)果確定免疫膠體金的最適pH及抗體標記量。標記了膠體金后的單抗加入10%BSA封閉15 min,離心棄上清,用復溶液復溶沉淀至合適的比例,用噴金儀器涂在玻璃纖維紙上,制作膠金墊。
1.4.2 檢測線和質(zhì)控線
用0.02 mol/L PBS(pH 7.4)將CymMV和ORSV單克隆抗體稀釋到1.0 mg/mL,劃線于硝酸纖維素膜(NC膜)上,作為檢測線(test line)。T1線為ORSV的檢測線,T2線為CymMV的檢測線。用0.02 mol/L PBS(pH 7.4)將羊抗鼠IgG分別稀釋到1.0 mg/mL,劃線在硝酸纖維素膜上,37℃烘干,作為質(zhì)控線(control line),簡稱C線。
1.5 試紙條組裝
以硝酸纖維素膜作為固相載體,用1.3篩選出的ORSV特異性單抗制作檢測線T1,CymMV特異性單抗制作檢測線T2,羊抗鼠二抗制作質(zhì)控線C,包被在硝酸纖維素膜上(圖1)。
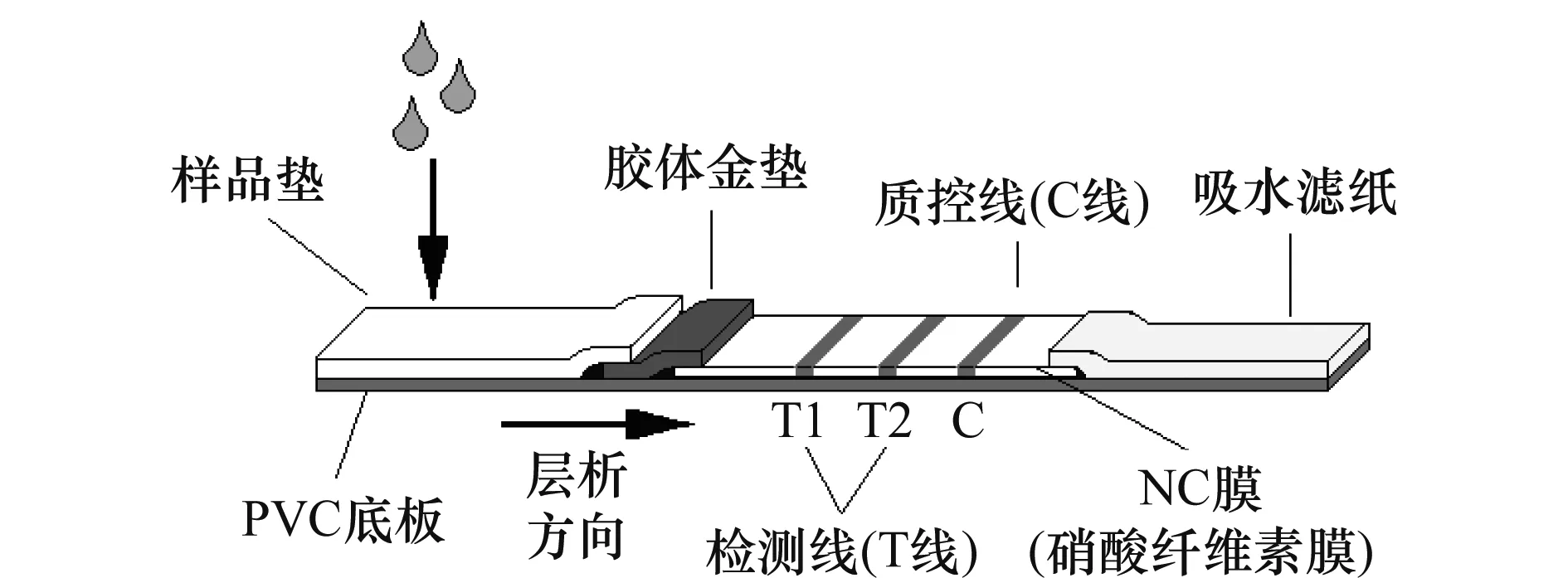
圖1 聯(lián)合免疫膠體金試紙條工藝設(shè)計圖Fig.1 Design of the complex gold immunochromatography assay stripe
用1.4.1篩選出的ORSV/CymMV通用型單抗C10制作成膠金墊。將包被膜和膠金墊配以樣品墊、吸水濾紙、PVC底板等制作成大板,然后用切條機切割成一定寬度的試紙條,裝卡、裝袋、包裝。
1.6 試紙條的質(zhì)量檢測
1.6.1 特異性檢測
分別將建蘭花葉病毒、齒蘭環(huán)斑病毒、南芥菜花葉病毒、黃瓜花葉病毒、番茄花葉病毒陽性對照按照說明與2 mL的PBS緩沖液混勻,低速離心5 min,上清即為制備好的待檢樣品。將上述溶液取60 μL滴于加樣孔中進行檢測,每種病毒重復2次。
1.6.2 靈敏度檢測
取CymMV和ORSV陽性對照進行倍比稀釋獲得10倍、20倍、40倍、80倍、160倍、320倍、640倍和1 280倍的樣品稀釋液,分別用試紙條進行靈敏度檢測,測試方法同1.6.1。
1.7 蘭花樣品檢測
分別在辰山植物園蘭花培養(yǎng)溫室、孫橋農(nóng)業(yè)園區(qū)蘭花種植苗圃采集有癥狀樣品,利用免疫膠體金試紙條及DAS-ELISA方法分別進行檢測,將結(jié)果進行對比分析,若結(jié)果不一致,再利用RT-PCR方法進行驗證。
1.8 Kappa值計算
Kappa值用于評價兩種不同方法的檢測結(jié)果是否具有一致性,是描述檢測一致性較為理想的指標。本文采用不帶加權(quán)的計算方法評價DAS-ELISA和免疫膠體金試紙條的一致性。Kappa=(Po-Pc)/(1-Pc),其中Po為實際一致率,Pc為理論一致率。Po=(a+d)/n;Pc=[(a+b)(a+c)+(c+d)(b+d)]/n2。
表1Kappa值計算表格
Table1TableforcalculatingthevalueofKappa

方法1Method1方法2 Method2陽性數(shù)量/份Positivesamplenumbers陰性數(shù)量/份Negativesamplenumbers合計Total陽性數(shù)量Positivesamplenumbersabg1陰性數(shù)量Negativesamplenumberscdg2合計Totalf1f2n
2 結(jié)果與分析
2.1 抗體配對篩選
抗體經(jīng)過純化后分別通過4×4和6×6的交叉配對反應(yīng),確定CymMV的C10與5B7、ORSV的4F3和6B4配對最佳。將上述4株單抗分別組合,制作二合一試紙條。利用該試紙條分別檢測CymMV和ORSV,結(jié)果發(fā)現(xiàn)兩個病毒之間存在嚴重的交叉反應(yīng),結(jié)果無法判定。進一步研究分析,單抗C10與ORSV存在明顯的交叉反應(yīng),因此可利用此特性,將C10作為通用型抗體用來制作膠體金,然后再用CymMV和ORSV特異性單抗分別制作檢測線。經(jīng)進一步篩選,確定最佳配對方式為:膠體金標記C10—分別包被4F3和5B7作為T1和T2檢測線。
2.2 免疫膠體金試紙條優(yōu)化參數(shù)
經(jīng)過試驗,免疫膠體金試紙條的條件優(yōu)化如下:膠體金制備按照V氯金酸(1%)∶V檸檬酸三鈉(1%)=1∶1的比例燒制,粒徑約40 nm;單抗C10標記量為10 μg/mL,標記pH為8.0;金標記物復溶液配方為: 0.1 mol/L Tris+10%蔗糖+1%PVP+1%BSA+0.5% Tween-20,鹽酸調(diào)pH至8.5;膠體金復合物濃縮比例為100 μL/mL;膠體金復合物噴涂量為10 μL/cm;檢測線T1,單抗4F3濃度為1.5 mg/mL;檢測線T2,單抗5B7濃度為1.5 mg/mL;質(zhì)控線,羊抗鼠IgG濃度為1.5 mg/mL;檢測線T1、T2和質(zhì)控線劃膜量均為1 μL/cm。
2.3 試紙條特異性
分別使用滴管滴加建蘭花葉病毒和齒蘭環(huán)斑病毒陽性對照約60~100 μL后,相應(yīng)病毒的檢測線及質(zhì)控線出現(xiàn)明顯條帶;兩種病毒陽性對照混合后各取50 μL加入檢測孔后,兩條檢測線和質(zhì)控線均出現(xiàn)明顯條帶;加入南芥菜花葉病毒、黃瓜花葉病毒、番茄花葉病毒的陽性對照,僅質(zhì)控線出現(xiàn)條帶,因此本試紙條具有較好的特異性。
2.4 試紙條靈敏度
分別將稀釋10、20、40、80、160、320、640、1 280倍的CymMV和ORSV陽性對照滴加于樣品孔檢測試紙條的靈敏度。結(jié)果發(fā)現(xiàn)試紙條可檢測稀釋至40倍的齒蘭環(huán)斑病毒汁液,而建蘭花葉病毒汁液稀釋至160倍仍可以檢測到。
2.5 DAS-ELISA檢測與免疫膠體金試紙條的檢測比對結(jié)果
從辰山植物園采集帶有癥狀的蘭花樣品7份,分別進行免疫膠體金試紙條檢測和DAS-ELISA檢測,結(jié)果(表2)表明,除7#樣品外,DAS-ELISA檢測與免疫膠體金檢測結(jié)果基本一致,反應(yīng)程度也基本一致。7#樣品ORSV試紙條檢測為陰性,而DAS-ELISA檢測為陽性,對該樣品進行RT-PCR檢測,結(jié)果為陽性,這一結(jié)果表明免疫膠體金試紙條對ORSV的檢測靈敏度較低,有可能出現(xiàn)假陰性結(jié)果。
表2蘭花樣品DAS-ELISA和免疫膠體金試紙條檢測結(jié)果比較1)
Table2DetectionresultofDAS-ELISAandcomplexgold-immunochromatographyassaystripes
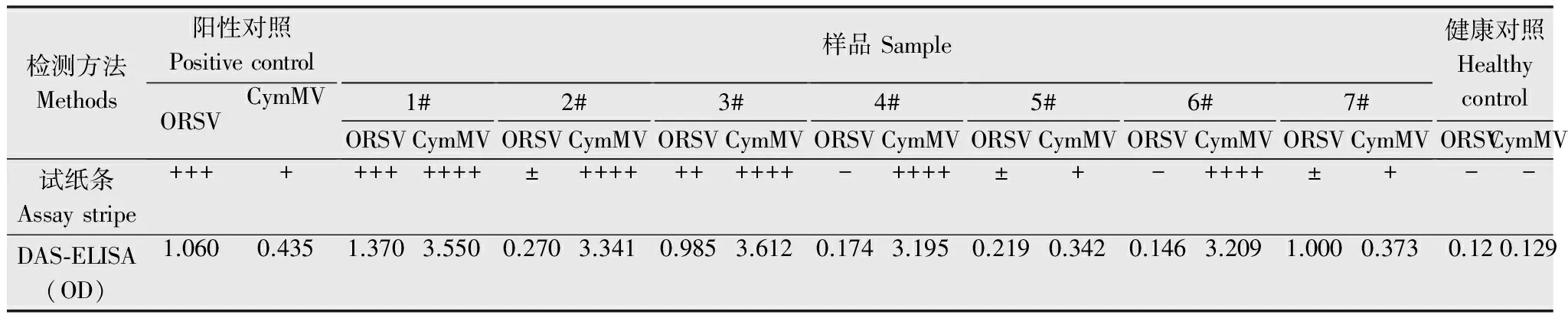
檢測方法Methods陽性對照PositivecontrolORSVCymMV樣品Sample1#ORSVCymMV2#ORSVCymMV3#ORSVCymMV4#ORSVCymMV5#ORSVCymMV6#ORSVCymMV7#ORSVCymMV健康對照HealthycontrolORSVCymMV試紙條Assaystripe+++++++++++±++++++++++-++++±+-++++±+--DAS?ELISA(OD)1.0600.4351.3703.5500.2703.3410.9853.6120.1743.1950.2190.3420.1463.2091.0000.3730.120.129
1) “+”表示試紙條檢測線顏色的深淺,+越多,表明病毒含量越高; “±”表示試紙條檢測線顏色肉眼不易判定;“-”表示未檢出。OD值為酶標儀在405 nm波長下測得的數(shù)值。
“+” means the depth of the color of the test line, more “+”, more virus; “±” means the test line cannot be determined with eyes; “-” means the result was not detected. OD value is the absorption values under wave 405 nm with microplate reader.
2.6 蘭花樣品檢測
我們從辰山植物園、孫橋農(nóng)業(yè)園區(qū)采集93份樣品進行檢測對比,免疫膠體金試紙條檢出CymMV陽性樣品51份,ORSV陽性樣品38份,其中CymMV和ORSV同時侵染樣品28份,而DAS-ELISA檢測出CymMV陽性樣品58份,ORSV陽性樣品43份,CymMV和ORSV同時侵染樣品31份。利用Kappa值來比較兩種檢測方法的符合性,由表3、表4可知免疫膠體金試紙條與DAS-ELISA檢測CymMV和ORSV的符合率均超過80%,基本能夠滿足田間及口岸一線的檢測需求。
表3免疫膠體金試紙條與DAS-ELISA檢測CymMV的一致性評價(Kappa值)
Table3ResultconsistencybetweenDAS-ELISAandcomplexgoldimmunochromatographyassaystripesbasedonKappavaluefordetectionofCymMV

免疫膠體金試紙條Complexgoldimmunochromatographyassaystripes雙抗體夾心酶聯(lián)免疫吸附法 DAS?ELISA陽性數(shù)量/份Positivesamplenumbers陰性數(shù)量/份Negativesamplenumbers合計Total陽性數(shù)量Positivesamplenumbers51051陰性數(shù)量Negativesamplenumbers73542合計Total583593Kappa值=84.6%
表4免疫膠體金試紙條與DAS-ELISA檢測ORSV的一致性評價(Kappa值)
Table4ResultconsistencybetweenDAS-ELISAandcomplexgoldimmunochromatographyassaystripesbasedonKappavaluefordetectionofORSV

免疫膠體金試紙條Complexgoldimmunochromatographyassaystripes雙抗體夾心酶聯(lián)免疫吸附 DAS?ELISA陽性數(shù)量/份Positivesamplenumbers陰性數(shù)量/份Negativesamplenumbers合計Total陽性數(shù)量Positivesamplenumbers38038陰性數(shù)量Negativesamplenumbers64955合計Total444993Kappa值=86.7%
3 討論
本研究在獲得建蘭花葉病毒和齒蘭環(huán)斑病毒單克隆抗體的基礎(chǔ)上研制了建蘭花葉病毒和齒蘭環(huán)斑病毒聯(lián)合免疫膠體金試紙條。該試紙條能夠在10 min之內(nèi)檢出這兩種嚴重危害蘭花的病毒,且特異性強,效果穩(wěn)定,操作簡便,與DAS-ELISA的檢測結(jié)果符合性好(Kappa值分別為84.6%和86.7%),能夠滿足蘭花實際樣品中建蘭花葉病毒和齒蘭環(huán)斑病毒的檢測,實現(xiàn)種植苗圃及口岸現(xiàn)場一線使用的目標。
免疫膠體金試紙條在現(xiàn)場使用過程中雖然操作比較簡單,但是還需注意以下兩點:①由于病毒分布的不均一性,不同位置取樣會導致結(jié)果出現(xiàn)差異性,特別是不同樣本之間相對強度的偏差,在生產(chǎn)調(diào)試過程中,檢測7#樣本時,ORSV未檢出明顯反應(yīng),而DAS-ELISA陽性,出現(xiàn)這一結(jié)果原因可能是兩種方法使用抗體不同,對病毒的檢測靈敏度不同,而導致結(jié)果有差異;②樣本處理之后,放置時間較長,結(jié)果會出現(xiàn)明顯的波動性,建議樣本處理后及時檢測,不要放置過夜。
[1] Zettler F W, Ko N J, Wisler G C, et al. Viruses of orchids and their control [J]. Plant Disease, 1990, 74: 621-625.
[2] Ryu K H, Park W M.Rapid detection and identification ofOdontoglossumringspotvirusby polymerase chain reaction amplication [J].FEMS Microbiology Letters,1995,133:265-269.
[3] Hu J S, Ferreira S, Wang M, et al. Detection ofCymbidiummosaicvirus,Odontoglossumringspotvirus,Tomatospottedwiltvirus, and potyviruses infecting orchids in Hawaii[J].Plant Disease, 1993, 77: 464-468.
[4] 聞偉剛, 譚中, 崔俊霞. 實時熒光RT-PCR方法檢測齒蘭環(huán)斑病毒與建蘭花葉病毒[J]. 植物保護, 2009, 35(4):101-104.
[5] 中國檢驗檢疫科學研究院,中華人民共和國上海出入境檢驗檢疫局. SN/T 2155-2008, 建蘭花葉病毒檢測方法[S].北京:中國標準出版社,2008.
[6] 中華人民共和國國家質(zhì)量監(jiān)督檢驗檢疫總局,中國國家標準化管理委員會.GB/T 28981-2012, 齒蘭環(huán)斑病毒檢疫鑒定方法[S].北京:中國標準出版社,2008.
[7] 梁新苗,邊勇,李建光,等. 4種葫蘆科植物病毒復合膠體金免疫層析試紙條的研制[J].植物檢疫,2013,27(1):39-42.
[8] 魏梅生,楊翠云,李桂芬.番茄環(huán)斑病毒和煙草環(huán)斑病毒復合型膠體金免疫層析試紙條的研制[J].植物檢疫,2008,22(2):75-77.
[9] 魏梅生,李桂芬,張周軍,等.馬鈴薯X病毒和馬鈴薯Y病毒膠體金免疫層析試紙條的研制[J].植物保護,2006,32(6):139-141.
[10] 孫艷秋, 趙奎華, 曹遠銀, 等.黃瓜細菌性角斑病免疫膠體金試紙條的研制[J].植物病理學報, 2011, 41(2): 131-138.
(責任編輯: 楊明麗)
ComplexgoldimmunochromatographyassayandapplicationforrapiddetectionofCymbidiummosaicvirusandOdontoglossumringspotvirus
Yu Zixiang1, Li Li2, Yu Luzhen1, Yang Cuiyun1, Wu Jianxiang3, Huang Weichang2, Yu Cui1
(1.ShanghaiEntry-ExitInspectionandQuarantineBureau,Shanghai200135,China; 2.ShanghaiChenshanBotanicalGarden,Shanghai201602,China; 3.InstituteofBiotechnology,ZhejiangUniversity,Hangzhou310058,China)
In order to directly detectCymbidiummosaicvirus(CymMV) andOdontoglossumringspotvirus(ORSV) in planting garden and import port, we developed gold-immunochromatographic assay stripe kit. Tri-sodium citrate with aqueous gold chloride was warmed up and mixed to make colloidal gold particles. Monoclonal antibody (McAb) C10 was selected to conjugate with colloidal gold as the detector antibody that was spotted on a conjugated pad, and the McAb 5B7 and 4F3 were used as capture antibody at the test line (T) respectively. Goat anti-mouse IgG antibody was used capture antibody at the control line (C). After an optimized process, the assay stripes were packaged. The result indicated that the viruses could be specifically detected on immune-strip within 10 minutes. 93 samples from Chenshan Botanical Garden and Sunqiao Agricultural Garden were tested, and the results were compared with those obtained by DAS-ELISA in order to examine the reliability. The two methods showed significant consistence (Kappa=84.6% and 86.7 % of CymMV and ORSV, respectively). The established gold-immunochromatographic assay could meet the requirements of primary screening of the two viruses in the gardens and the ports.
Cymbidiummosaicvirus;Odontoglossumringspotvirus; complex gold immunochromatography assay
2017-03-28
2017-05-16
上海市綠化和市容管理局(G152427)
* 通信作者 E-mail: yuc@shciq.gov.cn
S 41-30
A
10.3969/j.issn.0529-1542.2017.06.023

