LncRNAs在糖尿病神經血管病變中的研究進展
許玉榮, 李桂林
(南昌大學醫學院生理學教研室,江西 南昌 330006)
糖尿病是個全球性的問題,近年,多數國家糖尿病患者的人數呈不斷增加的趨勢,在糖尿病患者中,目前仍有約1.87億人沒有被診斷出來。糖尿病是一種因胰島β細胞功能障礙或胰島素分泌減少而導致糖穩態失衡的復雜代謝性疾病。對于糖尿病發病的分子機制,大多數研究都集中在胰島細胞類型的轉錄組水平[1],而對于長非編碼核糖核酸(long noncoding RNAs,lncRNAs)在糖尿病發病中的作用研究較少。
人類基因組蛋白編碼基因約有2萬個,而這僅占全基因組的1.5%[2]。因此,有98%以上的人類基因不編碼蛋白質。這些不編碼蛋白質的轉錄本根據其長度可分為小非編碼RNA和長非編碼RNA。長非編碼RNA是一類長度超過200個核苷酸的重要的異構非編碼RNA[3]。近年研究結果顯示,lncRNAs在表觀遺傳學水平、轉錄及轉錄后水平參與基因表達的調節,在生物學過程中發揮關鍵作用。LncRNAs具有多種功能,如RNA加工、結構支架、調控細胞凋亡和侵襲、誘導重新編程多功能干細胞、染色質修飾等[4]。目前,研究發現,多種lncRNAs參與了糖尿病并發癥過程,如糖尿病神經病變、糖尿病腎臟病變、糖尿病視網膜病變、糖尿病心血管病變等,但目前對于lncRNAs的作用機制方面卻仍知之甚少。隨著研究人員對lncRNAs在哺乳動物進化及人類疾病發生發展中作用的日益關注,lncRNAs參與各種疾病調控的機制已成為當前生命科學研究的新熱點。近年來,隨著大量lncRNAs的發現以及對其功能研究的深入,lncRNAs在多種常見病和多發病中的作用機制的研究也越來越多,本文將對lncRNAs在糖尿病神經病變和心血管病變中的作用進行綜述。
1 LncRNAs
1.1LncRNAs功能LncRNAs參與多種重要的生物功能調控過程。幾乎能影響基因生命周期中遺傳輸出的每一個階段,從表觀遺傳調控到染色質重塑,再到轉錄和轉錄后控制,以及蛋白質代謝的調控過程。
1.1.1表觀遺傳調控 LncRNAs的一個標志功能是它們介導的表觀遺傳調節能力。LncRNAs不但可以通過調節組蛋白和DNA的化學修飾,行使基因表達調控的功能,而且可以通過類似的機制調控表觀遺傳通路本身的基因。LncRNAs能夠實現基因調節的DNA結合蛋白和DNA序列緊密連接,從而對不同的順式或反式基因位點進行的表觀遺傳學修飾提供一個理想的對接平臺。許多lncRNAs識別蛋白質的方式是通過染色質修飾來實現的,表觀遺傳修飾抑制也改變了lncRNAs的表達模式,這表明它們的調控是由染色質狀態和前饋來控制的[5]。
1.1.2轉錄及轉錄后調控 RNA代謝的每一步都會進行精確調整及復雜的調控。研究發現,lncRNAs參與RNA穩定性的控制,包括mRNAs前體加工和mRNA降解。LncRNAs轉錄調控顯然是非常復雜的,許多有注解的轉錄子可能是從蛋白質編碼基因的初始轉錄物轉錄后加工得到的[6]。調控RNA的不同作用遠遠超出表觀基因組,他們以各種方式調節轉錄。非編碼RNA可以通過堿基配對的方式與DNA或RNA靶點結合,以掩蓋剪接位點、miRNA結合位點及啟動子,從而改變基因表達或蛋白質功能。此外,lncRNAs還可以作為轉錄輔激活而起作用。而且蛋白質定位及定位功能,也可由lncRNAs調控。核糖核酸具有獨特的生化特性,識別并結合大多數生物分子,故與蛋白質的親和力更甚,因此,lncRNAs可特異性結合蛋白。研究表明lncRNAs是通過直接結合和修飾蛋白活性來實現組織穩態的控制。LncRNAs介導調控的蛋白質活性還可以通過與轉錄因子的結合來實現[6]。
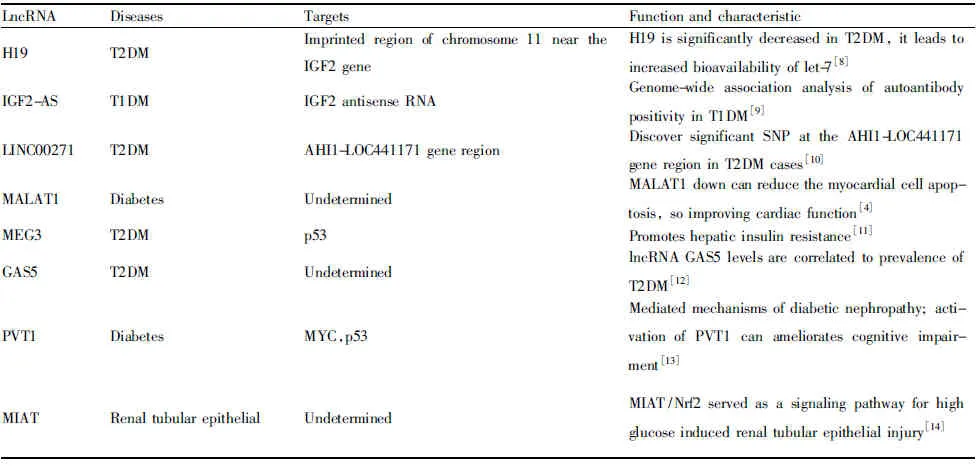
Tab 1 LncRNAs implicated in diabetes
1.2LncRNAs對基因表達影響的研究方法研究lncRNAs在基因表達中的作用和確定lncRNAs是順式還是反式調節,通常需要通過功能缺失或功能獲得實驗來分析[7]。功能缺失大多采用RNA干擾技術,通過如短發夾RNA(short hairpin RNA, shRNA)敲低lncRNAs的表達后,經高通量測序或基因芯片來確定它們在轉錄中的作用。以RNA功能缺失后受影響的相關基因為基礎,來推斷lncRNAs的功能。當然RNA干擾技術的干擾效率問題也隨即出現,因為shRNA的干擾機制主要在細胞質內,而很多lncRNAs位于細胞核內。但這種擔心隨著越來越多的lncRNAs被成功敲低而解除。大多數敲低了的lncRNAs在細胞培養中都表現出明顯的表型。除shRNA外,還有一種定點法使用鋅指核酸酶將RNA去穩定化元件整合到lncRNAs終止元件功能序列中,如聚腺苷酸信號、腺嘌呤-尿嘧啶富集元件等,使下游序列穩定性破壞,從而產生比RNA干擾更特異更有效的干擾效果[7]。
失調的lncRNAs可通過多種途徑在疾病的發生和發展中發揮重要作用。接下來將介紹與糖尿病相關的一些長非編碼RNA失調引起的糖尿病并發癥。
2 LncRNAs與糖尿病之間的關系研究
糖尿病主要分為兩類:1型糖尿病(type 1 diabetes mellitus,T1DM),是自身免疫性疾病,2型糖尿病(type 2 diabetes mellitus,T2DM),是表征為胰島素抗性及胰島β細胞功能受損的一種疾病。T2DM是我國最常見的糖尿病,95%以上的糖尿病患者屬于T2DM。糖尿病引起的并發癥主要是神經和血管病變。糖尿病神經病變是糖尿病最常見的慢性并發癥之一,病變可累及中樞神經及周圍神經,后者尤為常見。其中遠端感覺神經病變是最常見的病變,占所有糖尿病神經病變的50%以上。糖尿病的血管病變是常見的糖尿病并發癥之一,這也是導致糖尿病病人死亡的主要原因之一。血管病變又分大血管病變和微血管病變。LncRNAs參與糖尿病的發病,見Tab 1。
2.1LncRNAs與糖尿病神經病變糖尿病性神經性疼痛(diabetic neuropathic pain,DNP)是常見的糖尿病神經病變。但DPN 發病機制尚不明確,其中,血糖升高、血脂異常是導致外周神經損傷的重要因素。其可通過氧化應激,激活多元醇通路、內質網應激、線粒體功能障礙等途徑,引起外周神經的損傷。此外,神經滋養血管病變、神經營養因子、外周神經的解剖學特點等因素也參與了DPN發病機制。近期有研究表明,lncRNAs的表達異常也與DPN的發病機制有明顯的關聯[15]。
LncRNA uc.48+是一種在各個物種之間具有高度保守性的長非編碼RNA。DNP病人血清中uc.48+的表達水平較正常人群提高了3倍。在DNP模型大鼠背根神經節(dorsal root ganglion,DRG)中,uc.48+的表達較正常對照大鼠明顯升高[16]。糖尿病模型組大鼠的機械縮足閾值(mechanical withdrawal threshold,MWT)和熱縮足潛伏期(thermal withdrawal latency,TWL)較正常大鼠明顯降低。然而,糖尿病大鼠經uc.48+小干擾RNA處理后,其MWT和TWL均較糖尿病模型組大鼠明顯升高。此外,uc.48+小干擾RNA可降低糖尿病大鼠背根神經節ERK1/2、MAPK磷酸化水平及P2X3受體表達。因此,DNP的發生可能與uc.48+的過表達存在聯系,而uc.48+小干擾RNA可緩解DNP,其機制與P2X3受體和ERK1/2信號通路有關[16]。
另有研究表明,T2DM患者血清中lncRNA NONRATT021972濃度較健康受試者明顯升高。而NONRATT021972 siRNA處理T2DM大鼠后,其痛行為明顯減輕,表明NONRATT021972 siRNA可能減輕神經病理性疼痛。同時,NONRATT021972 siRNA可明顯降低DNP大鼠DRG中 P2X3受體表達水平、抑制ERK1/2的磷酸化、降低血清中腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)水平。因此,NONRATT021972 siRNA可通過抑制P2X3受體的表達上調、減少TNF-α的釋放,緩解由糖尿病引起的痛覺過敏[17]。故DNP的發生可能與lncRNA NONRATT021972的表達增加存在一定聯系,而NONRATT021972 siRNA則可緩解DNP,且其機制與P2X3受體和ERK1/2信號通路有關。故不同種類lncRNAs可能參與到同一疾病的調控過程中。
高糖和高游離脂肪酸是造成糖尿病神經系統損傷的主要原因。高糖高脂聯合處理PC12細胞,導致IL-6和TNF-α水平明顯升高,同時NONRATT021972的表達也明顯增加。對高糖高脂聯合處理PC12細胞誘導的NONRATT021972高表達進行小干擾RNA處理后,可抑制細胞中IL-6和TNF-α水平的升高。P2X7受體因在神經系統炎癥相關性疾病的病理生理中產生作用而備受關注,研究表明,發生神經系統炎癥相關性疾病時,P2X7受體表達上調,并可影響炎性介質的表達和釋放,參與神經系統炎性反應,誘導神經細胞功能損傷,是神經系統炎癥相關性疾病治療的新靶點。高糖高脂狀態下,PC12細胞中P2X7mRNA和蛋白表達明顯升高,而進行NONRATT021972 siRNA處理后,P2X7mRNA和蛋白明顯下降。因此,抑制NONRATT021972可以作為糖尿病性神經炎癥并發癥的新治療策略[18]。因此,同一種lncRNA也可能通過不同途徑參與到不同疾病的調控過程中。
糖尿病認知功能障礙是糖尿病中樞神經系統損傷造成的。有研究表明,自噬抑制劑3-甲基腺嘌呤(3-methyladenine,3-MA)可加重糖尿病小鼠的認知障礙,包括焦慮樣行為加劇、空間學習和記憶能力減退,尤其是空間逆轉記憶能力的減退。3-MA減弱糖尿病小鼠的長時程增強和增益效應,表明3-MA可加重糖尿病小鼠突觸可塑性的損傷。3-MA也可導致糖尿病小鼠海馬神經元凋亡。然而,3-MA可使糖尿病時上調的lncRNA漿細胞瘤變異易位1基因(plasmacytoma variant translocation 1 gene,PVT1)的表達明顯下降,推測PVT1參與了自噬。PVT1可以改善糖尿病小鼠海馬神經元的突觸可塑性損傷及細胞凋亡,進而改善糖尿病認知功能障礙[13]。
2.2LncRNAs與糖尿病血管病變大血管和微血管病變是糖尿病并發癥的主要特點。在糖尿病血管病變中,血管內皮在其病理變化中起著一個關鍵性的作用。血管內皮不再看成僅僅是一層分隔血管內外的屏障,而是一個同時起著調節血管功能的具有分泌能力的重要器官。糖尿病時,內皮細胞受損傷并釋放過多的細胞因子,從而引起炎癥。因此,了解引起內皮炎癥的分子機制,將有助于防止糖尿病患者血管內皮細胞損而最終導致的器官損傷。主要的血管系統疾病有糖尿病血管病變、動脈粥樣硬化、高血壓、心肌梗死等。LncRNAs 通過染色質重塑,轉錄、加工和轉錄后修飾等調節基因表達,進而參與到血管損傷、重塑和老化的調控過程中[19]。
肺腺癌轉移相關轉錄物1(metastasis associated lung adenocarcinoma transcript 1,MALAT1)是一個6.5 kb核內長非編碼RNA,在高血糖作用下誘導內皮細胞損傷[3]。MALAT1通過誘導蛋白如Bax、Bcl-2和p53,抑制腫瘤細胞死亡。而這些分子參與細胞周期的進展及血管生成與再生[20]。MALAT1在高糖處理12~72 h之內的人臍靜脈血管內皮細胞(human umbilical vein endothelial cells,HUVEC)表達即明顯升高,同時白細胞介素6(interleukin 6,IL-6)和TNF-α也明顯增多,機制研究表明,MALAT1對IL-6和TNF-α的調控是通過血清淀粉樣蛋白A3(serum amyloid A3,SAA3)抗原完成的[21]。因此,MALAT1參與糖尿病血管內皮細胞的早期炎癥反應。
糖尿病性視網膜病變(diabetic retinopathy,DR)是糖尿病患者中最常見的微血管并發癥之一。視力減退、視網膜炎、視網膜新生血管的形成等與之相關。MALAT1參與DR的發病機制,在糖尿病患者的房水及纖維血管膜、糖尿病大鼠或小鼠的視網膜、高糖處理的視網膜內皮細胞系RF/6A中,MALAT1的表達水平均明顯上調[22]。MALAT1敲低可改善糖尿病大鼠視網膜功能,減少視網膜細胞的凋亡,減少視網膜血管損傷,同時可明顯減輕糖尿病引起的視網膜血管滲漏和視網膜炎癥。MALAT1敲低可降低視網膜內皮細胞活力、減少細胞遷移和血管形成、防止內皮細胞的過度增殖。其機制與MALAT1敲低可以明顯改變p38 MAPKs的磷酸化水平,而不是ERK1/2或JNK1/2磷酸化的水平有關[21]。
糖尿病使心肌梗死或局部缺血,加劇了心臟損傷。而缺血性事件導致糖尿病心臟并發癥,在沒有明顯的心肌缺血和高血壓癥狀下,增加了心臟衰竭的風險[23]。糖尿病性心肌病 (diabetic cardiomyopathy,DCM)是一個重要的糖尿病心血管并發癥,表現為心功能不全發生獨立的冠狀動脈病和高血壓,繼續發展下去會帶來心臟衰竭的重大危險及增加死亡率。DCM的特征在于各種形態變化,包括肌細胞肥大、肌原纖維枯竭、間質纖維化和心肌內微血管變化,顯著特點是左心室功能的逐步減少[24]。DCM大鼠模型lncRNAs基因芯片檢測發現,MALAT1明顯上調。DCM模型大鼠MALAT1 shRNA 12周后,心肌細胞凋亡明顯減少,左室收縮和舒張功能明顯改善[4]。此外,在糖尿病引起的心臟收縮功能障礙的研究中發現,糖尿病心肌中MALAT1表達明顯上調,TNF-α、IL-1β、IL-6水平也明顯增加,MALAT1敲低可以明顯減少炎性細胞因子的濃度,表明MALAT1參與了DCM的炎癥過程[25]。
糖尿病腎病(diabetic nephropathy,DN)通常會引起慢性腎衰竭和終末期腎病。DN的主要特征是細胞外基質(extracellular matrix,ECM)在腎小球中的過度積累。環境和遺傳因素在DN發生發展中起主要作用。最近研究表明,表觀遺傳因素lncRNAs也與DN發病機制相關[25]。PVT1在多種腎細胞中均有表達,可能與1型或2型糖尿病終末期腎病進展有關。用葡萄糖處理的人腎小球系膜細胞PVT1表達明顯上調,同時主要ECM蛋白——纖連蛋白1和IV型膠原蛋白α1及兩種ECM蛋白的關鍵調節因子——轉化生長因子β1和纖溶酶原激活物抑制劑1水平也明顯上調。PVT1敲低可明顯減少主要ECM蛋白和ECM蛋白的關鍵調節因子。因此,PVT1可能通過涉及ECM積聚機制來介導DN的發展進程[13]。心肌梗死相關轉錄本(myocardial infarction associated transcript, MIAT)參與糖尿病引起的腎小管損傷。在1型糖尿病大鼠腎小管中,MIAT表達水平降低,其表達水平與血清肌酐和尿素氮呈負相關。體外高糖誘導人腎小管上皮細胞株(HK-2)也觀察到MIAT表達降低,細胞活力減弱。過表達MIAT可增加糖尿病和高糖條件下降低的核轉錄因子Nrf2的表達,并增加高糖條件下減弱的細胞活力。機制研究表明,MIAT可與核轉錄因子Nrf2結合,并負調控Nrf2的表達。MIAT通過穩定Nrf2的表達,調節近曲腎小管細胞活力[14]。
3 展望
目前人們對于lncRNAs認識仍然處于初步階段,從最初的無意義片段到最近認識到lncRNAs具有多種生物學功能,幾乎參與了生命進程的全過程。lncRNAs雖然不進行編碼蛋白,但是卻參與相關蛋白編碼基因的調控。lncRNAs的失調將會引發多種與之相關的疾病。LncRNAs能夠通過多種途徑參與到糖尿病的發生、發展進程,并作用于各種糖尿病性疾病,可能是一種lncRNA參與多種糖尿病性疾病調控,也可能多種lncRNAs共同作用參與一種糖尿病性疾病的調控。目前,人們對lncRNAs在糖尿病神經血管病變中的作用僅限于功能或機制研究,但對于lncRNAs是否可以成為臨床上糖尿病早期發現、病程進展和轉歸的診斷標志物,或開發改變lncRNAs表達(敲低或過表達)治療糖尿病的藥物仍無明顯進展。
[1] Kameswaran V, Kaestner K H. The missing lnc(RNA) between the pancreatic beta-cell and diabetes[J].FrontGenet, 2014,5(5): 200.
[2] Tsai F J, Yang C F, Chen C C, et al. A genome-wide association study identifies susceptibility variants for type 2 diabetes in Han Chinese[J].PLoSGenet, 2010,6(2): e1000847.
[3] Wu Y, Huang C, Meng X, et al. Long noncoding RNA MALAT1: insights into its biogenesis and implications in human disease[J].CurrPharmDes, 2015,21(34): 5017-28.
[4] Zhang M, Gu H, Xu W, et al. Down-regulation of lncRNA MALAT1 reduces cardiomyocyte apoptosis and improves left ventricular function in diabetic rats[J].IntJCardiol, 2016,203: 214-6.
[5] Sun M, Kraus W L. From discovery to function: the expanding roles of long noncoding RNAs in physiology and disease[J].EndocrRev, 2015,36(1): 25-64.
[6] Kornfeld J W, Bruning J C. Regulation of metabolism by long, non-coding RNAs[J].FrontGenet, 2014,5: 57.
[7] Schonrock N, Harvey R P, Mattick J S. Long noncoding RNAs in cardiac development and pathophysiology[J].CircRes, 2012,111(10): 1349-62.
[8] Gao Y, Wu F, Zhou J, et al. The H19/let-7 double-negative feedback loop contributes to glucose metabolism in muscle cells[J].NucleicAcidsRes, 2014,42(22): 13799-811.
[9] Plagnol V, Howson J M, Smyth D J, et al. Genome-wide association analysis of autoantibody positivity in type 1 diabetes cases[J].PLoSGenet, 2011,7(8): e1002216.
[10] Salonen J T, Uimari P, Aalto J M, et al. Type 2 diabetes whole-genome association study in four populations: the DiaGen consortium[J].AmJHumGenet, 2007,81(2): 338-45.
[11] Zhu X, Wu Y B, Zhou J, et al. Upregulation of lncRNA MEG3 promotes hepatic insulin resistance via increasing FoxO1 expression[J].BiochemBiophysResCommun, 2016,469(2): 319-25.
[12] Carter G, Miladinovic B, Patel A A, et al. Circulating long noncoding RNA GAS5 levels are correlated to prevalence of type 2 diabetes mellitus[J].BBAClin, 2015,4:102-7.
[13] Li Z, Hao S, Yin H, et al. Autophagy ameliorates cognitive impairment through activation of PVT1 and apoptosis in diabetes mice[J].BehavBrainRes, 2016,305: 265-77.
[14] Zhou L, Xu D Y, Sha W G, et al. Long non-coding MIAT mediates high glucose-induced renal tubular epithelial injury[J].BiochemBiophysResCommun, 2015,468(4): 726-32.
[15] 楊秀穎, 張 莉, 陳 熙,等. 2型糖尿病周圍神經病變機制研究進展[J]. 中國藥理學通報, 2016,32(5): 598-602.
[15] Yang S Y, Zhang L, Chen X, et al. Advances in research on mechanism of peripheral neuropathy in type 2 diabetes mellitus[J].ChinPharmacolBull, 2016,32(5): 598-602.
[16] Wang S, Xu H, Zou L, et al. LncRNA uc.48+ is involved in diabetic neuropathic pain mediated by the P2X receptor in the dorsal root ganglia[J].PurinergicSignal, 2016,12(1): 139-48.
[17] Peng H, Zou L, Xie J, et al. lncRNA NONRATT021972 siRNA decreases diabetic neuropathic pain mediated by the P2X receptor in dorsal root ganglia[J].MolNeurobiol, 2017,54(1): 511-23.
[18] Xu H, He L, Liu C, et al. LncRNA NONRATT021972 siRNA attenuates P2X7 receptor expression and inflammatory cytokine production induced by combined high glucose and free fatty acids in PC12 cells[J].PurinergicSignal, 2016,12(2): 259-68.
[19] 馬 婧,凌 霜,黨延啟,等. 非編碼RNA在血管損傷、重塑和老化中的作用[J]. 中國藥理學通報, 2016,32(1): 14-8.
[19] Ma J, Ling S, Dang Y Q, et al. The role of non-coding RNA in vascular injury,remodeling,aging [J].ChinPharmacolBull, 2016,32(1): 14-8.
[20] Tripathi V, Shen Z, Chakraborty A, et al. Long noncoding RNA MALAT1 controls cell cycle progression by regulating the expression of oncogenic transcription factor B-MYB[J].PLoSGenet, 2013,9(3): e1003368.
[21] Puthanveetil P, Chen S, Feng B, et al. Long non-coding RNA MALAT1 regulates hyperglycaemia induced inflammatory process in the endothelial cells[J].JCellMolMed, 2015,19(6): 1418-25.
[22] Yan B, Tao Z F, Li X M, et al. Aberrant expression of long noncoding RNAs in early diabetic retinopathy[J].InvestOphthalmolVisSci, 2014,55(2): 941-51.
[23] Bugger H, Abel E D. Molecular mechanisms of diabetic cardiomyopathy[J].Diabetologia, 2014,57(4): 660-71.
[24] Zhang M, Gu H, Chen J, et al. Involvement of long noncoding RNA MALAT1 in the pathogenesis of diabetic cardiomyopathy[J].IntJCardiol, 2016,202: 753-5.
[25] Furtado M B, Costa M W, Pranoto E A, et al. Cardiogenic genes expressed in cardiac fibroblasts contribute to heart development and repair[J].CircRes, 2014,114(9): 1422-34.

