自然發酵的葡萄醋中醋酸菌的分離鑒定
孫一帆,梁新紅*,高瑩瑩
(河南科技學院 食品學院,河南 新鄉 453003)
自然發酵的葡萄醋中醋酸菌的分離鑒定
孫一帆,梁新紅*,高瑩瑩
(河南科技學院 食品學院,河南 新鄉 453003)
為了了解自然發酵葡萄醋中醋酸桿菌的生長特性,采用分離純化培養、定性試驗等方法,從葡萄醋中篩選出優勢菌株SP001,通過菌落和細胞形態、生理生化試驗以及16S rRNA序列分析等方法對菌株進行鑒定,結果表明,菌株SP001被鑒定為巴氏醋桿菌(Acetobacter pasteurianus),其最大產酸量為2.31 g/100 mL,酒精轉化率為73.29%。
醋酸菌;分離純化;生長特性;鑒定
隨著人們生活水平的不斷提高,果醋的營養保健功能也越來越受到人們的重視。與食醋相比,果醋的營養成分更為豐富,含有十多種有機酸和人體必需的多種氨基酸、維生素、無機鹽、碳水化合物、微量元素等[1],其中果醋發酵菌種是影響果醋品質的關鍵因素。當前我國用于液體醋生產的醋酸菌菌種主要有AS1.41和滬釀1.01醋酸桿菌,該菌種應用于果醋生產不僅產酸能力低、耐酒精能力有待提高,而且形成的風味也不佳。因此,為了提高果醋產量,改善產品風味,當前的研究工作主要集中于從自然界分離培養高效專一菌種和對現有菌種進行誘變選育。周幗萍等[2]以大米糖化汁培養基為篩選培養基,從市售的醋酸菌粉和武漢錦春調味品廠的醋醅中分離得到了8株產酸快,轉化率高的醋酸菌,并以其中的3株試制木瓜果醋取得了良好的效果。陳洋等[3]從工業醋醅中分離出5株耐乙醇、耐高溫的產醋酸菌株,利用生理生化試驗和16S rDNA同源序列分析,初步認定其為巴氏醋桿菌(Acetobacter pasteurianus),通過對其耐乙醇、耐高溫發酵特性的研究,發現菌株FY4具有高耐受性,可產生大量的醋酸,在工業生產中具有潛在應用價值。吳越等[4]從杏皮渣汁自然發酵液、固態發酵醋醅和杏園的土壤中分離醋酸菌,對分離菌株進行產酸曲線的測定及生理生化鑒定,對產酸量高的菌株進行16SrDNA序列測定,在杏皮渣汁自然發酵液中分離得到的菌株Ac02為醋桿菌屬(Acetobacter)的Acetobacter pomorumLMG 18848,是一株在杏皮渣醋生產中有應用潛力的醋酸菌。
本試驗以自然發酵的葡萄醋為樣品,采用分離純化培養、定性試驗等方法,從中篩選出醋酸菌菌種,再通過革蘭氏染色、菌種的形態特征、生理生化等特征以及16S rRNA對其進行鑒定[5-7],并測定醋酸菌產酸量、醋酸菌生長曲線,對該菌種的生長特性進行研究,為該菌種今后在生產上的廣泛應用打下理論基礎。
1 材料與方法
1.1 材料與試劑
自然發酵的葡萄醋:實驗室自制;葡萄糖、酵母膏、KH2PO4、MgSO4、無水乙醇、瓊脂、蒸餾水、酚酞指示劑、溴甲酚紫、FeCl3、NaOH、結晶紫染色液、碘液、體積分數為95%的乙醇、番紅染液、二甲苯、香柏油:天津市科密歐化學試劑開發中心;凝膠回收試劑盒、15 000+2 000 bp DNA Maker:上海生工生物有限公司;細菌基因組DNA提取試劑盒:北京Solarbio公司;pUCm-T載體試劑盒、脫氧核苷三磷酸(deoxyribonucleoside triphosphate,dNTP):寶生物工程(大連)有限公司;10×PCR buffer、TAE buffer、TaqDNA聚合酶:歐瑞卡(北京)科技有限公司。
增殖培養基:1%酵母膏、2%葡萄糖、0.3%K2HPO4、0.2%MgSO4·7H2O,在電爐上加熱攪拌至完全溶解后在121℃、0.1 MPa高壓滅菌鍋中滅菌25 min,待冷卻至70℃以下加6%vol的無水乙醇。
平板分離培養基:1%酵母膏、2%葡萄糖、0.3%K2HPO4、0.2%MgSO4·7H2O、2%瓊脂,121℃、在電爐上加熱攪拌至完全溶解后在121℃、0.1 MPa高壓滅菌鍋中滅菌25 min,待冷卻至70℃以下加3%vol的無水乙醇,pH值自然。
斜面保藏培養基:同分離培養基。
基礎發酵培養基:1%酵母膏、2%葡萄糖,pH自然,121℃滅菌25 min,冷卻至70℃加入3%vol無水乙醇。
1.2 儀器與設備
SH-250P生化培養箱:上海精宏實驗儀器公司;HZP-250全溫振蕩培養箱:上海精宏實驗儀器公司;BS223S電子天平:賽多利斯(上海)貿易有限公司;WFJ7200分光光度計:尤尼柯(上海)儀器有限公司;CX21FS1C生物顯微鏡:奧林巴斯(廣州)工業有限公司;DYY-6C恒流恒壓電泳儀:北京市六一儀器廠;D-37520型高速冷凍離心機:德國Sigma公司;HH·W21·600-S電熱恒溫水溫箱:上海躍進醫療器械廠;T-GradientPCR儀:德國Biometra公司;BIO-BEST 140E型凝膠圖像分析系統:美國西盟公司。
1.3 實驗方法
1.3.1 產酸菌株的篩選
(1)初篩:采用平板涂布分離法[8],取1 mL果醋,制成10-3至10-5稀釋度的樣品稀釋液,分別取0.3 mL稀釋液涂布到加有溴甲酚紫指示劑的平板上,每個稀釋度制2個平板,在30℃恒溫培養箱中倒置培養3 d左右,然后挑取其中菌落長勢良好,分布均勻,透明圈大而清晰,且個數適中的1個平板中的全部單菌落進行復篩。
(2)復篩:采用劃線分離法進行復篩[9],分別挑1環活化好的初篩菌株轉接于分離培養基中,在30℃恒溫培養箱中倒置培養3 d左右,然后挑取其中菌落長勢良好的菌種接種于斜面固體培養基上進行斜面保存。
(3)產酸定性試驗:各挑取1環復篩后的菌株,分別接種于含3%vol乙醇的100 mL基礎發酵培養基中,30℃恒溫靜置培養72h。離心后取5 mL除去菌體的培養液于小燒杯中,用0.1 mol/L NaOH溶液中和至pH 7.0,煮沸后加入5%FeCl3溶液5~6滴,觀察現象,如形成紅褐色沉淀則為產醋酸細菌[10]。
(4)耐酒精能力測定:將發酵起始酒精度加水稀釋,分別調整為2%vol、4%vol、6%vol、8%vol、10%vol,發酵溫度設為30℃,接種量10%,培養基pH為自然,發酵時間為10 d,測定醋酸含量。
1.3.2 菌種生長曲線測定
將保存的已鑒定菌株在斜面培養基上活化2次,然后各取1環接種于4個分別裝有100 mL增殖培養基的三角瓶中,標號1#~4#,1#瓶作為對照放入冰箱保存。另3個三角瓶置于30℃、100 r/min搖床中培養,用分光光度計在610 nm波長條件下每隔3 h測一次吸光度值,直至濁度不變為止。以細菌菌懸液的吸光度值為縱坐標,培養時間為橫坐標,繪制其生長曲線[11]。
1.3.3 產酸量的測定
將菌種連續活化2次后,接種于增值培養基中,于(30±0.5)℃、100 r/min搖床培養8 d,采用堿式滴定法(以醋酸計)[12]。每隔24 h測定一次產酸量。測定其最大產酸量及出現時間,并計算酒精轉化率。產酸量、醋酸轉化率計算公式如下[13]:
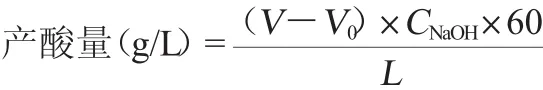
式中:V為NaOH滴定樣品的末讀數,mL;V0為NaOH滴定樣品的初讀數,mL;CNaOH為標準NaOH溶液的濃度,mol/L;L為樣品體積,mL;60為醋酸相對分子質量。

1.3.4 產酸菌株的形態特征
將復篩得到的產酸最高的一株菌,接種于平板培養基中30℃恒溫培養2 d后,觀察單菌落形態,取單菌落,涂片并用革蘭氏染色法[14]在油鏡下觀察該菌株菌體形態。
1.3.5 生理生化試驗
主要包括乙醇氧化、乙酸氧化、接觸酶、乳酸氧化、產葡萄糖酸檢驗、甘油生酮實驗、產纖維素實驗等[15-17]。
1.3.6 菌株的分子生物學鑒定
(1)PCR引物
16SrRNA正向引物:5'-AGG AAG CGG AAGAAT G-3'
16SrRNA反向引物:5'-TAGCCT TGCCCT CAA T-3'
(2)醋酸菌活化培養
將保存于-80℃冰箱的實驗室前期分離、純化獲得的醋酸菌轉接至裝有已高壓滅菌處理后的液體培養基中(接種量按1∶50進行活化培養)。活化8 h后用,采用劃線培養的方式分離單菌落。挑取單菌落轉接于高壓滅菌的液體培養基中(100 mL三角瓶中含有25 mL液體培養基)進行擴大培養。培養條件為37℃、180 r/min振蕩培養18 h。
(3)醋酸菌基因組的提取
取1 mL上述培養好的醋酸菌菌液放入1.5 mL的Eppendorf管中,室溫、5 000 r/min條件下離心2 min,棄上清;沉淀用1.0 mL含量為0.85%的NaCl溶液進行重懸,4℃、13000r/min離心5min,棄上清;沉淀物用520μLTE緩沖液進行重懸,向菌液中加入17μL的溶菌酶裂解細菌,裂解條件為:37℃水浴30min;向反應溶液中加蛋白酶K(20 mg/mL)
至終質量濃度為100 ng/mL,充分混勻裂解蛋白,裂解條件為:30℃水浴30 min;加30 μL10%十二烷基硫酸鈉(sodium dodecylsulfate,SDS)使蛋白進一步變性,反應條件為:30℃水浴30 min;繼續加入100 μL 5 mol/L NaCl溶液,務必充分混勻;加80 μL十六烷基三甲基溴化銨(cetyltrimethyl ammonium bromide,CTAB)/NaCl溶液混勻,并繼續反應,反應條件為:保持65℃水浴10 min;加等體積的苯酚∶氯仿∶異戊醇(25∶24∶1,V/V)混勻,抽提細菌DNA;4 ℃、13 000 r/min,離心10 min,去除蛋白質等雜質;用移液器緩慢吸取上清液至1.5 mL離心管中,加等體積氯仿∶異戊醇(24∶1)進一步抽提細菌DNA,混勻、離心;用移液器緩慢吸取1.5 mL上清液至新離心管,加0.6倍體積異丙醇混勻,沉淀DNA,反應條件為:室溫,靜置60 min;離心,棄上清,加500 μL體積分數為70%的乙醇混勻,洗滌DNA;離心、重新懸浮、重復3次,充分洗滌抽提的DNA;洗滌結束后,倒置離心管,干燥DNA沉淀20min;最后,將通過該方法抽提獲得的DNA溶于60μL TE緩沖液,-20℃條件下保存備用[18]。
(4)16S rRNA PCR擴增及PCR產物檢測
以上述方法制備的醋酸菌菌種基因組DNA為PCR擴增模板,采用總反應體系為50.0 μL的反應體系進行PCR擴增。試驗中所采用的PCR反應程序為:先于98℃保持5 min進行預變性,然后于98℃保持10 s使模版變性,然后將溫度降到56℃保持15 s使引物與模版充分退火,在72℃保持2 min使引物在模版上延伸,該反應程序循環次數為28次,PCR產物與10℃保存。
PCR反應體系(50 μL):5×Prime STAR Buffer(反應緩沖液)10.0 μL,dNTP Mixture(原料)4.0 μL,上、下游引物各1.0 μL,Primer STAR HS DNA Polymerase(聚合酶)0.5 μL,ddH2O 32.5 μL,基因組DNA 1 μL。將PCR反應體系分成3組,2個為試驗組,另一組為陰性對照組(模板用ddH2O替代)。
電泳膠體制備:取200 mg的瓊脂糖加入20 mL電泳緩沖液中(1×TAE),利用微波爐加熱溶解瓊脂糖(要求溶液透明、無顆粒狀物),將試驗溶液冷卻至55℃左右,使用移液器滴加1 μL的EB試劑,充分混勻,并將其倒入制膠板中。等待凝膠凝固,放入電泳槽中,緩沖液液面需高于膠體,檢查電泳電極放置情況,加樣孔務必位于電泳槽的負極。取5 μL PCR產物與1 μL 6×Loading Buffer上樣緩沖液均勻混合,然后用移液器緩慢加入到膠體加樣孔中進行電泳分析,電泳條件為:電壓220 V,電流300 mA,電泳液為1×TAE,時間為20 min。如果PCR擴增成功,將膠體放入凝膠成像系統后,可獲取1 670 bp的條帶圖像。
(5)16S rRNA基因片段的測序及分析
將獲得的PCR產物與pUCm-T載體按照試劑盒說明書上的操作要求就行連接,轉化感受態細胞并驗證為陽性的重組質粒,通過相關公司進行基因序列片段測序。測序結果數據輸入到GenBank數據庫中,利用網站中提供的在線BLAST功能組件對本試驗測序獲得的基因序列與數據庫中已經上傳的序列進行同源性比較。
2 結果與分析
2.1 菌株篩選結果
2.1.1 產酸醋酸菌初篩結果
從自然發酵的葡萄醋中選取樣品,利用平板涂布法,分離得到單菌落醋酸菌菌株,涂布法培養后平板內出現大而清晰的透明圈,隨著醋酸菌的生長,醋酸菌產生的酸不斷增多,形成的透明圈也不斷變大。如圖1所示,在相同的時間內,由于產酸量的不同,菌落周圍透明圈的大小也有明顯的差別。挑取其中菌落長勢良好,透明圈大而清晰,菌落分布均勻的菌種繼續分離培養。
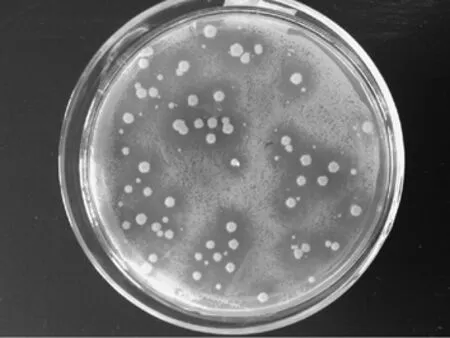
圖1 醋酸菌初篩后的透明圈示意圖Fig.1 Sketch map of transparent circle of acetic acid bacteria after preliminary screening
2.1.2 產酸醋酸菌復篩結果
采用劃線分離法將所挑選的初篩菌種進行轉接培養后得到大小一致、長勢良好的醋酸菌菌落。該醋酸菌菌落以乳白色為主,呈圓形,突起,表面較光滑,然后挑取其中一株菌落長勢良好的菌種做產酸定性實驗和鏡檢,將其命名為SP001。
2.1.3 菌株產酸定性結果
取5 mL除去菌體的發酵液,用0.1 mol/L NaOH溶液中和至中性,煮沸后用5%三氯化鐵溶液滴定,部分發酵瓶內的菌液產生磚紅色沉淀,說明該發酵液中有醋酸產生,證明此菌株為產醋酸菌株;未出現磚紅色沉淀,則說明該發酵液中沒有醋酸產生,證明此菌株不產醋酸或活性太低。
2.2 菌株產酸能力測定
將菌株連續活化2次后,接種于增值培養基中,于30℃、100 r/min搖床培養7 d,采用堿式滴定法(以醋酸計)每隔24 h測定一次產酸量,對該菌株的產酸特性進行研究,結果見圖2。
由圖2可知,醋酸菌SP001產酸量在第7天達到最大,最大產酸量為2.31 g/100 mL,此時酒精轉化率為73.29%。
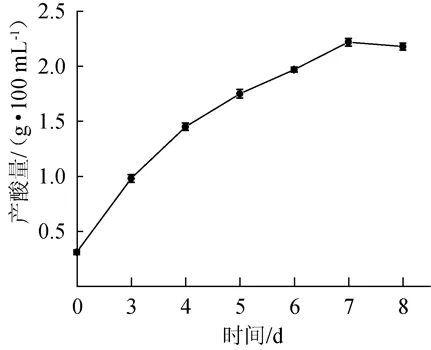
圖2 醋酸菌SP001產酸曲線Fig.2 Acid production curve of acetic acid bacteria SP001
2.3 菌株耐酒精能力測定
將發酵起始酒精度分別設定為2%vol、4%vol、6%vol、8%vol、10%vol,發酵溫度設為30℃,接種量10%,培養基pH為自然,發酵時間為10 d。結果見圖3。
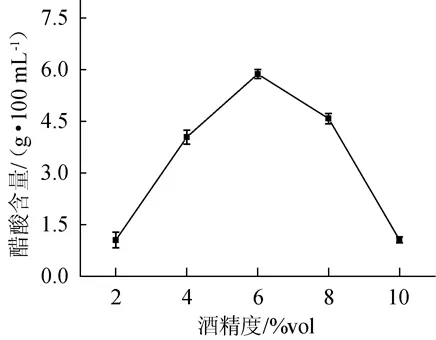
圖3 醋酸菌SP001耐酒精能力Fig.3 Ethanol tolerance of acetic acid bacteria SP001
由圖3可知,當酒精度為6%vol時,醋酸含量達到最大值為(5.86±0.11)g/100 mL。在酒精度>6%vol時,醋酸含量出現下降趨勢,在酒精度為10%vol時,醋酸含量下降至(1.43±0.09)g/100 mL。由此推斷,醋酸菌SP001的最佳耐受酒精度為6%vol。
2.4 菌株鑒定結果
2.4.1 形態觀察結果
經過篩選得到的醋酸桿菌在瓊脂平板上的菌落形態及革蘭氏染色結果見圖4。
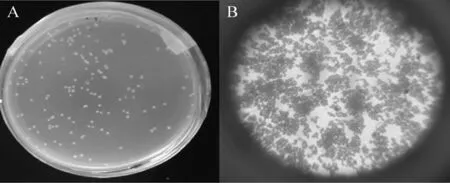
圖4 醋酸菌SP001的菌落(A)及細胞(B)形態Fig.4 Morphology of colonial(A)and cell(B)of acetic acid bacteria SP001
由圖4A可知,醋酸菌SP001菌落以乳白色為主,呈圓形、突起,表面較光滑,然后挑取其中菌落長勢良好的菌株做鏡檢。由圖4B可知,該醋酸桿菌革蘭氏染色為陽性,細胞為短桿狀或橢圓狀,單生或成對或成鏈生長;同時也可看出該菌種活性較強,顯微鏡下菌種數目為多不可計。
2.4.2 生理生化試驗
對已分離的醋酸菌SP001進行生理生化試驗,測定結果見表1。由表1可知,所分離的菌株SP001的乙醇氧化、乙酸氧化及乳酸氧化試驗、接觸酶、產葡萄糖酸、甘油生酮、產5-酮葡萄糖酸試驗結果呈陽性;產纖維素、葡萄糖發酵、氧化酶、淀粉水解、產γ-吡喃酮試驗結果呈陰性,符合醋酸菌所具備的生化特征。
2.4.3 分子生物學鑒定
醋酸菌SP001的16S rRNA基因片段的PCR擴增結果見圖5。由圖5可知,在15000bp處得到了一條清晰且無彌散的條帶,說明擴增成功,可以進行16S rRNA基因序列測定。
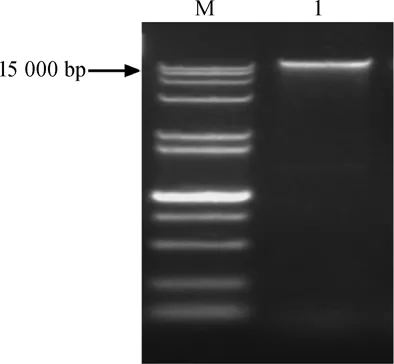
圖5 醋酸菌SP001的PCR擴增產物瓊脂糖電泳圖Fig.5 Agarose electrophoresis of PCR amplification products of acetic acid bacteria SP001

圖6 醋酸菌SP001系統發育樹Fig.6 Phylogenetic tree of acetic acid bacteria SP001
由圖6可知,將擴增產物序列測定后,結果在數據庫中利用BLAST軟件進行分析[19-21],可以得出分離菌株SP001和NBRC14818是同屬菌株。根據鑒定結果,分離醋酸桿菌SP001為巴氏醋桿菌(Acetobacter pasteurianus)。
3 結論
篩選出的醋酸菌確定為革蘭氏陽性菌,無芽孢。對其16S rRNA片段克隆與序列分析鑒定及前期對醋酸菌生物學特征的研究結果發現,該菌株與網上公布的醋酸菌菌株NBRC14818有97%的序列同源性,因此可以判斷這兩種菌是同屬菌種屬于同一個屬,但是因其序列相似性未達到99%以上,且16S rRNA序列種間變化很大,因此極有可能非同一個種,鑒定獲得的醋酸菌為巴氏醋桿菌(Acetobacter pasteurianus)SP001,該菌株培養前12 h為延滯期,12~36 h為該菌株的生長對數期。以自然發酵的葡萄醋為樣品,經過多次分離純化,最終篩選出純化醋酸菌,其醋酸產量為2.31g/100mL,酒精轉化率為73.29%。由于試驗所采用的樣品是自然發酵的果醋,所以篩選出的醋酸菌株產酸能力不高,因此還需進一步誘變育種,以提高發酵中醋酸的產量。
[1]牛蕾,楊幼慧.健康食品——果醋[J].中國釀造,2004,23(2):9-11.
[2]周幗萍,汪芳安,高 冰.醋酸菌篩選培養基的優化和優良醋酸菌分離的研究[J].中國釀造,2004,23(6):20-21.
[3]陳 洋,汪 超,高 冰,等.高耐受性醋酸菌的篩選及發酵特性研究[J].中國釀造,2015,34(12):34-39.
[4]吳 越,張富縣,艾乃吐拉·馬合木提,等.杏皮渣醋酸發酵醋酸菌的分離篩選和鑒定[J].新疆農業科學,2013,50(7):1297-1303.
[5]TZORTZAKIS N,CHRYSARGYRIS A,SIVAKUMAR D,et al.Vapour or dipping applications of methyl jasmonate,vinegar and sage oil for pepper fruit sanitation towards grey mould[J].Postharvest Biol Tech,2016,118(4):120-127.
[6]ESCALANTE A,RODRíGUEZ M E,MARTíNEZ A,et al.Characterization of bacterial diversity in Pulque,a traditional Mexican alcoholic fermented beverage,as determined by 16S rDNA analysis[J].FEMS Microbiol Lett,2004,235(2):273-279.
[7]LOONGSK,KHORCS,JAFARFL,et al.Utilityof16SrDNAsequencing for identification of rare pathogenic bacteria[J].J Clin Lab Anal,2016,30(6):1056-1060.
[8]威 晉,劉鳳霞,李永祥,等.高產醋酸菌的分離選育[J].中國釀造,1999,18(5):20-22.
[9]張 贊,梁關霞,席 超,等.優勢醋酸菌株QA-9號選育及其初步鑒定[J].中國釀造,2010,29(3):46-48.
[10]宮 強,關道明,王耀兵,等.大腸桿菌總DNA快速提取方法的比較研究[J].海洋環境科學,2005,24(4):63-66.
[11]姜曉芝,李志西.產酸菌株的分離及初步鑒定[J].中國釀造,2008,27(23):53-56.
[12]劉 蕓,曹 宜,劉 波.開菲爾粒中醋酸菌的分離鑒定[J].福建農業學報,2012,27(5):544-549.
[13]張忠明.高產醋酸菌的篩選及其形態生化特征研究[J].甘肅農業大學學報,2006,41(1):83-86.
[14]何文兵,劉雪蓮,馬冬雪.自然發酵的葡萄皮醋中醋酸菌的分離鑒定[J].中國釀造,2012,31(4):79-81.
[15]張紀忠.微生物分類學[M].上海:復旦大學出版社,1990:12.
[16]宋勇強,胡先望,沙 芮,等.一株高產酸醋酸菌的分離與鑒定[J].中國微生態學雜志,2015,27(9):997-1003.
[17]張霽紅,李明澤,曾朝珍,等.優勢醋酸菌株的篩選鑒定及乙醇脫氫酶活性研究[J].中國釀造,2017,36(5):100-104.
[18]李元召,孫俊良,李冬霄,等.一株產淀粉酶枯草芽孢桿菌16SrDNA的克隆及序列分析[J].河南科技學院學報:自然科學版,2013,41(3):3-4.
[19]蘇 波,康建平,黃 靜.16S rDNA序列分析鑒定一株芽孢桿菌[J].食品與發酵科技,2010,46(5):1-3.
[20]黃繼翔.產堿性蛋白酶芽孢菌株的鑒定[J].微生物通報,2011,38(2):157-163.
[21]陳相達,戴慧慧,劉 燕.一株高產淀粉酶枯草芽孢桿菌的篩選、鑒定及產酶條件的優化[J].溫州醫學院學報,2011,41(1):40-47.

SUN Yifan,LIANG Xinhong*,GAO Yingying
(School of Food Science,Henan Institute of Science and Technology,Xinxiang 453003,China)
TS26
0254-5071(2017)11-0028-05
10.11882/j.issn.0254-5071.2017.11.007
2017-06-20
國家自然基金面上項目(31771941);河南省高校科技創新團隊支持計劃項目(16IRTSTHN007)
孫一帆(1989-),女,助教,碩士,研究方向為發酵食品釀造和安全控制。
*通訊作者:梁新紅(1971-),女,副教授,博士,研究方向為蛋白質分離純化、功能性物質和發酵食品釀造和安全控制。

