Kiss-1在胃腺癌組織中的表達及對胃腺癌MKN-45細胞增殖、遷移能力的影響
王 欣 李宜炯 龐 超 楊艷紅 張瑞華 朱振龍 王政民
(河北醫科大學第一醫院病理科,河北 石家莊 050031)
Kiss-1在胃腺癌組織中的表達及對胃腺癌MKN-45細胞增殖、遷移能力的影響
王 欣 李宜炯1龐 超 楊艷紅 張瑞華 朱振龍 王政民
(河北醫科大學第一醫院病理科,河北 石家莊 050031)
目的探討腫瘤抑制因子(Kiss)-1在胃腺癌組織中的表達及對胃腺癌細胞增殖、遷移能力的影響。方法qRT-PCR檢測50例胃腺癌組織和對應的癌旁組織中Kiss-1水平。分別將Kiss-1小干擾RNA(siRNA Kiss-1)和對照小RNA(siRNA control)、Kiss-1過表達載體(p EGFP-N1-Kiss-1)和對照空載體(p EGFP-N1)轉染至胃腺癌細胞株(MKN-45)中,培養48 h后,Western印跡檢測細胞中Kiss-1、基質金屬蛋白酶(MMP)-9、MMP-2、β-連環蛋白(β-catenin)、C-myc蛋白水平,噻唑藍(MTT)檢測細胞增殖能力,細胞劃痕實驗檢測細胞遷移能力。用Wnt/β-catenin信號通路抑制劑FH535作用胃腺癌細胞后,檢測細胞增殖和凋亡情況。結果Kiss-1在胃腺癌組織中的表達水平顯著低于癌旁組織(Plt;0.01)。p EGFP-N1-Kiss-1組細胞存活率和遷移率顯著低于p EGFP-N1組,siRNA Kiss-1組顯著高于siRNA control組(Plt;0.01)。p EGFP-N1-Kiss-1組細胞中MMP-9、MMP-2、β-catenin、C-myc水平顯著低于p EGFP-N1組,siRNA Kiss-1組顯著高于siRNA control組(Plt;0.01)。抑制劑作用后的胃腺癌細胞增殖遷移趨勢與p EGFP-N1-Kiss-1組一致。結論Kiss-1在胃腺癌組織中低表達,Kiss-1通過Wnt/β-catenin信號通路抑制胃腺癌細胞增殖遷移能力。
胃腺癌;腫瘤抑制因子;遷移;Wnt/β-catenin信號通路
胃腺癌是胃癌的一種,由胃腺體細胞惡化產生〔1〕。胃腺癌的發病率占全部胃癌發病率的95%〔1〕。腫瘤抑制因子(Kiss)-1最初發現于黑素瘤細胞株中,是一種與腫瘤轉移密切相關的基因〔3〕。Kiss-1廣泛存在于正常的組織和器官中,在小腸、胎盤、睪丸、腦等組織中均具有不同程度的表達〔4〕。研究表明,Kiss-1參與膀胱癌、甲狀腺癌、子宮內膜癌等多種癌癥的轉移,在乳腺癌細胞、宮頸癌細胞增殖遷移過程中發揮抑制作用〔5,6〕。本研究運用qRT-PCR檢測胃腺癌組織中Kiss-1水平,并探討Kiss-1對胃腺癌細胞增殖遷移的影響。
1 材料與方法
1.1一般材料 組織及細胞:收集2010年8月至2013年3月在河北醫科大學第一醫院確診切除的50例胃腺癌患者的胃腺癌組織和對應的癌旁組織,其中男33例,女17例,平均年齡(58.47±12.34)歲。胃腺癌細胞株(MKN-45)購于河北醫科大學病理教研室。主要儀器及試劑:p EGFP-N1-Kiss-1由本實驗室保存;胰蛋白酶、DMEM、青鏈霉素均購于美國Sigma;Kiss-1、基質金屬蛋白酶(MMP)-9、MMP-2、β-連環蛋白(β-catenin)、C-myc單克隆抗體均購于北京鼎國生物科技有限公司;CO2培養箱購于美國Thermo;倒置顯微鏡購于日本尼康。
1.2方法
1.2.1qRT-PCR檢測組織中Kiss-1水平 50例胃腺癌組織和對應的癌旁組織剪碎后,在液氮中研磨成粉狀。取出100 mg組織粉末,加入Trizol裂解液1 ml,依次用氯仿、異丙醇抽提后,用乙醇洗滌。加入焦碳酸二乙酯(DEPC)水溶解后,用紫外分光光度計檢測提取的RNA。按照反轉錄試劑盒說明書反轉錄合成Kiss-1 cDNA。按照qRT-PCR試劑盒說明書分析Kiss-1 mRNA水平。Kiss-1上游引物:5′-CCTCTGTGCCACCCACTTTG-3′;Kiss-1下游引物:5′-TGTAGTTCGGCAGGTCCTTCT-3′。
1.2.2細胞培養 取出保存在液氮罐中的胃腺癌MKN-45細胞,迅速放在37℃的水浴鍋中融化后,加入含有10%胚牛血清(FBS)的DMEM細胞培養液,1 000 r/min離心10 min,加入5 ml細胞生長液懸浮細胞,種植于細胞培養瓶中,放置37℃,5% CO2培養箱中培養。觀察細胞密度達到90%時,棄去細胞培養液,用磷酸鹽緩沖液(PBS)洗滌細胞2次,加入0.25%的胰蛋白酶消化細胞,1 000 r/min離心10 min,棄酶消化液,加入細胞培養液懸浮細胞,接種到細胞培養瓶中培養。
1.2.3細胞轉染 收集培養至對數生長期的胃腺癌MKN-45細胞,加入細胞生長液,接種到6孔細胞培養板中,放在37℃,5% CO2培養箱中培養24 h。分別將Kiss-1小干擾RNA(siRNA Kiss-1)和對照小RNA(siRNA control)、Kiss-1過表達載體(p EGFP-N1-Kiss-1)和對照空載體(p EGFP-N1)轉染至胃腺癌細胞中,放置于37℃培養6 h后,更換成完全培養液繼續培養。
1.2.4Western印跡檢測轉染后細胞中Kiss-1水平 收集轉染48 h后的胃腺癌細胞,加入細胞裂解液,放置于冰上裂解細胞30 min。轉移細胞裂解液至離心管中,4℃,12 000 r/min離心20 min。取蛋白上清液至EP管中。用二喹啉甲酸(BCA)蛋白濃度檢測試劑盒檢測提取的蛋白樣品濃度。蛋白樣品與上樣緩沖液充分混合后,100℃煮沸5 min。取變性蛋白樣品加入到十二烷基硫酸鈉-聚丙稀酰胺凝膠(SDS-PAGE)上樣孔中,電泳初始電壓為80 V,電泳30 min后,調整電壓為120 V至電泳結束。取出蛋白凝膠,在4℃轉印至聚偏氟乙烯(PVDF)膜上。取出PVDF膜,加入5%脫脂奶粉封閉后,依次與一抗(600倍稀釋)、二抗(1 000倍稀釋)反應后,轉移至暗室中,滴加顯色液,曝光后,以甘油醛-3-磷酸脫氫酶(GAPDH)為內參,分析蛋白表達率。
1.2.5噻唑藍(MTT)檢測細胞增殖 培養至對數生長期轉染后的胃腺癌MKN-45細胞,加入胰蛋白酶消化細胞,離心后用細胞培養液懸浮細胞。調整每毫升細胞懸浮液中含有2×104個細胞,種植于96孔細胞培養板中,每孔加入細胞懸浮液100 μl。放置37℃,5% CO2培養箱中培養48 h后,在細胞中加入體積10 μl 5 mg/ml的MTT溶液,放在37℃孵育反應4 h。棄上清液,在細胞中加入100 μl的二甲基亞砜(DMSO)溶液。每組設置8個復孔,同時設置空白組,空白組中不加入細胞。觀察結晶物完全融化后,放置于酶標儀上檢測每孔的吸光度(OD值),計算細胞存活率。細胞存活率=(實驗組OD值-空白組OD值)/(對照組OD值-空白組OD值)。
1.2.6細胞劃痕實驗檢測細胞遷移 轉染后胃腺癌MKN-45細胞培養至對數生長期后,加入胰蛋白酶消化細胞,離心后,在細胞沉淀中加入細胞培養液,接種到24孔細胞培養板中,放置37℃,5% CO2培養箱中培養過夜。用移液槍槍頭小心在貼壁細胞中劃出一條細痕,加入PBS洗滌。加入細胞生長液,在37℃,5% CO2培養箱中培養48 h。倒置顯微鏡下觀察細胞劃痕寬度,計算細胞遷移率,細胞遷移率=遷移的距離/劃痕初始距離。
1.2.7Western印跡檢測細胞中MMP-9、MMP-2、β-catenin、C-myc表達水平 胃腺癌與20 μmol/L Wnt/β-catenin信號通路抑制劑FH535作用48 h后,收集細胞,提取細胞蛋白,Western印跡檢測MMP-9、MMP-2、β-catenin、C-myc水平。設置抑制劑FH535作用后的胃腺癌細胞為抑制劑組,同時設置對照組,對照組不加抑制劑。操作步驟同1.2.4。
1.3統計學方法 應用SPSS22.0軟件進行t檢驗、單因素方差表示。
2 結 果
2.1Kiss-1在胃腺癌組織中的表達 胃腺癌組織中Kiss-1水平明顯低于癌旁組織,差異顯著(Plt;0.01)。
2.2轉染后細胞中Kiss-1蛋白表達 siRNA control組和p EGFP-N1組細胞中Kiss-1蛋白水平沒有變化。p EGFP-N1-Kiss-1組顯著高于p EGFP-N1組。siRNA Kiss-1組顯著低于siRNA control組(Plt;0.01)。見圖1。

1:p EGFP-N1;2:p EGFP-N1-Kiss-1;3:siRNA control;4:siRNA Kiss-1;下圖同圖1 轉染后胃腺癌細胞中Kiss-1表達水平
2.3Kiss-1對胃腺癌細胞增殖遷移能力的影響 p EGFP-N1-Kiss-1組細胞存活率和遷移率顯著低于p EGFP-N1組,siRNA Kiss-1組顯著高于siRNA control組(Plt;0.01)。
2.4Western印跡檢測細胞中MMP-9、MMP-2、β-catenin、C-myc水平 p EGFP-N1-Kiss-1組細胞中MMP-9、MMP-2、β-catenin、C-myc水平顯著低于p EGFP-N1組,siRNA Kiss-1組顯著高于siRNA control組(Plt;0.01)。見圖2。
2.5抑制Wnt/β-catenin信號通路對胃腺癌細胞增殖遷移能力的影響 抑制劑組細胞存活率和遷移率均顯著低于對照組(Plt;0.01)。抑制劑組細胞中MMP-9、MMP-2、β-catenin、C-myc表達水平顯著低于對照組(Plt;0.01)。見圖3。

與p EGFP-N1組比較:1)Plt;0.01;與siRNA control組比較:2)Plt;0.01圖2 細胞中MMP-9、MMP-2、β-catenin、C-myc表達水平檢測結果
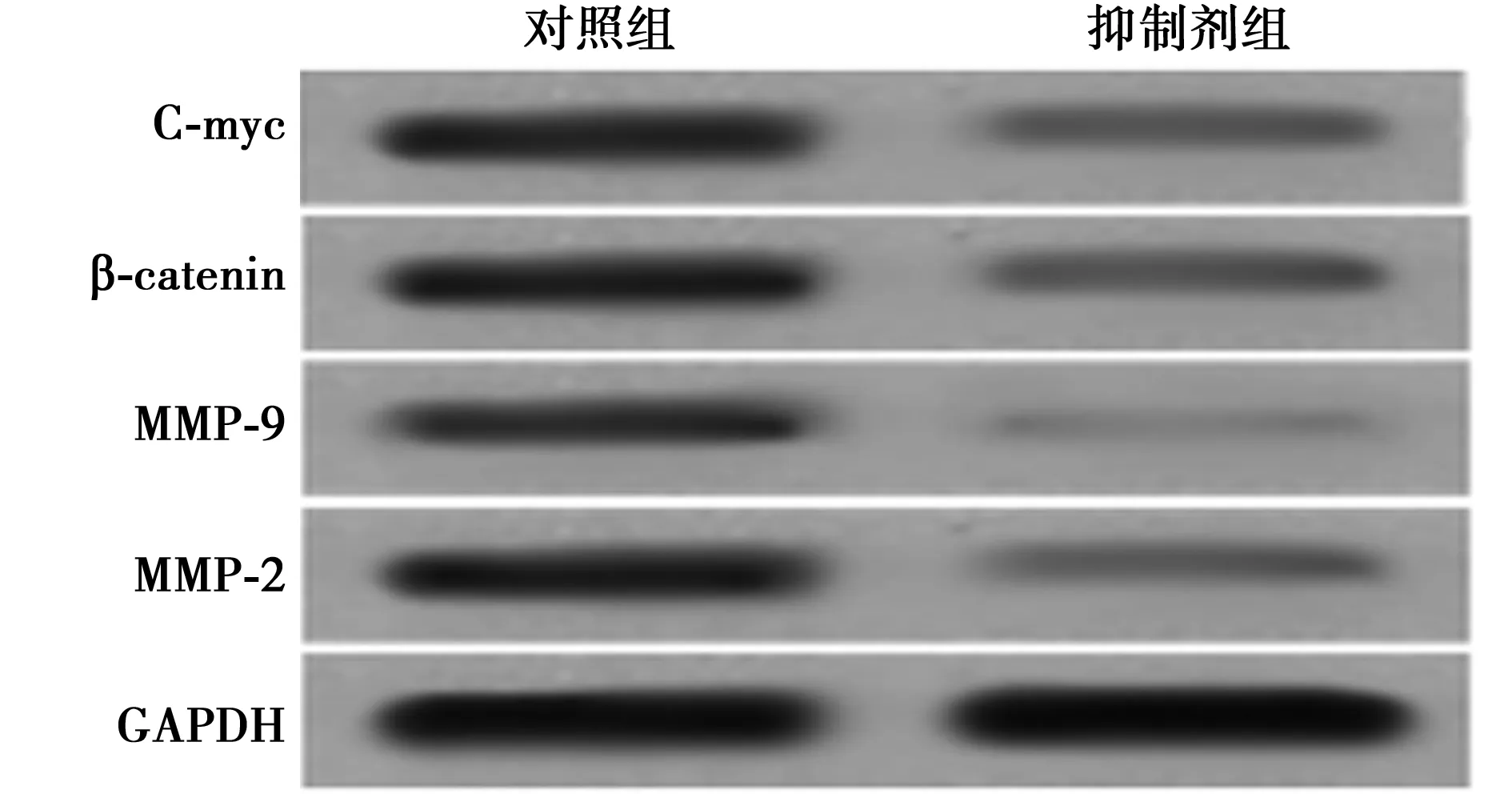
圖3 抑制Wnt/β-catenin信號通路對胃腺癌細胞增殖遷移能力的影響
3 討 論
Kiss-1基因位于1q32染色體上,編碼的Kiss-1蛋白由145個氨基酸組成。有研究表明,Kiss-1在多種腫瘤組織中表達下調甚至缺失。Kiss-1能夠抑制黑色素瘤細胞C8161在大鼠中的轉移能力〔7〕。過表達Kiss-1的乳腺癌細胞株的遷移能力與對照組相比明顯下降〔8〕。近年來研究表明,Kiss-1表達下調與甲狀腺癌、子宮內膜癌等多種癌癥的轉移密切相關〔9〕。本研究收集了50例胃腺癌患者的胃腺癌組織和對應的癌旁組織,qRT-PCR檢測結果發現Kiss-1在胃腺癌組織中表達下調。本研究結果提示,Kiss-1是一種抑癌基因。腫瘤細胞的增殖和遷移在腫瘤的發生發展過程中具有重要作用。腫瘤細胞的遷移受多種基因的復雜調控〔10〕。MMP是目前研究最多的與腫瘤細胞遷移相關的蛋白家族〔11〕。MMP-2和MMP-9在腫瘤的轉移過程中發揮關鍵作用〔12〕。本研究結果提示,Kiss-1可能是通過調控MMP-2和MMP-9作用于胃腺癌細胞。
Wnt/β-catenin信號通路廣泛存在于真核生物體內,屬于高度保守的信號通路〔13〕。β-catenin是Wnt/β-catenin信號通路中的關鍵效應因子,參與癌細胞的增殖、凋亡、侵襲和遷移過程〔14〕。C-myc是Wnt/β-catenin信號通路中的一個靶基因,調控癌細胞增殖過程,是一種癌基因〔15〕。FH535是Wnt/β-catenin信號通路的抑制劑,能夠特異性阻斷Wnt/β-catenin信號通路的激活〔16〕。本研究結果提示,Wnt/β-catenin信號通路抑制劑FH535能夠減弱胃腺癌細胞的增殖和遷移能力。
1Dixon M,Mahar AL,Helyer LK,etal.Prognostic factors in metastatic gastric cancer:results of a population-based,retrospective cohort study in Ontario〔J〕.Gastric Cancer,2016;19(1):150-9.
2劉愛東,馬 征,熊艷杰,等.胃腺癌中 PYGOPUS2,基質金屬蛋白酶-2 和-14 的表達及對預后的判斷價值〔J〕.中國老年學雜志,2016;36(12):2955-7.
3Radhakrishnan P,Ruh N,Harnoss JM,etal.Prolyl hydroxylase 3 attenuates MCL-1-mediated ATP production to suppress the metastatic potential of colorectal cancer cells〔J〕.Cancer Res,2016;76(8):2219-30.
4Lam K,Pan K,Linnekamp JF,etal.DNA methylation based biomarkers in colorectal cancer:a systematic review〔J〕.Biochim Biophys Acta,2016;1866(1):106-20.
5Chen S,Chen W,Zhang X,etal.Overexpression of Kiss-1 reduces colorectal cancer cell invasion by downregulating MMP-9 via blocking PI3K/Akt/NF-κB signal pathway〔J〕.In J Oncol,2016;48(4):1391-8.
6Moya P,Esteban S,Fernandez-Suarez A,etal.Kiss-1 methylation and protein expression patterns contribute to diagnostic and prognostic assessments in tissue specimens for colorectal cancer〔J〕.Tumor Biol,2013;34(1):471-9.
7Song Y,Duan X,Chen J,etal.The distribution of kisspeptin (Kiss) 1-and Kiss2-Positive neurones and their connections with gonadotrophin-releasing hormone-3 neurones in the zebrafish brain〔J〕.J Neuroendocrinol,2015;27(3):198-211.
8Yaron M,Renner U,Gilad S,etal.KISS1 receptor is preferentially expressed in clinically non-functioning pituitary tumors〔J〕.Pituitary,2015;18(3):306-11.
9Chaikhun T,Yanprapasiri C,Sotthibandhu P,etal.Kiss-1 mRNA/kisspeptin distribution in preoptic and arcuate nuclei of cycling buffalo (Bubalus bubalis) hypothalamus〔J〕.Paki Veterin J,2016;36(1):93-7.
10Dayer C,Stamenkovic I.Recruitment of matrix metalloproteinase-9 (MMP-9) to the fibroblast cell surface by lysyl hydroxylase 3 (LH3) triggers transforming growth factor-β (TGF-β) activation and fibroblast differentiation〔J〕.J Biol Chem,2015;290(22):13763-78.
11Desmeules P,Trudel D,Turcotte S,etal.Prognostic significance of TIMP-2,MMP-2,and MMP-9 on high-grade serous ovarian carcinoma using digital image analysis〔J〕.Hum Pathol,2015;46(5):739-45.
12Rodriguez-Calvo R,Ferrán B,Alonso J,etal.NR4A receptors up-regulate the antiproteinase alpha-2 macroglobulin (A2M) and modulate MMP-2 and MMP-9 in vascular smooth muscle cells〔J〕.Thromb Haemost,2015;113(6):1323-34.
13高 原,于 寧,陳 奇,等.十全大補湯含藥血清對 A549/DDP 細胞株中 Wnt/β-catenin 信號通路蛋白的干預作用〔J〕.中國實驗方劑學雜志,2016;22(1):129-33.
14Hofsteen P,Robitaille AM,Chapman DP,etal.Quantitative proteomics identify DAB2 as a cardiac developmental regulator that inhibits WNT/β-catenin signaling〔J〕.Proc Nat Acad Sci,2016;113(4):1002-7.
15Chiacchiera F,Rossi A,Jammula SG,etal.Polycomb complex PRC1 preserves intestinal stem cell identity by sustaining Wnt/β-catenin transcriptional activity〔J〕.Cell Stem Cell,2016;18(1):91-103.
16Okada K,Naito AT,Higo T,etal.Wnt/β-catenin signaling contributes to skeletal myopathy in heart failure via direct interaction with forkhead box O〔J〕.Circ Heart Fail,2015;8(4):799-808.
〔2017-02-11修回〕
(編輯 袁左鳴/滕欣航)
R73
A
1005-9202(2017)22-5530-04;
10.3969/j.issn.1005-9202.2017.22.019
河北省衛計委青年科技課題(20150642)
1 河北醫科大學第一醫院骨科
李宜炯(1982-),男,碩士,主治醫師,主要從事骨腫瘤研究。
王 欣(1982-),女,碩士,主治醫師,主要從事臨床腫瘤病理研究。

