立足“基礎” 強化“對策”
——高三化學一輪復習的幾個著眼點
河北 顏建河
立足“基礎” 強化“對策”
——高三化學一輪復習的幾個著眼點

新一輪高考復習已經拉開序幕,如何才能把握正確的備考方向呢?這是我們考生所面臨的首要問題,給考生指明高效備考方向,才能做到提“效”增“益”,立足“基礎”,強化“對策”才是復習之大策。從近年來的高考真題中不難發現,高考命題注重對化學學習能力的要求。其著眼點主要體現在:第一,接受、吸收、整合化學信息的能力;第二,分析和解決化學問題的能力;第三,化學實驗與探究的能力。基于此,依據化學的學科體系和學科特點,從三個方面進行針對性的復習,才能實現復習的最大效益。
著眼點之一:立足“課本”,強化基礎知識
高三化學一輪復習是中學化學學習非常重要的時期,也是鞏固基礎、優化思維、提高能力的重要階段。為此,在復習中一定要立足“課本”,強化基礎知識,特別要強化《考綱》對每個知識內容的要求層次,努力做到由點到線,由線到面,形成完整的基礎知識體系,實現對基礎知識的再認識,做到了解、理解(掌握)、綜合應用的目的。例如,在復習選修模塊“物質結構與性質”內容時,考生更應該強化課本知識,依據“考綱”對知識內容的要求層次,認認真真地梳理每一個知識點,達到相應的了解、理解(掌握)、綜合運用的層次要求。同時,要做到在解決化學問題(習題)時,能從課本上查找依據,明確認識試題的“源頭”、基礎都來自課本。無論是簡單題還是難題,“根”都離不開課本,且都能從課本上找出依據,培養分析問題和解決問題的能力。
例1(2015·全國Ⅰ卷)碳及其化合物廣泛存在于自然界中,回答下列問題:
(1)處于一定空間運動狀態的電子在原子核外出現的概率密度分布可用________形象化描述。在基態14C原子中,核外存在________對自旋相反的電子。
(2)碳在形成化合物時,其鍵型以共價鍵為主,原因是________。
(3)CS2分子中,共價鍵的類型有________,C原子的雜化軌道類型是________,寫出兩個與CS2具有相同空間構型和鍵合形式的分子或離子:________。
(4)CO能與金屬Fe形成Fe(CO)5,該化合物熔點為253 K,沸點為376 K,其固體屬于________晶體。
(5)碳有多種同素異形體,其中石墨烯與金剛石的晶體結構如圖所示:
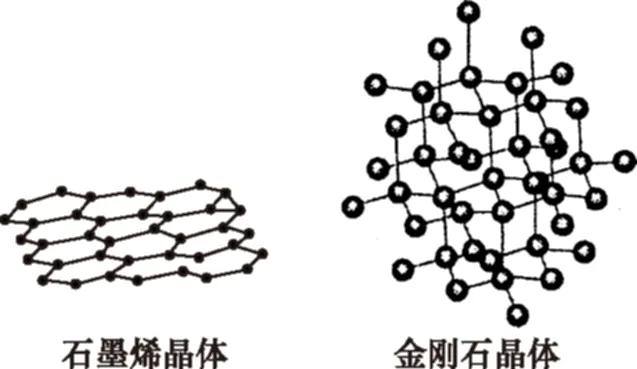
①在石墨烯晶體中,每個C原子連接________個六元環,每個六元環占有________個C原子。
②在金剛石晶體中,C原子所連接的最小環也為六元環,每個C原子連接________個六元環,六元環中最多有________個C原子在同一平面。
分析與解答:本題是一道涉及“物質結構與性質”模塊內容的題目,試題立足課本,強調對基礎知識的理解和運用,突出抽象思維、空間想象以及知識遷移能力的考查,試題有一定難度。解決好這類問題的關鍵,就是掌握課本知識,即物質結構與性質包括原子結構與性質(原子核外電子排布,元素電負性大小比較,元素金屬性、非金屬性的強弱等)、化學鍵與分子結構(化學鍵、鍵參數、分子的電子式、結構式、結構簡式的書寫等)、晶體結構與性質(晶體類型的判斷、物質熔沸點的高低比較、晶體的密度計算、均攤方法的應用等)。依據這些基礎知識,試題中的各個問題可迅速得以解決。
(1)電子在原子核外出現的概率密度可用電子云來描述;基態14C原子核外電子排布式為1s22s22p2,2個s軌道分別存在1對自旋相反的電子,2p軌道上的2個電子自旋方向相同。
(2)碳原子有4個價電子,且碳原子半徑較小,很難通過得或失電子形成穩定結構,在形成化合物時,通常通過共用電子對形成共價鍵,則鍵型以共價鍵為主。

(4)Fe(CO)5的熔、沸點較低,符合分子晶體的性質,則Fe(CO)5固體屬于分子晶體。
(5)①由圖可知,石墨烯中每個碳被3個六元環所共有,每個六元環占有的碳原子數為6×1/3=2個。②金剛石晶體中每個碳原子被12個環所共有。六元環呈船式或椅式結構,最多有4個原子共平面。
答案:(1)電子云 2 (2)C有4個價電子,且原子半徑小,難以通過得或失電子達到穩定電子結構 (3)σ鍵和π鍵 sp雜化 CO2、COS或SCN-、OCN-(4)分子 (5)①3 2 ②12 4
著眼點之二:立足“基礎”,強化核心考點
基礎和能力是相輔相成的,沒有基礎,能力就缺少了扎根的土壤。“考綱”明確了對知識內容的要求層次,特別是涉及理解(掌握)和綜合運用的知識,必將成為高考的核心考點。為此,在復習備考中要做到能領會所學知識的含義及其適用條件,能夠正確判斷、解釋和說明有關化學現象和問題。能“知其然”,還能“知其所以然”,從而實現知識的再升華。同時,高考強調命題要突出主干知識(核心知識)考查,不回避考試熱點和傳統題型,不再過分強調知識的覆蓋面,而是抓住主干知識,突出以能力測試為主導。例如,在復習中要依據“教材”特點和“考綱”要求,抓住主要知識的精髓,特別是中學化學的核心內容。這些內容包括:物質結構、氧化還原反應、離子反應、蓋斯定律、化學平衡、元素化合物知識、電化學、有機化學、化學實驗、化學基本計算等。同時,要依據“考綱”要求,深化對核心考點的理解,促進知識網絡的建構,提高解決化學問題的綜合能力。
例2(2015·全國Ⅱ卷)甲醇既是重要的化工原料,又可作為燃料。利用合成氣(主要成分為CO、CO2和H2)在催化劑作用下合成甲醇,發生的主要反應如下:



回答下列問題:
(1)已知反應①中的相關的化學鍵鍵能數據如下:
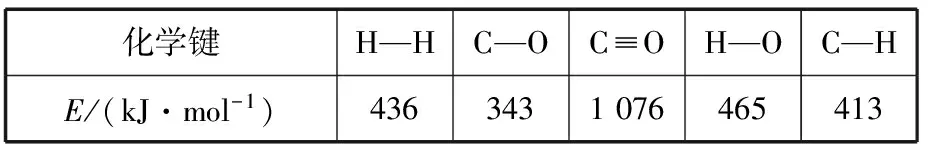
化學鍵H—HC—OC≡OH—OC—HE/(kJ·mol-1)4363431076465413
由此計算ΔH1=________kJ·mol-1,已知ΔH2=-58 kJ·mol-1,則ΔH3=________kJ·mol-1。
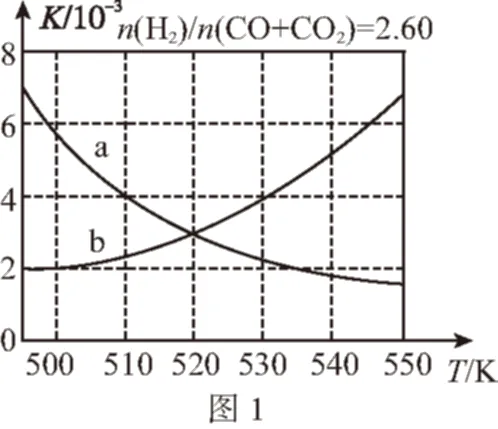
(2)反應Ⅰ的化學平衡常數K的表達式為________________ ;圖1中能正確反映平衡常數K隨溫度變化關系的曲線為________(填曲線標記字母),其判斷理由是
。
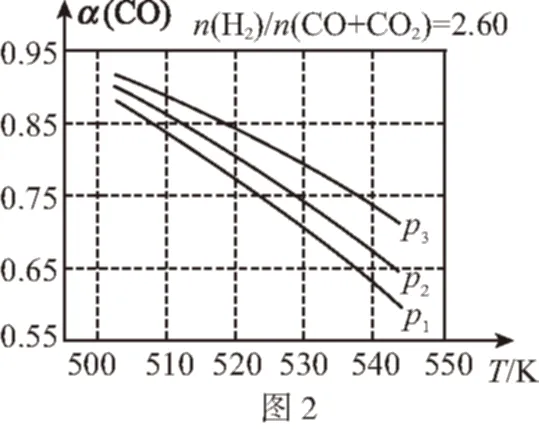
(3)合成氣的組成n(H2)/n(CO+CO2)=2.60時,體系中的CO平衡轉化率(α)與溫度和壓強的關系如圖2所示。α(CO)值隨溫度升高而________(填“增大”或“減小”),其原因是________________ 。圖2中的壓強由大到小為________,其判斷理由是
。
分析與解答:本題是一道涉及利用合成氣(主要成分為CO、CO2和H2)在催化劑的作用下合成甲醇的方法,著力考查反應熱計算、蓋斯定律應用、平衡常數以及外界條件對平衡狀態的影響等,試題有一定難度。解決好這類問題的關鍵,就是深刻理解蓋斯定律、化學平衡方面的相關核心知識,理解圖象、表格中數字的意義,聯系相關化學知識,巧妙地將表格語言轉換成化學語言,或利用相關數據進行計算,則試題中的各個問題可迅速給予解決。
(1)從反應①中的相關的化學鍵鍵能數據,則ΔH1=[E(C≡O)+2E(H-H)]-[3E(C-H)+E(C-O)+E(H-O)]=(1 076 kJ·mol-1+2×436 kJ·mol-1)-(3×413 kJ·mol-1+343 kJ·mol-1+465 kJ·mol-1)=-99 kJ·mol-1;根據蓋斯定律,由Ⅱ式-Ⅰ式可得反應Ⅲ式,即ΔH3=ΔH2-ΔH1=-58 kJ·mol-1-(-99 kJ·mol-1)=+41 kJ·mol-1。
(2)根據化學平衡常數的概念可寫出反應Ⅰ的K的表達式;反應Ⅰ是放熱反應,升高溫度,化學平衡向逆反應方向移動,化學平衡常數K減小,則曲線a符合。
(3)由圖2可知,壓強不變時,隨著溫度的升高,α(CO)減小;反應Ⅲ為氣體分子數不變的反應,加壓對其平衡無影響;反應Ⅰ為氣體分子數減小的反應,加壓使α(CO)增大;由圖2可知,固定溫度(如530 K)時,p1→p2→p3,α(CO)增大,則綜合分析可知:p3gt;p2gt;p1。
答案:(1)-99 +41 (2)K=c(CH3OH)/[c(CO)·c2(H2)] a 反應Ⅰ為放熱反應,升高溫度使其平衡向逆反應方向移動,平衡常數K應減小 (3)減小 由圖2可知,壓強恒定時,隨著溫度的升高,α(CO)減小p3gt;p2gt;p1溫度恒定時,反應Ⅰ為氣體分子數減小的反應,加壓使平衡向正反應方向移動,α(CO)增大,而反應Ⅲ為氣體分子數不變的反應,加壓對其平衡無影響,故增大壓強時α(CO)增大。
著眼點之三:立足“考點”,強化真題訓練
練習是化學總復習的重要組成部分,是運用知識解決問題的再學習、再認識過程,也是促進知識遷移,訓練思維,提高分析問題和解決問題能力的重要途徑,但練習量必須合理,以保證質量為前提,避免簡單的機械重復和陷入“題海”。為此,在復習進程中要做到對每個知識點的真正掌握,就必須強化真題訓練,做到在理解所學各部分化學知識之間的本質區別與內在聯系的基礎上,運用所掌握的知識進行必要的分析、類推或計算,解釋、論證一些具體的化學問題。要實現這一目標,必須認真研讀近幾年的高考真題,了解高考命題方向,通過訓練復習,掌握解題技巧、提高準確性,優化解題思路和方法。同時,做題一定要真正弄懂,融會貫通,并能舉一反三,實現能力的再升級。例如,以化學工藝流程(框圖)為載體,以圖象、數據、圖表為信息載體,以化學實驗控制變量為載體,以新藥、新的染料中間體、新型有機材料的合成為載體的高考主打題目,在強化真題訓練中,一定要訓練到位,認真反思,認真總結,才能做到戰無不勝。
例3(2015·天津卷)廢舊印刷電路板是一種電子廢棄物,其中銅的含量達到礦石中的幾十倍。濕法技術是將粉碎的印刷電路板經溶解、萃取、電解等操作得到純銅等產品。某化學小組模擬該方法回收銅和制取膽礬,流程簡圖如下:
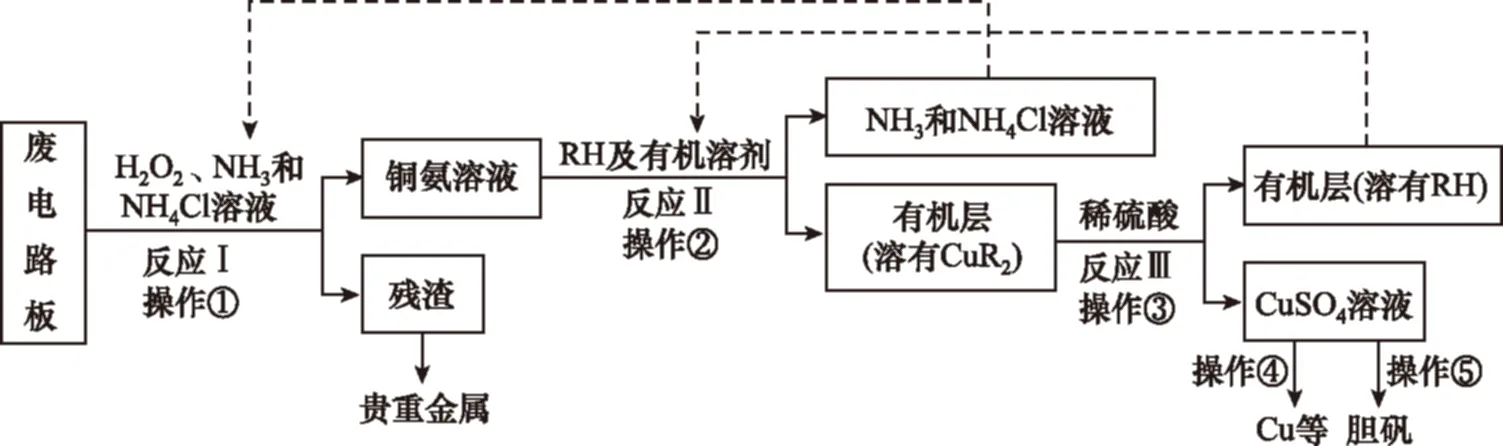
回答下列問題:
a.富集銅元素
b.使銅元素與水溶液中的物質分離
c.增加Cu2+在水中的溶解度
(3)反應Ⅲ是有機溶液中的CuR2與稀硫酸反應生成CuSO4和________。
若操作③使用如圖裝置,圖中存在的錯誤是________。

(4)操作④以石墨作電極電解CuSO4溶液。陰極析出銅,陽極產物是________。操作⑤由硫酸銅溶液制膽礬的主要步驟是________________________。
(5)流程中有三處實現了試劑的循環使用,已用虛線標出兩處,第三處的試劑是________。循環使用的NH4Cl在反應Ⅰ中的主要作用是
。
分析與解答:本題是一道模擬回收銅和制取膽礬方法的化學工藝流程題,著力考查物質制備流程的分析判斷,離子方程式的書寫,基本實驗操作的分析、判斷、評價和設計等,試題難度不大。解決好這類問題的關鍵,就是熟悉化學工藝流程試題的分析思路,認真讀題,特別要認真讀懂流程(框圖),并依據設問結合所學相關知識,則試題中的各個問題可迅速得以解決。
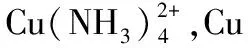
(3)CuR2中R元素為-1價,所以反應Ⅲ是有機溶液中的CuR2與稀硫酸反應生成CuSO4和RH;操作③使用的過濾操作中分液漏斗尖端未緊靠燒杯內壁,且分液漏斗內的液體太多。
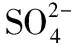
(5)電解CuSO4溶液時能得到硫酸,操作④中得到的硫酸可用在反應Ⅲ中,所以第三種循環的試劑為H2SO4;氯化銨溶液呈酸性,可降低溶液中氫氧根離子的濃度,防止由于溶液中的c(OH-)過高,生成Cu(OH)2沉淀。
河北省衡水市故城縣教育局)

