信息型方程式的書寫、氧化還原反應方程式的配平程序剖析
河南 徐業政
信息型方程式的書寫、氧化還原反應方程式的配平程序剖析

一、信息型方程式的書寫
信息型方程式的書寫能較好地考查學生自學能力、推理能力、信息轉化能力,因此成為高考試題中“出鏡率”很高的考點之一。正確地書寫信息型反應方程式有賴于三個方面的因素:一是心理因素,不能因為面對的是比較新穎的知識就認為自己無法解答出來而在心理上“未戰先降”,事實上此類方程式只要充分利用題給信息是不難寫出來的;二是有效信息的篩選與轉化,即要篩選出與方程式書寫有直接關系的信息并將文字信息轉化為化學符號信息;三是掌握書寫的一般程序。
1.信息轉換型
這是指將題目提供的反應物、生成物信息用相應的化學式表示出來的一類題型,因題目已明確了反應物與生成物分別是什么,故書寫的重點應放在化學式的準確書寫與化學計量數的確定上。
例1:火法煉銅可以從輝銅礦(Cu2S)中提取銅。下面是由Cu2S冶煉銅及制取CuSO4·5H2O的流程圖:
Cu2SO2△Cu焙燒Cu2O、CuO足量稀硫酸A操作ⅠB蒸發、結晶、過濾膽礬
(1)Cu2S→單質銅(另有一種氣體生成)的化學方程式為
。
(2)Cu2O置于足量稀硫酸中得到藍色溶液及紅色物質,寫出離子方程式:
。
解析:(1)由質量守恒原理及氧化還原反應價態變化規律知Cu2S與氧氣反應后得到的氣體物質是SO2,由此可寫出Cu2S+O2Cu+SO2,配平后即可。(2)由反應的現象知有Cu2+及Cu生成,故有Cu2O+H+Cu+Cu2++H2O,配平后即可。
答案:(1)Cu2S+O2△2Cu+SO2(2)Cu2O+2H+Cu+Cu2++H2O
2.推理性氧化還原反應方程式的書寫
這是指題中只提供部分反應物、生成物的信息,然后要求書寫出相應的方程式,這類題目有兩種情況,一是一般化學方程式的推理書寫,二是電極反應方程式的書寫。
例2:(依高考試題編制)回答下列問題:
(1)(2015江蘇)實驗室可用KOH、KClO溶液與 Fe(NO3)3溶液的反應制備高效水處理劑K2FeO4,其反應的離子方程式為
。
(2)(2016全國卷Ⅱ)實驗室可用次氯酸鈉溶液與氨反應制備聯氨(N2H4),寫出反應的化學方程式:________________ ;聯氨是一種常用的還原劑,向裝有少量AgBr的試管中加入聯氨溶液可觀察到有黑色固體單質生成,寫出反應的化學方程式:________________ 。酸性條件下,H2O2可氧化Fe2+,性條件下可與FeSO4溶液反應,寫出反應的離子方程式:
。
(3)(2012全國卷Ⅰ)與 MnO2- Zn 電池類似,K2FeO4- Zn 也可以組成堿性電池,K2FeO4在電池中作為正極材料,其電極反應式為________________ 。
解析:(1)本題只給出了部分反應物與生成物,需要通過推理判斷,確定其他物質。
①由元素價態變化知,題目明確給出的反應物有Fe3+、ClO-,生成物有FeO2-4,ClO-的還原產物是Cl-,故可先寫出:Fe3++ClO-FeO2-4+Cl-。
②依得失電子守恒原理確定已寫出部分中的氧化劑、還原劑、氧化產物、還原產物的計量數后得:2Fe3++3ClO-2FeO2-4+3Cl-。
③依電荷守恒及堿性條件確定在左側應添加“10OH-”,2Fe3++3ClO-+10OH-2FeO2-4+3Cl-,再根據質量守恒確定有水生成:2Fe3++3ClO-+10OH-2FeO2-4+3Cl-+5H2O。
(2)NaClO的還原產物是NaCl,故可首先寫出:NaClO+NH3N2H4+NaCl,依得失電子守恒原理配平后得:NaClO+2NH3N2H4+NaCl,最后依質量守恒得NaClO+2NH3N2H4+NaCl+H2O。
(3)①K2FeO4在正極上得到電子被還原為Fe(OH)3(堿性條件),故有FeO2-4+3e-Fe(OH)3。
②依據電荷守恒及電解質溶液呈堿性得:FeO2-4+3e-Fe(OH)3+5OH-。
③依質量守恒及分析左右兩側元素構成后得到:FeO2-4+3e-+4H2OFe(OH)3+5OH-。
通過前面問題的分析知:信息型氧化還原反應方程式、電極反應式的書寫程序大同小異,具體過程可分為如下幾步:
①寫式子:寫出明確給出的及易推出的物質的化學式;
②配計量數:確定“兩劑”(氧化劑、還原劑)、“兩產”(氧化產物、還原產物)的計量數;
③查守恒:檢查質量是否恒,對于離子方程式還要檢查電荷是否守恒;
④添物質:添加必要的物質,但也可能不需要添加。
在水溶液中進行的反應,添加的物質通常是“H2O、H+”或“H2O、OH-”,添加的原則是:在酸性溶液中不應添加OH-、在堿性溶液不應添加H+。此外還要牢記如下知識。
1.常用氧化劑對應的還原產物(一般情況下)

氧化劑MnO-4(H+)H2O2HNO3Cr2O2-7Cl2、ClO-、ClO-2、ClO-3、ClO2還原產物Mn2+H2ONO、NO2Cr3+Cl-
2.常用還原劑對應的氧化產物

還原劑H2O2Fe2+Cl-S、S2-H2C2O4SO2、SO2-3Fe氧化產物O2Fe3+Cl2SO2、SO2-4CO2SO3、SO2-4Fe2+、Fe3+
3.燃料電池中幾種元素或物質放電后的產物

常見元素HCO2Al堿性存在形式H2OCO2-3OH-AlO-2(強)酸性存在形式H+CO2H2OAl3+
二、氧化還原反應方程式的配平
配平的原理可表述為:反應過程中得失電子守恒或元素化合價升降總值相等。配平過程中需要明確如下幾個問題:①首先要配平哪兩種物質(以下簡稱首配物)的計量數,如何快速地確定首配物。②根據首配物組成求某種元素化合價變化值時要不要考慮該元素在其他物質中的組成情況,當一種物質中發生價態變化的元素不只一種時該如何處理。③配平的一般程序是怎么樣的。下面對此類問題進行討論。
1.首配物質的確定
符合下列條件的氧化劑、還原劑(以下簡稱兩劑),氧化產物、還原產物(以下簡稱兩產)可作為首配物。
①氧化劑:只有一種且全部被還原;
②還原劑:只有一種且全部被氧化;
③氧化產物、還原產物:各只有一種物質。
2.配平的順序
先標出化合價以確定首配物→以首配物的組成和元素變化前后的價態為依據求出化合價的升與降總值(Δ1、Δ2)→將所求的兩種首配物的Δ1、Δ2交換寫在另一種物質前面→確定其他含有價態變化元素的物質計量數→確定剩余物質的計量數
Δ=首配物中化合價發生變化的元素的原子數目×該元素的化合價的變化值
3.配平示例
類型1:首配物為“兩劑”或者是“兩產”
反應特點:氧化劑、還原劑均只有一種物質且全部被還原、被氧化或氧化產物、還原產物各只有一種。
例:配平C2H4+KMnO4+H2SO4——K2SO4+MnSO4+CO2+H2O
解析:標出相關元素的化合價后知,該反應的首配物可以是兩劑,也可以是兩產。
6C-22H4+12K2Cr+62O7+H2SO4——K2SO4+Cr+32(SO4)3+C+4O2+H2O
化合價的變化值并交叉書寫:
6C2H42[4-(-2)]________12K2Cr2O72(6-3)
再確定兩產的計量數:6C2H4+12K2Cr2O7+H2SO4——K2SO4+12Cr2(SO4)3+12CO2+H2O
最后確定其他物質的計量數:6C2H4+12K2Cr2O7+48H2SO412K2SO4+12Cr2(SO4)3+12CO2+60H2O,去掉公約數得到C2H4+2K2Cr2O7+8H2SO42K2SO4+2Cr2(SO4)3+2CO2+10H2O(說明:公約數也可以在Δ1、Δ2值“交叉”前約去)。
類型2:只能用“兩產”作首配物
反應特點:氧化劑、還原劑不止一種或者沒有全部被還原(被氧化)而氧化產物、還原產物各只有一種。
例:配平CuSO4+P4+H2OCu3P+ H3PO4+H2SO4
解析:分析該反應知硫酸銅為氧化劑,白磷既是氧化劑又是還原劑,兩劑中共有三種物質,而氧化產物是H3PO4、還原產物只有Cu3P,該反應屬于第2類,故首配物可以是兩產(也可以是氧化劑CuSO4)與氧化產物(H3PO4),配平過程如下。
Cu+2SO4+P04+H2O——6H3P+5O4+5Cu+13P-1+H2SO4
化合價變化值并交叉書寫:
6H3PO45-0 5Cu3P3(2-1)+{0-(-3)}=6
再配平兩劑的計量數15CuSO4+114P4+H2O——6H3PO4+5Cu3P+H2SO4
最后配平其他物質計量數:15CuSO4+114P4+24H2O——6H3PO4+5Cu3P+15H2SO4
除掉分母:60CuSO4+11P4+96H2O24H3PO4+20Cu3P+60H2SO4
*Cu3P 中兩元素的化合價均發生了變化,故求總數時直接求二者變化值的代數和(最后取正值)。
類型3:只能用氧化劑與氧化產物或者還原劑與還原產物作首配物
反應特點:氧化劑與氧化產物各只有一種物質且前者全部被還原;或者還原劑與還原產物各只有一種物質且前者全部被氧化。
例:配平方程式Cu2S+HNO3——Cu(NO3)2+NO↑+H2SO4+H2O
解析:分析該反應中各元素化合價變化知,本題的首配物應為NO與Cu2S
3Cu+12S-2+HN+5O3——C+2u(NO3)2+10N+2O↑+H2S+6O4+H2O
化合價變化值并交叉書寫:
3Cu2S2×1+8=10________10NO3
再確定Cu(NO3)2、H2SO4、HNO3的計量數后得:3Cu2S+(10+2×6)HNO3——6Cu(NO3)2+10NO↑+3H2SO4,最后確定H2O的計量數:3Cu2S+22HNO36Cu(NO3)2+10NO↑+3H2SO4+8H2O。
類型4:缺項配平
反應特點:方程式中某些反應物或者生成物未給定。
例:配平C+K2Cr2O7+H2SO4——CO2↑+K2SO4+Cr2(SO4)3+
解析:配平過程中可先不考慮所缺物質的組成如何,待其他物質計量數確定后再依質量守恒定律確定所缺物質的組成及計量數。
6C+4K2Cr2O7+H2SO4——CO2↑+K2SO4+Cr2(SO4)3+
化合價變化值并交叉書寫:
6C4________4K2Cr2O76
再配平其他物質得:6C+4K2Cr2O7+16H2SO4——6CO2↑+4K2SO4+4Cr2(SO4)3+________,依質量守恒生成物中應有16份的水,最后劃簡后得:3C+2K2Cr2O7+8H2SO43CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。
類型5:特定物質組合型
反應特點:無法找出符合上述原則的兩種物質作首配物,此時可通過分析反應式構成特點,利用某兩種物質間的特定關系,將兩種物質組合為一個整體。
例:配平KNO3+S+CCO2↑+K2S+N2↑
解析:由于K2S中鉀、硫原子個數比為2∶1且反應中只有KNO3、單質硫中含有鉀、硫元素,故KNO3的計量數一定是單質硫的計量數的2倍,因此可先將 KNO3與單質硫按物質的量之比為2∶1的比例組合成“一種物質”,然后求Δ值。
1(2KNO3+S) +3CCO2↑+K2S+N2↑
Δ1、Δ2值的求解(系數已約分處理):
1(2KNO3+S)2×5+1×2=12________3C4
最后可得到:2KNO3+S+3C3CO2↑+K2S+N2↑
類型6:調整計量數類
反應特點:無法找出前述方法中的首配物,此時可先確定“兩劑”“兩產”的計量數,最后再添加上沒有被氧化(被還原)的那一部分物質相應的數量。
例:配平KClO3+HClKCl+Cl2↑+H2O
解析:本題只能利用氧化劑、還原劑作首配物,首先確定被氧化、被還原的那一部分物質的計量數,然后調整計量數(即添加上沒有被氧化或沒有被還原的那一部分物質的數量)。
1KClO3+5HClKCl+Cl2↑+H2O
Δ1、Δ2值的求解:
1KClO35________5HCl1
再確定Cl2與KCl的計量數:1KClO3+5HCl1KCl+3Cl2↑+H2O
因有1份的-1價氯元素價態沒有變化,故HCl的計量數應由5調整為6,最后依質量守恒原理得: KClO3+6HClKCl+3Cl2↑+3H2O (計量數中的“1”沒有寫出來)。
4.幾類物質中元素化合價數值的確定技巧
(1)有機物:有機物中氫元素顯+1價,氧元素一般顯 -2價,碳元素的化合價則要利用化合價規則及分子的組成來確定,如C2H5OH中氧為-2價,氫為+1價,故碳為 -2價。
(2)不常見物質:非金屬性強的元素一定顯負價,如BrCl3中,氯的非金屬強于溴,故氯顯-1價,溴為+3價。
(3)組成較復雜的物質,分析時應先確定無變價的金屬元素及非金屬性強的元素的價態,然后利用化合價規則確定具有變價元素的價態,如KCNO中價態的確定,氧非金屬性最強,為-2價,鉀為+1價,C、N兩元素中,氮非金屬性較強為-3價,最后確定碳為+4價;若組成元素全部為非金屬元素,則非金屬性最弱的元素顯正價。
(4)組成不合常規的物質:如Na2Sx、Fe3C等物質,可認為該物質中的各元素化合價均為0(簡稱為0價標價法),在配平中,依0價為起點計算元素化合價的變化值。
例:配平 Fe3P+HNO3——Fe(NO3)3+NO↑+H3P4+H2O
解析:令Fe3P中各元素的化合價均為0,其首配物是還原劑Fe3P與還原產物NO2。
3Fe03P0+HN+5O3——Fe+3(NO3)3+14N+4O+H3P+5O4+H2O
化合價變化值并交叉書寫:
3Fe3P3×3+5=14________14NO3
再確定含有價態變化的其他物質的計量數:3Fe3P+41HNO3——9Fe(NO3)3+14NO↑+3H3PO4+H2O
最后確定H2O的計量數:3Fe3P +41HNO39Fe(NO3)3+14NO↑+3H3PO4+16H2O。
針對練習
1.實驗室中可用氯仿(CHCl3)與雙氧水直接反應制備光氣(COCl2)的反應方程式為
。
解析: 氯仿與雙氧水反應時,后者是氧化劑被還原,前者是還原劑被氧化為光氣,可先寫出CHCl3+H2O2COCl2+H2O,當得失電子相等時有如下結果:CHCl3+H2O2COCl2+H2O,再結合質量守恒可得到最后的方程式。
答案:CHCl3+H2O2COCl2+H2O+HCl
2.在堿性條件下向綠色的K2MnO4溶液中通入CO2后可得到紫色溶液和一種黑褐色固體,該反應的離子方程式為________________。在弱酸性條件下,向FeSO4溶液中加入KMnO4溶液可得到一種有特殊顏色的難溶性堿及一種難溶性氧化物,寫出相應離子方程式:
。
解析:形成紫色溶液說明有MnO-4生成,黑褐色固體是MnO2,由此可先寫出CO2+3MnO2-42MnO-4+MnO2↓,再結合溶液顯堿性及質量守恒定律可得到最后的方程式。
由題目涉及的元素知難溶性堿是Fe(OH)3,氧化物是MnO2,故可先寫出3Fe2++MnO-4MnO2↓+3Fe(OH)3↓。再結合質量守恒、電荷守恒可得到3Fe2++7H2O+MnO-4MnO2↓+3Fe(OH)3↓+5H+。
答案:2CO2+3MnO2-42MnO-4+MnO2↓+2CO2-3,3Fe2++7H2O+MnO-4MnO2↓+3Fe(OH)3↓+5H+
3.二氧化氯(ClO2)氣體是一種常用的高效自來水消毒劑。
(1)KClO3和濃鹽酸在一定溫度下反應會生成ClO2,同時還得到一種黃綠色氣體,寫出反應的化學方程式:________________________,濃鹽酸在該反應中表現出的性質是________ 。
(2)實驗室常用KClO3、草酸(H2C2O4)和稀硫酸制備ClO2,該反應中氧化產物與還原產物物質的量之比為________。
(3)將ClO2通入到硫化氫溶液中,然后加入少量的稀鹽酸酸化的氯化鋇溶液,發現有白色沉淀生成。寫出二氧化氯與硫化氫溶液反應的離子方程式:
。
(4) ClO2和Cl2在消毒時自身均被還原為Cl-,則常溫常壓下,等體積的ClO2的消毒能力是Cl2的________倍。
(5)自來水廠用ClO2處理后的水中,要求ClO2的濃度在0.1~0.8 mg/L之間。碘量法可以檢測水中ClO2的濃度(不同pH環境中粒子種類如圖所示),步驟如下:
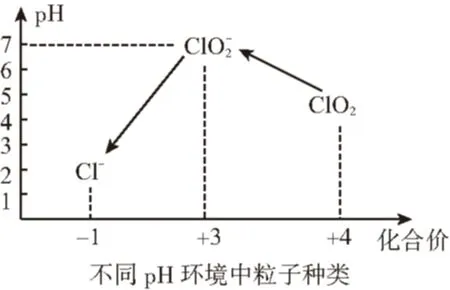
Ⅰ.取一定體積的水樣,加入一定量的碘化鉀,再將反應后溶液調至中性,并加入淀粉溶液,溶液變藍。
Ⅱ.加入一定量的Na2S2O3溶液。(已知2S2O2-3+I2S4O2-6+2I-)
Ⅲ.加硫酸調節水樣pH至1 ~3。請回答:
①操作Ⅰ中反應的離子方程式是
。
②在操作Ⅲ過程中,溶液又呈藍色,反應的離子方程式是
。
③若水樣的體積為1.0 L,在操作Ⅱ時消耗了1.0×10-3mol·L-1的Na2S2O3溶液10 mL則水樣中ClO2的濃度是________mg/L。
解析:(1)黃綠色氣體是Cl2,故可先寫出:KClO3+HCl(濃)2ClO2↑+Cl2↑,由價態變化規律知,ClO2是KClO3的還原產物,Cl2是HCl的氧化產物,依得失電子守恒配平后得:2KClO3+2HCl(濃)2ClO2↑+Cl2↑,再根據質量守恒知還有KCl及水生成,添加此兩種物質后配平即可。(2)KClO3的還原產物是ClO2、H2C2O4的氧化產物是CO2,由元素化合價變化知,反應中每生成1 mol ClO2可得到1 mol電子、每生成1 mol CO2失去1 mol電子,故生成氧化產物與還原產物物質的量之比為1∶1。(3)由題給信息可判斷H2S被氧化為SO2-4,ClO2的還原產物是Cl-,由此可寫出對應的離子方程式。(4)1 mol ClO2可得到 5 mol 電子、1 mol Cl2可得到2 mol電子,故等物質的量的兩種消毒劑的消毒能力ClO2是Cl2的2.5倍。

