氧化還原反應考查熱點及解答策略
安徽 代 鵬 李榮慧
氧化還原反應考查熱點及解答策略

氧化還原反應問題是高考化學的一個熱點。筆者對近年全國各地化學高考試卷中關于氧化還原反應問題進行了歸納和總結,與大家討論。
一、氧化還原反應概念與本質
例1(2016年上海卷)下列化工生產過程中,未涉及氧化還原反應的是
( )
A.海帶提碘 B.氯堿工業
C.氨堿法制堿 D.海水提溴
解析海帶提碘是KI變為I2,碘的化合價由-1價變為0價,屬于氧化還原反應,A錯誤;氯堿工業是電解NaCl的水溶液產生NaOH、H2、Cl2,有化合價的變化,屬于氧化還原反應,B錯誤;氨堿法制堿的原理是NH3+CO2+H2ONH4HCO3,沒有化合價的變化,不屬于氧化還原反應,C正確;海水提溴是將Br-變為Br2,溴的化合價由-1價變為0價,屬于氧化還原反應,D錯誤。
答案C
例2(2012年廣東卷)下列應用不涉及氧化還原反應的是
( )
A.Na2O2用作呼吸面具的供氧劑
B.工業上電解熔融狀態的Al2O3制備Al
C.工業上利用合成氨實現人工固氮
D.實驗室用NH4Cl和Ca(OH)2制備NH3
解析氧化還原反應的特征是反應前后元素化合價發生了變化。Na2O2用作呼吸面具的供氧劑:2Na2O2+2CO22Na2CO3+O2,發生了氧化還原反應,A錯誤;電解熔融Al2O3制Al的反應中Al元素化合價由+3變為0,是氧化還原反應,B錯誤;工業合成氨:N2+3H22NH3,氮化合價由0價變為-3價,是氧化還原反應,C錯誤;NH4Cl和 Ca(OH)2制備NH3的反應是復分解反應,D正確。
答案D
解題策略:氧化還原反應的實質是電子的得失,特征是元素化合價的升降。
二、氧化性和還原性強弱的比較
例3(2015年北京卷)在通風櫥中進行下列實驗:下列說法不正確的是

( )
A.Ⅰ 中氣體由無色變紅棕色的化學方程式為2NO+O22NO2
B.Ⅱ中的現象說明Fe表面形成致密的氧化層,阻止Fe進一步反應
C.對比Ⅰ、Ⅱ中現象,說明稀HNO3的氧化性強于濃HNO3
D.針對Ⅲ中現象,在Fe、Cu之間連接電流計,可判斷Fe是否被氧化
解析物質的氧化性強弱通過比較物質得電子能力的大小來判斷。Ⅰ是生成無色氣體NO,NO被氧氣氧化成紅棕色的NO2氣體,A正確;Ⅱ是因為鐵發生了鈍化反應,B正確;濃HNO3的氧化性強于稀HNO3,C錯誤;Ⅲ中Fe、Cu本身都能與硝酸反應,二者作電極構成原電池時,驗證鐵是否為負極,發生氧化反應,可連電流計,D正確。
答案C
例4(2014年上海卷)用FeCl3溶液腐蝕印刷電路板上的銅,所得的溶液中加入鐵粉。對加入鐵粉充分反應后的溶液分析合理的是
( )
A.若無固體剩余,則溶液中一定有Fe3+
B.若有固體存在,則溶液中一定有Fe2+
C.若溶液中有Cu2+,則一定沒有固體析出
D.若溶液中有Fe2+,則一定有Cu析出
解析還原性是Fegt;Cu,氧化性是Fe3+gt;Cu2+gt;Fe2+,則A若無固體剩余,說明鐵粉完全被鐵離子氧化,但此時溶液中不一定有Fe3+,A不正確;若有固體,則固體中一定有銅,可能有鐵,因此溶液中一定有Fe2+,B正確;若溶液中有Cu2+,則也可能有部分銅已經被置換出來,因此不一定沒有固體析出,C不正確;若溶液中有Fe2+,但如果鐵離子過量,則不一定有Cu析出,D不正確,答案:B。
解題策略:(1)在氧化還原反應中,氧化劑的氧化性強于氧化產物,還原劑的還原性強于還原產物。
(2)金屬活動性順序表從左到右還原性依次減弱,對應陽離子的氧化性依次增強。
(3)和同一種還原性物質反應,反應條件要求越低,其氧化性越強。
三、氧化還原反應方程式的書寫
例5(高考組合)
1.(2016年新課標Ⅰ卷,節選)NaClO2是一種重要的殺菌消毒劑,也常用來漂白織物等,其一種生產工藝如下:
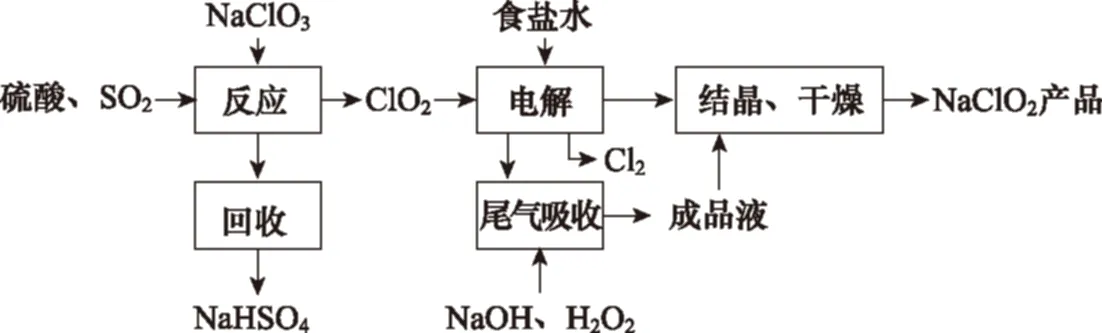
寫出“反應”步驟中生成ClO2的化學方程式:
。
解析NaClO3和SO2在H2SO4酸化條件下生成ClO2,其中NaClO3是氧化劑,還原產物為ClO2,根據電子守恒和原子守恒,可寫出此反應的化學方程式。
答案2NaClO3+SO2+H2SO42NaHSO4+2ClO2
2.(2016年上海卷,節選)NaCN超標的電鍍廢水可用兩段氧化法處理:
(1)NaCN與NaClO反應,生成NaOCN和NaCl
(2)NaOCN與NaClO反應,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有劇毒;HCN、HOCN中N元素的化合價相同。寫出第二次氧化時發生反應的離子方程式:________________。
解析NaOCN與NaClO反應,生成Na2CO3、CO2、NaCl和N2,首先確定反應物和生成物,因反應中氯元素化合價從+1價降低到-1價,得到2個電子。氮元素化合價從-3價升高到0價,失去3個電子,根據得失電子守恒進行配平。
答案2OCN-+3ClO-CO2-3+CO2↑+3Cl-+N2↑
3.(2015年天津卷,節選)完成NaClO3氧化FeCl2的離子方程式:
ClO-3+ Fe2++________ Cl-+ Fe3++
解析氯元素化合價從+5降低到-1價,得到6個電子,鐵元素的化合價從+2價升高到+3,失去1個電子,根據得失電子守恒,則氯酸根離子的系數為1,Fe2+的系數為6,則鐵離子的系數也是6,氯離子的系數是1,根據電荷守恒,氫離子系數為6,水的系數是3。
答案1 6 6H+1 6 3H2O
解題策略:用化合價升降法配平。在反應中,元素化合價升高總數等于元素化合價降低總數。對于離子反應還要注意考慮電荷守恒。
四、氧化還原反應的有關計算
例6(高考組合)
1.(2016年上海卷)O2F2可以發生反應:H2S+4O2F2SF6+2HF+4O2,下列說法正確的是
( )
A.氧氣是氧化產物
B.O2F2既是氧化劑又是還原劑
C.若生成4.48 L HF,則轉移0.8 mol電子
D.還原劑與氧化劑的物質的量之比為1∶4
解析氧元素的化合價由反應前的+1價變為0價,化合價降低,氧氣為還原產物,O2F2是氧化劑,A錯誤;O2F2中只有氧元素化合價降低,B錯誤;沒有指明標準狀況,無法計算,C錯誤;由方程式可知,D正確。
答案D
2.(2013年上海卷)一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到氣體VL(標準狀況),向反應后的溶液中(存在Cu2+和SO2-4),加入足量NaOH,產生藍色沉淀,過濾,洗滌,灼燒,得到CuO 12.0 g,若上述氣體為NO和NO2的混合物,且體積比為1∶1,則V可能為
( )
A.9.0 L B.13.5 L
C.15.7 L D.16.8 L
解析若混合物全部是CuS,其物質的量為0.15 mol,混合氣體中NO與NO2體積比為1∶1,設NOnmol,NO2nmol,電子轉移數0.15×(6+2)=1.2 mol,3n+n=1.2,計算得n=0.3,氣體體積V=13.44 L;若混合物全部是Cu2S,其物質的量為0.075 mol,轉移電子數0.075 mol×10=0.75 mol,3n+n=0.75,計算得n=0.187 5,氣體體積V=8.4 L,因此8.4 Llt;Vlt;13.44 L,故A項正確。
答案A

安徽省鳳陽縣第二中學,安徽省蚌埠市行知實驗學校)

