定性牽手定量的物質推斷題賞析
浙江 胡 華
定性牽手定量的物質推斷題賞析

浙江省普通高校招生化學選考中出現了一類定性牽手定量的物質推斷的試題,這類試題需要我們通過分析實驗結果推斷物質的組成,聯系所給的實驗、問題情景或圖示信息等,結合所學的相關知識和技能,還需抓住題供數量條件進行計算等定量分析,使定性與定量高度統一,才能作出正確判斷。試題難度較大,我們不妨作一聯系分析。
【真題賞析】
例1(2017年4月浙江27題)(6分)為探究黑色固體X(僅含兩種元素)的組成和性質,設計并完成如下實驗:
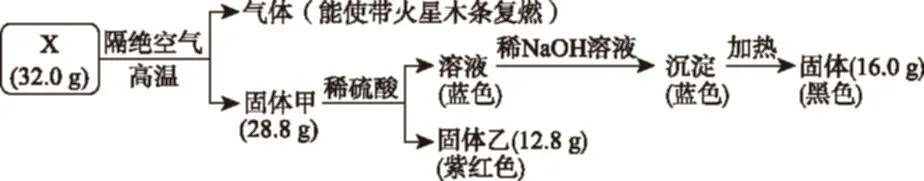
請回答:
(1)X的化學式是________。
(2)固體甲與稀硫酸反應的離子方程式是________。
(3)加熱條件下氨氣被固體X氧化成一種氣體單質,寫
出該反應的化學方程式:________。
【解析】解題需要根據題給信息定性和定量結合推斷元素無機化合物的組成、離子方程式書寫和簡單情境下的氧化還原方程式書寫。解答本題的思路:先根據現象確定X的組成元素,再根據數據計算組成元素的原子個數比。隔絕空氣高溫分解得到能使帶火星木條復燃的氣體,說明有氧元素,固體甲與硫酸反應得到的藍色溶液中含有Cu2+,紫紅色固體乙為Cu,得出固體甲即為Cu2O,從而確定X由Cu和O組成,Cu2O為28.8 g144 g/mol=0.2 mol,Cu為0.4 mol,X中O為32.0 g-0.4 mol×64 g/mol16 g/mol=0.4 mol,所以X為CuO。加熱條件下氨氣被CuO氧化成一種氣體單質N2,CuO被還原成Cu單質,根據化合價升降守恒、原子守恒配平方程式2NH3+3CuO△N2+3H2O+3Cu。
【答案】(1)CuO (2)Cu2O+2H+Cu+Cu2++H2O (3)2NH3+3CuO△N2+3H2O+3Cu
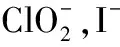
由相關反應知,2ClO2~I2~2Na2S2O3,由此可求出水中ClO2的濃度為0.675 mg/L。

(2)1∶1

(4)2.5

4.配平下列各反應式:
(1)____KMnO4+____H2O2+____H2SO4——____K2SO4+____MnSO4+____O2↑+____H2O
(2)____Fe+____NaNO2+____NaOH——____Na2FeO2+____H2O+____NH3↑
(3)____HNO3+____Cu2O——____Cu(NO3)2+____NO↑+____H2O
(4)____Pt+____HNO3+____HCl——____H2PtCl6+____NO↑+____H2O
(5)____Fe3C+____HNO3——____Fe(NO3)3+____NO2↑+____CO2↑+____H2O
(6)____KIO3+____H2SO4+____KI——____K2SO4+____I2+____H2O
答案: (1)2、5、3、1、2、5、8 (2)3、1、5、3、1、1
(3)14、3、6、2、7 (4)3、4、18、3、4、8

例2(2016年10月浙江27題)(6分)為探究不溶性鹽X(僅含四種元素)的組成和性質,設計并完成如下實驗:
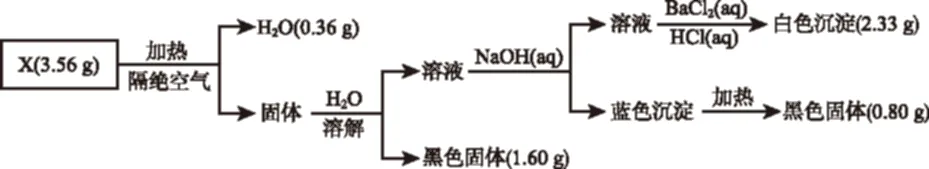
請回答:
(1)X的組成元素為H、O和________(用元素符號表示),化學式為________。
(2)寫出經一步反應能得到X的化學方程式(要求非氧化還原反應):________________________。
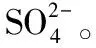
由上述分析可知,X(3.56 g)隔絕空氣加熱分解生成了H2O、CuSO4、CuO,由題給的信息已知不溶性鹽X僅含四種元素,X的組成中除含有H、O兩種元素外,則另外兩種元素為Cu、S元素。
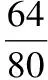

【答案】(6分)(1)S、Cu Cu3(OH)4SO4[或者2Cu(OH)2·CuSO4]

【模擬在線】
1.(2017·浙江省臺州市高三2月質評,27,6分)鳳凰石是一種用于建材裝飾的硅酸鹽礦物,已知某地出產的鳳凰石可看作由主要成分硅酸銅鹽X·3H2O(摩爾質量:334 g/mol)與含氧酸鹽雜質Y共同組成,X、Y均含三種元素,工業上利用下列流程制備銅鹽,在溶液Ⅱ中滴入KSCN溶液顯血紅色。
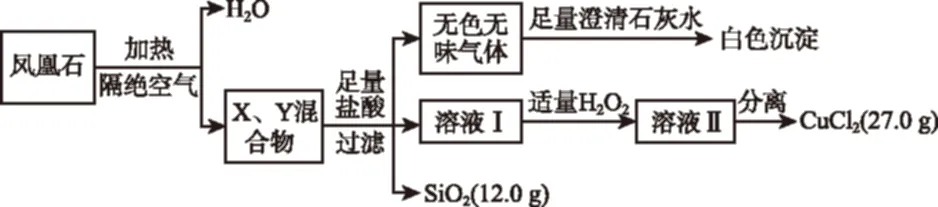
請回答:
(1)雜質Y中除氧以外還含有的元素為________(填元素符號),X的化學式為________。
(2)如果往溶液Ⅱ中繼續加入H2O2,發現有氣泡產生,有觀點認為是Y中的某元素離子將H2O2氧化所導致,寫出反應的離子方程式:________________。
【答案】(1)Fe、C Cu2Si2O6或2CuO·2SiO2


2.(2017·浙江省溫州中學3月模擬,27,6分)現有由四種元素組成的固體M,取2.3 g該固體溶于水,溶液為血紅色,滴加足量濃硝酸并加熱,溶液血紅色褪去,同時產生含有三種氣體的紅棕色混合物A。往褪色后溶液中加入足量BaCl2溶液,產生不溶于稀硝酸的白色沉淀6.99 g。過濾,往濾液中加足量NaOH溶液,產生紅褐色沉淀,過濾將沉淀充分灼燒得到0.8 g固體。將氣體混合物A通入過量的 Ba(OH)2溶液中,產生白色沉淀B,剩余氣體C為 0.42 g。氣體C無色無味,能使燃燒的木條熄滅,可排放到空氣中,不會改變空氣的成分。白色沉淀B能溶解在稀鹽酸中,并產生無色無味的氣體在標況的體積為0.672 L。
(1)M的化學式為________________。
(2)混合氣體A的成分是________ (填化學式)。
(3)往褪色后的溶液中滴加KSCN溶液時,可能有什么現象?
(4)固體M與硝酸發生題中反應時,氧化劑與還原劑的物質的量之比為____________。
(5)對于Fe2+的檢驗,從本題中得到什么啟發?________________________。
【答案】(1)Fe(SCN)3(2)NO2、CO2、N2(3)先變紅,后褪色或無現象(因為濃硝酸過量) (4)33∶1 (5)因為硝酸能氧化SCN-,所以,在檢驗Fe2+時,加入KSCN溶液后,不能用硝酸及氧化性更強的氧化劑氧化Fe2+(其他合理答案也可)
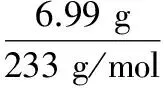
【原創提升】
(原創)為探究棕黃色固體W(含四種元素)的組成和性質,設計并完成如下實驗:
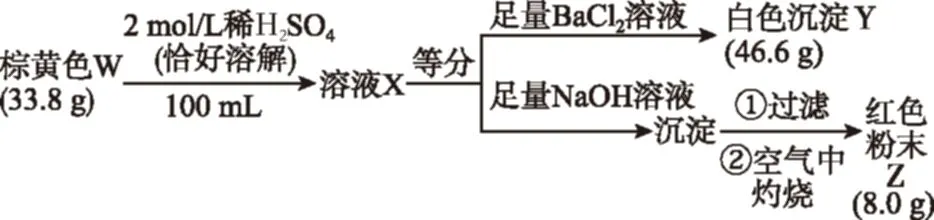
又知W是堿式鹽,請回答:
(1)W的化學式是________。
(2)產生白色沉淀Y反應的離子方程式是________。
(3)W在加熱條件下可制取鐵紅,其反應的化學方程式是________。
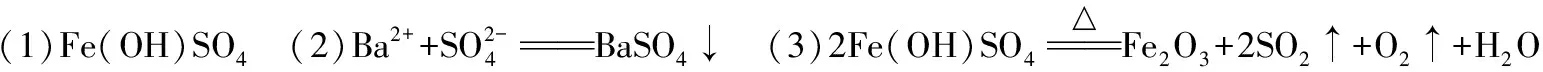

(作者單位:浙江省金華市湯溪中學)
河南省羅山高中)

