碳酸氫鈉考點的學理歸納
方大學
浙江
碳酸氫鈉考點的學理歸納
方大學

碳酸氫鈉是我們中學階段學習的一種重要的弱酸酸式鹽,因其水解的弱堿性和容易生成CO2成為生產、生活以及化學實驗中的重要物質,當然在高考命題中也備受青睞。考題往往從用途或生產、生活、化學實驗中的問題入手,考查同學們運用碳酸氫鈉的化學反應原理,分析問題、解決問題的能力。
一、碳酸氫鈉的用途
1.用作制藥工業
碳酸氫鈉有弱堿性,為吸收性抗酸藥,可作為制藥工業的原料,用于治療胃酸過多。碳酸氫鈉內服后,能迅速中和胃酸,作用迅速,且維持短暫,并有產生二氧化碳等多種缺點,不宜單用,常與碳酸鈣或氧化鎂等一起組成西比氏散用。
2.用作無機合成


3.用作食品工業的發酵劑、汽水和冷飲中二氧化碳的發生劑、黃油的保存劑
食品工業中一種應用最廣泛的疏松劑,用于生產餅干、糕點、饅頭、面包等,單用時,因受熱分解呈強堿性,用于面包時會帶黃色,并破壞小麥中維生素,最好與磷酸二氫鈣等酸性物質合用;是汽水飲料中二氧化碳的發生劑;可與明礬復合為堿性發酵粉,也可與純堿復合為民用食堿;可與檸檬酸、酒石酸等搭配配制固體清涼飲料的發泡劑(產生CO2);因系無害的弱堿性物質,洗滌蔬菜時添加約0.1%~0.2%可使綠色穩定。
尚可用于食品燙漂、去澀味。因其能使pH上升,故可提高蛋白質的持水性,促使食品組織細胞軟化,促進澀味成分溶出。對羊奶有去膻作用(用量10~20 mg/kg)。
4.用作滅火劑
消防器材中用于生產酸堿滅火劑和泡沫滅火劑。
5.用作分析試劑
取本品約1 g,精密稱定,加水50 mL使溶解,加甲基紅-溴甲酚綠混合指示液10滴,用鹽酸滴定液(0.5 mol/L)滴定至溶液由綠色變為紫紅色,煮沸2 min,冷卻至室溫,繼續滴定至溶液由綠色變為暗紫色。每1 mL鹽酸滴定液(0.5 mol/L)相當于42.00 mg的NaHCO3。
6.用作洗滌劑
對洗滌劑過敏的人,可在清水中加少許小蘇打,能把碗、盤子洗干凈。也可以用小蘇打來擦洗不銹鋼鍋、銅鍋或鐵鍋,小蘇打還能清洗熱水瓶內的積垢。
二、碳酸氫鈉的性質
1.與無機酸、有機酸反應


2.與堿反應

與氫氧化鈣反應:碳酸氫鈉的劑量要分過量和少量


3.與鹽反應


4.雙水解


5.加熱

6.電離和水解

三、真題回放
1.(2016江蘇卷)根據侯氏制堿原理制備少量NaHCO3的實驗,經過制取氨氣、制取NaHCO3、分離NaHCO3、干燥NaHCO3四個步驟,下列圖示裝置和原理能達到實驗目的的是
( )

【解析】氯化銨受熱分解生成的氨氣和氯化氫在試管口遇冷又生成氯化銨固體,不能用加熱氯化銨固體的方法制備氨氣,A錯誤;應該從右側導管通入CO2氣體,B錯誤;從溶液中分離出碳酸氫鈉固體用過濾的方法,C正確;碳酸氫鈉受熱易分解,不能用該裝置干燥碳酸氫鈉,D錯誤。故選C。
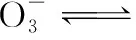
【解析】當少量酸性物質進入血液中,平衡向右移動,使H+濃度變化較小,血液中的pH基本不變;當少量堿性物質進入血液中,平衡向左移動,使H+濃度變化較小,血液的pH基本不變。
3.(原創)從化學角度解釋下列問題。
(1)泡騰片(含NaHCO3、檸檬酸、酒石酸)放入水中,為什么水會“沸騰”并變冷?____________
____________。
(2)能否利用氯化鈣溶液鑒別碳酸鈉溶液與碳酸氫鈉溶液,理由是____________。

浙江省義烏市教育研修院)

