論電解質溶液復習教學中的理性思維
應化德
浙江
論電解質溶液復習教學中的理性思維
應化德

本文的理性思維是指對電解質溶液的相關概念的理解方式,掌握電解質問題的相對處理方法、近似處理方法、抓主放次的處理方法,樹立微粒觀、守恒觀、變化觀、平衡觀、離子相互牽制觀,分析判斷離子反應的反應順序和定量關系,形成理解電解質溶液性質的相對思想和絕對思想等。只有這樣,解決電解質溶液問題時才能游刃有余。
一、概念的理解方式
化學學科體系由基本概念和基本原理構成,概念的學習并不是把概念的定義記住,而是要理解概念的意義,知道其內涵與外延,并有相應的概念理解方式。人們對物質的認識有相對性,概念自身也可不斷地發展與豐富。
電解質溶液涉及一些重要的概念,如電解質、非電解質、強弱電解質、pH、電離平衡常數、鹽類水解等。下面談電解質的理解方法:
電解質是在水溶液或熔融狀態下能導電的化合物,首先電解質是化合物而非混合物,是能夠導電的化合物,是在水溶液或熔融狀態下導電,而非本身能導電。
電解質→化合物→能導電的→水溶液或熔融狀態。
為進一步理解電解質的內涵和一些物質的性質,可以設計如下問題:
1.如何評價“電解質本身往往是不導電的”?
如HCl在氣態、液態、固態時均不能導電,但它是電解質。NaCl在固體時不能導電,但熔融狀態時能導電,物質三態的性質有所不同,離子化合物在常溫時均為固態,所以上述描述相對正確。
2.NH3一般認為是非電解質,但實驗證明,液態氨氣與H2O的電導率接近,且與水一樣也是雙聚電離,問:
(1)NH3是電解質嗎?
(根據信息,按定義判斷是電解質)
(2)寫出NH3的電離方程式。

(3)Na能與NH3發生反應,寫出化學方程式。

3.液態的SO2也會發生與H2O相似的電離,寫出電離方程式。

4.CH3CH2OH是非電解質,但工業上用乙醇和NaOH反應制備乙醇鈉(需及時吸收生成的水),乙醇能與Na反應生成H2。
(1)上述事實說明乙醇有什么性質?(有電離的傾向,有酸的傾向)
(2)C2H5ONa水解溶液呈什么性?用離子方程式表示。

物質的分類,主要依據物質的組成和性質,人們在不同的階段對物質性質的認識存在相對性。電解質與非電解質的區分也是相對的。
二、問題處理方式
1.相對處理方法
相對處理方法是指以某種物質的性質做參照物,與其互相對比,或兩個過程相互抵消而得出結論的思維方法。
例如:在CH3COOH和CH3COONa的混合溶液中,c(Na+)與c(CH3COO-)的大小問題,可采用相對處理的方法,可以快速得出結論,分析如下:


當溶液pH<7時,可認為CH3COO-不水解而CH3COOH電離,水解被電離抵消,所以c(CH3COO-)>c(Na+)
當溶液pH=7時,可認為CH3COOH電離、CH3COO-水解都不產生,只有CH3COONa的電離,所以c(CH3COO-)=c(Na+)
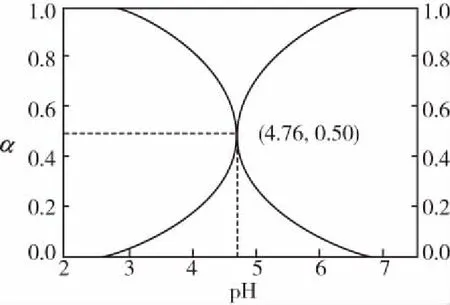
當溶液pH>7時,可認為只有水解而CH3COOH不電離,所以c(CH3COO-) 再如:NH3·H2O的Kb=1.8×10-5,CH3COOH的Ka=1.8×10-5,CH3COONH4溶液呈中性,那么NH4NO2溶液、NH4CN溶液的酸堿性如何呢? 以CH3COONH4為參照物,由于HNO2的酸性(Ka=4.6×10-4)比CH3COOH強,而HCN的酸性(Ka=4.93×10-10)比CH3COOH弱,根據“越弱越水解,誰強呈誰性”,可知NH4NO2溶液為酸性,而NH4CN溶液為堿性。 2.近似處理方法 在弱電解質溶液電離的平衡體系中,數據的近似處理,使問題簡化,容易得出結論,但要注意近似處理的條件范圍。 例如:已知CH3COOH的電離平衡常數K=1.8×10-5,求0.1 mol·L-1的CH3COOH溶液中的c(H+),設電離度為α, c0 0 c-cαcαcα 經查α=0.0134,則1-α≈1(一般弱電解質的α都比較小、但在稀溶液中α會比較大) 同樣可以推算pH=2的鹽酸和醋酸的物質的量濃度分別為0.01 mol·L-1、5.56 mol·L-1,僅僅相差555倍,相同體積相同pH的HCl與CH3COOH溶液分別與足量的鋅粒反應生成的H2相差555倍,讓學生從感性認識上升到理性認識,理性認識更有說服力。 例如:(浙江高考2016年4月第30題節選) N2H4的水溶液呈弱堿性,室溫下其電離常數K1≈1.0×10-6,則0.01 mol·L-1N2H4水溶液的pH等于________(忽略N2H4的二級電離和H2O的電離)。 分析NH3、N2H4、R-NH2的水溶液呈堿性的原因,氮原子上的孤電子對與水電離的氫離子形成配位鍵,電離出OH-。 1×10-4, 所以pH=10。 例如:求0.1 mol·L-1NH4Cl溶液中的c(H+)。 ≈7.5×10-7mol·L-1 例如:求CH3COOH和CH3COONa混合液為中性時,兩者的濃度比。 分析:設CH3COOH和CH3COONa的濃度為c1、c2mol·L-1,c(H+)為xmol·L-1, c1c20 c1-xc2+xx 也就是當CH3COOH和CH3COONa混合液中,當兩者濃度之比為1∶200時溶液接近中性,這對理解溶液的性質,量的關系有一定的化學意義。 所以CH3COOH與CH3COONa濃度比為1∶1時,溶液呈酸性,這是比較溶液離子濃度的前提。 3.抓大放小(抓主放次)的處理方法 抓大放小,分清主次的處理方法,可以快速比較溶液中粒子濃度的大小,快速近似地計算等。 例如:已知NaHSO3溶液呈現酸性,比較NaHSO3溶液中的粒子濃度大小。 ②方程式c(H2SO3)=c(OH-), 同樣考慮水的電離③可得c(OH-)>c(H2SO3)。 所以離子濃度大小關系為 例如:N2H4易溶于水,是與氨相類似的弱堿,已知其常溫下電離常數K1≈1.0×10-6,常溫下,將0.2 mol·L-1N2H4·H2O與0.1 mol·L-1鹽酸等體積混合(忽略體積變化),則此時溶液的pH等于___________(忽略N2H4的二級電離)。 分析:N2H4·H2O與鹽酸反應后,N2H4·H2O與N2H5Cl的濃度均為0.05 mol·L-1,首先要判斷該溶液是酸性還是堿性,酸性則以水解為主,而堿性則以電離為主,根據N2H4·H2O的K值與NH3·H2O的K值接近,可判斷為堿性(NH3·H2O與NH4Cl為1∶1時,溶液為堿性遷移過來),則 0.05-x0.05+xx 所以pH=8。 以此類推,若HCN與NaCN 1∶1的溶液呈堿性,則以水解方程式近似計算。 1.微粒觀、存在觀 (浙江高考2017年4月第23題)25℃時,在含CH3COOH和CH3COO-的溶液中,CH3COOH和CH3COO-二者中各自所占的物質的量分數(α)隨溶液pH變化的關系如圖所示。下列說法不正確的是 ( ) A.在pH<4.76的溶液中,c(CH3COO-) B.在pH=7的溶液中,α(CH3COOH)=0,α(CH3COO-)=1.0 C.在pH>4.76的溶液中,c(CH3COO-)與c(OH-)之和可大于c(H+) D.在pH=4.76的溶液中加鹽酸,α(CH3COOH)與α(CH3COO-)之和保持不變 點評:B項是錯的,pH=7時,從圖象上看,似乎α(CH3COOH)=0,α(CH3COO-)=1.0是對的,本題的考查學生的微粒觀、存在觀,盡管此時α(CH3COOH)很小,但不可能為0,高考第一次出現,有一定的隱蔽性。 2.守恒觀 電解質溶液中存在電荷守恒、物料守恒、質子守恒等。 3.變化觀、平衡移動觀 量變引起質變,如CH3COOH與CH3COONa的兩者量的比例變化導致溶液酸堿性的變化。多元弱酸的電離逐級減弱,如H2SO3的電離: 4.離子相互牽制觀 同一離子同時牽制幾個平衡,如在HF、CH3COOH的水解溶液中,c(H+)同時制約HF、CH3COOH、H2O的電離平衡。 溶液中c(H+)=c(F-)+c(CH3COO-)+c(OH-),溶液的氫離子的總濃度同時制約三個平衡,有 弱電解質電離的強弱,決定相應陽離子、酸根離子的水解程度,也影響多離子反應的反應順序。 弱電解質的分步電離→水解程度大小→離子反應順序,如: 碳酸電離: 碳酸鈉水解: 向碳酸鈉與碳酸氫鈉混合液滴加鹽酸的反應順序: 理解反應先后的本質原因,掌握判斷的方法。如在CH3COOH和HCl的混合溶液中加入NaOH溶液,HCl先反應,反應本質是H+與OH-的中和反應,若CH3COOH先與NaOH反應生成CH3COONa,HCl又會與CH3COONa反應生成CH3COOH。反應順序、定量關系是高考考查主要思想之一。下列化學反應都要考慮順序: ①CH3COOH、HCl(HX、HY)的混合液中滴加NaOH溶液 ②NaOH、Ca(OH)2混合溶液中通入CO2 ③Na2CO3、NaHCO3混合溶液中滴加鹽酸 ④NH4Cl、AlCl3混合溶液中滴加NaOH溶液 ⑤HCl、MgCl2、AlCl3混合溶液中滴加NaOH溶液 ⑦NH4Fe(SO4)2、NH4Al(SO4)2溶液中分別滴入Ba(OH)2溶液 ⑧NaHCO3與Ca(OH)2溶液相互滴加 (浙江高考2013年第12題)25℃時,用濃度為0.100 0 mol·L-1的NaOH溶液滴定20.00 mL濃度均為0.100 0 mol·L-1的三種酸HX、HY、HZ,滴定曲線如圖所示。下列說法正確的是 ( ) A.在相同溫度下,同濃度的三種酸溶液的導電能力順序:HZ B.根據滴定曲線,可得Ka(HY)≈10-5 C.將上述HX、HY溶液等體積混合后,用NaOH溶液滴定至HX恰好完全反應時:c(X-)>c(Y-)>c(OH-)>c(H+) 此題考查強弱酸的判斷,pH的變化,離子濃度的變化,守恒思想的應用,K值的求算,c(H+)的表達式。此題滲透K值的相對處理、反應順序、離子的相互牽制等學科思想。 浙江省金華市外國語學校)
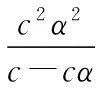

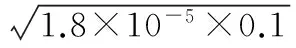

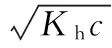

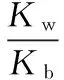
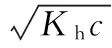

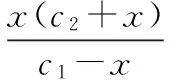
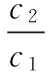
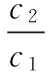
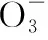
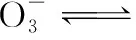
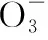



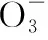
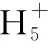

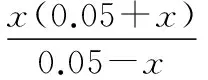
三、電解質溶液學科思想或觀點

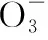
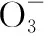

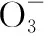

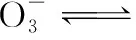
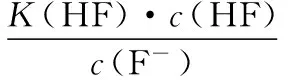
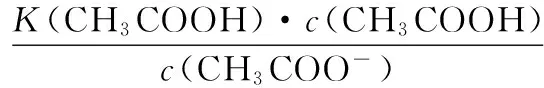
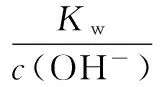
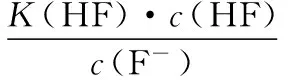
四、電解質溶液中的離子反應

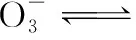
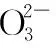
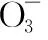
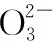
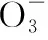

五、典型試題解析