黃河鯉嗜水氣單胞菌的分離、毒力及用藥分析
趙賢亮,陳 鶴,楊 瀟,巴新霞,李 莉,孔祥會
( 河南師范大學 水產學院,河南 新鄉 453007 )
黃河鯉嗜水氣單胞菌的分離、毒力及用藥分析
趙賢亮,陳 鶴,楊 瀟,巴新霞,李 莉,孔祥會
( 河南師范大學 水產學院,河南 新鄉 453007 )
自發病黃河鯉4種組織中分離致病菌,結合形態學和16S rDNA序列分析,發現分離到的細菌屬氣單胞菌屬。回歸感染試驗發現,患病魚體出現鰓蓋等多處組織出血且伴隨腸炎等癥狀,表明引起黃河鯉發病的致病菌為嗜水氣單胞菌,命名為HNAh01。半致死密度測定發現,嗜水氣單胞菌HNAh01的半致死密度為1.38×107cfu/mL。藥敏結果表明,該致病性嗜水氣單胞菌是典型的多重耐藥嗜水氣單胞菌,但對恩諾沙星極為敏感。因此,選擇恩諾沙星對分離菌株進行體外藥效學和用藥分析試驗。藥效學試驗表明,恩諾沙星對嗜水氣單胞菌HNAh01的最小抑菌質量濃度為1.56 ng/mL,最小殺菌質量濃度為3.12 ng/mL,防耐藥突變質量濃度為12.5 ng/mL,耐藥選擇窗的范圍為1.56~12.5 ng/mL。用藥分析結果顯示,黃河鯉口服劑量為10 mg/kg時對嗜水氣單胞菌HNAh01的相對保護率達83%。本文研究為嗜水氣單胞菌的防治提供了理論基礎與實踐依據。
黃河鯉;嗜水氣單胞菌;恩諾沙星;用藥分析
黃河鯉(Cyrinuscarpio)是我國四大名魚之一,其產業化迅速發展,在促進漁業經濟及區域漁民增收上發揮著重要作用。但是,由于養殖生態環境惡化(水體污染、富營養化、高密度養殖等)導致各種病害頻發,嚴重制約黃河鯉養殖業的可持續發展。嗜水氣單胞菌(Aeromonashydrophila)作為一種條件性致病菌,其具有多種毒力因子及胞外產物,可引起魚類、兩棲類、爬行類等多種冷血動物和哺乳動物發病,是一種典型的人—畜—魚共患病病原菌[1],一直是國內外學者研究的熱點。嗜水氣單胞菌可感染多種水產養殖魚類,如草魚(Ctenopharyngodonidellus)[2]、鰱魚(Hypophthalmichthysmolitrix)[3]、鳙魚(Aristichthysnobilis)[4]、鯉魚[5]、鯽魚(Carassiusauratus)[6]、麥穗魚(Pseudorasboraparva)[7]、尼羅羅非魚(Oreochromisniloticus)[8]和斑點叉尾(Ietaluruspunetaus)[9]等。
本研究從河南師范大學水產學院養殖基地獲得患病黃河鯉,通過體表觀察和剖檢分析發病癥狀,對發病鯉的4種不同組織進行病原分離純化,通過16S rDNA序列分析鑒定病原菌。選擇病原菌進行回歸感染、病原菌半數致死密度計算、藥敏試驗及用藥分析,旨在為研究鯉魚感染細菌性疾病及臨床合理用藥提供理論依據。
1 材料與方法
1.1 材料來源
病魚采自河南師范大學水產學院養殖基地瀕臨死亡黃河鯉,體質量約50 g,體長約12.0 cm。患病鯉魚鰓蓋、鰭基等多處組織具有充血癥狀,解剖樣品發現腸炎等癥狀。
1.2 主要試劑
細菌基礎培養基、腦心浸液肉湯培養基、抗生素均購自上海生工生物工程有限公司,PCR相關試劑均為寶生物工程技術服務公司產品。引物及測序分析由上海生工生物工程有限公司完成。
1.3 菌株分離及16S rDNA測序驗證
取患病鯉魚的鰓、腸、腎和肝臟組織進行病原分離和純化。觀察細菌基礎培養基上菌落生長的形態特征,并進一步用16S rDNA的PCR擴增引物(F:5′-AGAGTTTGATCATGGCTCAG-3′ 和R:5′-CTACGGTTACCTTGTTACGAC-3′)對其進行序列擴增。
PCR反應體系:模板DNA 1 μL,16S rDNA上下游引物各1 μL,dNTP 2.5 μL,PCR Buffer 2.5 μL,ExTaq 0.25 μL,ddH2O補足至25 μL。PCR反應條件:95 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30個循環;72 ℃延伸10 min。將PCR產物送至上海生工生物工程有限公司測序。
將已得到的序列與GenBank進行序列相似性比對,確定其物種。
1.4 半致死密度測定
細菌在腦心浸液肉湯固體培養基上28 ℃培養16 h,挑取單菌落于新鮮腦心浸液肉湯液體培養基中過夜培養,再用無菌生理鹽水(0.85%)按5倍梯度稀釋,分別配成2×106~2.5×108cfu/mL 4個密度梯度的菌懸液。取50尾黃河鯉分為5組,每組10尾,分別于腹腔注射0.2 mL菌懸液,對照組每尾注射等體積生理鹽水,魚感染試驗在20~26 ℃室溫下進行。觀察試驗魚發病癥狀,每12 h統計魚的死亡情況,連續觀察7 d。依據累計法(Reed-Muench法)[10]計算該病原菌的半數致死密度。
1.5 抗菌藥物最小抑菌質量濃度和最小殺菌質量濃度測定
病原菌對常見抗生素的最小抑菌質量濃度測定采用96孔板進行。將2倍梯度稀釋的抗菌藥物分別加入至滅菌的96孔板中,第1至第11孔加藥液,每孔10 μL,第12孔不加藥液作為生長對照。過夜培養的菌液經腦心浸液肉湯培養基1∶1000稀釋后(每孔約1×105~2×105cfu),向每孔中加100 μL,密封后置28 ℃培養箱中16~20 h,以能抑制細菌生長的最小藥物質量濃度,即為最小抑菌質量濃度。從最小抑菌質量濃度以上的孔中取100 μL培養液,涂布于腦心浸液肉湯瓊脂平板上,以菌落數不超過5個的最小藥物質量濃度為最小殺菌質量濃度,試驗重復3次。
1.6 防耐藥突變質量濃度和突變選擇窗的測定
防耐藥突變質量濃度的測定參考文獻[11]。將單菌落接種于腦心浸液肉湯培養基中,過夜培養后,菌液于3000 r/min離心5 min,將菌體懸浮于10倍原液體積的腦心浸液肉湯培養基中,震蕩培養6 h,再次離心后將菌液密度用適量的腦心浸液肉湯培養基調整為3×1010cfu/mL。分別取調整好密度的菌液100 μL均勻涂抹在每個含有1~10 個最小抑菌質量濃度的恩諾沙星藥物瓊脂平板上,每個藥物質量濃度4個平板。腦心浸液肉湯固體平板于30 ℃孵育72 h,以72 h后沒有菌落生長的最低藥物質量濃度即為恩諾沙星對該病原菌的防耐藥突變質量濃度。突變選擇窗的上界為防耐藥突變質量濃度,下界為細菌的最小抑菌質量濃度,即突變選擇窗的范圍為最小抑菌質量濃度至防耐藥突變質量濃度。
1.7 恩諾沙星的給藥及細菌攻毒試驗
將50 mg/mL的恩諾沙星溶液用無菌生理鹽水稀釋至0.625、1.25 mg/mL和2.5 mg/mL,健康黃河鯉分別口服0.2 mL藥物,即口服劑量分別為2.5、5 mg/kg和10 mg/kg恩諾沙星,對照組以等體積無菌生理鹽水代替。每日給藥一次,連續給藥6 d[12-13]。給藥3 d后分別對各組試驗魚進行病原菌攻毒,每尾魚注射0.2 mL 5×107cfu/mL HNAh01菌株。感染后每12 h觀察黃河鯉的死亡情況,持續7 d。
恩諾沙星的相對保護率/%=[1-(治療組死亡率/對照組死亡率)]×100%
2 結果與分析
2.1 病原菌分離鑒定
將發病魚體的4種組織分離得到的病原菌在細菌基礎固體瓊脂培養基上28 ℃培養16 h后,菌落為園形,直徑約1 mm,表面光滑,半透明,乳白色,中央隆起(圖1)。
從4種組織平板中分別挑取單菌落培養并提取細菌基因組DNA,擴增16S rDNA基因序列,將PCR產物進行瓊脂糖凝膠電泳,發現其片段長度約為1500 bp。PCR產物測序結果采用在線BLAST分析(http://blast.ncbi.nlm.nih.gov),結果發現分離菌序列與GenBank中多個已報道的嗜水氣單胞菌序列同源性最高,達99%以上。結合分離菌的表型及分子生物學分析,判定該菌株為氣單胞菌屬。選取其中一株HNAh01作進一步的研究。

圖1 病魚鰓(a)、腸(b)、腎(c)和肝(d)的病原菌分離
2.2 菌株HNAh01毒力分析
人工感染試驗表明,菌株HNAh01注射黃河鯉12 h后,5×107cfu/mL及2.5×108cfu/mL密度組首先出現死亡情況,攻毒48 h內,各個密度梯度中試驗魚分別出現不同數量的死亡,對照組全部正常。其中,24 h后,107cfu/mL密度組出現死亡,注射36 h后,2.5×108cfu/mL密度組魚全部死亡(圖2)。死亡魚體從體表觀察和剖檢結果都表現出與自然發病相似的癥狀,主要表現為鰓蓋、胸鰭、腹鰭等基部及多處內臟出血,確定感染鯉魚的病原菌為嗜水氣單胞菌。根據累計法計算嗜水氣單胞菌HNAh01的半數致死密度為1.38×107cfu/mL,即每尾魚注射約2.7×106cfu即會導致魚體死亡50%。
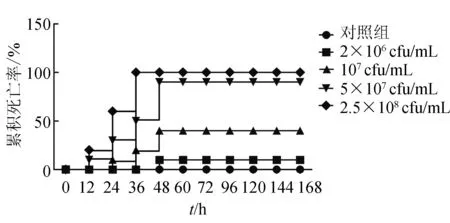
圖2 嗜水氣單胞菌HNAh01感染試驗結果
2.3 耐藥性分析
采用微量液體稀釋法測定嗜水氣單胞菌HNAh01對常見抗菌藥物的最低抑菌質量濃度。以實驗室一株敏感且低毒力菌株作為對照菌株[14],比較該分離菌株的耐藥性。結果表明,嗜水氣單胞菌HNAh01對鏈霉素、青霉素類抗生素和磺胺類抗生素均表現出較高耐藥性(最小抑菌質量濃度≥64 μg/mL),且對巴洛沙星、慶大霉素、卡那霉素和頭孢曲松鈉也表現一定的耐藥性(嗜水氣單胞菌HNAh01最小抑菌質量濃度/對照菌株最小抑菌質量濃度≥4)。在所有受試的抗生素中,嗜水氣單胞菌HNAh01僅對恩諾沙星和氟苯尼考表現出敏感性,特別是恩諾沙星的最小抑菌質量濃度為0.00156 μg/mL(表1)。這一結果可為發病魚的藥物防治提供用藥依據,但其藥物的劑量、效果還待進一步研究。

表1 嗜水氣單胞菌HNAh01及對照菌株對常見抗生素的藥敏試驗結果
注:S,敏感,與對照菌株的最小抑菌質量濃度比≤4;R,耐藥,與對照菌株的最小抑菌質量濃度比≥4;-,對照菌株和分離菌株均對此抗生素表現較強的耐藥性.
2.4 恩諾沙星用藥分析
微量液體稀釋法及涂平板結果顯示,恩諾沙星對嗜水氣單胞菌HNAh01的最小抑菌質量濃度為1.56 ng/mL,最小殺菌質量濃度為3.12 ng/mL,最小殺菌質量濃度/最小抑菌質量濃度為2。防耐藥突變質量濃度測定結果發現,恩諾沙星的防耐藥突變質量濃度為12.5 ng/mL,突變選擇窗的范圍為1.56~12.5 ng/mL。這一結果暗示魚體血液或肌肉中恩諾沙星質量濃度在達到12.5 ng/mL時,既能有效的發揮殺菌效果,又能減少恩諾沙星耐藥菌株的發生概率。
[12-13]的研究,鯽魚口灌5 mg/kg恩諾沙星時,血清中恩諾沙星的峰質量濃度達到(1.88±0.19) μg/mL,且血藥質量濃度大于防耐藥突變質量濃度發揮抗菌療效的時間可達24 h以上。因此,選取3個質量濃度梯度的恩諾沙星劑量進行用藥分析。健康黃河鯉分別口服2.5、5 mg/kg和10 mg/kg劑量的恩諾沙星,每日給藥1次,連續給藥6 d。給藥3 d后,用5×107cfu/mL菌懸液感染健康黃河鯉,結果發現2.5、5 mg/kg和10 mg/kg恩諾沙星的相對保護率分別為33.3%、66.7%和83.3%,且給藥組的魚體死亡時間均推遲至少12 h,即攻毒24 h后魚體才開始出現死亡情況(圖3)。
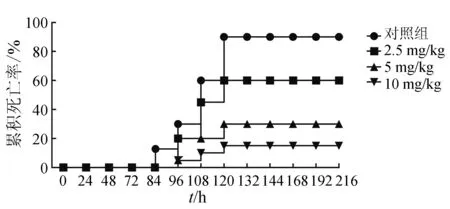
圖3 口服不同劑量恩諾沙星的防治效果
3 討 論
3.1 嗜水氣單胞菌的毒力及耐藥性
嗜水氣單胞菌存在于許多水生動物的體表和鰓上,是魚類最主要致病菌之一,可引起魚類疥瘡病、潰瘍病、出血病、敗血病等多種疾病,死亡率極高[15]。在我國淡水漁業養殖區,魚類因感染嗜水氣單胞菌發病的情況非常普遍,給水產養殖業造成了巨大的經濟損失[16]。有研究發現,嗜水氣單胞菌感染致病的雜交鱘(Husodauricus♀×Acipenserschrencki♂),出現體表發紅、鰓絲潰爛、腹腔內臟出血、神經壞死彌散等癥狀[17]。在回歸感染試驗中,本研究分離到的嗜水氣單胞菌HNAh01使試驗魚的胸鰭、腹鰭等基部及肛門充血,與自然發生的爆發癥狀表現一致。毒力研究表明,該菌株的半致死密度為1.38×107cfu/mL,與實驗室對照菌株相比具有較強的致病性,因此其具有較高的研究價值。
在水產動物病害防治中,養殖者大量使用抗菌藥物進行防治魚類細菌性疾病。近年來,隨著抗生素的大量使用,濫用或錯用問題突出,水產致病菌包括嗜水氣單胞菌的耐藥現象越來越嚴重。在本研究中,分離到的嗜水氣單胞菌HNAh01耐藥情況十分嚴重,特別對鏈霉素、青霉素類抗生素和磺胺類抗生素均表現出較高耐藥性,對巴洛沙星、慶大霉素、卡那霉素和頭孢曲松鈉也表現一定的耐藥性,這一結果表明分離到的菌株是一株典型的多重耐藥嗜水氣單胞菌。在所有受試的抗生素中,嗜水氣單胞菌HNAh01僅對恩諾沙星和氟苯尼考表現出敏感性。因此,在實際的生產實踐中可以科學合理地使用恩諾沙星和氟苯尼考進行防治,以預防耐藥菌株的產生與加重。
3.2 抗菌藥物的用藥分析
為了科學合理地使用抗菌藥物進行水產動物病害的防治,以恩諾沙星為研究對象進行藥物用量與藥效的評估。恩諾沙星作為第三代喹諾酮類抗菌藥物,在畜禽和水產養殖中應用廣泛,具有口服吸收效果好、抗菌譜廣、抗菌力強、作用迅速及與其他抗生素之間無交叉耐藥性等特點[18-19]。在水產養殖用藥過程中,要做到對水產養殖動物的精準用藥,必須掌握致病菌對藥物的敏感性,即最小抑菌質量濃度。根據抗菌藥物有效血藥質量濃度維持在最小抑菌質量濃度和防耐藥突變質量濃度之間,且不對機體產生毒害作用的評價標準,本研究采用3個給藥劑量且采取攻毒前和攻毒后連續給藥的模式,結果表明,口服10 mg/kg的恩諾沙星后可以起到極好的治療效果,且停藥3 d后魚體基本不會再出現發病癥狀。這一結果與徐麗娟等[12-13,20]的研究結論相似。
在水產養殖過程中,針對不同地區、不同時期及發病細菌的種類進行流行病學調查,適當調整藥物劑量及種類的用藥方案,結合不同藥物在魚體內的藥物代謝動力學和藥效學研究,不僅做到科學的“精準用藥”模式,在應用中具有較好的用藥效果,同時也極大緩解水產養殖動物致病菌的耐藥問題。本文主要探討恩諾沙星用藥劑量及用藥效果,該試驗結果可為研究鯉魚源嗜水氣單胞菌分離鑒定及臨床選藥提供參考,為水產養殖精準用藥提供依據。
參考文獻:
[1] Rahim Z, Sanyal S C, Aziz K M, et al. Isolation of enterotoxigenic, hemolytic, and antibiotic-resistantAeromonashydrophilastrains from infected fish in Bangladesh[J]. Applied and Environmental Microbiology, 1984, 48(4):865-867.
[2] Mao W F, Wang Y, Wang W B, et al. Enhanced resistance toAeromonashydrophilainfection and enhanced phagocytic activities in human lactoferrin-transgenic grass carp (Ctenopharyngodonidellus)[J]. Aquaculture, 2004, 242(1):93-103.
[3] Dar G H, Dar S A,Kamili A N, et al. Detection and characterization of potentially pathogenicAeromonassobriaisolated from fishHypophthalmichthysmolitrix(Cypriniformes:Cyprinidae)[J]. Microbial Pathogenesis, 2016(91):136-140.
[4] 孫承文, 任燕, 石存斌, 等. 鰱鳙魚源致病性嗜水氣單胞菌的分離、鑒定[J]. 廣東農業科學, 2010, 37(9):5-8.
[5] Gopalakannan A, Arul V. Immunomodulatory effects of dietary intake of chitin, chitosan and levamisole on the immune system ofCyprinuscarpioand control ofAeromonashydrophilainfection in ponds[J]. Aquaculture, 2006, 255(1):179-187.
[6] Brenden R A, Huizinga H W. Pathophysiology of experimentalAeromonashydrophilainfection in goldfish,Carassiusauratus(L.)[J]. Journal of Fish Diseases, 1986, 9(2):163-167.
[7] 賀文旭, 毛會麗, 楊利敏, 等. 豫北地區主要淡水魚類感染嗜水氣單胞菌的流行病學調查[J]. 水產科學, 2016, 35(3):278-283.
[8] Pridgeon J W, Klesius P H, Song L, et al. Identification, virulence, and mass spectrometry of toxic ECP fractions of West Alabama isolates ofAeromonashydrophilaobtained from a 2010 disease outbreak[J]. Veterinary Microbiology, 2013, 164(3):336-343.
[10] Thakur A K, Fezio W L. A computer program for estimating LD50and its confidence limits using modified Behrens-Reed-Muench cumulant method[J]. Drug and Chemical Toxicology, 1981, 4(3):297-305.
[11] Sindelar G, Zhao X, Liew A, et al. Mutant prevention concentration as a measure of fluoroquinolone potency against mycobacteria[J]. Antimicrobial Agents and Chemotherapy, 2000, 44(12):3337-3343.
[12] 徐麗娟, 權可艷, 王浩, 等. 恩諾沙星控制嗜水氣單胞菌性鯽敗血癥的防耐藥用藥方案[J]. 中國水產科學, 2013, 20(3):635-643.
[13] 王浩, 權可艷, 徐麗娟, 等. 恩諾沙星控制草魚維氏氣單胞菌的用藥方案[J]. 淡水漁業, 2013, 43(2):48-53.
[14] Wang M, Zhao X, Kong X, et al. Molecular characterization and expressing analysis of the c-type and g-type lysozymes in Qihe crucian carpCarassiusauratus[J]. Fish & Shellfish Immunology, 2016(52):210-220.
[15] 陸承平. 致病性嗜水氣單胞菌及其所致魚病綜述[J]. 水產學報, 1992,17(3):282-288.
[16] Zhang X, Yang W, Wu H, et al. Multilocus sequence typing revealed a clonal lineage ofAeromonashydrophilacaused motileAeromonassepticemiaoutbreaks in pond-cultured cyprinid fish in an epidemic area in central China[J]. Aquaculture, 2014(432):1-6.
[17] 徐祥, 李華, 葉仕根, 等. 雜交鱘嗜水氣單胞菌病的組織病理學研究[J]. 大連海洋大學學報, 2014,29(3):227-231.
[18] 劉開永, 汪開毓. 恩諾沙星在水產中的應用與研究[J]. 中國獸藥雜志, 2004, 38(10):32-34.
[19] 黃文祥, 鄧文武. 恩諾沙星在水產動物體內藥物代謝的研究概況[J]. 中國實用醫藥, 2009, 4(12):233-234.
[20] 張雅斌, 劉艷輝, 張祚新, 等. 恩諾沙星在鯉體內的藥效學及藥動力學研究[J]. 大連水產學院學報, 2004, 19(4):239-242.
Isolation,Virulence,ResistanceandMedicationofAeromonashydrophilafromCommonCarpCyprinuscarpio
ZHAO Xianliang, CHEN He, YANG Xiao, BA Xinxia, LI Li, KONG Xianghui
( College of Fisheries, Henan Normal University,Xinxiang 453007, China )
A pathogenic bacterial strain was isolated from four tissues of common carpCyprinuscarpiosuffering from hemorrhagic septicemia. Combined with the morphological characteristics and the 16S rDNA sequence analysis showed that the identified isolate belongs toAeromonashydrophila, named HNAh01. Recurrent infection showed that the LD50was 1.38×107cfu/mL after artificial infect healthy common carp with hemorrhages at the base of pectoral and pelvic fins. The drug sensitivity test revealed that HNAh01 was a typical multi-drug resistantA.hydrophila. However, the pathogen was extremely sensitive to enrofloxacin and the minimum inhibitory concentration (MIC) was 1.56 ng/mL, the minimum bactericidal concentration (MBC) was 3.12 ng/mL, mutant prevention concentration (MPC) was 12.5 ng/mL, and drug selection window (MSW) in the range of 1.56—12.5 ng/mL. Medication showed that once-daily dose of 10 mg/kg for 6 d the relative protection ratio (RPS) was amounted to 83%. The methods described in this study also can be used for developing dose guidelines for other anti-bacterial drugs for the prevention and treatment ofA.hydrophila.
Cyrinuscarpio;Aeromonashydrophila; enrofloxacin; medication
10.16378/j.cnki.1003-1111.2017.05.017
2016-08-29;
2016-10-10.
國家自然科學基金資助項目(31502204);廣東省海洋生物技術重點實驗室開放基金資助項目(GPKLMB201503).
趙賢亮(1983—),男,博士;研究方向:水產動物免疫與病害防治.E-mail:zxl830724@163.com.通訊作者:孔祥會(1968—),男,博士;研究方向:水產動物免疫與病害防治.E-mail:xhkong@htu.cn.
S917.1
A
1003-1111(2017)05-0642-05

