FAM213B基因啟動子在豬子宮內膜細胞的轉錄調控
張愛玲,孫顯月,盧孝璋,吳琦,李加琪,張豪
?
FAM213B基因啟動子在豬子宮內膜細胞的轉錄調控
張愛玲1, 2,孫顯月2,盧孝璋2,吳琦2,李加琪2,張豪2
(1廣東高校應用生態工程技術開發中心/廣東第二師范學院生物與食品工程學院廣州 510310;2華南農業大學動物科學學院/廣東省農業 動物基因組學與分子育種重點實驗室,廣州510642)
分析豬FAM213B基因啟動子轉錄活性區域,并檢測轉錄因子NFκB對啟動子活性及豬FAM213B基因表達影響,為深入了解FAM213B基因的轉錄調控機制影響前列腺素合成、母豬妊娠等繁殖活動奠定基礎。采集卵泡期子宮,分離子宮內膜上皮組織,經膠原酶方法獲得豬原代子宮內膜細胞,用于豬FAM213B基因啟動子活性檢測。參照筆者所在課題組前期研究獲得的豬FAM213B基因mRNA全序列(GenBank登錄號:KX444503)以及5¢調控區序列(GenBank登錄號:100134955),通過PCR擴增豬FAM213B基因較長啟動子序列,并進行測序鑒定;在此基礎上,PCR擴增帶有I和I限制性酶切位點的FAM213B基因啟動子7個5'端缺失片段,并通過雙熒光素酶報告基因載體系統構建豬FAM213B基因啟動子7個不同的5'端缺失載體。將7個載體經無內毒素處理后與pRL-TK質粒用陽離子脂質體法一起轉染豬子宮內膜細胞,用雙熒光素酶報告基因系統進行Luciferase活性檢測,比較各啟動子片段轉錄活性。生物信息學分析FAM213B基因啟動子潛在轉錄因子結合位點,通過ChIP試驗驗證FAM213B基因啟動子與潛在轉錄因子NFκB的相互作用。構建NFκB1和RelA的超表達載體,化學合成NFκB1和RelA的干擾siRNA片段,分別轉染豬子宮內膜細胞,通過雙熒光素酶報告基因系統進行Luciferase活性檢測和熒光定量PCR分別檢測超表達和干擾表達NFκB1和RelA對豬FAM213B基因啟動子活性和mRNA表達影響。PCR和測序獲得豬FAM213B基因啟動子長度為 2 261 bp(-2178/+83)。生物信息學預測結果表明豬FAM213B基因啟動子區存在潛在的CREB、CCAAT增強子結合蛋白、E-box因子的結合位點,炎性因子NFκB潛在結合位點分別位于-1143/-1132和-664/-655區間。啟動子報告基因活性檢測結果表明:重組載體P2(-1352/+30)熒光活性最高,極顯著高于P1(-1 760/+30)(<0.01),在-1 760/-1 352區域存在負調控元件;而P2顯著高于P3(-919/+30)(<0.05),表明在-1 352/- 919區域存在正調控元件;P3(-919/+30)活性極顯著高于P4(-604/+80)(<0.01),表明在-919/-604區域存在正調控元件;P4、P5、P6和P7活性差異不顯著,-1352/-919區域為核心啟動子區,-1352/-604對于維持該啟動子較高轉錄活性起著重要的作用。ChIP結果表明啟動子區-1143/-1132存在NFκB1結合位點,-664/-655存在RelA結合位點。超表達載體pcDNA3.1-NFκB1與P2(-1352/+30)啟動子片段重組載體共轉染豬子宮內膜細胞后,P2啟動子活性極顯著高于對照組(<0.01),pcDNA3.1-NFκB1載體單獨轉染豬子宮內膜細胞后FAM213B基因mRNA表達量顯著高于對照組(<0.05);超表達載體pcDNA3.1-RelA與P3(-919/+30)啟動子片段重組體共轉染豬子宮內膜細胞,P3啟動子活性極顯著低于對照組(<0.05),pcDNA3.1-RelA載體單獨轉染豬子宮內膜細胞后,FAM213B基因的mRNA表達量顯著低于對照組。轉染NFκB1和RelA的siRNA片段干擾片段,FAM213B基因啟動子活性和mRNA表達量則表現與超表達相反的結果。獲得了豬FAM213B基因啟動子核心啟動子序列為-1352/-919區域,NFκB是FAM213B基因啟動子的轉錄因子,NFκB成員NFκB1和RelA在豬子宮內膜細胞中對FAM213B基因的表達起調控作用。
豬;FAM213B基因;啟動子;NFκB;子宮內膜細胞
0 引言
【研究意義】FAM213B (family with sequence similarity 213, member B,又稱為前列腺酰胺合成酶 (prostamide F synthas,PGFS),屬于硫氧還蛋白超家族(the thioredoxin-like superfamily)成員[1],能夠催化前列腺素PG生成過程中間產物PGH2向花生四烯酸酯或者前列腺素E2(prostaglandin E2,PGE2)的轉變;FAM213B也能夠直接催化PGH2生成PGF2a[2],因此FAM213B具有雙重的催化作用。PGF2α是一種溶解黃體因子[3],而PGE2則能夠抑制黃體溶解[4-5],PGE2/PGF2α須受到嚴格控制,恰當的比例維持著母豬的發情周期和妊娠[6-7]。FAM213B基因表達調控必須受到較精確的調控,才能發揮其生理功能。轉錄水平是基因表達調控的重要方式,啟動子決定了基因表達的時空特異性以及表達量的高低。因此,對豬FAM213B基因啟動子進行轉錄活性研究,并確定其特異轉錄因子,對于揭示其調控PG合成以及在母豬妊娠、發情等繁殖活動的生理功能具有重要的意義。【前人研究進展】哺乳動物前列腺素PG的合成離不開前列腺酰胺合成酶PGFS。PGFS有三種同工酶,PGFS I、PGFS II屬于醛酮還原酶(aldo-keto reductase,AKR)超家族,FAM213B則屬于硫氧還蛋白樣超家族(Thioredoxin-like,Trx-like superfamily)成員[1]。作為一種氧化還原酶,FAM213B在NADPH作為質子供體情況下,能直接將PGH2作為底物一步合成PGF2α,并且FAM213B合成PGF2α效果優于其他PGFS酶,這種現象較早在小鼠和豬大腦及脊髓中發現,并推測在中樞神經系統起著重要的作用[8]。在PG生成過程中,PGH2、PGE2與PGF2a均是重要的中間產物。在FAM213B的作用下,前列腺素H2(prostaglandin H2,PGH2)可以生成PGE2,也可以由PGH2直接生成PGF2a[2]。雖然PGH2生成PGE2也受到了其他相關酶類催化,如PTGES[9]、PTGS2[10-11]等,但是FAM213B的調控作用研究并不多見。PG成員眾多,不同的成員具有不同的生物學功能,在動物繁殖過程中起主要調節作用是PGE2和PGF2α[6]。令人感興趣的現象是PGE2和PGF2α具有相反的生理功能,如PGF2α是一種溶解黃體因子[3],而PGE2則能夠抑制黃體溶解[4-5]。所以,為了避免PGF2α在妊娠建立時對卵巢黃體的溶黃作用,子宮PGF2α的分泌由內分泌轉為外分泌,即由分泌至子宮靜脈改為直接分泌至子宮腔中[12]。此外,孕體和子宮內膜在附植前能合成大量的PGE2,早期妊娠中子宮分泌的PGE2多于PGF2α[13]。由于PGF2α由PGE2轉化而來,在母豬妊娠階段,具有黃體保護作用的PGE2和溶黃作用的PGF2α維持適當的對妊娠的建立和維持具有重要的作用[14],如較高比例的PGE2:PGF2α有利于母豬妊娠的建立和維持、保持高產仔數等[15]。可以看出,在母豬妊階段,PGE2、PGF2α的生成量、生成位置受到了嚴格調控。那么,作為催化PGE2生成PGF2α的酶,以及作為催化PGH2直接生成PGF2α的酶,FAM213B的催化作用在這個過程中起著非常重要的作用,FAM213B也可能受到嚴謹控制進而控制PGE2/PGF2α的比例,但是目前關于豬FAM213B相關研究還較鮮見。【本研究切入點】可以看出,由于PGE2/PGF2α的比例、生成部位在母豬妊娠階段均會發生變化,那么是不是FAM213B的時空表達也與此一致。鑒于此,對豬FAM213B基因啟動子進行轉錄活性和結合轉錄因子的研究,有望揭示FAM213B基因的表達規律,也為深入揭示PG生成的復雜的催化機制提供依據。前期課題組通過高通量測序技術對長大二元雜交母豬和二花臉豬懷孕12 d的子宮內膜轉錄組進行分析比較,發現FAM213B基因在兩者子宮內膜存在表達差異[16],可能是母豬產仔數相關候選基因。并且前期已經通過RACE技術獲得豬FAM213B基因mRNA和啟動子序列[17],因此在此基礎上將開展本研究工作。【擬解決的關鍵問題】分析豬FAM213B基因啟動子在豬子宮內膜中的轉錄活性及其核心轉錄區,并確定其特異的結合轉錄因子及結合位點。
1 材料與方法
試驗工作于2013年6月至2015年6月在廣東省農業動物基因組學與分子育種重點實驗室完成。
1.1 材料
用于提取DNA的耳組織以及轉染用豬子宮內膜細胞,來源于長大雜交母豬(LL),樣品采自廣東陽江某豬場。用于進行ChIP的子宮內膜細胞來源于懷孕12d 母豬子宮內膜。
大腸桿菌DH5α感受態細胞和pMD -20T Vector(含T4 DNA連接酶)購自TaKaRa公司,pGL-3 Basic Vector、pRL-TK Vector以及限制性內切酶購自Promega公司。DL2000分子量標準、DNA凝膠回收試劑盒、DNA聚合酶、dNTPs等購自廣東東盛生物技術公司。無內毒素質粒小提試劑盒購自OMEGA公司。
1.2 方法
1.2.1 豬子宮內膜細胞的培養 采集卵泡期子宮,低溫狀態下迅速帶回實驗室。剪取子宮內膜上皮組織于含有雙抗的PBS中,漂洗數次。用眼科剪將子宮內膜上皮組織剪成1 mm3大小,加入2倍體積的0.1%膠原酶I,37℃水浴搖床消化,每隔半小時混搖一次。2.5 h后加入等體積的的終止液(含10% FBS的DMEM/F12)。把消化液和終止液的混合液用150 μm(100目)細胞篩過濾,吸取濾液至離心管中,500 r/min離心5 min,然后再經過1 000 r/min離心5 min和PBS重懸,計數沉淀細胞,以2×105個細胞/mL接種于細胞培養瓶中,于37℃、5% CO2培養箱中靜置培養。
在接種后24 h左右原代細胞貼壁,經過3—5 d達到90%融合。此時,吸出培養液,用PBS漂洗2次后,加入0.25%胰蛋白酶消化3—5 min。待大部分細胞變圓時,加入等體積終止液,輕輕吹打數次。將細胞懸液轉移至離心管中,1 000 r/min離心5 min后棄上清,再加入5 mL PBS重懸細胞,1 000 r/min離心5 min后棄上清,接種于新的培養瓶繼續培養,備用。
1.2.2 豬FAM213B基因啟動子5¢缺失片段報告基因重組載體的構建與雙熒光素酶活性檢測 基因組DNA提取采用常規的酚-氯仿抽提法。參照本課題組獲得的豬FAM213B基因mRNA全序列(GenBank登錄號:KX444503)以及5¢調控區序列(GenBank登錄號:100134955),首先設計引物(表1引物:5′-FAM231B),引物由廣州英駿公司合成,下同。擴增獲得豬FAM213B基因啟動子區2 261 bp(-2178/+83),將此構建至T載體,測序后,命名為T-FAM213B-P。設計7對引物(P1- P7),以T-FAM213B-P質粒為模板,用于擴增豬FAM213B基因不同的啟動子片段,見表1。反應程序為:98℃預變性1 min;98℃變性30 s,57—62℃退火30 s,72℃延伸0.5—2.5 min(根據PCR產物的長度進行調整,1 kb·min-1),循環數為33;72℃后延伸10 min。
將上述PCR擴增獲得DNA片段用DNA凝膠回收試劑盒進行回收純化后,用I和I進行雙酶切,同時對pGL-Basic載體進行酶切,酶切體系為:10×Buffer 10 μL,PCR產物或者載體50 μL,I和I各5 μL,ddH2O 30 μL,37℃反應3 h。然后將雙酶切后的DNA片段和pGL-Basic載體分別回收純化后,各DNA片段分別與pGL-Basic載體進行連接,連接反應體系成分為:1 μL Ligation Buffer,2 μL pGL3- basic 載體雙酶切產物,6.8 μL各DNA片段,0.2 μL T4 DNA 連接酶,22℃保持4 h。將連接產物轉化大腸桿菌DH5α,涂布氨芐青霉素瓊脂平板,37℃過夜培養,挑取單克隆進行測序,陽性質粒依次命名為P1、P2、P3、P4、P5、P6和P7。用OMEGA無內毒素試劑盒提取構建好的各個載體,與pRL-TK質粒用陽離子脂質體法轉染細胞,48 h后,用雙熒光素酶報告基因系統進行Luciferase活性檢測,比較各啟動子片段轉錄活性。
反應體系為:10 μL SYBR /RoX qPCR Master Mix(2 x),上下游引物各0.6 μL(10 μmol·L-1),cDNA模板1 μL,補充滅菌雙蒸水7.8—20 μL。
1.2.3 CHIP試驗證實豬FAM213B基因啟動子與轉錄因子NFκB相互作用 通過在線軟件(MatIspector (Search for IF binding siets:http://www. genomatix.de/;http://www.cbrc.jp/research/db/TFSEARCH. html)對豬FAM213B基因啟動子進行生物信息學分析,發現啟動子區域存在2個潛在的核轉錄因子NFκB(nuclear transcription factor κB, NFκB)結合位點。在此基礎上,通過ChIP試驗驗證FAM213B基因啟動子與轉錄因子NFκB的相互作用,試驗過程按染色質免疫共沉淀試劑盒(EZ-CHIP,MILLIPORE)說明書操作,用于擴增兩個結合位點的引物見表1:CHIP-NFκB1和CHIP-RelA引物。
1.2.4 轉錄因子NFκB對豬FAM213B基因啟動子的調控作用 根據NCBI公布的NFκB1(p50,前體為p105,Gene ID: 751869)和RelA(p65,Gene ID: 100135665)mRNA序列設計引物擴增帶酶切位點的CDS片段,構建超表達載體,引物序列見表1:pcDNA-NFκB1和pcDNA-RelA。以子宮內膜組織mRNA為模板擴增NFκB1和RelA的CDS序列,經測序鑒定后連接至真核表達載體pcDNA3.1/mcy-His(-)B中,得到的載體分別命名為O-P-NFκB1和O-P-RelA。
根據GenBank上豬NFκB1(NM_001048232.1)和RelA(NM_001114281.1)基因已知序列,按siRNA序列設計原則,結合Ambion公司提供的網上在線設計工具進行設計,設計NFκB1和RelA的siRNA引物。將siRNA序列進行BLAST比對,以確定和其它基因沒有同源性,由廣州銳博公司合成,引物序列見表1:siRNA-N1、siRNA-N2、siRNA-N3和siRNA-R1、siRNA-R2、siRNA-R3。干擾片段的轉染按Invitrogen公司的Lipofectamine? LTX and PLUS? Reagents試劑盒說明書進行操作,轉染50 nmoL的siRNA片段。將siRNA轉染豬子宮內膜細胞后48 h,PBS漂洗1次,抽提總RNA后進行qRT-PCR檢測NFκB1和RelA的表達量(引物:q-NFκB1、q-RelA),驗證siRNA的干擾效果,同時用qRT-PCR(SYBR Green Realtime PCR Mix)檢測siRNA干擾兩個轉錄因子后FAM213B基因表達情況(q-FAM213B)。本試驗用于驗證、NFκB表達量的熒光定量PCR的引物以及內參基因的引物見表1,所用模板是長大二元雜母豬子宮內膜組織的cDNA。反應體系為:10 μL SYBR /RoX qPCR Master Mix(2 x),上下游引物各0.6 μL(10 μmol·L-1),cDNA模板1 μL,補充滅菌雙蒸水7.8 μL至20 μL。反應的條件為:預變性:94℃,5 min;變性:94℃,30 s,退火:60℃,30 s,延伸:72℃,30 s,循環數為40個;后延伸:72℃,40 s。在PCR反應的過程中,設置獲得熔解曲線的程序。樣品設置相同的閾值線,用CFX Manager軟件輸出擴增的Ct值,在Excel表格中,采用2-ΔΔCt法分析組織相對表達量,選擇GADPH基因作為內標基因進行均一化處理,以長大二元雜母豬中作為參照因子分析超表達或干擾NFκB核轉錄因子后FAM213B基因的相對表達量,并且進行-test檢驗分析各組間是否存在顯著差異。

表1 豬FAM213B基因啟動子5¢缺失片段、ChIP、NFκB1和RelA超表達與干擾表達以及mRNA定量分析引物信息
下劃線表示保護堿基,斜體表示限制性酶切位點,上游酶切位點I:,下游酶切位點I:;上游酶切位點I:下游酶切位點I:
Italic type: protective bases; Underline type:I (),I ()I()I ()
1.2.5 生物信息學常用網站 基因序列查詢:GenBank:http://www.ncbi.nlm.nih.gov;Ensembl:http://asia.ensembl.org/index.html;轉錄因子結合位點分析:MatInspector (http://www.genomatix.de/);PCR引物設計的軟件:primer5.0;核酸序列比對、拼接的軟件:DNASTAR、Vector NTI.10。
2 結果
2.1 豬FAM213B基因啟動子5'缺失片段報告基因重組載體的構建
將豬啟動子區序列通過在線生物學軟件進行分析,預測啟動子區潛在的順式作用元件和結合反式作用因子,發現FAM213B基因啟動子區存在潛在的轉錄因子結合位點(圖1-A),如cAMP應答元件結合蛋白(cAMP-response element binding protein, CREB)、CCAAT增強子結合蛋白(CCAAT/ enhancer binding protein, C/EBP)、E-box結合因子(E- box binding factors)、OCT-1(Octamer transcription factor-1)等因子的潛在結合位點。核因子κB (nuclear factor κB,NFκB)結合位點分別位于-1143/-1132和-664/-655區間,具體見圖1-B。根據在線預測結果,擴增啟動子7個5'端缺失片段(大小見表1,P1-P7引物擴增片段大小),并構建報告基因重組載體,擴增結果和重組載體的酶切鑒定結果見圖1-C、D。
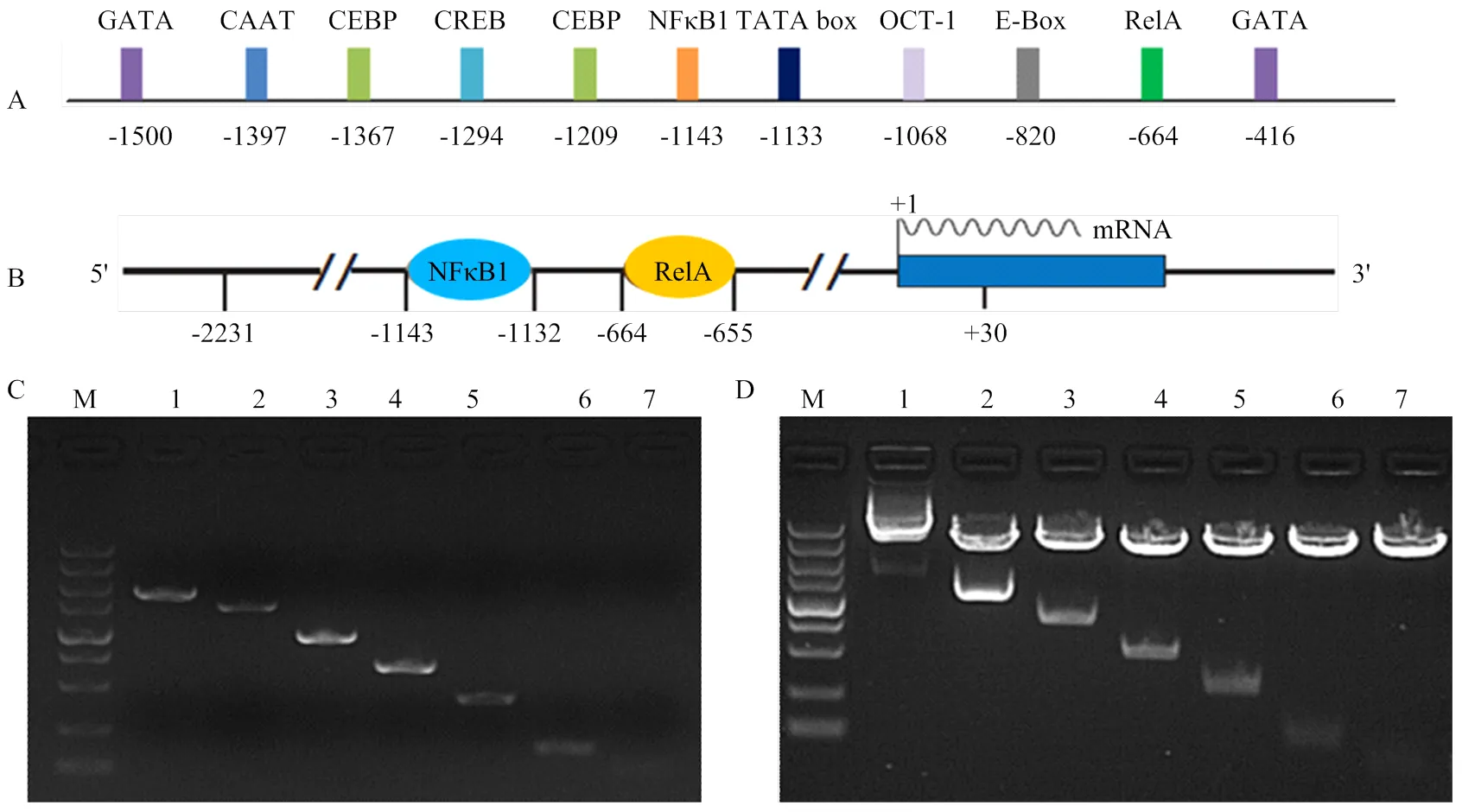
M:DNA分子量標準(DL5 000 Marker),從上到下依次為:5 000、3 000、2 000、1 500、1 000、750、500、250和100 bp. A:豬FAM213B 基因啟動子區重要順式作用元件及結合因子預測結果;B:豬FAM213B 基因啟動子區NFκB1和RelA結合預測結果;C:豬FAM213B基因啟動子各缺失片段擴增結果(1-7);D:豬FAM213B基因啟動子各缺失片段重組載體雙酶切鑒定結果(1-7)
2.2 豬FAM213B基因5'缺失片段轉錄活性分析
培養豬子宮內膜細胞,采用瞬時轉染方法,將豬FAM213B基因啟動子各缺失片重組載體分別轉染細胞,同時共轉染內參pGL-TK質粒,啟動子報告基因活性檢測結果見圖2。結果表明:重組載體P2(-1352/+30)熒光活性最高,而且極顯著高于P1(-1760/+30),推測在-1760/-1352區域存在負調控元件;而P2顯著高于P3(-919/+30),推測在-1352/- 919區域存在正調控元件;P3(-919/+30)活性極顯著高于P4(-604/ +80),推測在-919/-604區域存在正調控元件。P4、P5、P6和P7活性差異不顯著,綜合分析,-1350/-604對于維持該啟動子較高轉錄活性起著重要的作用。
2.3 豬FAM213B基因啟動子結合核轉錄因子NFκB的鑒定
生物信息學預測轉錄因子結合位點,發現在FAM213B基因啟動子上存在2個潛在的NFκB結合位點,分別是-1143處的NFκB1因子結合位點以及-664處的RelA結合位點(圖1-A)。
采用NFκB1和RelA的特異性抗體,通過免疫共沉淀的方式把懷孕12 d的母豬子宮內膜NFκB-DNA復合體沉淀下來,從而特異性地富集結合NFκB1和RelA因子的DNA片段。同時在潛在2個NFκB結合位點附近設計引物,以富集的DNA為模板進行擴增,其結果見圖3。可以看到,富集NFκB1-DNA和RelA- DNA的片段分別被引物ChIP-NFκB1和ChIP-RelA擴增到了預期的DNA片段(120 bp和102 bp,圖3中NFκB1和RelA5泳道);用IgG特異性抗體對DNA進行富集,然后用ChIP-NFκB1和ChIP-RelA引物擴增進行擴增,并沒有獲得DNA片段(圖3中2個IgG泳道);擴增經RNA聚合酶II特異性抗體富集DNA,則獲得了預期大小的DNA片段(圖3中2個RNA-polymerase II泳道);同時用ChIP-NFκB1和ChIP-RelA擴增沒有經過富集的DNA,也擴增到了預期大小DNA片段(圖3中2個Input泳道)。該結果表明NFκB1和RelA可通過相應的DNA順式作用元件與豬FAM213B基因啟動子區結合,結合位置分別位于:-1143和-664附近。
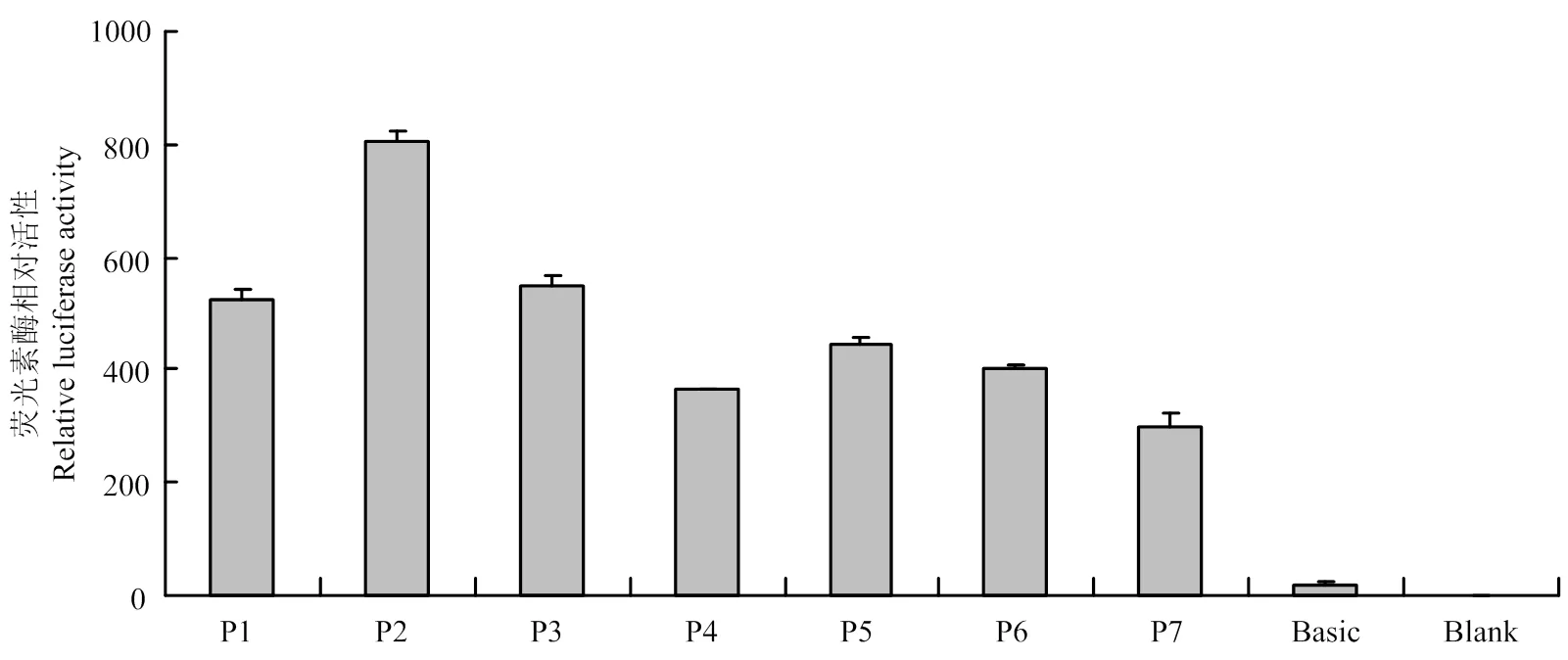
圖2 豬FAM213B基因不同啟動子片段在豬子宮內膜細胞轉錄活性
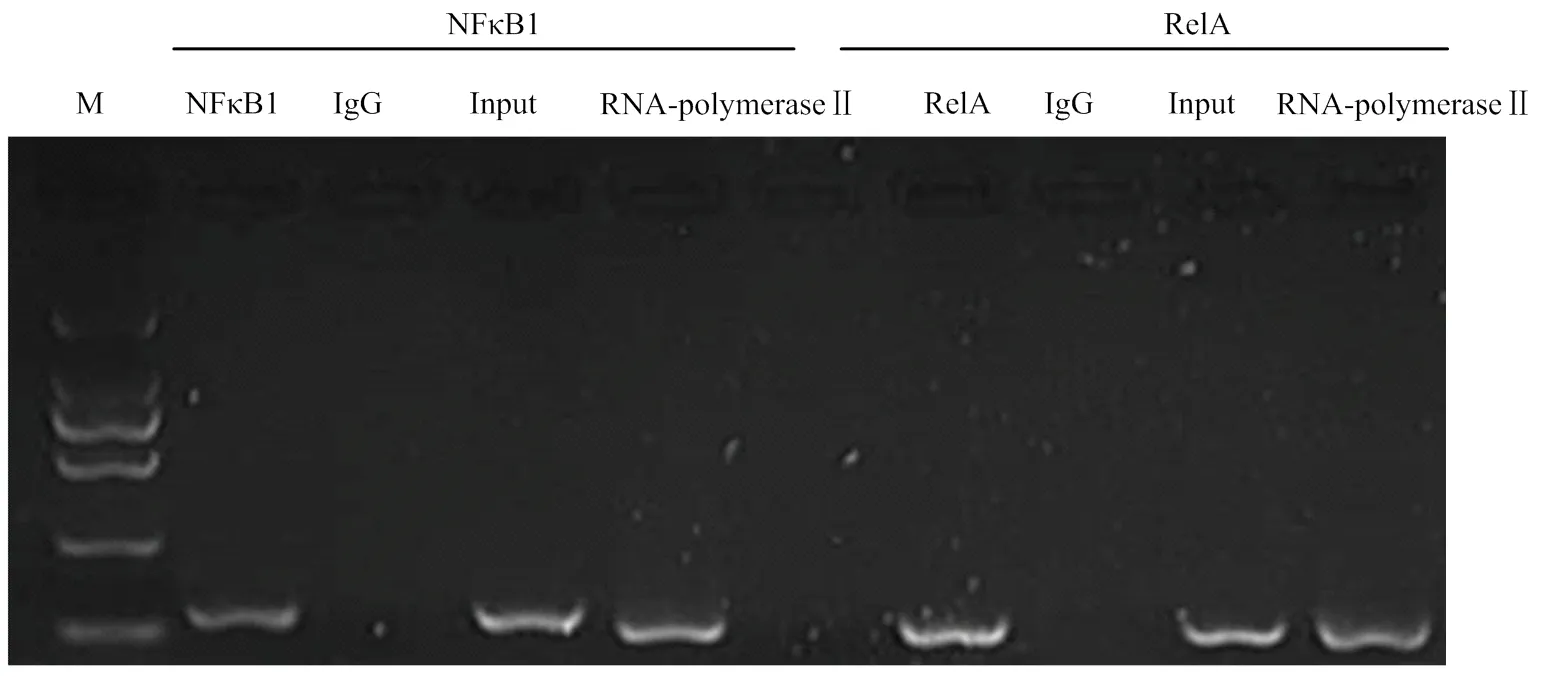
M: DL2000,從上到下為:2000,1000,750,500,250,100 bp;IgG: 陰性對照;Input和RNA-polymerase II:陽性對照
2.4 NFκB對豬FAM213B基因表達的調控作用
2.4.1 超表達NFκB對豬FAM213B基因表達影響 采用共轉染的方式,將NFκB1超表達載體pcDNA3.1- NFκB1與P2(-1352/+30)啟動子片段重組體共轉染豬子宮內膜細胞,以檢測NFκB1對FAM213B基因啟動子活性的影響,同時將pcDNA3.1-NFκB1單獨轉染豬子宮內膜細胞,轉染48 h后加入Trizol裂解細胞用于RNA提取,反轉錄成cDNA后采用實時熒光定量PCR檢測FAM213B基因的表達量。結果表明:共轉染pcDNA3.1-NFκB1的啟動子活性極顯著高于對照組(<0.01),結果如圖4-A所示,表明NFκB1可通過結合FAM213B基因啟動子的相應位點,顯著提高熒光素酶報告基因的活性。而且,轉染pcDNA3.1-NFκB1載體后(濃度為100、200 ng),FAM213B基因mRNA表達量顯著高于對照組(<0.05,圖4-B)。
同樣,將pcDNA3.1-RelA與P3(-919/+30)啟動子片段重組體共轉染豬子宮內膜細胞的活性檢測結果見圖4-C:共轉染pcDNA3.1-RelA的啟動子活性極顯著低于對照組(<0.01),表明RelA可通過結合FAM213B基因啟動子的NFκB相應位點,抑制其表達,從而顯著降低熒光素酶報告基因的活性(圖4-C)。單獨將pcDNA3.1-RelA載體轉染豬子宮內膜細胞后,FAM213基因mRNA表達水平如圖4-D所示,當pcDNA3.1-RelA濃度為100和200 ng時,FAM213B基因的mRNA表達量顯著低于對照組(<0.05),表明FAM213B基因的mRNA水平在RelA的作用下顯著性降低。
2.4.2 干擾NFκB對豬FAM213B基因mRNA表達影響 采用siRNAs干擾子宮內膜細胞內源性的NFκB1和RelA,檢測兩者對啟動子及表達的影響。各設計3條干擾NFκB1(表1:siRNA-N1,siRNA-N2和siRNA-N3)和RelA(表1:siRNA-R1,siRNA-R2和siRNA-R3)的siRNAs,轉染濃度為50 nmol siRNA,利用qRT-PCR檢測干擾NFκB1和RelA的效率發現,轉染后的siRNA-N1相比于對照組在轉錄水平上顯著降低內源性NFκB1的表達量;轉染siRNA-R2相比于對照組在轉錄水平上顯著降低內源性RelA的表達量(結果略)。siRNA-N1和siRNA-R2均能很好地干擾子宮內膜細胞內源性NFκB1和RelA的表達,可用于后續的干擾試驗。
對子宮內膜細胞轉染siRNA-N1和P2質粒,檢測NFκB1被干擾后豬FAM213B基因啟動子(P2,-1143/-1132)活性的變化;轉染siRNA-R1和P3,檢測RelA被干擾后豬FAM213B基因啟動子(P3,-664/-655)活性的變化。結果見圖5-A:干擾NFκB1后,啟動子活性顯著低于對照組(<0.05),表明干擾NFκB1后,FAM213B基因啟動子P2顯著降低熒光素酶報告基因活性;干擾RelA后,則啟動子P3活性顯著高于對照組(<0.05),表明干擾RelA后,FAM213B基因啟動子P3可顯著提高熒光素酶報告基因活性。因此,NFκB1對FAM213B基因啟動子轉錄活性具有正調控作用,RelA則具有負調控作用。
將siRNA-N1和siRNA-R2分別轉染豬子宮內膜細胞后,熒光定量PCR檢測豬FAM213B基因的表達量,結果見圖5-B:干擾NFκB1后,FAM213B基因的mRNA表達量顯著低于對照組(<0.05),而干擾RelA后,FAM213B基因的mRNA表達量顯著高于對照組(<0.05),因此,進一步驗證NFκB1可促進FAM213B基因的轉錄,RelA可抑制FAM213B基因的轉錄。
3 討論
PGE2/PGF2α的比例對于母豬的發情周期、妊娠建立和維持具有重要的作用[6-7],而FAM213B基因與PGE2/PGF2α的比例、生成有關,進而可能影響母豬的妊娠、胚胎發育等繁殖活動,因此揭示FAM213B基因表達規律對于深入闡釋影響母豬繁殖性能分子機制具有積極的意義。本研究在前期獲得FAM213B基因完整mRNA序列基礎上,獲得2 261 bp的啟動子片段,初步檢測其具有轉錄活性[18],而且預測獲得啟動子上具有潛在的典型轉錄因子結合位點。進而克隆其不同長度的啟動子片段,并分析不同的片段轉錄活性,確定轉錄起始位點上游的-1352/-604區域對于維持FAM213B基因較高的啟動子活性具有重要作用。在這個區域包括了預測的NFκB1和RelA因子的結合位點,分別是-1143和-664位點。P2啟動子(-1352/+30)活性最高,而且顯著高于P3(-919/+30),即在缺少了-1352/-919區域后,轉錄活性下降(圖2),表明-1352/-919含有正向調控元件。通過ChIP已經證實NFκB1能夠結合到啟動子上相應的位置(圖3),而且超表達NFκB1后,啟動子P2活性、FAM213B的mRNA表達均表現增加(圖4-A和B),干擾后兩者均表現下降趨勢,這充分說明了NFκB1與啟動子上的順式作用元件結合,起到了正向調控的作用。同理,P3啟動子活性(-9191/+30)顯著高于P4(-604/+30)(圖2),表明缺少了-919/-604區域后啟動子活性也表現下降,這個區域同樣含有正向調控元件。RelA也能夠結合該區域預測的位點(圖3),但是超表達與干擾RelA后,則呈現與NFκB1相反的結果(圖4-C和D),這樣看似與-919/-604區域存在正向調控元件相矛盾。但是,可以看出,表現最高轉錄活性的P2同時包含了-1352/-919和-919/-604兩個區域,因此可以推測,在豬子宮內膜細胞中,NFκB1與RelA可能并非同時發揮作用,或者NFκB1對啟動子的正向調控作用削弱了RelA的負向調控作用。本課題組研究人員發現在豬的顆粒細胞中,NFκB1 (p50)的過表達能夠促進miR-34c(其靶基因是叉頭框因子FoxO3a)的轉錄活性及表達水平,而RelA(P65)的過表達則抑制miR-34c的轉錄活性及表達水平[19],表明NFκB1在豬顆粒細胞中對miR-34c啟動子起正向調控作用,而RelA則具有負向調控作用。雖然針對不同的基因啟動子,但是NFκB1和RelA表現了一致的調控作用。
NFκB1與RelA均屬于NFκB家族,該家族包括:p50(NFκB1)、p52(NFκB2)、p65 (RelA, NFκB3)、Rel (cRel)和RelB[20]。參與免疫反應的早期和炎癥反應各階段的許多分子都受NF-κB的調控,因此NF-κB又被稱為炎性因子。其實,NFκB也是一種可被誘導表達的轉錄因子,可以調節多種與細胞存活與增殖、細胞生長與分化、炎癥等相關基因的表達[17, 21]。NFκB一般結合在基因特異的位點(κB位點,5′-GGGRNNYYCC-3′;R,嘌呤;Y,嘧啶;N,任意堿基),并增強基因的表達[22]。有研究表明,在人子宮分泌期NFκB1和RelA表達量上升[23],在胚胎植入窗口期RelA表達量也很高[24]。豬的胚胎附植類似于一種炎性反應,并且被依賴于NFκB調節的一些基因的調控;在發情周期、懷孕母豬子宮內膜中,發現NFκB被激活,進而進一步調控母豬繁殖相關基因的表達[25];有文獻報道,在母豬胚胎植入前NFκB就開始被激活[26]。在豬的子宮內膜中,一些與炎性相關基因白細胞介素-6和白細胞抑制因子等也受到了NFκB的調控[27]。雖然有研究表明,NFκB經常以NFκB1/RelA(p50/p65)二聚體形式激活基因的轉錄[22],但是其他形式二聚體也發揮著相應的作用。在豬卵巢顆粒細胞中,NFκB1二聚體促進了PGF2α的升高,但不影響PGE2;但是RelA二聚體則能夠增強PGE2和PGF2α兩者的釋放[28];在豬顆粒細胞中,NFκB能夠調控顆粒細胞的增殖,凋亡以及雌激素、孕酮等激素的分泌過程[28]。在人子宮內膜基質細胞和羊膜間充質中,NFκB能夠促進PGF2α的生成[29],相反,在大鼠黃體細胞中,NFκB能夠下調孕激素(P4)的分解[30]。可以看出,NFκB家族成員關乎著PGE2和PGF2α兩者的生成,NFκB調控FAM213B基因可能是其中的一種方式或者機制。實際上,PGE2/PGF2α的比例還受到其他一些酶的調控,受到嚴格控制,如豬羰基還原酶1(CBR1)作為催化PGE2向/PGF2α轉化的限速酶可以影響兩者的比例[31]。因此,在豬子宮內膜中PGE2/PGF2α的精細比例受到多個基因或者酶的控制。而FAM213B基因作為其中的一種限速酶,可能是受到NFκB調控作用進而調節PGE2/PGF2α比例,但是仍需要進一步驗證。
4 結論
成功克隆了豬FAM213B基因的啟動子片段,并構建5'缺失片段的熒光素酶報告基因重組載體,確定-1352/-919區域為核心啟動子區;在-1143/-1132和-664/-655分別存在NFκB1和RelA結合位點,而且NFκB1和RelA分別對FAM213B基因啟動子活性和mRNA的表達起調控作用。
[1] SUZUKI-YAMAMOTO T, TOIDA K, SUGIMOTO YISHIMURA K. Colocalization of prostaglandin F(2alpha) receptor FP and prostaglandin F synthase-I in the spinal cord., 2009, 50(10): 1996-2003.
[2] KOMOTO J, YAMADA T, WATANABE K, WOODWARD D FTAKUSAGAWA F. Prostaglandin F2alpha formation from prostaglandin H2 by prostaglandin F synthase (PGFS): crystal structure of PGFS containing bimatoprost., 2006, 45(7): 1987-1996.
[3] CHRISTENSON L K, FARLEY D B, ANDERSON L HFORD S P. Luteal maintenance during early pregnancy in the pig: role for prostaglandin E2., 1994, 47(1): 61-75.
[4] ZIECIK A J. Old, new and the newest concepts of inhibition of luteolysis during early pregnancy in pig., 2002, 23(1/2): 265-275.
[5] GADSBY J E, LOVDAL J A, BRITT J HFITZ T A. Prostaglandin F2 alpha receptor concentrations in corpora lutea of cycling, pregnant, and pseudopregnant pigs., 1993, 49(3): 604-608.
[6] WACLAWIK AZIECIK A J. Differential expression of prostaglandin (PG) synthesis enzymes in conceptus during peri-implantation period and endometrial expression of carbonyl reductase/PG 9-ketoreductase in the pig.ogy 2007, 194(3): 499-510.
[7] WEEMS C W, WEEMS Y SRANDEL R D. Prostaglandins and reproduction in female farm animals., 2006, 171(2): 206-228.
[8] MORIUCHI H, KODA N, OKUDA-ASHITAKA E, DAIYASU H, OGASAWARA K, TOH H, ITO S, WOODWARD D FWATANABE K. Molecular characterization of a novel type of prostamide/ prostaglandin F synthase, belonging to the thioredoxin- like superfamily., 2008, 283(2): 792-801.
[9] WACLAWIK A, RIVERO-MULLER A, BLITEK A, KACZMAREK M M, BROKKEN L J, WATANABE K, RAHMAN N AZIECIK A J. Molecular cloning and spatiotemporal expression of prostaglandin F synthase and microsomal prostaglandin E synthase-1 in porcine endometrium., 2006, 147(1): 210-221.
[10] UENISHI H, EGUCHI T, SUZUKI K, SAWAZAKI T, TOKI D, SHINKAI H, OKUMURA N, HAMASIMA NAWATA T. PEDE (Pig EST Data Explorer): construction of a database for ESTs derived from porcine full-length cDNA libraries., 2004, 32(Database issue): D484-488.
[11] TANIKAWA N, OHMIYA Y, OHKUBO H, HASHIMOTO K, KANGAWA K, KOJIMA M, ITO SWATANABE K. Identification and characterization of a novel type of membrane-associated prostaglandin E synthase., 2002, 291(4): 884-889.
[12] BAZER F WTHATCHER W W. Theory of maternal recognition of pregnancy in swine based on estrogen controlled endocrine versus exocrine secretion of prostaglandin F2alpha by the uterine endometrium., 1977, 14(2): 397-400.
[13] FRANCZAK A, KUROWICKA B, OPONOWICZ A, PETROFF B KKOTWICA G. The effect of progesterone on oxytocin-stimulated intracellular mobilization of Ca2+and prostaglandin E2 and F2alpha secretion from porcine myometrial cells., 2006, 81(1-2): 37-44.
[14] DAVIS D LBLAIR R M. Studies of uterine secretions and products of primary cultures of endometrial cells in pigs., 1993, 48: 143-155.
[15] BAZER F W, THATCHER W W, MATINAT-BOTTE F, TERQUI M, LACROIX M C, BERNARD S, REVAULT MDUBOIS D H. Composition of uterine flushings from Large White and prolific Chinese Meishan gilts., 1991, 3(1): 51-60.
[16] 王首奇. 母豬懷孕11-12天子宮內膜差異表達基因的篩選與分析[D]. 廣州:華南農業大學, 2011.
Wang S Q. Screening and analysis of differential gene expression in endometrum on pregnant days 11-12[D]. Guangzhou: South China Agricurial University, 2011. (in Chinese)
[17] SETHI G, SUNG BAGGARWAL B B. Nuclear factor-kappaB activation: from bench to bedside., 2008, 233(1): 21-31.
[18] 張愛玲,孫顯月,盧孝璋,李加琪,張豪. 豬FAM213B基因mRNA和啟動子的克隆及序列分析.華南農業大學學報, 2017, 38(3): 1-8.
ZHANG A L, SUN X Y, LU X Z, LI JQ, ZHANG H. Cloning and sequence analysis of mRNA and promoer of pig FAM213B gene., 2017, 38(3): 1-8. (in Chinese)
[19] XU Y, ZHANG A L, XIAO G, ZHANG Z, CHEN Z M, ZHANG H, LI J Q. p53 and NFκB regulate microRNA-34c expression in porcine ovarian granulosa cells., 2015, 15(8): 1816-1824.
[20] LINDSTROM T MBENNETT P R. The role of nuclear factor kappa B in human labour., 2005, 130(5): 569-581.
[21] SHISHODIA SAGGARWAL B B. Nuclear factor-kappaB activation: a question of life or death., 2002, 35(1): 28-40.
[22] INOUE J, GOHDA J, AKIYAMA TSEMBA K. NF-kappaB activation in development and progression of cancer., 2007, 98(3): 268-274.
[23] LAIRD S M, TUCKERMAN E M, CORK B ALI T C. Expression of nuclear factor kappa B in human endometrium; role in the control of interleukin 6 and leukaemia inhibitory factor production., 2000, 6(1): 34-40.
[24] KING A E, COLLINS F, KLONISCH T, SALLENAVE J M, CRITCHLEY H OSAUNDERS P T. An additive interaction between the NFkappaB and estrogen receptor signalling pathways in human endometrial epithelial cells., 2010, 25(2): 510-518.
[25] ROSS J W, ASHWORTH M D, MATHEW D, REAGAN P, RITCHEY J W, HAYASHI K, SPENCER T E, LUCY MGEISERT R D. Activation of the transcription factor, nuclear factor kappa-B, during the estrous cycle and early pregnancy in the pig., 2010, 8: 39.
[26] MATHEW D J, SELLNER E M, GREEN J C, OKAMURA C S, ANDERSON L L, LUCY M CGEISERT R D. Uterine progesterone receptor expression, conceptus development, and ovarian function in pigs treated with RU 486 during early pregnancy., 2011, 84(1): 130-139.
[27] GEISERT R DYELICH J V. Regulation of conceptus development and attachment in pigs., 1997, 52: 133-149.
[28] PAVLOVA S, KLUCSKA K, VASICEK D, KOTWICA JSIROTKIN A V. Transcription factor NF-kappaB (p50/p50, p65/p65) controls porcine ovarian cells functions., 2011, 128(1-4): 73-84.
[29] SUGINO N, KARUBE-HARADA A, TAKETANI T, SAKATA ANAKAMURA Y. Withdrawal of ovarian steroids stimulates prostaglandin F2alpha production through nuclear factor-kappaB activation via oxygen radicals in human endometrial stromal cells: potential relevance to menstruation., 2004, 50(2): 215-225.
[30] TELLERIA C M, GOYENECHE A A, STOCCO C OGIBORI G. Involvement of nuclear factor kappa B in the regulation of rat luteal function: potential roles as survival factor and inhibitor of 20alpha- hydroxysteroid dehydrogenase., 2004, 32(2): 365-383.
[31] WACLAWIK A, JABBOUR H N, BLITEK AZIECIK A J. Estradiol-17beta, prostaglandin E2 (PGE2), and the PGE2 receptor are involved in PGE2 positive feedback loop in the porcine endometrium., 2009, 150(8): 3823-3832.
(責任編輯 林鑒非)
Regulation of the Promoter of FAM213B Gene in Porcine Endometrial Cells
ZHANG AiLing1,2, SUN XianYue2, LU XiaoZhang2, WU Qi2, LI JiaQi2, ZHANG Hao2
(1Development Center of Applied Ecology and Ecological Engineering in Universities/Biology and Food Engineering Institute, Guangdong University of Education, Guangzhou 510310;2Guangdong Provincial Key Lab of Agro-animal Genomics and Molecular Breeding/College of Animal Science, South China Agricultural University, Guangzhou 510642)
To interpret partially the role of FAM213B gene expression in prostaglandin synthetise and sow pregnancy through the identification of the transcription region of porcine FAM213B gene promoter and the effection of NFκB on the promoter.The porcine endometrium from the uterus in follicular phase was digested by collagenase and the isolated endometrial cells were cultured for the detection of thepromoter activity. Based on the mRNA and promoter sequences of FAM213B gene obtained in our former work (GenBank ID: KX444503 and 100134955), the longer 5′ regulationary sequence was amplified and sequenced. Then, seven promoter fragments with 5′ terminal deletion, containingI andI sites, were linked into the Dual-luciferase Reporter vectors. Seven constructed vectors treated by endotoxin free and pRL-TK plasmid were co-transfected into endometrial cells through liposome method. The core region of transcriptional activity of the gene promoter was identified through the Dual-luciferase Reporter Assay System. The putative transcription factors binding sites were analyzed by bioinformatics, and the binding of NFκB withpromoter were detected by ChIP (Chromatin immunoprecipitation). The over-expression vectors of NFκB1and RelA and interference fragments of their own were transfected into endometrial cells. Then, the transcription activity of the promoter and mRNA expression of the gene were detected by the Dual-luciferase Reporter system and fluorescent quantitative, respectively.Through the PCR and sequencing, one fragment of 2 261 bp (-2178/+83) of porcine FAM213Bgene were obtained. The bioinformatics analysis showed that there were putative binding sites of CREB, CCAAT, E-box, and NFκB in the promoter. And the putative binding sites of NFκB were found in -1143/-1132 and -664/-655 regions. The result of the Dual-luciferase Reporter showed the region of P2 (-1352/+30) exhibited the strongest transcriptional activity, and it was significantly higher than that of P1 (-1760/+30) (<0.01), which showed there were negative regulation elements in -1760/-1352 region. And the transcriptional activity of P2 (-1352/+30) was significantly higher than that of P3(-919/+30) (<0.05), implying the existence of positive elements in -1352/- 919 region. The significant stronger activity of P3 (-919/+30) than P4(-604/+80) (<0.01) meant the existence of positive elements in -919/-604 region. No significant differences were observed between P4, P5, P6, and P7. The region of -1352/-919 was the core element of the promoter. The results of Chromatin Immunoprecipitation (ChIP) demonstrated that NFκB1 binds to one site around -1143/-1132, and RelA site around -664/-655. The co-transfection of the over expression of pcDNA3.1-NFκB1 and P2 vector into endometrial cells increased the activity of the promoter (<0.01), and the transfection of pcDNA3.1-NFκB1 enhanced the mRNA expression of(<0.05). While the co-transfection of the over expression of pcDNA3.1-RelA and P3 vector into endometrial cells decreased the activity of the promoter (<0.05), and the transfection of pcDNA3.1-RelA weakened the mRNA expression of the gene. At the same time, the transfection of inference siRNA fragments of NFκB1 and RelA into endometrial cells led the contrary results for the activity of the promoter and the mRNA expression of the gene.The core region of porcine FAM213B gene promoter was identified round -1352/-919. NFκB was the trancription factor of FAM213B gene. NFκB1 and RelA, two members of NFκB family, regulate the expression of FAM213B gene in endometrial cells.
pig; FAM213B gene; promoter; NFκB; endometrial cells
2017-03-10;
2017-10-30
國家自然科學基金(31201771)、國家現代農業產業技術體系建設專項(CARS-35)、廣州市科學研究專項一般項目(201707010001)
聯系方式:張愛玲,Tel:020-85285159;E-mail:zhangmeixial@163.com

